包含TB10.4的疫苗的制作方法
本申请为分案申请,其原申请的申请日为2009年7月14日,申请号为200980136013.9,名称为“包含tb10.4的疫苗”。
本发明公开了一种具有低剂量抗原的人用疫苗,包含佐剂中的融合于抗原85-复合体(如ag85b)的多肽的tb10.4;以及结核分枝杆菌(mycobacteriumtuberculosis)的免疫和治疗方法。
背景技术:
全世界正致力于开发出比当前使用的卡介苗(bcg)疫苗更有效的结核分枝杆菌疫苗,这包括不同的策略,例如活的减毒疫苗(9)、病毒载体化的结核分枝杆菌疫苗(11)和亚单位疫苗(12,14)。亚单位疫苗方法拥有诸多优点,例如,安全性和稳定性增加,以及经证实的加强之前的bcg接种的能力(4,7)。另外,由于亚单位疫苗似乎不受环境中分枝杆菌的影响,因此这类疫苗可能在发展中国家中特别有用(3)。然而,该领域的进展已因缺乏引起细胞介导的强免疫(cmi)应答的佐剂而被延误。因此,仍然需要能形成多功能免疫细胞从而提供更强的抵御结核分枝杆菌的保护作用的免疫原性组合物。
技术实现要素:
本研究检查了作为抵御结核分枝杆菌感染的新疫苗的ag85b-tb10.4(hyvac4)和
具体实施方式
本发明公开了一种人用免疫原性组合物,包含tb10.4蛋白和ag85-复合蛋白,所述tb10.4蛋白和ag85-复合蛋白任选地可融合在一起或作为分开的蛋白提供,其中蛋白总量少于约25.0μg、优选地少于10.0μg或者等于约0.5μg/抗原剂量。
所公开的免疫原性组合物可以额外地包含佐剂。本发明的优选佐剂具有至少一种聚阳离子肽和至少一种寡核苷酸,优选地,所述寡核苷酸为tlr9激动剂。
本发明的优选佐剂为
本发明公开了一种人用疫苗,包含上述免疫原性组合物。
本发明还公开了一种在人中诱导抵御结核分枝杆菌的保护作用的方法,所述方法包括将一种如上所述的免疫原性组合物引入该人中。
本研究检查了作为抵御结核分枝杆菌感染的新疫苗的ag85b-tb10.4(hyvac4)融合蛋白和
在形成抵御结核分枝杆菌感染的有效疫苗的尝试中,ag85b-tb10.4融合蛋白和
(1)
(2)
(3)ag85b-tb10.4融合蛋白具有的优点是它不含可用于诊断目的的任何蛋白例如esat-6。esat-6是一种极有价值的诊断试剂,并且是诸多商业化诊断测试的基础(5,10,13)。将esat-6排除在日后的疫苗之外将使得诊断测试和疫苗可平行使用,因为ag85b-tb10.4融合蛋白不会影响任何具体的诊断测试;
(4)由于ag85b和tb10.4两者均由bcg表达,因此本发明的疫苗还可用作bcg的加强疫苗。
结果表明,ag85b-tb10.4和
这是证明
在整篇说明书中,除非上下文另有要求,否则措辞“包含”或其变化形式例如“含有”或者“包括”将被理解为意味着包括所述要素、整数、要素组或整数组,但是并不排除任何其他要素、整数、要素组或整数组。
抗原
本发明的抗原可以包含融合于tb10.4蛋白的ag85-复合体的蛋白,包括例如ag85-复合体的蛋白ag85a、ag85b或ag85c。
ag85b-tb10.4是一种不寻常的免疫原性分子,该分子必须以低剂量给予,以引发最大量的多功能免疫细胞,诱导更多的干扰素-γ表达和增加的抵御结核分枝杆菌的保护作用。在本说明书中,ag85b-tb10.4融合蛋白与术语h4和hyvac4可互换。
在另一个实施方案中,抗原可包含ag85复合体的蛋白和tb10.4蛋白,其中所述ag85复合蛋白没有融合于所述tb10.4蛋白。
优选的所述ag85复合体的蛋白为ag85b。
每种蛋白均可通过糖基化或脂质化进行修饰(mowatetal.1991;lustigetal.1976)。每种蛋白均可通过添加辅基、纯化部分或者信号肽进行修饰。每种蛋白均可被修饰一次或多次,或者不进行任何修饰。每种蛋白均可被单独地或者组合地修饰。每种蛋白均由具体的氨基酸进行表征,并可由具体的核酸序列编码。在本发明范围内的是这样的序列以及通过重组方法或者合成方法产生的类似序列和变化序列,其中这些氨基酸序列已通过在重组蛋白中置换、插入、添加或者缺失一个或者多个氨基酸残基而被修饰,同时保留其免疫原性,这通过本文所述的任何一种或者全部生物学分析法得到确认。
置换优选地是“保守”的。这样的置换通过下表定义。第二列同一区块、优选第三列同一行的氨基酸可以彼此置换。第三列中的氨基酸表示为单字母代码。
佐剂
在本发明的一个实施方案中,抗原可以包含佐剂中的融合于tb10.4蛋白的ag85复合蛋白。
在另一个实施方案中,抗原可以包含佐剂中的ag85复合蛋白和tb10.4蛋白(即非融合的)。
ag85b-tb10.4是一种不寻常的免疫原性分子,该分子必须以低剂量给予,以引发最大量的多功能免疫细胞,诱导更多的干扰素-γ表达和增加的抵御结核分枝杆菌的保护作用。实例有包含聚阳离子肽[如聚赖氨酸(klk肽)或者聚精氨酸]和寡脱氧核酸分子的佐剂,但是不限于该佐剂。
本发明的优选佐剂为聚阳离子肽[如聚赖氨酸(klk肽)或者聚精氨酸]和寡脱氧核酸分子[i-odn]的混合物。适合与本发明一起使用的i-odn的实例为寡聚dic如5`-icicicicicicicicicicicicic-3`。对适合与本发明一起使用的i-odn的完整综述提供于pct国际申请公开文本no.wo0193905和wo0193903,这两份申请均通过援引纳入本文。适合与本发明一起使用的klk肽的一个实例为nh2klklllllklk-cooh或klklllllklk-nh2。适合的聚阳离子肽的其他实例为rlrlllllrlr-nh2、rlklllllklr-nh2、kfkfffffkfk-nh2、kwkwwwwwkwk-nh2或kvkvvvvvkvk-nh2。对适合与本发明一起使用的聚阳离子肽的完整综述提供于pct国际申请公布文本no.wo0232451,这份申请通过援引纳入本文。
此前的研究已经证明,阳离子脂质体中的ag85b-tb10.4融合蛋白或者ag85b-esat-6融合蛋白诱发了抵御结核分枝杆菌的有效保护作用,并且在小鼠结核分枝杆菌动物模型中,
在本研究中,剂量为0.5μg的ic31[100nmol肽(nh2-klklllllklk-cooh)和5nmol寡核苷酸(5`-icicicicicicicicicicicicic-3`)]中的ag85b-tb10.4融合蛋白诱发了强inf-γ应答。该强inf-γ应答的范围与5.0μg没有ic31的ag85b-tb10.4融合蛋白的大致相同。而且,0.5μgic31[100nmol肽(nh2-klklllllklk-cooh)和5nmol寡核苷酸(5`-icicicicicicicicicicicicic-3`)]中的ag85b-tb10.4融合蛋白提供了范围与bcg的大致相同的强保护。令人意外地,这要好于仅5.0μg或者15.0μg的ag85b-tb10.4融合蛋白(即没有ic31),表明仅ag85b-tb10.4融合蛋白的最佳剂量少于约5.0μg/剂量。
而且,在用任一疫苗组分刺激之后,最低剂量的ic31中的ag85b-tb10.4融合蛋白(0.5μg)产生了最高的ifn-γ应答(参见图1和2)。最后,用ic31中的ag85b-tb10.4融合蛋白进行的接种诱导了两个主要cd4+t细胞群,一个表达ifn-γ、il-2和tnf-α,另一个表达il-2和tnf-α。这两个t细胞群均属于中枢记忆t细胞,并且均是长期记忆所必需的(17)。重要的是,如通过elisa测量的ifn-γ表达所观察到的,使用剂量为0.5μg的ic31中的hyvac4融合蛋白诱导了表达ifn-γ、il-2和tnf-α的多功能细胞群中的最大细胞数目(参见图3)。
本发明证明了以下内容:
(1)佐剂ic31和阳离子脂质体展现出对抗原剂量的不同敏感性;和
(2)ic31中的最佳抗原剂量是抗原依赖的。
例如,0.5μgic31中的ag85b-tb10.4融合蛋白诱发了显著保护作用,而5.0μgic31中的ag85b-tb10.4融合蛋白却不能(图4)。
总之,这些结果突显了在测试新的佐剂/抗原制剂时分析抗原剂量的重要性,并且教导了疫苗中的最佳抗原剂量取决于抗原和佐剂两者。
而且,在本发明中,所观察到的多功能t细胞的量和ic31中的ag85b-tb10.4疫苗诱发的保护作用强度之间的相关性与最近的一项研究相一致,在这项研究中,抵御硕大利什曼原虫(leishmaniamajor)感染的保护性免疫性与长期记忆应答和产生的多功能t细胞的数目呈直接相关(6)。
附图说明
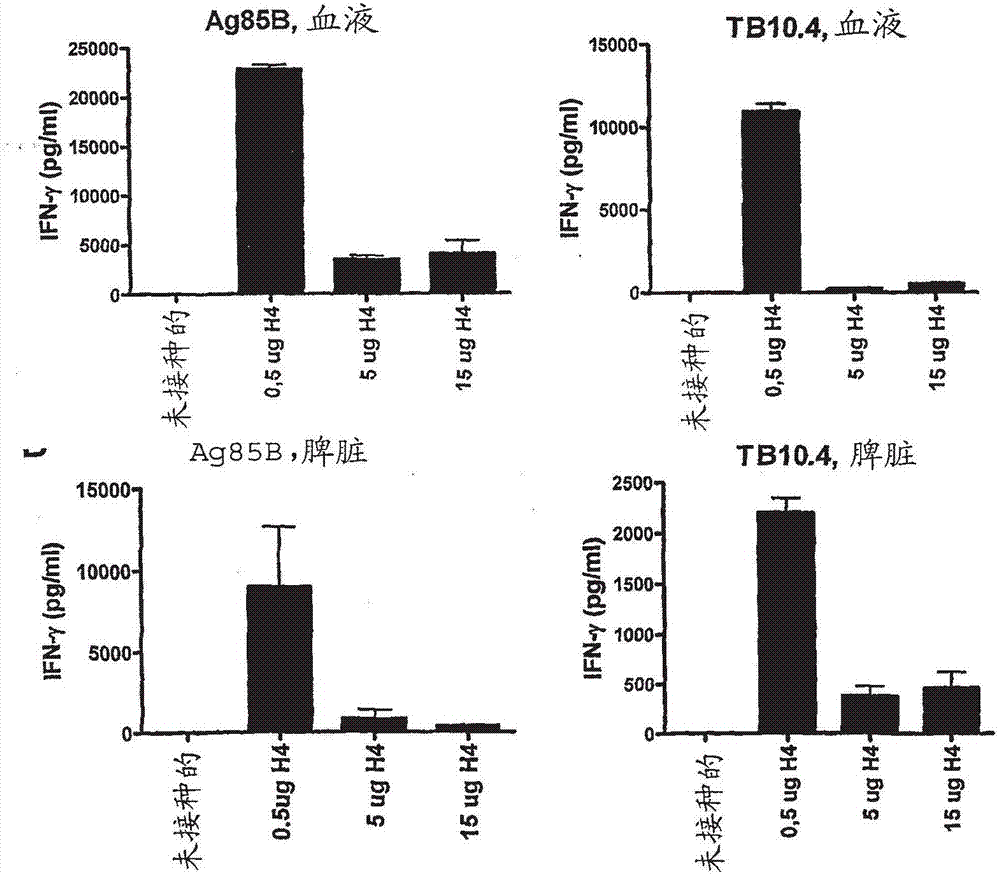
图1.对接种抗原的免疫识别。用1.0或5.0μg/ml的ag85b、tb10.4或者cfp10刺激从用不同剂量的ic31中的h4接种的小鼠组和盐水对照组中分离到的pbmc。72小时之后,通过elisa确定细胞释放的ifn-γ的浓度。在第三次接种后一周,从每组的五只小鼠分离并合并pbmc。数值表示为三次重复试验的平均值,sem表示为棒。
图2.对不同器官中的ag85b的识别。用ag85b或者tb10.4刺激从用不同剂量的在ic31中配制的h4免疫的小鼠组或者盐水对照组中分离到的pbmc(a)和脾细胞(b)72小时,之后通过elisa测量ifn-γ细胞因子的分泌情况。条棒代表三只个体小鼠的平均值。给出了sem。在(a)和(b)中,与5.0μg和15.0μg的接种剂量相比,0.5μgh4的接种剂量表现出显著(p<0.05,单尾anova和tukey事后检验(tukey’sposttest))更高的抗原应答。
图3.ag85b和tb10.4特异性的t细胞是多功能的。(a)在接种后2周,对pbmc和脾细胞进行抗原性刺激后通过流式细胞术评估ifn-γ、tnf-α和il-2的生产情况。将饼形图按照接种剂量分组,并根据细胞因子生产特点进行色彩编码,该饼形图总结了对给定细胞因子生产特点阳性的cd4+t细胞应答的级分。(b)每个可能的细胞因子组合示于柱状图的x轴,并且对每一免疫组给出了表达任一细胞因子组合的hyvac4(h4)特异性的cd4+t细胞的百分数。在cd8+t细胞亚群中没有观察到应答。(c)(a)中的facs分析的点图,示出来自用0.5μg或5.0μghyvac4接种的小鼠的cd4+脾脏细胞的il-2和ifn-γ表达情况。给出了在每个象限中的百分数。
图4.h4的保护效力。在两个独立的实验(a和b)中,将小鼠组用三种不同剂量的在ic31中配制的h4进行接种,并与盐水和bcg-接种的对照相比较。全部组均在首次接种后十周用有毒力的结核分枝杆菌通过气雾途径(aerosolroute)攻击。攻击后六周,将所有小鼠处死并通过细菌计数测量肺中的细菌负荷(cfu)。在两个实验中,数据均表示为每组六只小鼠的平均值,平均值的标准误由棒示出。在接种组中的统计学比较通过单尾anova和tukey事后检验进行。仅示出所选组的显著差异。***:p<0.001,*:p<0.05.
材料和方法
动物
用购自丹麦ejby的taconic的8至12周龄c57bl/6xbalb/cf1雌性小鼠进行研究。将感染动物圈养在放置于bsl-3设施中层流安全罩内的笼子中。根据丹麦司法部(danishministryofjustice)和动物保护委员会推行的条例,并遵从ec指示86/609和的usalac实验动物保健和使用建议来使用小鼠。
细菌
将结核分枝杆菌erdman于37℃在
免疫
以2周的间隔在小鼠后背上以皮下的方式用实验疫苗将其免疫三次,所述实验疫苗含有0.5、5.0或15.0μg的ag85b-tb10.4融合蛋白(h4)/剂量,由ic31乳化,总体积为0.2ml/剂量。剂量为100nmol肽和5nmol寡核苷酸。所有的疫苗均使用如前人描述的10mmtris-hcl/270mm山梨糖醇缓冲液(ph7.9)[12]配制,以获得每只小鼠0.2ml的最终体积。在首次亚单位接种时,一组小鼠接受了单一剂量的在尾基部皮下注射的bcgdanish1331(2.5×105cfu),一组接受盐水注射。在首次接种后10周对所有的小鼠组进行攻击。
实验性感染
在通过气雾途径攻击时,将动物用大约50cfu的结核分枝杆菌erdman/小鼠进行感染。在攻击后六周将这些小鼠处死。通过用7h11培养基地系列三倍稀释各个全器官匀浆物来确定脾脏或肺中的细菌数目,实验重复两次。将来自bcg接种的动物的器官用补充有2.0μg2-噻吩-羧酸酰肼(tch)的培养基培养以选择性抑制测试器官中残留bcg细菌生长。在37℃孵育2-3周后对菌落计数。将肺中的细菌负荷表示为基于六只动物的接种组的细菌计数的log10。
淋巴细胞培养物
如前人所述(2)获得来自脾脏的淋巴细胞。通过密度梯度纯化血液淋巴细胞(pbmc)。将从每个实验中五只小鼠收集到的细胞培养于微量滴定孔中(96-孔板;nunc,roskilde,denmark),在体积为200μl补充有以下成分的rpmi1640中含有2×105个细胞:5×10-5m2-巯基乙醇、1%青霉素-链霉素、1mm谷氨酰胺和5%(体积/体积)胎牛血清。基于之前的剂量-应答研究,所使用的分枝杆菌抗原全都为15μg/ml或5μg/ml,而所使用的作为细胞活力的阳性对照的伴刀豆球蛋白a(concanavalina)的浓度为1μg/ml。所有制剂均在细胞培养物中进行测试,并发现在本研究中使用的浓度下是无毒的。在孵育72小时之后从培养物收集上清,用于对ifn-γ进行研究。
ifn-γ酶联免疫吸附测定(elisa)
在4℃下,用pbs中的单克隆仓鼠抗小鼠ifn-γ(genzyme,cambridge,mass.)包被微量滴定板(96孔;maxisorb;nunc)。用1%(重量/体积)牛血清白蛋白-0.05%tween20封闭游离结合位点。对培养物上清进行测试,重复三次,并用生物素标记的大鼠抗小鼠单克隆抗体(clonexmg1.2;pharmingen,sandiego,ca)来检测ifn-γ。将重组ifn-γ(pharmingen,sandiego,ca)用作标准品。
淋巴细胞的facs分析
胞内细胞因子染色步骤:将来自小鼠的血液、脾脏或肺的细胞用2μg/mlag刺激1-2小时,随后用10μg/ml布雷菲德菌素a(brefeldina)(sigma-aldrich,usa)在37℃孵育6小时。之后,将细胞在4℃保存过夜。第二天,用0.5μg/ml抗-cd16/cd32mab(bdpharmingen,usa)将fc受体封闭10分钟,然后将细胞用facs缓冲液(含0.1%叠氮化钠和1%fcs的pbs)洗涤,并使用0.2μg/ml抗-cd4(克隆:rm4-5)、抗-cd8(克隆:53-6,7)单克隆抗体对所指出的表面标记进行染色。然后用facs缓冲液洗涤细胞,使用cytofix/cytoperm试剂盒(bdpharmingen,denmark)根据厂商说明书透化细胞,并用0.2μg/ml抗-ifn-γ(克隆:xmg1.2)、抗-tnf-α(克隆:mp6-xt22)或抗-il-2(克隆:jes6-5h4)单克隆抗体进行细胞内染色。洗涤之后,将细胞重悬于4%(重量/体积)甲醛溶液(ph7.4)(bie&berntsen,denmark),并用六色bdfacscanto流式细胞仪(bdbiosciences,usa)通过流式细胞术对其进行分析。
统计学方法
将所获得的数据通过方差分析进行检验。通过tukey检验分析平均值之间的差异的统计学显著性。<0.05的p值被认为是显著的。
实施例1
用ic31中的ag85b-tb10.4融合蛋白免疫之后诱发的免疫应答
本发明人首先分析了在ic31中递送的ag85b-tb10.4融合蛋白的免疫原性,并分析了在免疫之后该融合蛋白的两个组分是否可为免疫系统所识别。将各组小鼠用ic31中的ag85b-tb10.4融合蛋白免疫。作为阴性对照,一组小鼠仅接受了佐剂(数据未给出)。为了检查ic31中的最佳抗原剂量,本发明人使用了15.0、5.0和0.5μg的ag85b-tb10.4融合蛋白。最后一次注射后一周,对小鼠采血,并在用不同浓度的ag85b和tb10.4蛋白(5μg/ml和1μg/ml)对纯化的pbmc进行体外刺激之后对ifn-γ释放进行评估(图1a)。用ic31中的ag85b-tb10.4融合蛋白进行的免疫诱发了强的ag85b和tb10.4蛋白特异性的ifn-γ应答。令人意外地,该应答对抗原免疫剂量敏感。因此,在用ag85b(9401+/-3668pg/mlifn-γ)或者tb10.4(4694+/-3992pg/mlifn-γ)刺激之后,最低剂量的ic31中的ag85b-tb10.4融合蛋白给出了最高的ifn-γ应答(图1a)。相对于用0.5μgag85b-tb10.4融合蛋白接种的小鼠,使用剂量为5.0μg或15.0μg的ag85b-tb10.4融合蛋白显著地降低了对ag85b和tb10.4蛋白两者的ifn-γ应答(p<0.001)。对于高免疫剂量——15μgag85b-tb10.4融合蛋白/免疫剂量,这一点尤为明显,其给出的ifn-γ应答没有不同于在非接种小鼠中(或者在ag85b-tb10.4融合蛋白接种的并且用对照抗原cfp10在体外刺激的小鼠中)观察到的应答。相同的剂量依赖性随后在一个独立的实验中重复出现,在这个独立的实验中分析了血液和脾脏中的免疫应答(图2)。这些结果表明,在所测试的抗原剂量中,0.5μg的ic31中的ag85b-tb10.4融合蛋白的最低剂量诱发了最强的全身性应答。
实施例2
使用ic31中的ag85b-tb10.4融合蛋白进行的接种诱导多功能cd4+t细胞
接下来,本发明人分析了通过用ic31中的ag85b-tb10.4融合蛋白进行免疫所诱导的t细胞表型。具体地,本发明人的兴趣在于该疫苗诱导多功能(ifn-γ+il-2+tnf-α+)cd4+t细胞的能力,因为这些细胞已被证明与抵御感染(例如硕大利什曼原虫)的保护性免疫性有关,并且已被证明形成了长期记忆应答的基础(6,15)。将来自ic31中的ag85b-tb10.4融合蛋白接种的小鼠的pbmc用ag85b或tb10.4融合蛋白在体外刺激,并通过流式细胞术分析cd4、cd8、ifn-γ、tnf-α和il-2的表达情况。结果表明,用ic31中的ag85b-tb10.4融合蛋白进行免疫诱导了两个主要的多功能t细胞群:cd4+ifn-γ+il-2+tnf-α+和cd4+il-2+tnf-α+t细胞(图3)。在ag85b和tb10.4特异性的t细胞中观察到了这一现象。值得注意的是,如图1中所观察到的,与用5.0μg的ic31中的hyvac4融合蛋白免疫的组相比,在用0.5μg的ic31中的hyvac4免疫的组中有更高的应答(参见图3),并且主要区别在于用仅0.5μg接种的组给出了显著更多的多功能t细胞。总之,用ic31中的ag85b-tb10.4融合蛋白进行免疫诱导了多功能cd4+t细胞,并确认,不仅就ifn-γ表达而言,而且就多功能t细胞的数目而言,降低ag85b-tb10.4融合蛋白的量增加了疫苗的免疫原性。
实施例3
ag85b-tb10.4融合蛋白和ic31在小鼠结核分枝杆菌感染模型中的保护效力
最后,本发明人检查了ic31中的ag85b-tb10.4融合蛋白的保护效力,以及关于疫苗免疫原性的剂量依赖性是否也反映在疫苗的保护效力中。以两周的间隔用ic31中的ag85b-tb10.4融合蛋白将小鼠接种三次。作为保护作用的阳性对照,一组小鼠用bcg免疫一次。首次接种后十周,用有毒力的结核分枝杆菌erdman通过气雾途径攻击小鼠。攻击后六周,将小鼠处死并测定肺中的细菌数目。正如针对疫苗的免疫原性时观察到的一样,最低的ag85b-tb10.4融合蛋白免疫剂量引起了最高的保护。因此,用0.5μgic31中的ag85b-tb10.4融合蛋白接种的小鼠其肺中含有的细菌数目为5.0+/-0.2log10cfu。这与在bcg接种小鼠中观察到的数目(4.90+/-0.35log10cfu)相等,但是与未接种小鼠中的细菌数目(5.83+/-0.12log10cfu)相比显著较低(p<0.001)(图4a)。相比之下,用5.0μg或者15.0μgic31中的ag85b-tb10.4融合蛋白接种的小鼠中的细菌数目与未接种小鼠的肺中存在的水平没有显著差异(图4a)。重复该实验得到了相同的结论,但是全部组中的细菌总数均略低(图4b)。因此,就inf-γ生产和多功能t细胞的数目而论,疫苗——ic31中的ag85b-tb10.4融合蛋白——诱导抵御结核分枝杆菌的保护作用的能力与疫苗的免疫原性有关,并且在使用最低的抗原剂量时最高。
来自这些清楚了解的结核分枝杆菌动物模型的出人意料的体内结果,支持将本发明的免疫原性组合物用作人的结核分枝杆菌疫苗。
实施例4
ag85b-tb10.4融合蛋白和ic31在临床试验中的保护效力
在人临床试验中,用少于约5.0μg至25.0μg的ic31中的ag85b-tb10.4接种受试者。
该低剂量的ag85b-tb10.4与在临床试验中当前使用的其他结核分枝杆菌亚单位疫苗形成了鲜明的对比。例如,40.0μg的as02a中的mtb72f/剂量(19)和50.0μg的ic31中的ag85b-esat-6/剂量(临床数据尚未公布)。
以上公开内容大致地描述了本发明。通过参照以下的具体实施例可以获得更为完全的理解。描述这些实施例的目的仅仅是为了进行举例说明,而无意于限制本发明的范围。考虑到了形式改变和等价替换,因为这些情形可以想到或者是适宜的。尽管本文采用了下位概念,但是这样的概念旨在描述而非限制。
参考文献:
1.agger,e.m.,i.rosenkrands,a.w.olsen,g.hatch,a.williams,c.kritsch,k.lingnau,a.vongabain,c.s.andersen,k.s.korsholm,andp.andersen.2006.protectiveimmunitytotuberculosiswithag85b-esat-6inasyntheticcationicad-juvantsystemic31.vaccine24:5452-5460.
2.brandt,l.,m.elhay,i.rosenkrands,e.b.lindblad,andp.andersen.2000.esat-6subunitvaccinationagainstmycobacteriumtuberculosis.infectimmun68:791-795.
3.brandt,l.,j.feinocunha,a.weinreicholsen,b.chilima,p.hirsch,r.appel-berg,andp.andersen.2002.failureofthemycobacteriumbovisbcgvaccine:so-mespeciesofenvironmentalmycobacteriablockmultiplicationofbcgandinducti-onofprotectiveimmunitytotuberculosis.infectimmun70:672-678.
4.brandt,l.,y.a.skeiky,m.r.alderson,y.lobet,w.dalemans,o.c.turner,r.j.basaraba,a.a.izzo,t.m.lasco,p.l.chapman,s.g.reed,andi.m.orme.2004.theprotectiveeffectofthemycobacteriumbovisbcgvaccineisincreasedbycoadministrationwiththemycobacteriumtuberculosis72-kilodaltonfusionpolypro-teinmtb72finm.tuberculosis-infectedguineapigs.infectimmun72:6622-6632.
5.brock,i.,k.weldingh,e.m.leyten,s.m.arend,p.ravn,andp.andersen.2004.specifict-cellepitopesforimmunoassay-baseddiagnosisofmyeobacteriumtuber-culosisinfection.jclinmicrobiol42:2379-2387.
6.darrah,p.a.,d.t.patel,p.m.deluca,r.w.lindsay,d.f.davey,b.j.flynn,s.t.hoff,p.andersen,s.g.reed,s.l.morris,m.roederer,andr.a.seder.2007.multifunctionalth1ceilsdefineacorrelateofvaccine-mediatedprotectionagainstleishmaniamajor.natmed13:843-850.
7.dietrich,j.,c.andersen,r.rappuoli,t.m.doherty,c.g.jensen,andp.ander-sen.2006.mucosaladministrationofag85b-esat-6protectsagainstinfectionwithmycobacteriumtuberculosisandboostspriorbacilluscalmette-guerinimmunity.jimmunol177:6353-6360.
8.dietrich,j.,c.aagaard,r.leah,a.w.olsen,a.stryhn,t.m.doherty,andp.andersen.2005.exchangingesat6withtb10.4inanag85bfusionmolecule-basedtuberculosissubunitvaccine:efficientprotectionandesat6-basedsensitivemonitoringofvaccineefficacy.jimmunol174:6332-6339.
9.horwitz,m.a.,g.harth,b.j.dillon,ands.maslesa-galic.2000.recombinantbacilluscalmette-guerin(bcg)vaccinesexpressingthemycobacteriumtuberculosis30-kdamajorsecretoryproteininducegreaterprotectiveimmunityagainsttubercu-losisthanconventionalbcgvaccinesinahighlysusceptibleanimalmodel.procnatlacadsciusa97:13853-13858.
10.lalvani,a.,a.a.pathan,h.mcshane,r.j.wilkinson,m.latif,c.p.conlon,g.pasvol,anda.v.hill.2001.rapiddetectionofmycobacteriumtuberculosisinfec-tionbyenumerationofantigen-specifictcells.amjrespircritcaremed163:824-828.
11.lustigjv,riegerhl,kraftsc,hunterr,rothbergrm.1976,cellimmunol24(1):164-7
12.mcshane,h.,a.a.pathan,c.r.sander,s.m.keating,s.c.gilbert,k.huygen,h.a.fletcher,anda.v.hill.2004.recombinantmodifiedvacciniavirusankaraexpressingantigen85aboostsbcg-primedandnaturallyacquiredantimycobacteri-alimmunityinhumans.natmed10:1240-1244.
13mowatam,donachieam,reidg,jarretto.1991,immunology72(3):317-22
14.olsen,a.w.,l.a.vanpinxteren,l.m.okkels,p.b.rasmussen,andp.andersen.2001.protectionofmicewithatuberculosissubunitvaccinebasedonafusionprote-inofantigen85bandesat-6.infectionandimmunity69:2773-2778.
15.ravn,p.,a.demissie,t.eguale,h.wondwosson,d.lein,h.amoudy,a.s.mus-tafa,a.k.jensen,a.holm,i.rosenkrands,f.oftung,j.olobo,c.f.von-reyn,andp.andersen.1999.humantcellresponsestotheesat-6antigenfrommyco-bacteriumtuberculosis.j.infect.dis.179:637-645.
16.skeiky,y.a.,m.r.alderson,p.j.ovendale,j.a.guderian,l.brandt,d.c.dil-lon,a.campos-neto,y.lobet,w.dalemans,i.m.orme,ands.g.reed.2004.differentialimmuneresponsesandprotectiveefficacyinducedbycomponentsofatuberculosispolyproteinvaccine,mtb72f,deliveredasnakeddnaorrecombinantprotein.jimmunol172:7618-7628.
17.stockinger,b.,c.bourgeois,andg.kassiotis.2006.cd4+memorytcells:functi-onaldifferentiationandhomeostasis.immunolrev211:39-48.
18.weinreicholsen,a.,l.a.vanpinxteren,l.mengokkels,p.birkrasmussen,andp.andersen.2001.protectionofmicewithatuberculosissubunitvaccinebasedonafusionproteinofantigen85bandesat-6.infectimmun69:2773-2778.
19.wu,c.y.,j.r.kirman,m.j.rotte,d.f.davey,s.p.perfetto,e.g.rhee,b.l.freidag,b.j.hill,d.c.douek,andr.a.seder.2002.distinctlineagesoft(h)lcellshavedifferentialcapacitiesformemorycellgenerationinvivo.natureimmu-nology3:852-858.
20.usfda.1995.guidanceforindustry:estimatingthemaximumsafestartingdoseininitialclinicaltrialsfortherapeuticsinadulthealthyvolunteers.u.s.departmentofhealthandhumanservices,foodanddrugadministration,centerfordrugevaluationandresearch.
21.leroux-roelsi,leroux-roelsg,ofori-anyinamoetal.safetyandimmunogenic-ityofthemtb72f/as02atuberculosisvaccineinppd-negativebelgianadults.medicalandhealthinthetrotpics.marseille.france.11-15sept2005(ahstracto-036)
序列表
<110>国家血清研究中心
<120>包含tb10.4的疫苗
<130>15030pc
<160>4
<170>patentinversion3.1
<210>1
<211>338
<212>prt
<213>结核分枝杆菌(mycobacteriumtuberculosis)
<400>1
metglnleuvalaspargvalargglyalavalthrglymetserarg
151015
argleuvalvalglyalavalglyalaalaleuvalserglyleuval
202530
glyalavalglyglythralathralaglyalapheserargprogly
354045
leuprovalglutyrleuglnvalproserprosermetglyargasp
505560
ilelysvalglnpheglnserglyglyalaasnserproalaleutyr
65707580
leuleuaspglyleuargalaglnaspasppheserglytrpaspile
859095
asnthrproalapheglutrptyraspglnserglyleuservalval
100105110
metprovalglyglyglnserserphetyrserasptrptyrglnpro
115120125
alacysglylysalaglycysglnthrtyrlystrpgluthrpheleu
130135140
thrsergluleuproglytrpleuglnalaasnarghisvallyspro
145150155160
thrglyseralavalvalglyleusermetalaalaserseralaleu
165170175
thrleualailetyrhisproglnglnphevaltyralaglyalamet
180185190
serglyleuleuaspproserglnalametglyprothrleuilegly
195200205
leualametglyaspalaglyglytyrlysalaseraspmettrpgly
210215220
prolysgluaspproalatrpglnargasnaspproleuleuasnval
225230235240
glylysleuilealaasnasnthrargvaltrpvaltyrcysglyasn
245250255
glylysproseraspleuglyglyasnasnleuproalalyspheleu
260265270
gluglyphevalargthrserasnilelyspheglnaspalatyrasn
275280285
alaglyglyglyhisasnglyvalpheasppheproaspserglythr
290295300
hissertrpglutyrtrpglyalaglnleuasnalametlysproasp
305310315320
leuglnargalaleuglyalathrproasnthrglyproalaprogln
325330335
glyala
<210>2
<211>325
<212>prt
<213>结核分枝杆菌(mycobacteriumtuberculosis)
<400>2
metthraspvalserarglysileargalatrpglyargargleumet
151015
ileglythralaalaalavalvalleuproglyleuvalglyleuala
202530
glyglyalaalathralaglyalapheserargproglyleuproval
354045
glutyrleuglnvalproserprosermetglyargaspilelysval
505560
glnpheglnserglyglyasnasnserproalavaltyrleuleuasp
65707580
glyleuargalaglnaspasptyrasnglytrpaspileasnthrpro
859095
alapheglutrptyrtyrglnserglyleuserilevalmetproval
100105110
glyglyglnserserphetyrserasptrptyrserproalacysgly
115120125
lysalaglycysglnthrtyrlystrpgluthrpheleuthrserglu
130135140
leuproglntrpleuseralaasnargalavallysprothrglyser
145150155160
alaalaileglyleusermetalaglyserseralametileleuala
165170175
alatyrhisproglnglnpheiletyralaglyserleuseralaleu
180185190
leuaspproserglnglymetglyproserleuileglyleualamet
195200205
glyaspalaglyglytyrlysalaalaaspmettrpglyproserser
210215220
aspproalatrpgluargasnaspprothrglnglnileprolysleu
225230235240
valalaasnasnthrargleutrpvaltyrcysglyasnglythrpro
245250255
asngluleuglyglyalaasnileproalaglupheleugluasnphe
260265270
valargserserasnleulyspheglnaspalatyrasnalaalagly
275280285
glyhisasnalavalpheasnpheproproasnglythrhissertrp
290295300
glutyrtrpglyalaglnleuasnalametlysglyaspleuglnser
305310315320
serleuglyalagly
325
<210>3
<211>340
<212>prt
<213>结核分枝杆菌(mycobacteriumtuberculosis)
<400>3
metthrphephegluglnvalargargleuargseralaalathrthr
151015
leuproargargleualailealaalametglyalavalleuvaltyr
202530
glyleuvalglythrpheglyglyproalathralaglyalapheser
354045
argproglyleuprovalglutyrleuglnvalproseralasermet
505560
glyargaspilelysvalglnpheglnglyglyglyprohisalaval
65707580
tyrleuleuaspglyleuargalaglnaspasptyrasnglytrpasp
859095
ileasnthrproalaphegluglutyrtyrglnserglyleuserval
100105110
ilemetprovalglyglyglnserserphetyrthrasptrptyrgln
115120125
proserglnserasnglyglnasntyrthrtyrlystrpgluthrphe
130135140
leuthrargglumetproalatrpleuglnalaasnlysglyvalser
145150155160
prothrglyasnalaalavalglyleusermetserglyglyserala
165170175
leuileleualaalatyrtyrproglnglnpheprotyralaalaser
180185190
leuserglypheleuasnprosergluglytrptrpprothrleuile
195200205
glyleualametasnaspserglyglytyrasnalaasnsermettrp
210215220
glyproserseraspproalatrplysargasnaspprometvalgln
225230235240
ileproargleuvalalaasnasnthrargiletrpvaltyrcysgly
245250255
asnglythrproseraspleuglyglyaspasnileproalalysphe
260265270
leugluglyleuthrleuargthrasnglnthrpheargaspthrtyr
275280285
alaalaaspglyglyargasnglyvalpheasnpheproproasngly
290295300
thrhissertrpprotyrtrpasngluglnleuvalalametlysala
305310315320
aspileglnhisvalleuasnglyalathrproproalaalaproala
325330335
alaproalaala
340
<210>4
<211>96
<212>prt
<213>结核分枝杆菌(mycobacteriumtuberculosis)
<400>4
metserglnilemettyrasntyrproalametleuglyhisalagly
151015
aspmetalaglytyralaglythrleuglnserleuglyalagluile
202530
alavalgluglnalaalaleuglnseralatrpglnglyaspthrgly
354045
ilethrtyrglnalatrpglnalaglntrpasnglnalametgluasp
505560
leuvalargalatyrhisalametserserthrhisglualaasnthr
65707580
metalametmetalaargaspthralaglualaalalystrpglygly
859095
- 还没有人留言评论。精彩留言会获得点赞!