MBL在制备预防或治疗效应T细胞引发疾病药物中的应用的制作方法
本发明涉及甘露聚糖结合凝集素的新用途技术领域,具体涉及mbl在制备预防或治疗效应t细胞引发疾病药物中的应用。
背景技术:
甘露糖结合凝集素(mannan-bindinglectin,mbl)是主要由肝细胞分泌的高度保守的血浆蛋白,为c型凝集素超家族中胶凝素(collectins)家族成员。mbl也是一种急性期反应蛋白,在应激(如病原体感染、外科手术等)时,其血浆浓度可升高2-3倍。具有前抗体(ante-antibody)之称的mbl通过其糖识别域(carbohydraterecongnitiondomain,crd)广泛识别分布于多种病原体如细菌、病毒、寄生虫、真菌等表面的糖结构,包括d-甘露糖、l-岩藻糖、n-乙酰葡萄糖胺、n-乙酰甘露糖胺等。其胶原样区(collagen-likeregion,clr)结合甘露聚糖相关丝氨酸蛋白酶(mbl-associatedserineprotease,mbl-masp),激活补体凝集素途径而发挥溶破和间接调理功能;或者与吞噬细胞胶凝素受体结合,以不依赖补体的方式启动调理吞噬。science曾刊文(thompsonc.proteinprovestobeakeylinkininnateimmunity[j].science,1995,269(5222):301-302.)称其为“天然免疫系统中的关键分子”。现有资料已表明,mbl是未免疫宿主体内最重要的抗感染天然免疫分子。
目前已发现mbl结构基因的3个点突变(cgt52tgg、ggc54gac和gga57gaa)以及启动子和5′非翻译区突变所致血浆mbl低下而引起的调理吞噬缺损为迄今所发现的最常见的遗传性免疫缺损病。mbl缺损者终生处于高度的感染风险之中,随时可患各种感染甚至威胁生命的感染。近些年研究表明,mbl的抗病机制与其血清浓度水平相关,低水平的mbl容易导致机体的防御功能明显减弱,容易感染克罗恩病、自身免疫性神经障碍、原发性免疫缺陷以及侵袭性真菌感染;相反,最新研究表明高水平的mbl能够提高慢性阻塞性肺疾病患者的存活率。
随着对mbl研究的不断深入,发现其除了可识别并清除病原体,还具备许多内源性功能(endongenousfunctions),如结合自身免疫球蛋白;识别缺血再灌注损伤中暴露的自身抗原或疾病状态下修饰的自身抗原;参与对凋亡细胞的吞噬;能够与单核细胞系thp1细胞相互作用,抑制c.albicans诱导的细胞因子分泌,同时对b淋巴细胞系raji细胞,及t细胞系jurkat细胞均具有免疫调节作用。因此,mbl作为天然免疫中具有多重功能的模式识别分子,不仅仅参与机体的天然免疫防御,亦在天然免疫与获得性免疫之间发挥其作用。固研究mbl与获得性免疫的关系,具有重要的科学意义和潜在的医学实践意义。
t淋巴细胞是获得性免疫的主要参与者,其中调节性t细胞(regulatorytcell,tregs)参与机体免疫能力的调节。作为人体自身免疫的重要防线,tregs细胞在维持机体免疫耐受方面有着不可忽视的作用。一方面,tregs细胞的缺失会导致x连锁隐性遗传性疾病的发生。这是一种严重的多发性自身免疫疾病,导致幼年发病的肠道和多个内分泌腺的炎症,显著缩短患者寿命。另一方面,在多种自身免疫性疾病和炎症性疾病的患者和动物模型中,均发现有tregs细胞数目的减少,包括多发性硬化症、系统性红斑狼疮、1型糖尿病、类风湿关节炎、炎性肠病、牛皮鲜和动脉粥样硬化等。这些研究成果都提示对tregs细胞数目的干预可能是治疗多种自身免疫性疾病和炎症性疾病的针对靶点。
近年来研究发现,tregs细胞作为体内具有免疫调节功能的cd4+t细胞亚群,其可以分为天然调节性t细胞(naturalregulatorytcell,ntreg)和诱导产生的适应性调节性t细胞(inducedregulatorytcell,itreg),ntreg细胞在胸腺中发育,在维持机体免疫耐受、移植免疫和自身免疫病等方面发挥着重要作用;itreg细胞是由cd4+t细胞在某些特定生理条件下在外周诱导分化而来,同样具有ntreg细胞相似的功能特点。因此,寻找新的调节tregs细胞诱导分化因素,对于机体维持免疫耐受、治疗多种自身免疫性疾病具有重要的科学意义和临床实践价值。已有文献报道tgf-β、il-1β、il-2在tregs细胞的诱导分化中至关重要,联合应用cd3/cd28单抗和tgf-β1可提高tregs细胞的表达。但是,是否还有未知的的促进tregs细胞的诱导分化的因素亟待进一步深入开发研究。
tregs细胞表型为cd4+cd25+foxp3+t细胞,其表面标记cd25是高亲和力白介素2受体(il-2r)的一个组成部分,并且在treg发育中有重要作用。研究认为,foxp3是treg的特异性转录因子,该转录因子由x染色体编码,其在促使treg分化成熟及维持treg免疫抑制功能中起关键作用。
ntreg细胞在胸腺中发育,在维持机体免疫耐受、移植免疫和自身免疫病等方面发挥着重要作用;itreg细胞同样具有ntreg细胞相似的功能特点。因此,寻找新的调节treg细胞功能影响的因素,对于机体维持免疫耐受、治疗多种自身免疫性疾病具有重要的科学意义和临床实践价值。已有研究发现,体外tgf-β联合il-2通过上调cd25和foxp3来诱导cd4+cd25-t细胞转化为cd4+cd25+t细胞,这些经刺激诱导转化而来的cd4+cd25+t细胞与ntreg具有类似的抑制功效。但是,是否还有未知的的促进treg细抑制功效的因素亟待进一步深入开发研究。
本课题组近年来一直从事mbl相关研究的工作。在mbl参与免疫调节方面,发现mbl能诱导单核细胞向树突状细胞分化并促进其功能成熟、高浓度mbl以剂量依赖方式抑制lps诱导的树突状细胞成熟以及lps刺激的thp1/cd14细胞产生tnf-α和il-12,mbl还可与b淋巴细胞系raji细胞及t细胞系jurkat细胞相互作用,调节免疫反应。以上均说明mbl具有多种免疫调节作用。
技术实现要素:
本发明的目的是提出了mbl在制备预防或治疗效应t细胞引发疾病药物中的应用,主要探讨了mbl对itreg细胞抑制效应t细胞增殖的影响,结果表明mbl能够增强itreg细胞抑制效应t细胞增殖作用,这不仅是在理论上有显著性突破(在此之前从未有关mbl诱导tregs细胞的文献报道),而且具有潜在的临床医学意义,为治疗效应t细胞引发的感染性疾病、自身免疫性疾病及变态反应性疾病等提供了一种新的治疗途径。
本发明为实现上述目的采用如下技术方案,mbl在制备预防或治疗效应t细胞引发的感染性疾病、自身免疫性疾病或/和变态反应性疾病药物中的应用,其中mbl通过增强itreg细胞抑制效应t细胞增殖实现药物的功效。
进一步优选,所述感染性疾病包括利什曼原虫感染、疟原虫感染、李斯特菌感染、油门螺杆菌感染、单纯疱疹病毒感染、人类免疫缺陷病毒感染、乙型肝炎病毒感染和丙型肝炎病毒感染。
进一步优选,所述自身免疫性疾病包括系统性红斑狼疮、非肥胖糖尿病、类风湿性关节炎、1型糖尿病、特应性皮炎、graves病和斑秃。
进一步优选,所述变态反应性疾病包括过敏性鼻炎和支气管哮喘。
进一步优选,所述mbl为联合应用配体和单克隆抗体亲和层析纯化人血浆天然mbl蛋白。
进一步优选,所述mbl的浓度高于其在体内的生理浓度。
本发明具有以下优点:
1、本发明经过研究得到了调节tregs细胞抑制功能的新因素,即mbl直接增强tregs细胞对效应t细胞增殖的抑制作用;
2、本发明凸显出mbl的一种新功能,不但在固有免疫中发挥重要的抗感染作用,而且在针对tregs细胞功能的干预中可能是治疗多种自身免疫性疾病和炎症性疾病的针对靶点;
3、本发明所用的免疫细胞来自于人脐带血,区别于现有研究中用的外周血,鉴于脐带来源丰富、富含优质的造血干细胞和免疫前体细胞及再生能力强等优点,因此,脐带血成为本发明实验过程标本来源的首选。
附图说明
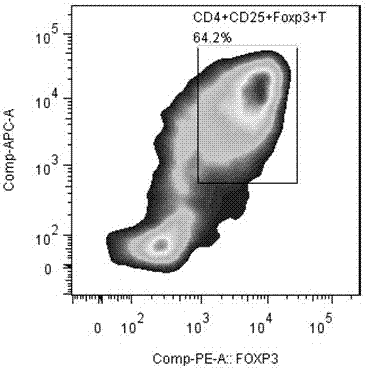
图1是流式细胞术检测新鲜cbmc中foxp3的表达情况图;
图2是流式细胞术检测cbmc在不同条件下转录因子foxp3的表达情况图;
图3是cck-8法检测itreg对pbmcs的增殖影响图;
图4是不同浓度mbl作用itreg对pbmcs增殖影响图;
图5是免疫磁珠分选cd4+cd25-t细胞foxp3的表达情况图;
图6是流式细胞术检测cd4+cd25-t在诱导条件下转录因子foxp3的表达情况图;
图7是cck-8法检测itreg对cd4+cd25-t细胞的增殖影响图;
图8是不同浓度mbl作用itreg对cd4+cd25-t细胞的增殖影响图。
具体实施方式
以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
实施例1
实验材料
1、实验所用细胞来源
新生儿脐带血采自新乡医学院第三附属医院和新乡市第一人民医院妇产科足月健康新生儿,胎儿娩出后立即从胎盘脐静脉穿刺采血放入含有28ml保存液的采血袋中。所有血样标本均在采样后4h内送达实验室。
2、主要试剂
培养基rpmi1640、胎牛血清(fetalbovineserum,fbs)、10×pbs溶液均购自thermofisherscientific公司。
淋巴细胞分离液(ficoll-paqueplus),是ficolltmpm400和密度1.077g/ml的泛影酸钠的无菌内毒素(<0.12eu/ml)测试溶液,购自gehealthcarelifesciences公司。
抗人cd3单克隆抗体(cd3mab)、抗人cd28单克隆抗体(cd28mab)、pe-cyanine7标记的cd3mab、fitc标记的cd4mab、pe标记的rorγtmab以及cellstimulationcocktail(plusproteintransportinhibitors)均购自ebioscience公司。
cd4+cd25+tregs分选试剂盒、ld分选柱、ms分选柱、macs分选架均购自miltenyibiotec公司。
重组人mbl购自r&dsystem公司。
cellcountingkit-8(cck-8)购自同仁化学研究所。
3、主要仪器和设备
超净工作台,sw-cj-2fd型,苏州净化设备有限公司。
水浴箱,ssw-420-2s型,上海博讯公司。
co2培养箱,thermo,thermo公司。
低速台式离心机,tdl-5型,上海安享科学仪器厂。
流式细胞仪,facscalibur型,美国bd公司。
倒置显微镜,ts100-f型,日本nikon公司。
低温离心机,eppendorf5810r型,德国eppendorf公司。
纯水仪,nw型,healforece公司。
4、常用试剂配制
(1)1×pbs溶液
1体积份10×pbs溶液+9体积份蒸馏水;
(2)50×tae电泳液
tris碱242g
naedta˙h2o37.2g
ddh2o800ml
醋酸57.1ml
以上用ddh2o补至1000ml后,室温保存,需要用的时候,稀释为1×tae。例如:需要使用200ml的1×tae,则量取4ml的50×tae,196ml的ddh2o,混匀即可;
(3)1×fix/perm溶液
1体积份fix/permconcentrate+3体积份fix/permdiluent
例如:需要使用4ml的1×fix/perm溶液,则量取1ml的fix/permconcentrate,3ml的fix/permdiluent,混匀即可;
(4)1×permbuffer溶液
1体积份10×permbuffer+9体积份deionizedwater
例如:需要10ml的1×permbuffer溶液,则量取1ml的10×permbuffer,9ml的deionizedwater,混匀即可。
实验方法
1、脐带血单个核细胞(cordbloodmononuclearcell,cbmc)的制备
acd抗凝的脐带血,用等量的预冷pbs溶液稀释,置于淋巴细胞分离液上,常规密度梯度离心法(400×g,30min)分离获取单个核细胞(cbmc),用无菌pbs洗三次(每次1500r/min,10min),用含10wt%fbs的rpmi1640培养基重悬细胞,并计数。
2、包被anti-cd3mab
将1mg/ml的anti-cd3mab用无菌1×pbs分别稀释至2μg/ml和5μg/ml,加入96孔板,50μl/孔,4℃过夜。
3、诱导剂对tregs细胞的诱导分化
上述的cbmc悬液每106/ml细胞数植入预先包被anti-cd3mab(2μg/ml)的96孔细胞培养板中,每孔200μl,各孔均加入anti-cd28mab(1μg/ml)、tgf-β1(5ng/ml),实验组分别加入不同浓度(1-10ng/ml)的mbl,对照组不加mbl,每种培养条件均设置5个复孔。将细胞置于37℃,体积分数为5%的co2培养箱中培养。于培养的第3天收集细胞用于相关实验。
4、流式细胞术检测新鲜cbmc及cbmc在不同条件下转录因子foxp3的表达
(1)收集新鲜cbmc和cbmc在不同条件培养后的细胞悬液加入1.5mlep管,106个细胞/管(约100μl);
(2)于4℃离心机400×g,离心5min,弃上清;
(3)加入400μl1×pbs重悬细胞,于4℃离心机400×g,离心5min,弃上清;
(4)分别加入200μl1×pbs重悬细胞,分别加入pecyanine7-cd3(1μl)、fitc-cd4(2μl)、apc-cd25(2μl),冰上避光孵育30min;
(5)孵育完成后,于4℃离心机400×g,离心5min,弃上清;
(6)加入400μl1×pbs,于4℃离心机400×g,离心5min,弃上清;
(7)分别加入200μl1×fix/perm重悬细胞,冰上避光孵育30min;
(8)孵育完成后,直接加入200μl1×permbuffer,于4℃离心机500×g,离心6min,弃上清;
(9)分别加入400μl1×permbuffer重悬细胞,于4℃离心机500×g,离心6min,弃上清;
(10)分别加入100μl1×permbuffer和2μlpe-foxp3,于冰上避光孵育30min,之后于4℃离心机500×g,离心6min,弃上清;
(11)分别加入400μl1×permbuffer重悬细胞,于4℃离心机500×g,离心6min,弃上清;
(12)分别加入400μl1×pbs重悬细胞,待上机检测,倘若不能及时上机检测可加入500μl4wt%多聚甲醛重悬细胞,于24-48h内上机。
结果:从图1可以看出,新鲜cmbc低表达cd4+cd25+foxp3+t细胞,即cbmc低表达tregs细胞;从图2可以看出,mbl可以提高cbmc中cd4+cd25+foxp3+t细胞的比例,即显著提高cbmc中itreg的比例。
5、用cck-8法检测itreg对pbmcs的增殖影响
将从实验组中分选出的cd4+cd25+t细胞(即itreg)与新鲜提取的人外周血单个核细胞(peripheralbloodmononuclearcells,pbmcs)以1:8、1:4、1:2、1:1比例混合作为实验组,pbmcs为对照组,分别加入包被抗cd3(2μg/ml)和cd28(1μg/ml)单克隆抗体,在37℃,体积分数为5%的co2培养箱中培养4天。培养终止前4h,每孔加入20μlcck-8试剂,继续培养4h,酶联免疫分析仪上检测波长450nm的光密度(od)值,按下列公式计算itreg细胞抑制率。
抑制cd4+cd25-t细胞的增殖(%)=[(未含有itreg细胞的孔中被刺激的cd4+cd25-t细胞-加入itreg细胞的孔中被刺激的cd4+cd25-t细胞)/(未含有itreg细胞的孔中被刺激的cd4+cd25-t细胞-只含有培养基的空白孔)]×100%。
结果:从图3可以得出,itreg细胞以浓度依赖方式抑制pbmcs的增殖,结果提示诱导的itreg细胞具有明显的细胞免疫抑制功能,并且抑制率呈现浓度依赖性。
6、不同浓度mbl对itreg抑制pbmcs增殖的影响
cck-8法检测不同剂量的mbl对itreg细胞与pbmcs以1:1混合培养时的增殖抑制作用。itreg细胞与pbmcs以1:1作为对照组,在此基础上加入不同浓度的mbl作为实验组。每孔细胞体积为200μl,每孔细胞浓度为2×105,然后混合培养于包被anti-cd3抗体96孔板培养4天。培养终止前4h,每孔加入20μlcck-8试剂,继续培养4h,酶联免疫分析仪上检测波长为450nm的光密度(od)值。并计算相应的抑制率。
结果:从图4可以看出,高浓度mbl能够增强itreg对pbmcs增殖的抑制率。
实施例2
实验材料
1、实验所用细胞来源
参考实例1
2、主要试剂
参考实例1
3、主要仪器和设备
参考实例1
4、常用试剂配制
参考实例1
实验方法
1、脐带血单个核细胞的制备
参考实例1
2、包被anti-cd3mab
参考实例1
3、cd4+cd25-t细胞及cd4+cd25+t细胞磁性分选
样品准备
采用密度梯度离心分离外周单个核细胞,为去除血小板,用buffer重悬细胞并200×g离心10-15min,小心吸取上清,重复洗涤。
磁性标记非cd4+t细胞
整个过程要快速完成,并保持细胞处于预冷状态,防止成帽现象出现。
推荐孵育的温度为2-8℃。
ms柱磁性标记≤107细胞、ld柱磁性标记≤108细胞。
采用带有30μm的血液尼龙过滤网的过滤器处理细胞悬液,过滤器使用前用buffer湿润一下。
(1)计数细胞;
(2)细胞悬液于300×g离心10min,完全去上清;
(3)每107加入90μlbuffer重悬细胞;
(4)每107加入10μlcd4+tcellbiotin-antibodycocktail;
(5)混匀并在冰箱(2-8℃)孵育5min;
(6)每107加入20μlanti-biotinmicrobeads;
(7)混匀并在冰箱(2-8℃)孵育10min;
(8)进入下一步磁性分选(所需细胞悬液至少500μl,如不够可添加buffer);
cd4+t细胞的磁性负分选
依据总细胞数目选择适合的分选柱。
总是要等到分离柱中的液体流尽时,再执行下一步。
用ld分离柱分选
将ld分离柱放置于macs分选器中。
加入2×1mlbuffer润洗分离柱。
将细胞悬液置于ld分离柱中。
收集流出的液体,并用1mlbuffer冲洗分离柱2次。收集到的液体即是未标记的cd4+t细胞。
磁性标记cd4+cd25+调节性t细胞
(1)收集的细胞悬液于300×g离心10min,完全弃上清;
(2)加入90μlbuffer重悬细胞;
(3)加入10μlcd25microbeads;
(4)混匀并在冰箱(2-8℃)避光孵育15min;
(5)(可选项)加入染色抗体。比如,10μlcd25-pe、10μlcd4-fitc或cd4-apc,在冰箱(2-8℃)避光孵育5min;
(6)加入1-2mlbuffer洗涤细胞,300×g离心10min,完全弃上清;
(7)加入500μlbuffer重悬细胞。细胞数目应小于108,大于108应相应增加buffer的体积;
(8)进入下一步磁性分选。
ms分离柱阳性分选cd4+cd25+调节性t细胞
为使分选的细胞纯度达到最高,需要使用两个ms分离柱。
(1)将ms分离柱置于macs分选器中;
(2)加入500μlbuffer润洗分离柱;
(3)将500μl细胞悬液置于ms分离柱中,收集流出的液体(cd4+cd25-t细胞);
(4)加入500μlbuffer冲洗ms分离柱3次,完全收集流出的液体(cd4+cd25-t细胞);
(5)将ms分离柱移出macs分选器,放置合适的收集管上;
(6)加入1mlbuffer置于ms分离柱中,立即推动活塞将标记的细胞置于收集管中;
(7)为增加cd4+cd25+细胞的纯度,上一步收集的cd4+cd25+细胞必须通过第二个ms分离柱,重复1-6;
(8)cd4+cd25-t细胞1000rpm离心5min;
(9)弃去上清,cd4+cd25-t细胞加入5ml10wt%fbs的rpmi-1640完全培养液并细胞计数。
4、不同浓度mbl对tregs细胞的诱导分化
上述的cbmc悬液每106/ml细胞数植入预先包被anti-cd3mab(2μg/ml)的96孔细胞培养板中,每孔200μl,各孔均加入anti-cd28mab(1μg/ml)、tgf-β1(5ng/ml),实验组分别加入不同浓度(1-10ng/ml)的mbl,对照组不加mbl,每种培养条件均设置5个复孔。将细胞置于37℃,体积分数为5%的co2培养箱中培养。于培养的第3天收集细胞用于相关实验。
5、流式细胞术检测新鲜cd4+cd25-t、cd4+cd25+t及cd4+cd25-t细胞在不同条件下转录因子foxp3的表达,方法参考实例1。
结果:从图5可以看出,高浓度的cd4+cd25-t细胞不表达foxp3;从图6可以看出,mbl能够促进cd4+cd25-t细胞向itreg细胞诱导分化。
6、用cck-8法检测itreg对cd4+cd25-t的增殖影响
方法参考实例1,结果:从图7可以得出,itreg细胞以浓度依赖方式抑制cd4+cd25-t的增殖,结果表明诱导的itreg细胞具有明显的细胞免疫抑制功能,并且抑制率呈现浓度依赖性。
7、不同浓度mbl对itreg抑制cd4+cd25-t增殖的影响
cck-8法检测不同剂量的mbl对itreg细胞与cd4+cd25-t以1:1混合培养时的增殖抑制作用。itreg细胞与cd4+cd25-t以1:1作为对照组,在此基础上加入不同浓度的mbl作为实验组。每孔细胞体积为200μl,每孔细胞浓度为2×105,然后混合培养于包被anti-cd3抗体96孔板培养4天。培养终止前4h,每孔加入20μlcck-8试剂,继续培养4h,酶联免疫分析仪上检测波长为450nm的光密度(od)值。并计算相应的抑制率。
结果:从图8可以看出,高浓度mbl能够增强itreg对cd4+cd25-t增殖的抑制率。
以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!