一种用于T1、T2双模态磁共振造影剂的磁性纳米颗粒复合物及其制备方法与流程
本发明属于新型核磁共振造影剂的制备和肿瘤诊疗成像技术领域,具体涉及一种用于t1、t2双模态磁共振造影剂的磁性纳米颗粒复合物及其制备方法。
背景技术:
磁共振成像(mri)具有非侵入性、生物安全性以及高的空间分辨率等固有优势而被认为是疾病诊断的最有效手段之一。在mri中,质子密度和翻转时间不同会影响弛豫速率,导致不同生物组织和器官表现出特征的mri对比。然而,当目标器官和周围部位对比效果不明显时,精确的检测目标区域存在困难。mri造影剂可以加速目标部位的t1或t2弛豫率,从而增强病灶部位和正常组织的对比度,在临床应用中通过加强对比度来增加灵敏度和图像质量,从而使诊断更准确。
通常的mri造影剂被分为两类:一类是钆(gd)或锰(mn)等顺磁性化合物,该类造影剂可以引起周围质子弛豫变化并主要改变t1弛豫时间,应用在t1加权成像中得到较快的t1弛豫速率(r1,1/t1),引起t1加权图像变亮;另一种是超顺磁性物质,大部分是基于氧化铁的纳米颗粒,可以缩短t2弛豫时间,引起较快的t2弛豫速率(r2,1/t2)使t2加权成像变暗。然而t1加权成像和t2加权成像造影剂都有它们各自的优点和缺点。例如基于钆的t1加权mri造影剂具有优秀的造影效果,但同时也具有生物毒性威胁,有些临床用钆类造影剂具有使肾脏疾病或肾脏移植后的病人发生肾源性系统性纤维化(nsf)的潜在威胁;基于t2加权成像的超顺磁性氧化铁纳米颗粒具有低毒性,但另一方面,因为磁敏感伪影和它的负造影效果,与周围具有低mr信号的骨、脉管系统等邻近组织不能很好的区别,氧化铁纳米粒子造影剂的应用受到限制。锰的小分子化合物用于t1成像可以减少自由的锰离子直接用于成像的毒性,且与锰的纳米颗粒相比一般具有较高的弛豫率,而ph响应的成像效果可以进一步提高成像的性能。
环境响应诊断成像可以有效的提高造影剂的成像性能使得成像和检测更准确。由于恶性肿瘤代谢途径的改变,肿瘤微环境与正常组织相比有明显的差异。肿瘤酸性微环境的形成与上调糖酵解代谢、乳酸大量生产使得ph值下降相关。发展对该特殊ph变化敏感的纳米粒子用作肿瘤的超灵敏探测、成像和治疗具有一定潜力。
传统的mri造影剂主要影响t1、t2其中一种成像模式,将t1和t2造影剂结合的双模态造影剂为造影剂带来新的突破。然而,该类造影剂的设计实现存在挑战。将ph响应的成像和t1、t2双模态成像模式相结合设计新的成像单元,这类造影剂可以提供区分病变部位和正常部位更精确的磁共振成像信息,在分子影像学的应用中具有极大的应用潜力。
技术实现要素:
本发明提供了一种用于t1、t2双模态磁共振造影剂的磁性纳米颗粒复合物及其制备方法,该磁性纳米颗粒用于制备新一代弛豫率高,毒性低,循环时间长的t1/t2双模态磁共振成像造影剂,将t1和t2两种成像模式结合,同时结合造影剂的环境响应性能,在低ph下释放锰-卟啉实现ph响应的t1成像,最终提高成像的性能和准确度,并且造影剂具有良好的生物相容性。
该磁性纳米颗粒复合物的制备方法中,各步骤反应所需的条件温和,易于操作。
实现本发明上述目的所采用的技术方案为:
一种用于t1、t2双模态磁共振造影剂的磁性纳米颗粒复合物,所述的磁性纳米颗粒复合物为三层核-壳结构,所述的核为fe3o4纳米颗粒,中间层为负载5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉盐酸盐的二氧化硅层,最外层为靶向整合素受体的环肽基团-crgd的聚丙烯酸聚合物层。
一种用于t1、t2双模态磁共振造影剂的磁性纳米颗粒复合物的制备方法,其特征在于包括如下步骤:
1、oa@fe3o4@nsio2@msio2的制备:
1.1、先将油酸包裹的fe3o4纳米颗粒oa@fe3o4分散在环己烷中,得到oa@fe3o4分散液;
1.2、在环己烷和
1.3、在十六烷基三甲基氯化铵和有机碱三乙醇胺的混合水溶液中,加入oa@fe3o4@nsio2水分散液和正硅酸乙酯,此时体系的ph为9-10,oa@fe3o4@nsio2、正硅酸乙酯与十六烷基三甲基氯化铵的质量比为1:15-25:300-400,在60-100℃下反应0.5-1.5小时,得到包裹一层介孔二氧化硅的oa@fe3o4@nsio2,记为oa@fe3o4@nsio2@msio2;
2、oa@fe3o4@nsio2@msio2@paa-crgd的制备:
2.1、将聚丙烯酸分散在ph5.0-6.0的缓冲溶液中,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺和环肽c(rgdyk),聚丙烯酸、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n-羟基琥珀酰亚胺、环肽c(rgdyk)的摩尔比为1-3:0.5-1.5:1-3:0.1-1,调整体系的ph至7.0-7.5,在室温下反应10-12小时,所得的混合产物透析掉残余未反应的小分子后,得到paa-crgd溶液;
2.2、将oa@fe3o4@nsio2@msio2分散在去离子水中,加入paa-crgd溶液和氨水,此时体系的ph为8-10,oa@fe3o4@nsio2@msio2与paa-crgd的质量比为1:1.5-2.5,超声混合均匀,边搅拌边滴加异丙醇,使得paa-crgd沉积在oa@fe3o4@nsio2@msio2表面上,得到oa@fe3o4@nsio2@msio2@paa-crgd;
3、5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉盐酸盐的制备:
3.1、在甲醇中,5,10,15,20-2-([4-叔丁基-苯甲酰氨基]氨基甲酸乙酯)卟啉与四水合乙酸锰反应,5,10,15,20-2-([4-叔丁基-苯甲酰氨基]氨基甲酸乙酯)卟啉和四水合乙酸锰的摩尔比为1:5-6,在60-80℃下回流10-14小时,得到5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉;
3.2、在二氯甲烷中,5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉与氯化氢的1,4-二氧六环溶液反应,5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉与氯化氢的摩尔比为1:90-110,室温下反应10-14小时脱去n-boc保护基团,得到5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉盐酸盐;
4、mn-iosp的制备:
将oa@fe3o4@nsio2@msio2@paa-crgd分散于装有去离子水和异丙醇的混合溶液的反应容器中,加入5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉盐酸盐溶液,oa@fe3o4@nsio2@msio2@paa-crgd与5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉盐酸盐的质量比是1:1-2,将容器置于摇床中,在30-40℃下混合22-26小时,得到用于t1、t2双模态磁共振造影剂的磁性纳米颗粒,记为mn-iosp。
进一步,步骤2.1.2中,加入氨水的质量分数为25-30%;步骤2.2.2中,加入氨水的浓度为2mol/l。
进一步,步骤2.2.1中,先加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺,室温下搅拌2h,再加入环肽c(rgdyk)。
进一步,步骤2.2.2中,异丙醇用0.5-1.5小时滴加完成,最终体系中水与异丙醇的体积比为1:8-10。
进一步,步骤2.2.1中,所得的混合产物用截留分子量为1000da的透析袋进行透析。
进一步,所述的缓冲溶液为mes缓冲溶液,2-吗啉乙磺酸的浓度为50mm。
进一步,所述的聚丙烯酸的重均分子量为2000。
进一步,所述的氯化氢的1,4-二氧六环溶液的浓度为3-4m。
进一步,所述摇床的转速为100rpm。
与现有技术相比,本发明的有益效果和优点在于:
1、本发明的磁性纳米颗粒复合物用于制备t1/t2双模态磁共振成像造影剂,所得造影剂对细胞和组织毒性较小,具有较高的生物相容性,对于肿瘤部位具有较良好的t1、t2成像增强效果。
2、本发明的磁性纳米颗粒复合物最外层连接了-crgd后为具有被动靶向和主动靶向能力的纳米颗粒复合物,增强了其对肿瘤部位的靶向性。
3、本发明的磁性纳米颗粒复合物用于制备t1/t2双模态磁共振成像造影剂,所得的造影剂在ph7.4和ph5.0的pbs中r2/r1的比值分别为20.6和7.7,证明其在弱酸性环境下具有增强的t1成像效果。
附图说明
图1为实施例1制备的oa@fe3o4(a)、oa@fe3o4@nsio2(b)、oa@fe3o4@nsio2@msio2(c)和oa@fe3o4@nsio2@msio2@paa-crgd(d)的透射电镜图。
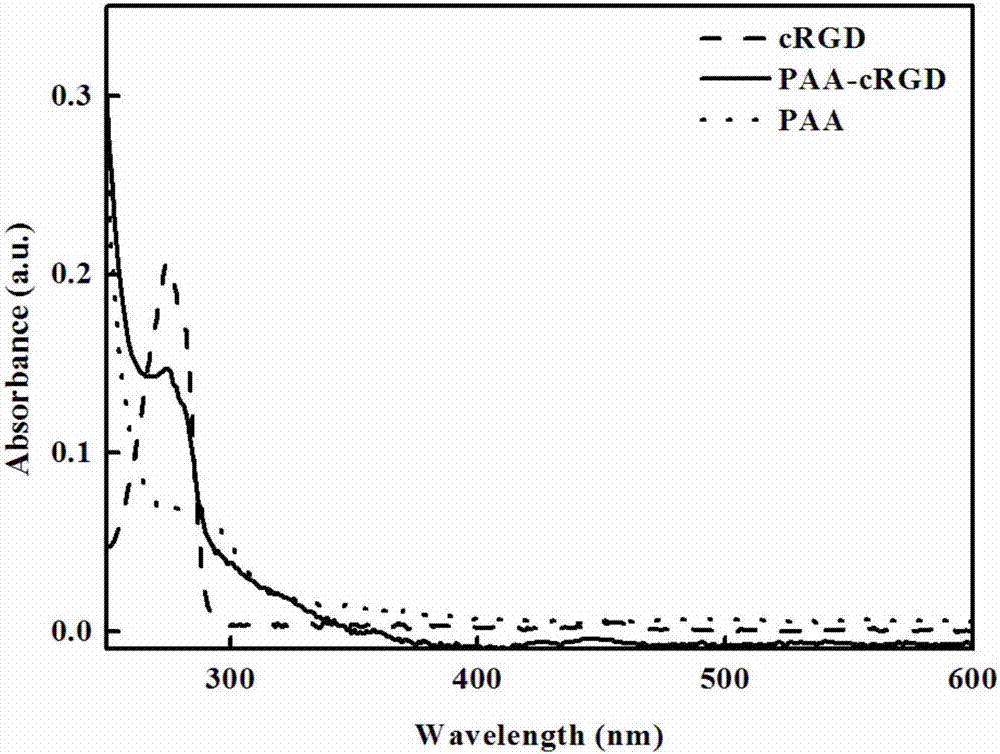
图2为实施例1制备的paa-crgd、paa和c(rgdyk)的紫外吸收光谱图。
图3为实施例1制备的oa@fe3o4@nsio2@msio2@paa-crgd的氮气吸附-脱附曲线。
图4为实施例1制备的oa@fe3o4@nsio2、oa@fe3o4@nsio2@msio2和oa@fe3o4@nsio2@msio2@paa-crgd的磁滞回线。
图5为实施例1制备的mn-iosp在不同浓度、ph的pbs缓冲溶液中t1、t2弛豫率。
图6为实施例1制备的mn-iosp与非小细胞肺癌a549细胞共同孵育后的t1、t2mr成像图。
图7为实施例1制备的mn-iosp用于造影剂对裸鼠肿瘤部位的t1、t2mr加权成像图。
图8为实施例1制备的mn-iosp用于造影剂对a549细胞的mtt实验图。
图9为实施例1制备的mn-iosp用于造影剂在肿瘤移植的裸鼠尾静脉注射2天后的h&e染色组织切片图。
具体实施方式
下面结合具体实施方式对本发明进行详细说明。
实施例1
1、油酸包裹的fe3o4纳米颗粒的制备:
1.1、将1.08gfecl3·6h2o、3.65g油酸钠溶解在8ml乙醇、6ml蒸馏水和14ml己烷的混合溶剂中,得到混合液,将混合液加热到70℃并回流4h,回流结束后,冷却至室温,分层,分离得上方有机层,将有机层用蒸馏水洗涤3次,干燥,得到油酸铁;
1.2、称取1.8g油酸铁和0.62g油酸加入三角烧瓶中,然后加入10g三辛胺,搅拌下将三角烧瓶以25℃/min的速度加热至340℃,并保温搅拌1h,搅拌下再用氮气气流流过三角烧瓶,将三角烧瓶内的混合产物冷却至室温,将混合产物用乙醇-己烷混合溶剂沉淀-再分散(每次提纯使用乙醇100ml、己烷10ml)提纯三次,最后再用乙醇沉淀,得到油酸包裹的fe3o4纳米颗粒,记为oa@fe3o4,将oa@fe3o4分散在环己烷中,配制成7.5mg/ml的oa@fe3o4分散液。
2、oa@fe3o4@nsio2@msio2的制备:
2.1、移取1ml
2.2、将2.0gctac(十六烷基三甲基氯化铵)和0.2gtea(三乙基胺)溶解在20ml去离子水中,然后加入10mloa@fe3o4@nsio2水分散液,超声混合均匀后在80℃下搅拌1h,再加入120μlteos(正硅酸乙酯),此时体系的ph为9-10,继续搅拌反应1h,反应结束后冷却至室温,离心分离,所得的固体用甲醇和去离子水依次洗涤,重复洗涤的操作3次,所得的固体用nacl的甲醇溶液(1wt%,每次使用量为20ml)分散,3小时后离心分离,重复该分散-离心过程3次,以除去残留的ctac,接着用去离子水(每次使用量为20ml)分散所得固体,离心分离,重复该分散-离心过程3次,45℃真空干燥,得到包裹一层介孔二氧化硅的oa@fe3o4@nsio2,记为oa@fe3o4@nsio2@msio2,备用。
3、oa@fe3o4@nsio2@msio2@paa-crgd的制备:
3.1、将400mg聚丙烯酸(mw分子量=2000)分散在ph5.5的mes缓冲溶液(50mm)中,接着加入20mgedc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺)和12mgnhs(n-羟基琥珀酰亚胺),搅拌2h,然后加入10mg环肽c(rgdyk),用0.1m氢氧化钠溶液调整体系的ph值至7.4,在室温(25℃)下反应12h,反应结束后,所得混合产物用截留分子量为1000da的透析袋在去离子水中透析,除去残留的edc、nhs和c(rgdyk),透析每8小时换一次去离子水,每次使用去离子水2l,一共更换5次去离水后收集透析袋中溶液,得到2mg/ml的paa-crgd溶液;
3.2、将0.01goa@fe3o4@nsio2@msio2加入10ml去离子水中,超声10min分散,然后加入10mlpaa-crgd溶液和150μl的氨水(2mol/l),继续超声混合1h,此时体系的ph值为8-10,搅拌下再用滴液漏斗逐滴滴加180ml异丙醇,约1小时滴加完成,离心,所得的固体用乙醇、去离子水(乙醇和去离子水每次使用量均为20ml)依次洗涤离心,该洗涤离心的过程重复3次,45℃真空干燥12h,得到oa@fe3o4@nsio2@msio2@paa-crgd纳米颗粒。
4、5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉盐酸盐的制备:
4.1将94mg5,10,15,20-四(4-羧基苯基)卟啉、143mgedc和90mgnhs混合后溶解在4mldmf(n,n-二甲基甲酰胺)中,氮气保护和室温(25℃)下反应1小时活化羧基,然后加入151mgn-boc-乙二胺和118mgdmap(4-二甲氨基吡啶),室温下(25℃)继续磁力搅拌反应24h,反应结束后,将所得的混合产物倒入100ml饱和nacl溶液中,使用砂芯漏斗过滤,用饱和nacl溶液冲洗漏斗上的滤渣,接着用甲醇冲洗漏斗上的滤渣,收集滤液,滤液用旋转蒸发仪蒸干甲醇得到残余物,将残余物用硅胶柱进一步纯化,使用的展开剂为二氯甲烷/甲醇=90:10,收集产物并干燥,得到5,10,15,20-2-([4-叔丁基-苯甲酰氨基]氨基甲酸乙酯)卟啉;
4.2、将所得的15,20-2-([4-叔丁基-苯甲酰氨基]氨基甲酸乙酯)卟啉(50mg)和四水合乙酸锰(50mg)加入甲醇中,在70℃油浴中加热回流12小时,反应完成后过滤,所得的滤渣用硅胶柱分离纯化(展开剂为二氯甲烷/甲醇=90:10),收集产物并干燥,得到5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉,(maldims)calculated(m)1411.5712;observed(m)1411.5767.
5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉的结构式为:
4.3、在0℃冰浴中,将所得的5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉(30mg)和0.5ml4m氯化氢的1,4-二氧六环溶液加入二氯甲烷中,再直接在室温下(25℃)反应12小时脱去n-boc保护基团,得到5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉盐酸盐,(maldims)calculated(m)1155.2682,(m-4hcl)1011.3615;observed(m-4hcl)1011.3632.
5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉盐酸盐的结构式为:
5、mn-iosp的制备:
将所得的5,10,15,20-2-([4-苯甲酰氨基]氨基甲酸乙酯)锰-卟啉盐酸盐加入水中配成10mg/ml的溶液a,将5mgoa@fe3o4@nsio2@msio2@paa-crgd纳米颗粒分散于水(5ml)和异丙醇(45ml)的混合溶液中,得到分散液b,将1ml溶液a和分散液b加入反应容器中,将反应容器置于摇床中(摇床温度为37℃,转速100rpm)混合24h,混合结束后,离心,所得的固体用ph7.4的pbs溶液(10ml)洗涤-离心3次,得到用于t1、t2双模态磁共振造影剂的磁性纳米颗粒复合物,记为mn-iosp。
将本实施例制得的mn-iosp重新分散在溶液中,用于检测mn-iosp的各项性质和成像性能。
将本实施例制得的oa@fe3o4、oa@fe3o4@nsio2、oa@fe3o4@nsio2@msio2和oa@fe3o4@nsio2@msio2@paa-crgd用透射电镜进行扫描,所得的透射电镜图如图1所示,由图1可以看出,oa@fe3o4、oa@fe3o4@nsio2、oa@fe3o4@nsio2@msio2和oa@fe3o4@nsio2@msio2@paa-crgd等纳米颗粒分散性良好,粒径均一,oa@fe3o4@nsio2@msio2@paa-crgd纳米颗粒的粒径大小约为100nm。
将本实施例制得的paa-crgd溶液用紫外吸收光谱分析检测,所得的紫外吸收光谱图如图2所示,从图2可以看出,274nm处的吸收峰证明环肽c(rgdyk)成功连接到了paa上。
将本实施例制得的oa@fe3o4@nsio2@msio2@paa-crgd纳米颗粒进行氮气吸附-脱附等温实验,得到的氮气吸附-脱附曲线如图3所示,由图3可知,该纳米颗粒的比表面积为349m2/g,孔径分布在3.5nm处达到峰值,证明该纳米颗粒具有介孔结构。
将本实施例制得的oa@fe3o4@nsio2、oa@fe3o4@nsio2@msio2和oa@fe3o4@nsio2@msio2@paa-crgd进行磁滞回线表征,所得的磁滞回线如图4所示,从图4可以看出,这三种纳米颗粒都具有超顺磁性。
将本实施例制得的mn-iosp分散在ph值(7.4、6.5)的pbs缓冲溶液和ph值5.0的醋酸铵缓冲溶液(三种缓冲溶液浓度均为10mm)中,测试不同浓度mn-iosp(以mn元素的浓度计)在不同ph值的缓冲溶液中的t1、t2弛豫时间,将t1、t2弛豫时间对ph和浓度作图,得到的关系曲线如图5所示,由图5可知,在ph7.4和ph5.0的缓冲溶液中,r2/r1的比值分别为20.6和7.7。
将本实施例制得的mn-iosp和非小细胞肺癌a549细胞共同培养,按照mn元素的浓度计算,加入不同浓度(10μm-100μm)的纳米颗粒复合物mn-iosp水分散液,每个浓度使用5*106个非小细胞肺癌a549细胞,1小时后用pbs缓冲液将非小细胞肺癌a549细胞表面的mn-iosp冲洗掉,胰酶消化细胞并用pbs缓冲液收集消化后的细胞,将消化后的细胞转移到直径5mm的核磁管中进行t1、t2加权的mr成像,如图6所示。从图6中可以看出,随着加入mn-iosp浓度的上升,t1、t2弛豫效果增强,由此可见,t1、t2成像加强作用效果与mn-iosp浓度(mn元素浓度)呈明显依赖性。
实验一、本发明的磁性纳米颗粒复合物mn-iosp用于造影剂的磁共振成像实验。
实验方法:
在鼠龄4-5周的balb/c雄性裸鼠大腿皮下种植a549细胞(使用细胞数量1*107),并将种植肿瘤后的裸鼠再饲养2周,直到腿部可以用肉眼观察到小的肿瘤。通过尾静脉对裸鼠注射造影剂(所述的造影剂为将5mgmn-iosp分散在0.01m的pbs中配制成5mg/ml的分散液),注射剂量为200μl,浓度为1.1mgmn/kg(裸鼠体重),使用7.0t小动物成像(brukerbiospec70/20usr)对裸鼠肿瘤部位进行t1、t2加权成像。
实验结果:
所得的磁共振成像如图7所示,注射3小时后检测肿瘤部位的t1、t2弛豫时间发生明显改变,t1弛豫缩短、t2弛豫缩短,由此可见,该磁性纳米颗粒复合物mn-iosp可用于制备造影剂,可用于肿瘤部位的t1、t2双模态成像。
实验二、本发明的磁性纳米颗粒复合物mn-iosp用于造影剂对细胞、组织毒性测试实验
实验方法:
1、在96孔板中接种a549细胞,每孔细胞数量为5000个,培养24小时后分别加入不同浓度的mn-iosp溶液(以mn元素的浓度计),加入4h后吸出,用pbs冲洗掉细胞表面的mn-iosp后,加入rpmi-1640培养基再培养44小时,并加入终浓度为0.5mg/ml的mtt溶液,4小时后除去未反应的mtt溶液,加入200μl的dmso,检测各组细胞的od值,根据od值来判断细胞的存活率。
2、在鼠龄4-5周的balb/c雄性裸鼠大腿皮下种植a549细胞(使用细胞数量1*107),并将种植肿瘤后的裸鼠再饲养2周,直到腿部可以用肉眼观察到小的肿瘤,通过尾静脉对裸鼠注射造影剂(所述的造影剂为将5mgmn-iosp分散在0.01m的pbs中配制成5mg/ml的分散液),注射剂量为200μl、浓度为1.1mgmn/kg(裸鼠体重),对照组注射200μlpbs,48小时后处死裸鼠进行病理切片,遵照标准h&e染色法进行检测。
实验结果:
1、不同浓度的mn-iosp溶液下的细胞存活率如图8所示,从图8可以看出,不同浓度的mn-iosp溶液均无明显的急性细胞毒性。
2、肿瘤移植的裸鼠注射造影剂后的h&e染色组织切片如图9所示,从图9可以看出,mn-iosp无明显的组织毒性。
- 还没有人留言评论。精彩留言会获得点赞!