淫羊藿苷在制备治疗心律失常药物中的应用的制作方法
本发明属于淫羊藿苷技术领域。具体涉及一种淫羊藿苷在制备治疗心律失常药物中的应用。
背景技术:
心律失常是由于窦房结激动异常或激动产生于窦房结以外、激动的传导缓慢、阻滞或经异常通道传导,即心脏活动的起源和(或)传导障碍导致心脏搏动的频率和(或)节律异常。心律失常是心血管疾病中重要的一组疾病,它可单独发病,亦可与其他心血管疾病伴发。其预后与心律失常的病因、诱因、演变趋势、是否导致严重血流动力障碍有关。心律失常可由各种器质性心血管病(如高血压、心肌缺血和心肌梗死、心肌损伤等)、药物中毒、电解质和酸碱平衡失调等因素引起,部分心律失常也可因植物神经功能紊乱所致。近年来,尽管在心律失常的药物治疗上已取得很大的进展,但心律失常病人的死亡率仍然较高。因此,抗心律失常药物的研发已成为当前治疗心脏疾患领域中最为重要的研究内容之一。
心律失常的发病机制与心肌细胞动作电位复极化过程的异常有关,主要表现为心肌细胞动作电位异常。其中,钠通道、钙通道和钾通道在心肌细胞动作电位的形成中有着重要作用,抗心律失常药物也多与之相关。抗心律失常药可直接与离子通道结合,或通过受体等的间接作用,使细胞内外离子浓度发生变化,从而抑制心肌细胞的电活动,纠正心律失常。然而,抗心律失常药不仅影响异常电活动,对正常的电活动也有影响。另外,由于电活动的过度抑制也会产生新的心律失常(致心律失常作用),通过抑制离子流也会影响心肌收缩力,不少药物在心功能低下或心功能不全时禁用。因此,抗心律失常药在某种意义上是难以正确使用的药物,但其效用显著,在临床上处于重要的地位。
目前所用抗心律失常药物的分类及作用机制:
抗心律失常药物现在广泛使用的是改良的Vaughan Williams分类,根据药物作用的电生理学特点,可将抗心律失常药分为四类,其中I类药又分为A、B、C三个亚类。
(一)I类——钠通道阻滞药
1.IA类适度阻滞钠通道,属此类的有奎尼丁等药。
2.IB类轻度阻滞钠通道,属此类的有利多卡因等药。
3.IC类明显阻滞钠通道,属此类的有氟卡尼等药。
(二)II类——β肾上腺素受体阻断药
β肾上腺素受体阻断药因阻断β受体而有效,代表性药物为普萘洛尔。
(三)III类——抑制多种钾电流,选择地延长动作电位时程(APD)及有效不应期的药
除胺碘酮外,Ⅲ类药物目前临床使用已十分谨慎,尤其是抑制IKr的药物。由于IKr是动作电位复极主要的外向电流,IKr减小,能延长APD,导致QT间期延长。许多非心血管类的药物由于能有效抑制IKr,因而存在着引发LQT综合症和尖端扭转型室速等恶性心律失常的风险,许多此类药物已经撤离了美国药品市场。因此,IKr被抑制的程度已被作为评估一种新药是否致心律失常作用的指标。
(四)IV类——钙拮抗药
钙拮抗药阻滞钙通道而抑制Ca2+内流,代表性药物有维拉帕米。
淫羊藿苷(C33H40O15,分子量为676.66)是从中药淫羊藿中提取的一种黄酮类有机物。淫羊藿苷具有广泛的药理作用,如具有抗炎、抗氧化、抗肿瘤和神经保护等作用。“淫羊藿苷在制备治疗通风药物中的应用”(CN201310149856.0)专利技术,报道了淫羊藿苷具有治疗痛风的作用;“淫羊藿苷类化合物及其应用”(CN201410586824.1)专利技术,发现对脱水淫羊藿苷进行结构改造,可预防或者治疗骨质疏松。然而,淫羊藿苷对心肌细胞动作电位、各种离子通道电流以及整体(活体)水平心律失常的影响未见报道。
技术实现要素:
本发明的目的是在现有技术的基础上,提供一种能制备抗心律失常的药物。
本发明是这样实现的:淫羊藿苷在制备治疗心律失常药物方面的应用;所述药物为胶囊、微囊、脂质体、颗粒体、注射液、片剂或口服液。
为叙述简便起见,先将本发明涉及到的技术术语的中文名称及其括号内的英文缩写统一描述如下,以后将用括号内的英文缩写进行描述:左心室肌细胞(LVM);左心房肌细胞(LAM);瞬时钠电流(INaT);晚钠电流(INaL);L-型钙电流(ICaL);内向整流钾电流(IK1);快速延迟整流钾电流(IKr);瞬时外向钾电流(Ito);超快速激活的延迟整流钾电流(IKur);乙酰胆碱敏感型钾电流(IKAch);缓慢延迟整流钾电流(IKs);动作电位(AP);动作电位时程(APD);异丙肾上腺素(ISO);延迟后除极(DAD);触发激动(TA);早期后除极(EAD);海葵毒素(ATX-II);AP的最大去极化速率(Vmax);AP复极50%的时程(APD50);AP复极90%的时程(APD90);动作电位幅值(APA);静息电位(RMP);半数抑制浓度(IC50);刺激周长(CL)。
本发明采用新西兰大耳兔进行实验,通过测定淫羊藿苷对LAM的AP、LAM的离子通道电流、LVM的AP、LVM的离子通道电流、由ISO和高钙引起的LVM的DAD、由ISO和高钙引起的TA、ATX-II引起的LVM的EAD和乌头碱诱发的整体(活体)水平心律失常的作用,证实了淫羊藿苷的抗心律失常作用。具体如下:
淫羊藿苷(5μmol/L和10μmol/L)不仅能够浓度依赖性地减小LAM的Vmax、APD50和APD90,而且能浓度依赖性地减小LVM的Vmax、APD50、APD90和动作电位复极的频率依赖性,而对LAM的APA和RMP没有影响,亦对LVM的APA和RMP没有影响。
ISO(1μmol/L)和高钙(3.6mmol/L)能引起LVM的DAD和TA。淫羊藿苷不仅能有效地抑制DAD和TA,而且能有效地消除ATX-II(10nmol/L)引起的EAD。
淫羊藿苷能够浓度依赖性地抑制LAM和LVM的INaT,IC50分别为12.28±0.29μmol/L(n=8)和11.83±0.92μmol/L(n=10)。淫羊藿苷(1μmol/L,10μmol/L,20μmol/L和40μmol/L)还能抑制10nmol/L ATX-II增大的INaL。
淫羊藿苷浓度依赖性地抑制LAM和LVM的ICaL,IC50分别为13.43±2.73μmol/L(n=9)和4.78±0.89μmol/L(n=13)。并且对LVM的ICaL的抑制效果是LAMs的2.8倍,即对LVM的ICaL的抑制具有一定的心室依赖性。
淫羊藿苷(40μmol/L)不仅对LVM的IK1和IKr无作用,且对LAM的Ito和IKur亦无作用。
在整体(活体)条件下,淫羊藿苷(3mg/kg)可以延长和增加乌头碱诱发心律失常(乌头碱作为一个特殊的Na+通道激动剂可延长该通道的开放时间,进而引起细胞内Na+积累和Ca2+超载,最终引起各种心律失常)的发生时间(时间阈值)和用量(剂量阈值),同时有效降低其诱发室性心动过速和室颤的发生率以及新西兰大耳兔的死亡率。
淫羊藿苷在制备治疗心律失常药物中的应用;所述药物为胶囊、微囊、脂质体、颗粒体、注射液、片剂或口服液。
本发明与现有技术相比,具有以下优点和效果:
1.淫羊藿苷兼有I和IV类抗心律失常的药理作用,同时还能抑制INaL。通过阻滞ICaL、INaL和INaT,淫羊藿苷不仅抑制ISO和高钙引起的DAD和TA,而且还抑制由ATX-II诱发的EAD;故对细胞性心律失常(EAD、DAD和TA)具有显著的抑制效应。
2.淫羊藿苷还能明显抑制心肌细胞动作电位复极的频率依赖性,即随着心率或刺激频率的增加APD逐渐缩短,反之则延长。
3.淫羊藿苷不仅对LVM的IK1和IKr无明显作用,且对LAM的Ito和IKur亦无明显作用,尤其是对IKr和IK1没有影响,增加了使用安全性。
4.在整体(活体)条件下,淫羊藿苷可以延长和增加乌头碱诱发心律失常的发生时间(时间阈值)和用量(剂量阈值),同时有效降低其诱发室性心动过速和室颤的发生率以及新西兰大耳兔的死亡率。
因此,淫羊藿苷可成为一种新的和有效的抗心律失常药物。
附图说明
图1.为淫羊藿苷对乌头碱诱发的心律失常的试验结果图;
图2.为淫羊藿苷对LVM的频率依赖性的浓度依赖性减弱试验结果图;
图3.为淫羊藿苷对LVM的EAD的抑制试验结果图;
图4.为淫羊藿苷对LVM的DAD及TA的抑制试验结果图;
图5.为淫羊藿苷对LVM和LAM的INaT浓度依赖性抑制试验结果图;
图6.为淫羊藿苷对ATX-II增大的LVM的INaL的浓度依赖性抑制试验结果图;
图7.为淫羊藿苷对LVM和LAM的ICaL浓度依赖性抑制试验结果图。
具体实施方式
为了验证本发明的技术效果,本具体实施方式通过从细胞水平和整体水平的研究,说明淫羊藿苷在制药领域的新用途。
1材料
1.1动物
健康成年的新西兰大耳兔,体重1.7~2kg,不论雌雄,由武汉科技大学动物实验中心提供。
1.2主要仪器
EPC9膜片钳放大器(德国Heka Electronic公司);三维微操纵仪(美国Sutter公司);荧光倒置显微镜(日本Nikon公司);两步玻璃微电极拉制仪(日本Narishige公司);恒速泵(保定申辰泵业有限公司)。
1.3药品与试剂
I型胶原酶和CsCl购自美国Gibco公司,牛磺酸、血清白蛋白和HEPES购自瑞士Roche公司,谷氨酸和牛磺酸购自武汉中南生物制品研究所,其它药品均购自美国Sigma Aldrich公司。
1.4实验溶液配制
(1)无钙台式液(mmol/L):NaCl为135,NaH2PO4为0.33,KCl为5.4,MgCl2为1.0,HEPES为10,葡萄糖为10,用NaOH调PH至7.4。
(2)KB液(mmol/L):KOH为70,KCl为40,KH2PO4为20,谷氨酸为50,牛磺酸为20,EGTA为0.5,葡萄糖为10,HEPES为10,MgSO4为3,用KOH调PH至7.4。
(3)记录AP的电极内液(mmol/L):天门冬氨酸钾为110,KCl为30,NaCl为5.0,HEPES为10,EGTA为0.1,MgATP为5.0,磷酸肌酸为5.0,CAMP为0.05,用KOH调PH至7.2。
(4)记录AP和IK1的灌流液为台式液(mmol/L):NaCl为135,NaH2PO4为0.33,KCl为5.4,MgCl2为1.0,1.8为CaCl2,HEPES为10,葡萄糖为10,用NaOH调PH至7.4。
(5)记录INaT的灌流液(mmol/L):NaCl为30,CaCl2为1.0,CsCl为105,MgCl2为1.0,CdCl2为0.05,HEPES为5.0,葡萄糖为5.0,用CsOH调PH至7.4。
(6)记录INaT和INaL的电极内液为(mmol/L):CsCl为120,CaCl2为1.0,MgCl2为5.0,Na2ATP为5.0,四乙基氯化铵为10,EGTA为11,HEPES为10,用CsOH为调PH至7.3。
(7)记录INaL和ICaL的灌流液(mmol/L):NaCl为135,CsCl为5.4,MgCl2为1.0,葡萄糖10,NaH2PO4为0.33,BaCl2为0.3,HEPES为10,CaCl2为1.8,用NaOH调PH至7.4。
(8)记录ICaL的电极内液(mmol/L):CsCl为80,CsOH为60,天门冬氨酸为40,CaCl2为0.65,HEPES为5.0,EGTA为10,MgATP为5.0,磷酸肌酸钠为5.0,用CsOH调PH至7.2。
(9)记录IKr的灌流液(mmol/L):NaCl为135,KCl为5.4,MgCl2为1.0,葡萄糖为5.0,CdCl2为0.2,NaH2PO4为0.33,HEPES为5.0,CaCl2为1.0,用NaOH调PH至7.4。灌流液中加入30μmol/L的293B,用于阻断IKs。
(10)记录IKr的电极内液(mmol/L):KCl为140,MgCl2为1.0,Na2ATP为2.0,EGTA为10,HEPES为5.0,用KOH调PH至7.25。
(11)记录IK1的电极内液(mmol/L):KCl为140,MgCl2为1.0,K2ATP为5.0,EGTA为10,HEPES为5.0,用KOH调PH至7.3。
(12)记录IKur与Ito的灌流液(mmol/L):NaCl为140,KCl为5.4,MgCl2为1.0,葡萄糖为10,NaH2PO4为0.33,HEPES为5.0,CaCl2为1.8,用NaOH调PH至7.4。向灌流液中加入200μmol/L的BaCl2、200μmol/L的CdCl2和1.0μmol/L的阿托品,依次阻断IK1、ICaL和IKAch。
(13)记录IKur与Ito的电极内液(mmol/L):天门冬氨酸钾为110,KCl为20,GTP为0.1,MgCl2为1.0,HEPES为10,EGTA为5.0,MgATP为5.0,磷酸肌酸为5.0,用KOH调PH至7.2。
2、实验方法
2.1、整体实验。取健康成年的新西兰大耳兔20只,雌雄不限,随机分成两组:乌头碱组和淫羊藿苷+乌头碱组。乌头碱组在实验前半小时腹腔注射生理盐水,淫羊藿苷+乌头碱组在实验前半小时腹腔注射3mg/kg淫羊藿苷。实验开始时,两组兔子均经耳缘静脉注射甲苯噻嗪(7.5mg/kg,i.m.)和氯胺酮(30mg/kg,i.v.)进行麻醉,记录II导联心电图,然后通过恒速泵经耳缘静脉给予2ug/kg/min的乌头碱以诱发心律失常。求出乌头碱诱发室性早搏、室性心动过速和室颤的时间,同时求出乌头碱诱发室性早搏、室性心动过速和室颤的乌头碱用量。
2.2、采用酶解法分离单个心肌细胞。选用健康成年的新西兰大耳兔,体重1.7~2kg,不论雌雄,经耳缘静脉注射2000单位肝素钠充分抗凝后,再注射甲苯噻嗪(7.5mg/kg,i.m.)和氯胺酮(30mg/kg,i.v.)以安眠和麻醉。然后将新西兰大耳兔仰卧捆绑固定在兔台上,迅速开胸暴露并分离出心脏,将心脏置于装有37℃的无钙台式液的培养皿中使心脏停止跳动,适当修剪(去除脂肪和结缔组织)后经主动脉逆行插管,将心脏悬挂固定于Langendoff灌流装置上,用氧饱和(体积分数为95%的O2和5%的CO2)且恒温(37℃)的无钙台式液灌流5min,将心腔内残留的血液冲洗干净。再换用含有I型胶原酶(1g/l)和牛血清白蛋白(1g/l)的无钙台式液行逆行灌流,整个过程在恒温(37℃)和100%氧气持续通入的条件下进行,消化酶解30min后终止消化,换用预先加热至37℃和100%氧饱和的KB液反复冲洗5min,从而将心脏中残留的胶原酶液置换出来,以免继续消化。置换完成之后分别将左心房和左心室剪下来放于KB液中,在KB液中将心房和心室剪碎反复吹打,然后经尼绒膜过滤后将细胞悬液保存于含有牛血清白蛋白(1g/l)的KB液中。静置至少1小时后进行试验,试验中所有灌流液都用体积分数为95%的O2和5%的CO2饱和且温度为37℃。
2.3、全细胞膜片钳技术记录LVM的AP、INaT、INaL、ICaL、IK1和IKr,全细胞膜片钳技术记录LAM的AP、INaT、ICaL、IKur和Ito。将细胞悬液滴入特制的细胞池中并置于荧光倒置显微镜的工作台上,待细胞沉降贴壁后用灌流液灌流,而后进行全细胞膜片钳实验。电极由两步玻璃微电极拉制仪拉制,并经热抛光,充入电极内液后电极电阻为1.5-2.5MΩ。电信号经Ag/AgCl电极引导,由膜片钳放大器放大和滤波后储存在计算机硬盘中。
2.4、数据分析
应用Fitmaster进行数据分析,用Origin8.0进行作图和统计分析,所有数据用Mean±SD表示。INaT和ICaL的稳态激活和稳态失活的曲线用Boltzman方程拟合:Y=1/[1+exp(Vm-V1/2)/k],其中Vm表示膜电压,V1/2表示半数激活或半数失活电压,k表示斜率,Y表示相对比值(拟合稳态激活曲线时Y表示G/Gmax,拟合稳态失活曲线时Y表示I/Imax)。电流密度由电流幅度/细胞电容计算得到。两组均数间比较采用T检验(T检验是一种统计学上进行两组均数比较的假设检验方法),多组均数间比较采用方差分析,P<0.05表示有统计学差异。
3、结果
3.1、淫羊藿苷对乌头碱诱发的心律失常的作用
图1为淫羊藿苷对乌头碱诱发的心律失常试验结果图;其中:A为乌头碱组,B为淫羊藿苷+乌头碱组。从图1可以看出:乌头碱组中乌头碱诱发室性早搏、室性心动过速和室颤的时间阈值(min)依次为19、24和56,而淫羊藿苷+乌头碱组乌头碱诱发的心律失常的时间阈值显著延长(P<0.01)。说明淫羊藿苷对乌头碱诱发的心律失常有抑制作用。在乌头碱组中,新西兰大耳兔室性早搏、室性心动过速和室颤的发生率均为100%;在淫羊藿苷+乌头碱组中,新西兰大耳兔室性早搏的发生率为90%,室性心动过速的发生率为40%,室颤的发生率为10%。与乌头碱组相比,淫羊藿苷+乌头碱组中乌头碱诱发新西兰大耳兔室性早搏、室性心动过速和室颤的用量和时间显著增加(P<0.01),新西兰大耳兔的存活率显著提高(P<0.01)。结果分别见表1和表2。
表1淫羊藿苷对乌头碱诱发的心律失常的剂量阈值
与对照组相比##p<0.01。
表2乌头碱诱发心律失常的时间阈值
与对照组相比##p<0.01。
3.2、淫羊藿苷对动作电位及其频率依赖性的作用
1.5倍阈强度、持续5ms和1Hz的刺激频率连续记录动作电位,待稳定后,依次加入5μmol/L和10μmol/L淫羊藿苷。淫羊藿苷不仅浓度依赖性的减小LVM的Vmax、APD50和APD90,亦能减小LAM的Vmax、APD50和APD90,但对LAM的APA和RMP没有影响,亦对LVM的APA和RMP没有影响,结果见表3。
表3淫羊藿苷对左心室和左心房肌细胞动作电位各参数的影响
与对照组相比:#p<0.05,##p<0.01;与5μmol/L淫羊藿苷相比:*p<0.05,**p<0.01。
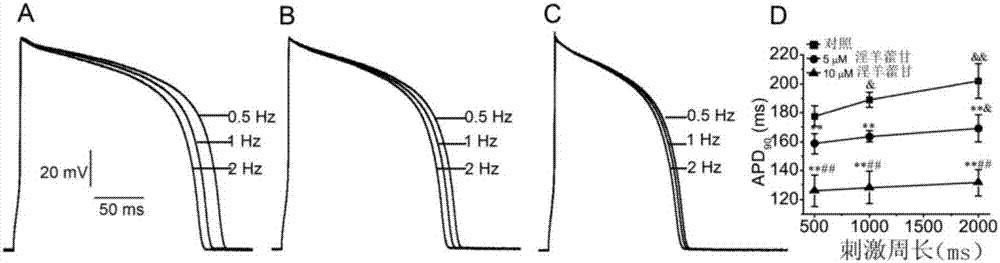
图2为淫羊藿苷对LVM的频率依赖性的浓度依赖性减弱试验结果图;其中:A为对照组,B为5μmol/L淫羊藿苷干预组,C为10μmol/L淫羊藿苷干预组,D为上述三组APD90数据汇总。从图2可以看出:在A图中,随着频率增大动作电位时程越短,即频率依赖性;在B图和C图中,淫羊藿苷能浓度依赖性地减弱频率依赖性;在D图中,在0.5Hz刺激频率下,5μmol/L和10μmol/L淫羊藿苷能使LVM的APD90依次减小16.5±4.8%和34.5±6.4%(n=9,其中n表示试验中细胞的例数,下同)。刺激频率为1Hz时,淫羊藿苷能使APD90依次减小13±4.9%和32.2±7.4%。刺激频率为2Hz时,淫羊藿苷能使APD90依次减小10.5±4.3%和28.5±7.2%。说明淫羊藿苷能浓度依赖性地减弱频率依赖性。
3.3、淫羊藿苷消除细胞性心律失常
在CL=4000ms的刺激下,待LVM的AP稳定后,用含10nmol/L的ATX-II(一种晚钠电流开放剂)的灌流液冲灌细胞,10例细胞中有7例出现EAD。20μmol/L淫羊藿苷可使7例细胞的EAD全部消失。结果如图3所示,图3为淫羊藿苷对LVM早发后除极的抑制试验结果图;其中:A为对照组,B为10nmol/L的ATX-II干预组,C为10nmol/L的ATX-II+20μmol/L淫羊藿苷干预组。从图3可以看出:10nmol/L的ATX-II能显著延长APD(P<0.01)并诱发EAD,而20μmol/L淫羊藿苷能缩短ATX-II引起的APD延长并消除ATX-II诱发的EAD。
另1组试验中,CL=300ms,串刺激(每个串刺激15个脉冲)间隔为9s的条件下记录,待LVM的动作电位稳定后,用含1μmol/L的ISO和3.6mmol/L的CaCl2的灌流液冲灌细胞,可以使9例LVM中的6例产生DAD,其中的3例同时出现TA。结果如图4,图4为淫羊藿苷对LVM的DAD及TA的抑制试验结果图;其中:A为对照组,B为1μmol/L的ISO+3.6mmol/L高钙干预组,C为1μmol/L的ISO+3.6mmol/L的高钙+10μmol/L的淫羊藿苷干预组。从图4可以看出:10μmol/L的淫羊藿苷能完全抑制1μmol/L的ISO和3.6mmol/L的高钙诱发的TA并使DAD明显减弱。
说明淫羊藿苷能有效消除细胞性心律失常。
3.4、淫羊藿苷对INaT和INaL的作用
在研究淫羊藿苷对INaT浓度依赖性作用时,待药物作用稳定后(2.5min),才能加入下一个浓度药物。图5为淫羊藿苷对LVM和LAM的INaT浓度依赖性抑制试验结果图;其中:A为对照组电流图,B为10μmol/L淫羊藿苷干预组电流图,C为不同浓度的淫羊藿苷对LVM和LAM的INaT的影响的I-V曲线。从图5可以看出:淫羊藿苷(1μmol/L,5μmol/L,10μmol/L和20μmol/L)浓度依赖性地抑制LVM和LAM的INaT。淫羊藿苷抑制LVM和LAM的INaT,IC50依次为11.83±0.92μmol/L(n=10)和12.28±0.29μmol/L(n=13)。结果表明:淫羊藿苷对LVM的INaT的抑制效果与对LAM的INaT的抑制效果相似(p>0.05)。
另有试验证明:加入20μmol/L淫羊藿苷前和加入20μmol/L淫羊藿苷后,LVM半数失活电压V1/2依次为-85.47±1.36mV和-91.45±1.48mV(n=8,与对照组相比p<0.01),斜率k依次为8.48±1.05和8.28±0.76(n=8,与对照组相比p>0.05);LAM的半数失活电压V1/2依次为-76.1±1.52mV和-82.28±0.96mV(n=6,与对照组相比p<0.01),k依次为8.29±1.64和8.72±0.81(n=6,与对照组相比p>0.05)。结果表明:淫羊藿苷能使LVM和LAM的INaT稳态失活曲线左移,说明淫羊藿苷能加速INaT的失活过程,且不影响斜率k,但是对LVM和LAM的稳态激活曲线都没有作用。
给LVM施加一个从-80mV以5mV阶跃去极化至+60mV的电压脉冲,持续300ms,频率为0.5Hz,钳制在-90mV,可以记录到INaL,在200ms时测量其大小。为了鉴别所记录电流是否为INaL,向细胞外液中加入4μmol/L河豚毒素可将INaL从-0.39±0.004pA/pF减小到-0.13±0.023pA/pF(n=6,与对照组相比p<0.01),但不改变INaT,这种河豚毒素敏感的电流即为INaL。图6为淫羊藿苷对ATX-II增大的LVM的INaL的浓度依赖性抑制试验结果图;其中:A为对照组电流图,B为10nmol/L的ATX-II干预组电流图,C为10nmol/L的ATX-II+40μmol/L淫羊藿苷干预组电流图,D为不同浓度的淫羊藿苷对ATX-II增大的LVM的INaL的影响的I-V曲线。从图6可以看出:10nmol/L的ATX-II可使INaL明显增大,淫羊藿苷(1μmol/L,10μmol/L,20μmol/L和40μmol/L)能浓度依赖性的抑制ATX-II增大的INaL(n=6)。
3.5、淫羊藿苷对ICaL的作用
将LVM细胞钳制在-40mV,去极化至+5mV,持续300ms,频率为0.2Hz,连续记录ICaL。在对照条件下ICaL有run down现象(随机记录时间的延续,通道电流逐渐减小的现象),持续5min,下降8.5%,然后趋向稳定,基本稳定时间为15min,并且在这段稳定时间内进行相关试验:第一根电流曲线为对照并开始用含10μmol/L的淫羊藿苷的灌流液冲灌细胞,第10根(用药后第45秒)至第13根(用药后第60秒)之间可见ICaL迅速减小,之后随着时间的延续ICaL逐渐变小,第27根(用药后130秒)时药物作用稳定后开始复灌(无淫羊藿苷),第55根(用药后270秒)时,ICaL恢复82%,达到最大值。以上结果表明,淫羊藿苷对ICaL不仅有抑制作用,且药效作用快也容易洗脱,是一种可逆性抑制。
在研究淫羊藿苷对ICaL浓度依赖性作用时,待药物作用稳定后(2.5min),才能加入下一个浓度药物。图7为淫羊藿苷对LVM和LAM的ICaL浓度依赖性抑制试验结果图;其中:A为对照组电流图,B为10μmol/L淫羊藿苷干预组电流图,C为不同浓度的淫羊藿苷对LVM和LAM的ICaL影响的I-V曲线。从图7可以看出:淫羊藿苷能浓度依赖性的抑制LVM和LAM的ICaL;淫羊藿苷抑制LVM和LAM的ICaL,IC50依次为4.78±0.89μmol/L(n=8)和13.43±2.73μmol/L(n=9)。
另有试验证明:10μmol/L淫羊藿苷可以使LVM的稳态失活曲线的V1/2从-25.7±1.01mV偏移到-28.87±2.18mV(n=10,与对照组相比p<0.01),k从7.16±1.08变成7.52±2.31(与对照组相比p>0.05);10μmol/L淫羊藿苷可以使LAM的稳态失活曲线的V1/2从-29.96±0.85mV偏移到-33.94±1.33mV(n=10,与对照组相比p<0.01),k从5.86±0.82变成7.4±1.14(与对照组相比p<0.01)。结果表明淫羊藿苷能使LVM和LAM的ICaL失活曲线向左偏移,失活加快。
3.6淫羊藿苷对钾电流的作用
在研究淫羊藿苷对IK1、IKr、Ito和IKur的作用时,待药物作用稳定(8min)后,才能继续加入下一个浓度。
从-120mV开始以5mV阶跃去极化至+50mV,持续400ms,频率为0.5Hz,将LVM钳制在-40mV(为了使钠通道失活),可以引出IK1。依次加入10μmol/L和40μmol/L淫羊藿苷,IK1大小无明显变化(n=18)。
将LVM钳制在-40mV,以10mV的阶跃去极化至+50mV,持续3s,然后复极化至-40mV,持续5s,记录IKr,只测量其尾电流。依次加入10和40μmol/L的淫羊藿苷,IKr的尾电流大小无明显变化(n=12)。
记录LAM的Ito的脉冲为钳制在-80mV,直接去极化至-40mV,持续100ms(阻断钠电流),然后以10mV阶跃去极化至+50mV,持续400ms。加入40μmol/L的淫羊藿苷,Ito大小无明显变化(n=15)。
将细胞钳制在-50mV,直接去极化至+30mV,持续80ms,这段预脉冲是为了阻断Ito,复极化到-50mV,持续50ms,从-40mV开始以10mV的阶跃去极化至+60mV,持续140ms,复极化至-30mV,可以引出IKur。依次加入20mol/L和40μmol/L的淫羊藿苷,IKur大小无明显变化(n=15)。
综上所述,淫羊藿苷能在制备治疗心律失常药物中应用;所述药物为胶囊、微囊、脂质体、颗粒体、注射液、片剂或口服液。
本具体实施方式具有以下优点和效果:
1.淫羊藿苷兼有I和IV类抗心律失常的药理作用,同时还能抑制INaL。通过阻滞ICaL、INaL和INaT,淫羊藿苷不仅抑制ISO和高钙引起的DAD和TA,而且还抑制由ATX-II诱发的EAD;故对细胞性心律失常(EAD、DAD和TA)具有显著的抑制效应。
2.淫羊藿苷还能明显抑制心肌细胞动作电位复极的频率依赖性,即随着心率或刺激频率的增加APD逐渐缩短,反之则延长。
3.淫羊藿苷不仅对LVM的IK1和IKr无明显作用,且对LAM的Ito和IKur亦无明显作用,尤其是对IKr和IK1没有影响,增加了使用安全性。
4.在整体(活体)条件下,淫羊藿苷可以延长和增加乌头碱诱发心律失常的发生时间(时间阈值)和用量(剂量阈值),同时有效降低其诱发室性心动过速和室颤的发生率以及新西兰大耳兔的死亡率。
因此,淫羊藿苷可成为一种新的和有效的治疗心律失常药物。
应当理解的是,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,而所有这些改进和变换都应属于本发明所附权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!