抗病毒中药组合物及其制备方法和用途与流程
发明领域
本发明属于药物研究开发领域,涉及了具有抗多种急性传染病毒毒株的中药组合物,特别涉及一种能抗甲型流感病毒、寨卡病毒、登革热病毒及基孔肯雅病毒等病毒的中药组合物及其制备和应用。
发明背景
甲型流感病毒、寨卡病毒(zikv)、登革热病毒(den)、基孔肯雅病毒(chikv)由于传播途径普遍,通过蚊煤或呼吸道传播导致病毒迅速蔓延,传染性强、死亡率极高,对人类健康造成了很大威胁。人们已经对这些病毒进行了广泛研究。从分类学上看,甲型流感病毒属正粘液病毒科(orthomyxoviridae);寨卡病毒和登革热病毒属黄病毒科(flaviviridae)黄病毒属(flavivirus);基孔肯雅病毒属披膜病毒科(togaviridae)甲病毒属(alphavirus)。但是,防治甲型流感病毒、寨卡病毒、登革热病毒、基孔肯雅病毒是世界性难题。目前针对这些急性传染病病毒的预防和治疗没有有效的药物和令人满意的临床治疗方案:
1、临床用于甲型流感病毒防治药物主要包括m2离子通道抑制剂和神经氨酸酶抑制剂两大类,金刚烷胺和金刚乙胺的不良反应包括神经毒性等,但同时一般会在开始治疗后2至3天就出现耐药株。奥司他韦不良反应主要为消化道不适,呼吸系统和中枢神经系统不良反应,同时全球流感监测网络在世卫组织合作中心和其它实验室支持下进行了系统监测确证了对甲型h1n1流感病毒耐药。扎那米韦临床采用经口吸入,药粉被直接吸入到病毒的复制部位(呼吸道内)而发挥作用,局部给药给临床患者带来极大不便,可诱导支气管痉挛,不推荐潜在肺疾病患者。正是由于甲型流感病毒高度的变异性而增加了对其预防和治疗难度,因此非常有必要探索高效低毒的新治疗方法。
2、寨卡病毒作为一种rna病毒,目前尚未开发出有效的疫苗和特异性抗病毒药物及治疗手段。
3、登革热病毒和基孔肯雅病毒感染均未开发出有效的抗病毒药物。
中药(tcm)在中国已有数千年的使用历史。中药主要是基于植物制剂中的多种化学成分,其通过多种分子靶点和细胞机制而相互作用并且同时发挥作用。所述多种成分具有不同的功能:某些可以发挥治疗有效性,而另外一些可以减少毒性或者提高生物利用度。目前,植物提取物的混合物已经在世界范围内广泛用于疾病的控制并且越来越被西方国家所接受。
基于中药组合物的抗病毒药物的开发已经有人进行了尝试,但是目前的研究仍处于初步探索阶段,缺少令人信服的实验数据。
名为“一种治疗感染黄病毒科的血液细胞修复中药”的中国专利申请201610226648.x公开了一种治疗感染黄病毒科的血液细胞修复中药,据称对登革热病毒、寨卡病毒等导致的疾病有治愈作用;但是,说明书中并未提供具体的实验数据,尤其是抗病毒数据。
名为“一种治疗登革热的中药组合物”的中国专利申请201610424049.9公开了一种治疗登革热的中药组合物,并未提供任何治疗效果数据。
名为“一种治疗登革热的中药制剂及其制备方法”的中国专利申请201510408826.6公开了一种治疗登革热的中药制剂,说明书提供了对比试验证明了该中药制剂有一定的治疗效果,但并无直接抗病毒活性数据。
名为“一种治疗登革热的中药制剂的制备方法”的中国专利申请201410607204.1公开了一种治疗登革热的中药制剂及其制备方法,说明书提供了药物毒性数据以及临床数据证明了该中药制剂有一定的治疗效果,但并无直接抗病毒活性数据。
技术实现要素:
因此,提供一种具有抗病毒活性的药物组合物是人们所期望的。尤其是,人们迫切需要一种能有效对抗甲型流感病毒、寨卡病毒、登革热病毒、基孔肯雅病毒等急性传染病病毒的药物组合物。
发明人出人意料地发现以蒲公英、百部、山慈菇、葛根、白术、白薇为主要原料药配制成的中药组合物具有显著的抗病毒效力,尤其是对于甲型流感病毒、寨卡病毒、登革热病毒、基孔肯雅病毒等多种急性传染病病毒具有广谱、高效抗病毒活性。
发明人通过大量体内、体外实验发现:以蒲公英、百部、山慈菇、葛根、白术、白薇为主要原料药配制成的中药组合物针对正粘液病毒科、黄病毒科和披膜病毒科的病毒具有显著的抗病毒活性,特别是针对黄病毒科黄病毒属、披膜病毒科甲病毒属和正粘液病毒科甲型流感病毒属的病毒,例如甲型流感病毒(包括h1n1、h7n7和h9n2病毒等)、寨卡病毒、登革热病毒(包括登革热i型和登革热ii型病毒)、基孔肯雅病毒等,具有显著的抗病毒活性。
因此,在一些具体实施方式中,本发明提供了一种抗病毒中药组合物,其是由蒲公英、百部、山慈菇、葛根、白术、白薇药材为原料药制备而成的。
本发明组合物中的各原料中药都是常用中药,在《中国药典》以及《中华本草》等中均有详细的记载,并且都可以通过商业途径容易地获得。本发明对这些中药材的产地来源等并无特别限制,只要符合相关国家标准或规定即可。
在本说明书中,术语“蒲公英”(herbataraxaci)指菊科植物蒲公英taraxacummongolicumhand.-mazz.、碱地蒲公英taraxacumsinicumkitag.或同属数种植物的干燥全草。
在本说明书中,术语“百部”(radixstemonae)是指百部科植物直立百部stemonasessilifolia(miq.)miq.、蔓生百部stemonajaponica(bl.)miq.或对叶百部stemonatuberosalour.的干燥块根。
在本说明书中,术语“山慈菇”是指兰科植物杜鹃兰cremastraappendiculata(d.don)makino干燥假鳞茎,亦称“毛慈菇”。
在本说明书中,术语“葛根”(radixpuerariae)是指豆科植物野葛puerarialobata(willd.)ohwi或甘葛藤puerariathomsoniibenth.的干燥根。
在本说明书中,术语“白术”(rhizomaatractylodismacrocephalae)是指菊科植物白术atractylodesmacrocephalakoidz.的干燥根茎。
在本说明书中,术语“白薇”(radixcynanchiatrati)是指萝藦科植物白薇cynanchumatratumbge.或蔓生白薇cynanchumversicolorbge.的干燥根及根茎。
业已发现,当蒲公英、百部、山慈菇、葛根、白术、白薇的重量比在以下范围内时,所得中药组合物的抗病毒药效尤佳:蒲公英药材的重量为30-70份,百部药材的重量为20-40份,山慈菇药材的重量为20-40份,白薇药材的重量为20-50份,葛根药材的重量为20-50份,白术药材的重量为20-60份。
因此,在一些具体实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:30-70重量份的蒲公英,20-40重量份的百部,20-40重量份的山慈菇,20-50重量份白薇,20-50重量份的葛根,20-60重量份的白术;其中各原料药的优选相对比例如下:
蒲公英:优选30-60重量份,更优选35-55重量份,最优选40-50重量份;
百部:优选25-35重量份,最优选25-30重量份;
山慈菇:优选25-35重量份,最优选25-30重量份;
白薇:优选20-45重量份,更优选20-40重量份,最优选25-35重量份;
葛根:优选20-45重量份,更优选20-40重量份,最优选25-35重量份;
白术:优选20-55重量份,更优选20-50重量份,最优选30-40重量份。
本领域技术人员可以理解:以上所述每一味原料药的任意一个优选用量范围可以与其他原料药的任意一个优选用量范围任意组合,所得各种组合方式都构成本发明的特定实施方式。因此本发明提供了如下一些实施方式。
在一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:30-60重量份的蒲公英,20-40重量份的百部,20-40重量份的山慈菇,20-50重量份白薇,20-50重量份的葛根,20-60重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:30-60重量份的蒲公英,25-35重量份的百部,25-35重量份的山慈菇,20-45重量份白薇,20-45重量份的葛根,20-50重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:30-60重量份的蒲公英,25-35重量份的百部,25-35重量份的山慈菇,20-40重量份白薇,20-40重量份的葛根,20-50重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:30-60重量份的蒲公英,25-35重量份的百部,25-35重量份的山慈菇,25-35重量份白薇,25-35重量份的葛根,30-40重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:35-55重量份的蒲公英,20-40重量份的百部,20-40重量份的山慈菇,20-50重量份白薇,20-50重量份的葛根,20-60重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:35-55重量份的蒲公英,25-35重量份的百部,25-35重量份的山慈菇,20-45重量份白薇,20-45重量份的葛根,20-50重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:35-55重量份的蒲公英,25-35重量份的百部,25-35重量份的山慈菇,20-40重量份白薇,20-40重量份的葛根,20-50重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:35-55重量份的蒲公英,25-35重量份的百部,25-35重量份的山慈菇,25-35重量份白薇,25-35重量份的葛根,30-40重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:40-50重量份的蒲公英,20-40重量份的百部,20-40重量份的山慈菇,20-50重量份白薇,20-50重量份的葛根,20-60重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:40-50重量份的蒲公英,25-35重量份的百部,25-35重量份的山慈菇,20-45重量份白薇,20-45重量份的葛根,20-50重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:40-50重量份的蒲公英,25-35重量份的百部,25-35重量份的山慈菇,20-40重量份白薇,20-40重量份的葛根,20-50重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其包括以下配比的原料药:40-50重量份的蒲公英,25-35重量份的百部,25-35重量份的山慈菇,25-35重量份白薇,25-35重量份的葛根,30-40重量份的白术。
在另一些优选实施方式中,本发明提供了一种抗病毒中药组合物,其中各原料药的用量比例如本说明书中提供的各个具体实施例所述,且每味药的用量相对于实施例中的具体用量可以有约±16%范围内的变动,更优选的每味药的用量相对于实施例中的具体用量可以有约±15%、±12%、±10%、±8%、±5%、±4%、±3%或±2%范围内的变动。
已经发现:当各药材的重量比在以上优选的范围内时,根据本发明的中药组合物的抗病毒活性尤其显著。
本发明的抗病毒中药组合物,可以直接以各原料药的组合方式(例如药包)提供,患者抓药后可以按照中医传统方法直接加水煎服。但是,优选的,本发明的抗病毒中药组合物可以采用现代中药加工处理方式,制成中药提取物组合物(例如预混物)的形式,这样患者用药会更加方便快速。
因此,在一些具体实施方式中,本发明提供了一种抗病毒中药组合物,其包括原料药蒲公英、百部、山慈菇、葛根、白术、白薇的提取物,其中各原料药的相对比例如下:蒲公英为30-70重量份,百部为20-40重量份,山慈菇为20-40重量份,白薇为20-50重量份,葛根为20-50重量份,白术为20-60重量份,且各原料药的优选相对比例如前所述。
在本说明书中,术语“提取物”是指通过使用水或有机溶剂提取中药材原料而获得的提取物。优选地,可以使用提取溶剂如水、c1-c6醇、己烷、氯仿、乙酸甲酯、乙醚等获得的提取物,更优选地,提取溶剂为水、甲醇、乙醇、丙醇、丁醇、戊醇、己醇或其组合,最优选地,提取溶剂选自水、乙醇或其组合。
最优选地,本发明所述的中药组合物中的提取物为各原料药的水提取物和乙醇提取物的组合。这里,“水提取物”是指采用水(包括冷水、温水或热水)提取中药材获得的提取物。这里,“乙醇提取物”是指采用纯乙醇或乙醇水溶液提取中药材获得的提取物。
优选的,本发明所述的中药组合物中的提取物是经干燥的。最优选的,本发明所述的中药组合物中的提取物是干燥的粉末或颗粒形式。
为了获得提取物组合物形式的本发明的中药组合物,例如,可以用水对各中药材进行提取,获得水提取物;也可以用各种浓度(例如40-95%)乙醇水溶液对各种药材进行提取,获得乙醇提取物;也可以将水提取物和乙醇提取物两者合并在一起,得到水提取物和乙醇提取物的组合。在一些优选实施方式中,本发明的中药组合物包括水提取物和乙醇提取物的组合。
本领域技术人员可以根据需要确定具体的提取步骤和提取顺序,例如可以每味药单独提取再合并提取物,或者将一部分或全部种药材先组合在一起再一并提取。不同的提取工艺和操作步骤会影响提取效率和工艺效率。一种比较快速有效的提取方式是:将待提取中药材分成a、b两组,一组用水提取,得水提取物;将第一组的提取残留物与第二组合并后用醇(或醇的水溶液)提取,得醇提取物;再将所得水提取物和醇提取物两者合并。或者反之,将待提取中药材分成a、b两组,一组用醇(或醇的水溶液)提取,得醇提取物;将第一组的提取残留物与第二组合并后用水提取,得水提取物;再将所得醇提取物和水提取物两者合并。
因此,在一些具体实施方式中,本发明还进一步提供了抗病毒中药组合物的制备方法,其包括:
1)取蒲公英、百部、白薇药材以及任选的其他药材,加醇提取,得醇提取物;
2)将步骤1)醇提取物的制备中生成的药渣与葛根、白术、山慈菇药材以及任选的其他药材合并,加水提取,将所得水提取液浓缩后加醇沉淀,取上清液得水提取物;
3)合并步骤1)所得醇提取物和步骤2)所得水提取物,经任选的后处理即得到所述抗病毒中药组合物;
其中各药材的用量如下:蒲公英为30-70重量份,百部为20-40重量份,山慈菇为20-40重量份,白薇为20-50重量份,葛根为20-50重量份,白术为20-60重量份(各药材的优选用量如前文所述)。
优选的,以上步骤所述醇是指乙醇的水溶液,例如为40-95%的乙醇水溶液、或40-80%的乙醇水溶液。取决于具体实施方式,可以使用60%、65%、70%、75%、90%等各种浓度的乙醇水溶液。
步骤3)所述的“后处理”是本领域公知的常规后处理步骤,本领域技术人员根据最终想要的组合物形式可以适当确定所需的后处理操作。例如,如果只需要溶液形式的组合物作为中间产品,则不需要任何后处理步骤。另一方面,如果需要固体形式的组合物,则后处理步骤可以包括浓缩、然后干燥从而获得固体形式的组合物。所述干燥可以采用制药领域常用的任何干燥方法,例如喷雾干燥、微波干燥、真空干燥等。
以上所述步骤1)、步骤2)、步骤3)之前、之后或步骤中间都可以包括其他额外操作,例如为了操作方便,对步骤1)获得的醇提取物可以进行浓缩,对步骤2)获得的水提取物也可以进行浓缩。必要时,也可以进行灭菌操作。
本说明书中,用“任选的”修饰的药材、组分等表示该药材或组分根据需要在某些实施方式中可以存在,而在其他某些实施方式中可以不存在。类似地,用“任选的”或“任选地”修饰的操作或步骤表示该步骤或操作根据需要在某些实施方式的方法中可以存在,而在其他某些实施方式的方法中可以不存在。
发明人发现,采用以上步骤1)至步骤3)的提取方法会提高提取效率,从经济上考虑更加合算。
每一步骤中的具体提取时间、重复次数、乙醇溶液的浓度、提取溶剂的用量等操作参数可以根据需要进行适当调整。
在一些实施方式中,步骤1)所述醇提取物的制备方法为:取蒲公英、百部、白薇药材,加6-10倍量乙醇回流提取1-3次,每次1-2小时,过滤,合并提取液,减压浓缩,即得所述醇提取物。例如,可以加8倍量40-95%乙醇(例如60%、75%或90%的乙醇水溶液)提取1个半小时,过滤;然后再加8倍量40-95%乙醇(例如60%、75%或90%的乙醇水溶液)提取1个半小时,过滤;合并两次所得滤液,即得醇提取物。
在一些实施方式中,步骤2)所述水提取物的制备方法为:取所述醇提取物的制备中生成的药渣与葛根,山慈菇,白术药材合并,加6-12倍量水回流提取1-3次,每次1-4小时,过滤,合并所得滤液,浓缩成稠膏;然后向稠膏中加乙醇水溶液(例如70-95%乙醇水溶液)至乙醇终浓度为60-80%,静置沉淀12-48小时,过滤除去滤渣,即得所述水提取物。例如,取所述醇提取物的制备中生成的药渣,与葛根、白术、山慈菇药材合并,加10倍量水提取2个小时,过滤;然后再加10倍量水提取2个小时,过滤,合并两次所得滤液,即得水提液;浓缩成稠膏,加75%或90%的乙醇水溶液至乙醇终浓度为约70%,静置沉淀36小时,过滤除去滤渣得水提取物;
在一些实施方式中,步骤3)所述操作为:合并步骤1)所得醇提取物和步骤2)所得水提取物,浓缩并喷雾干燥,得到所述抗病毒中药组合物。
本发明的抗病毒中药组合物由蒲公英、百部、山慈菇、葛根、白术、白薇药材为原料药制备而成。如果需要,本发明所述的中药组合物可以包含其他中药材(或中药材提取物)。
例如,发明人业已发现,在本发明的抗病毒中药组合物中额外加入地骨皮和桑白皮后,本发明的中药组合物更加适合体内应用。例如在本发明的抗病毒中药组合物中额外加入地骨皮和桑白皮后,其还具有优异的解热作用,而解热作用有助于增强患者本身对病毒的抵抗力,从而进一步增强了本发明的中药组合物的抗病毒效力。
在本说明书中,术语“地骨皮”(cortexlycii)是指茄科植物枸杞lyciumchinensemill.或宁夏枸杞lyciumbarbaruml.的干燥根皮。
在本说明书中,术语“桑白皮”(cortexmori)是指桑科植物桑morusalbal.的干燥根皮。
因此,在一些具体实施方式中,本发明的抗病毒中药组合物额外含有地骨皮和桑白皮,其中桑白皮为20-60重量份(优选20-55重量份,更优选20-50重量份,最优选25-40重量份),地骨皮为20-60重量份(优选20-55重量份,更优选20-50重量份,最优选30-40重量份)。
因此,在一些具体实施方式中,本发明提供了一种抗病毒中药组合物,其包括原料药蒲公英、百部、山慈菇、葛根、白术、白薇、地骨皮和桑白皮的提取物,其中各原料药的相对比例如下(每一味原料药的任意一个优选用量范围可以与其他原料药的任意一个优选用量范围任意组合):
蒲公英:30-70重量份,优选30-60重量份,更优选35-55重量份,最优选40-50重量份;
百部:20-40重量份,优选25-35重量份,最优选25-30重量份;
山慈菇:20-40重量份,优选25-35重量份,最优选25-30重量份;
白薇:20-50重量份,优选20-45重量份,更优选20-40重量份,最优选25-35重量份;
葛根:20-50重量份,优选20-45重量份,更优选20-40重量份,最优选25-35重量份;
白术:20-60重量份,优选20-55重量份,更优选20-50重量份,最优选30-40重量份;
桑白皮:20-60重量份,优选20-55重量份,更优选20-50重量份,最优选25-40重量份;
地骨皮:20-60重量份,优选20-55重量份,更优选20-50重量份,最优选30-40重量份。
在一些具体实施方式中,本发明的中药组合物仅由以上规定比例的原料药蒲公英、百部、山慈菇、葛根、白术、白薇、地骨皮和桑白皮的提取物组成。
在另一些具体实施方式中,本发明的中药组合物除了蒲公英、百部、山慈菇、葛根、白术、白薇、地骨皮和桑白皮外,还可以根据需要或为了其他目的而含有其他中药材。
因此,在一些具体实施方式中,本发明还进一步提供了抗病毒中药组合物的制备方法,其包括:
1)取蒲公英、百部、白薇、桑白皮药材以及任选的其他药材,加醇提取,得醇提取物;
2)将步骤1)醇提取物的制备中生成的药渣与葛根、白术、山慈菇、地骨皮药材以及任选的其他药材合并,加水提取,将所得水提取液浓缩后加醇沉淀,取上清液得水提取物;
3)合并步骤1)所得醇提取物和步骤2)所得水提取物,经任选的后处理即得到所述抗病毒中药组合物;
其中各药材的用量如下:蒲公英为30-70重量份,百部为20-40重量份,山慈菇为20-40重量份,白薇为20-50重量份,葛根为20-50重量份,白术为20-60重量份,桑白皮为20-60重量份,地骨皮为20-60重量份(各药材的优选用量如前文所述)。
优选的,以上步骤所述醇是指乙醇的水溶液,例如为40-95%的乙醇水溶液、或40-80%的乙醇水溶液。取决于具体实施方式,可以使用60%、65%、70%、75%、90%等各种浓度的乙醇水溶液。步骤3)所述的“后处理”是本领域技术人员根据最终想要的组合物形式可以适当确定的。
本发明的中药组合物,作为药物活性物质,需要时可加入药物可接受的载体或助剂,按照制剂学常规技术制成所需的制剂。制剂中的药物活性物质,可以是0.1-99.9%(例如1-99%或50-98%或50-95%等),其余作为药物可接受的载体或助剂。
本发明的制剂可以是任何可药用的剂型,包括:颗粒剂,片剂,糖衣片剂,薄膜衣片剂,肠溶衣片剂,胶囊剂,口服液,滴丸剂,冲剂,丸剂,散剂,混悬剂,粉剂等。
优选的,本发明的制剂是口服剂型,如:颗粒剂,片剂,胶囊剂,丸剂等。
优选的,本发明的药物制剂,以单位剂量形式存在,所述单位剂量形式是指制剂的单位,如片剂的每片,颗粒剂每袋,胶囊的每粒胶囊等。
单位剂量形式的制剂中优选含1%左右至90%左右(例如20%-80%或30-60%)的活性成分。例如,胶囊、片剂或糖衣丸等单次给药的单位剂型可含有约1mg至约100g(例如10mg至80g、50mg至50g、1g-20g等)的活性成分。
为了制成合适的剂型,作为药物活性物质的本发明的中药组合物可以任选地与适于给药的无机或有机、固体或液体可药用载体或助剂混合或结合。例如,适合的载体特别包括填充剂如糖(例如乳糖)、甘露醇或山梨醇、纤维素制品和/或磷酸钙(磷酸三钙或磷酸氢钙);粘合剂如淀粉糊、明胶、甲基纤维素和/或聚乙烯乙烯吡咯烷酮;崩解剂如淀粉、羧甲基淀粉、交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐(如海藻酸纳)。
在一些具体实施方式中,本发明还提供了为有治疗需要的患者治疗病毒感染性疾病或病状的方法,该方法包括给患者施用有效量的根据本发明任一实施方式的中药组合物。其中,所述患者优选是哺乳动物,尤其优选人。所述施用优选是经口施用。
在一些具体实施方式中,本发明还提供了根据本发明任一实施方式的中药组合物在治疗患者的由病毒导致的疾病或病状方面的用途。其中,所述患者优选是哺乳动物,尤其优选人。
在一些具体实施方式中,本发明还提供了根据本发明任一实施方式的中药组合物在制备用于治疗病毒感染性疾病或病症的药物中的用途。其中,所述疾病或病症优选是哺乳动物、尤其是人的疾病或病症。所述药物优选是口服药物。
在一些具体实施方式中,本发明还提供了用于治疗病毒感染性疾病或病症的根据本发明任一实施方式的中药组合物。其中,所述疾病或病症优选是哺乳动物、尤其是人的疾病或病症。所述中药组合物优选用于口服。
在本说明书中,术语“治疗”指对病毒感染性疾病或病症的预防性或防止性治疗、以及治愈性或缓解性治疗。
在本说明书中,术语“病毒感染性疾病或病症”和“由病毒导致的疾病或病状”具有相同的含义,可互换使用,是指由病毒的传播和感染导致的疾病或病症。
尤其适于采用本发明的中药组合物进行治疗的病毒感染性疾病或病症是由正粘液病毒科、黄病毒科和披膜病毒科的病毒所导致的疾病或病症,特别是黄病毒科黄病毒属、披膜病毒科甲病毒属和正粘液病毒科甲型流感病毒属的病毒所导致的疾病或病症,例如流感、东部马脑炎(eee)、西部马脑炎(wee)、委内瑞拉马脑炎(vee)、乙型脑炎(je)、森林脑炎(rsse)、丙型肝炎(hcv)、登革热等。最优选地,本发明的中药组合物尤其适用于治疗或预防由甲型流感病毒(包括h1n1、h7n7和h9n2病毒等)、寨卡病毒、登革热病毒(包括登革热i型和登革热ii型病毒)、基孔肯雅病毒导致的疾病,包括:流感、基孔肯雅热、登革热(denguefever,df)、登革出血热(denguehaemorrhagicfever,dhf)、登革休克综合症(dengueshocksyndrome,dss)、寨卡病毒病、小头畸形病(microcephaly)等。
治疗中给药的具体方式和剂量可以由主治医生考虑患者的具体情况,尤其是年龄、体重、生活方式、活动水平、疾病严重程度等条件来选择。
一般情况下,哺乳动物的单次给药量约在1-20,000mg/kg范围内。例如,对于优选的治疗人类患者来说,当以中药提取物预混物形式给药时,合适的剂量可以在1-2,000mg/kg、2-1,000mg/kg、5-500mg/kg或10-100mg/kg范围内。如果需要,也可以把此给药量分成任选地平均的几份服用。以上提及的剂量可以按照一定间隔重复施用,例如,每天三次、每天一次、每周一次等等。
本说明书中,“mg/kg”或“mg·kg-1”的意思是按照待治疗的哺乳动物(包括人)的每公斤体重计给药的毫克数,“g/kg”或“g·kg-1”的意思是按待治疗的哺乳动物(包括人)的每公斤体重计给药的克数。
以上所提到的本发明的各个具体实施方式和各个特征的优选级和优选方面可以任意组合,其组合所得各种技术方案都在本发明的范围内。
本发明的有益效果表现在:
本发明的中药组合物具有抗多种急性传染病病毒毒株活性,并且安全性良好。经体内和体外药效学试验结果证明本发明的中药组合物具有显著抗病毒作用,尤其是抗甲型流感h1n1、h7n7和h9n2病毒、寨卡病毒、登革热i型和登革热ii型病毒、基孔肯雅病毒等的广谱抗病毒作用;同时还可能具有提高机体免疫力的作用,对抗病毒具有辅助治疗作用;毒理学试验结果证明该中药组合物安全性良好:猴1个月长毒未观察到有害作用剂量(noael)相当于临床拟用剂量的15倍。
本发明中药组合物有潜力开发成一种口服广谱、抗多种传染性病毒植物复方药,可以用于预防和治疗多种病毒感染性疾病,并可以解决病毒频繁突变导致抗药性的问题,同时安全性良好且使用方便,将是这一疾病领域的临床治疗的革新性重大突破。
附图说明
图1是表示实施例1中药组合物阻止抑制vero细胞中登革2型病毒复制的实验结果图示。其中,纵坐标“den2e1/1000β-actin”表示登革2型病毒在vero细胞中拷贝结果,计算为相对于每1000个β肌动蛋白的登革2型病毒e1基因拷贝数;横坐标“mock”代表病毒对照组(细胞+培养液);“0”代表病毒对照组(细胞+病毒+培养液),“drug”表示受试药物。“**”表示p<0.01;“***”表示p<0.001。
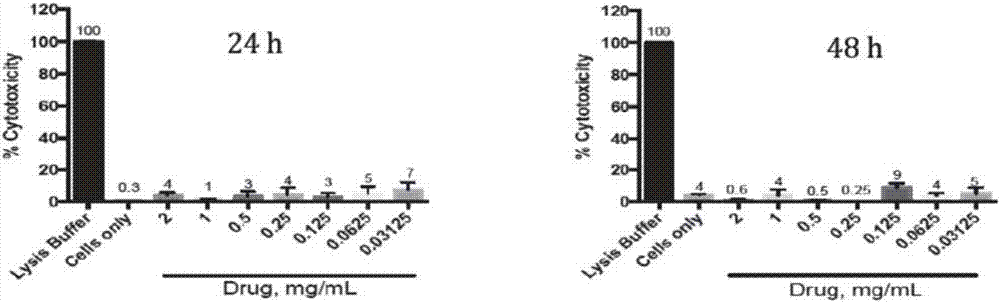
图2是表示ldh法检测实施例1中药组合物的vero细胞毒性的实验曲线。纵坐标“%cytotoxicity”表示细胞毒性百分比,横坐标中“lysisbuffer”代表细胞裂解液,“cellsonly”表示仅有细胞存在,“drug”表示受试药物。
图3是表示实施例2中药组合物阻止寨卡病毒与vero细胞结合的实验结果图示。其中,纵坐标“zikve1/β-actin”表示寨卡病毒与vero细胞的结合结果,计算为相对于每个β肌动蛋白的寨卡病毒e1基因拷贝数;横坐标“mock”代表病毒对照组(细胞+培养液);“0”代表病毒对照组(细胞+病毒+培养液),“drug”表示受试药物。“*”表示p<0.05。
图4是表示实施例4中药组合物抑制基孔肯雅病毒蚀斑形成的实验曲线。纵坐标“numberofplaque”表示蚀斑数目,“plaqueneutralization(%)”表示蚀斑中和百分比,横坐标处“drug”表示受试药物。
图5是表示实施例5中药组合物抑制基孔肯雅病毒与细胞受体的体外结合的实验结果图示。其中,纵坐标“chikve1/β-actin”表示基孔肯雅病毒与vero细胞的结合结果,计算为相对于每个β肌动蛋白的基孔肯雅病毒e1基因拷贝数;横坐标“mock”代表病毒对照组(细胞+培养液);“0”代表病毒对照组(细胞+病毒+培养液),“drug”表示受试药物。“*”表示p<0.05。
图6是表示实施例6的中药组合物抑制寨卡病毒蚀斑形成的实验曲线。纵坐标“plaqueneutralization(%)”表示蚀斑中和百分比,横坐标处“drug”表示受试药物。
图7是表示实施例6中药组合物对血液中寨卡病毒水平的降低作用的实验结果图示。其中,纵坐标“zikve1/100β-actin”表示寨卡病毒在小鼠血液中的复制结果,计算为相对于每100个β肌动蛋白的寨卡病毒e1基因拷贝数;横坐标“control”代表对照组,“medium”代表中剂量药物组,“high”代表高剂量药物组;“d2”表示第二天,“d4”表示第四天。
图8是表示实施例6中药组合物对脾脏、脑和子宫内寨卡病毒复制的抑制作用的实验结果图示。其中,纵坐标“zikve1/100β-actin”表示寨卡病毒在小鼠血液中的复制结果,计算为相对于每100个β肌动蛋白的寨卡病毒e1基因拷贝数;横坐标“control”代表对照组,“medium”代表中剂量药物组,“high”代表高剂量药物组;“spleen”表示脾脏,“brain”表示脑,“uterus”表示子宫。
图9是实施例6中药组合物对小鼠体重影响的实验结果图示。其中,纵坐标“wtingrams”表示小鼠体重(单位:克);横坐标“before”表示给药前,“after”表示给药后;“control”代表对照组,“medium”代表中剂量药物组,“high”代表高剂量药物组。
图10是显示实施例6中药组合物在发热模型动物中的解热作用的实验日程图示。其中“bw”表示体重,“analtemp”表示肛温。
图11是显示实施例6中药组合物的恒河猴毒性实验的实验日程图示。
图12显示了实施例1至实施例6的中药组合物的指纹图谱。
具体实施例
以下通过实施例的具体实施方式再对本发明的上述内容作进一步的详细说明。应当理解,此处所描述的具体实例仅仅用以解释本发明,并不用于限定本发明。在不脱离本发明的精神和原则之内做的任何修改,以及根据本领域普通技术知识和惯用手段做出的等同替换或者改进,均应包括在本发明的保护范围内。
以下实施例中所报道的数字是尽可能精确的,但是本领域技术人员理解由于不可避免的测量误差和实验操作问题,每一个数字都应该被理解为约数,而不是绝对准确的数字。例如,由于称量器具的误差,关于各实施例组合物中各药物的重量值,应该理解为其可能具有±2%或±1%的误差。
实施例1
实施例1的中药组合物配方如下:
蒲公英:470g
百部:280g
山慈菇:280g
白薇:315g
葛根:315g
白术:380g
所用的原料药之中,蒲公英采集自中国河北省,白薇采集自中国河南省,葛根采集自中国河北省,百部采集自中国广西省,山慈菇采集自中国四川省,白术采集自中国浙江省。
实施例1的中药组合物制备工艺如下:
(1)取470g蒲公英、280g百部、315g白薇药材,加8倍量60%乙醇提取1个半小时,过滤;然后再加8倍量60%乙醇提取1个半小时,过滤;合并两次所得滤液,即得醇提液;
(2)取所述醇提液的制备中生成的药渣,合并315g葛根、280g山慈菇、380g白术药材,加10倍量水提取2个小时,然后再加10倍量水提取2个小时,过滤,合并两次所得滤液,浓缩成稠膏,加90%乙醇并搅拌直至乙醇终浓度为约75%,静置24小时,取上清液,得水提液;
(3)合并步骤1所得醇提液和步骤2所得水提液,浓缩并喷雾干燥后即得本发明实施例1所述中药组合物。所得组合物为棕色粉末状,重量约0.34kg,直接用于下面的体外体内实验。
下面对实施例1所述中药组合物(该组合物在实验中被称为“受试药物”或“受试物”)进行各种药效学研究,以验证其药效。
1.实施例1组合物体外抑制登革2型病毒(dengue-2)复制试验
vero细胞(非洲绿猴肾细胞,购自美国模式培养物保藏所(atcc),ccl-81)以6×105/孔铺于六孔板中,5%co237℃孵育24小时,形成单层细胞。受试物溶解于pbs缓冲液中,过滤除菌,分别稀释到1.0和0.1mg/ml。将登革2型病毒(购自美国模式培养物保藏所atcc,vr-1584)和0.1mg/ml、1.0mg/ml的受试物分别加入到vero单层细胞中,37℃下培养24小时,通过qpcr对细胞内病毒复制(登革2型e基因)进行定量分析,具体分析方法见paulam,shiy,acharyad,etal.deliveryofantiviralsmallinterferingrnawithgoldnanoparticlesinhibitsdenguevirusinfectioninvitro.[j].journalofgeneralvirology,2014,95(8):1712-22.
pcr实验结果显示受试物能够显著抑制体外登革2型病毒的复制(见图1)。
2.乳酸脱氢酶(ldh)法检测实施例1组合物对vero细胞毒性
试验采用ldhcytotoxicitydetectionkitplus试剂盒(购自rochediagnostics),操作方式详见试剂盒说明书,过程简单描述如下:vero细胞(购自美国模式培养物保藏所(atcc),ccl-81)以100μl4×104/孔铺于96孔细胞培养板中,并设置两个复孔(即每个实验一式两份)。培养板以5%co237℃孵育过夜。受试物溶解于pbs缓冲液中,过滤除菌,分别稀释到1.0、0.25、0.125、0.0625、0.03125、0.0156mg/ml。10μl不同浓度(2.0、1.0、0.25、0.125、0.0625、0.03125、0.0156mg/m1)的受试物加入细胞培养板中,以10μlpbs作为空白对照,同样设两个复孔。培养板以5%co237℃孵育24和48小时。孵育后,用elx808ultramicroplatereader酶标仪(biotek)于450nm处读数,测定培养液中ldh浓度,按照试剂盒说明书计算细胞毒性。
实验结果显示,受试物在2mg/ml浓度下孵育48小时,不引起明显的vero细胞毒性(见图2)。这些结果排除了受试物抑制登革病毒的作用是由细胞毒性所引起的可能性,进一步确认受试物在体外能够抑制登革病毒感染。
实施例2
实施例2的中药组合物配方如下:
蒲公英:680g
百部:390g
山慈菇:400g
白薇:480g
葛根:440g
白术:540g
原料药的来源同实施例1。实施例2的中药组合物制备工艺如下:
(1)取680g蒲公英、390g百部、480g白薇药材,加10倍量60%乙醇提取1个半小时,过滤;然后再加10倍量60%乙醇提取1个半小时,过滤;合并两次所得滤液,即得醇提液;
(2)取所述醇提液的制备中生成的药渣,合并440g葛根、400g山慈菇、540g白术药材,加8倍量水提取2个小时,然后再加8倍量水提取2个小时,过滤,合并两次所得滤液,浓缩成稠膏,加90%乙醇并搅拌直至乙醇终浓度为约75%,静置24小时,取上清液,得水提液;
(3)合并步骤1所得醇提液和步骤2所得水提液,浓缩并喷雾干燥后即得本发明所述中药组合物。所得组合物为棕色粉末状,重量约0.5kg,直接用于下面的体外体内实验。
下面对实施例2所述中药组合物(该组合物在实验中被称为“受试药物”或“受试物”)进行各种药效学研究,以验证其药效。
1.实施例2组合物体外抗寨卡病毒(zikv)药效学研究
vero细胞来源及处理方式同实施例1(见实施例1的1),以6×105/孔铺于六孔板中,37℃,5%co2中孵育24小时,形成单层细胞。将感染系数为1的寨卡病毒(由美国疾控中心虫媒病毒部门(cdcarbovirusbranch)提供)与1.0mg/ml、0.1mg/ml的受试物水溶液混合并加到vero单层细胞上,4℃孵育1小时。在此温度下,病毒可以与细胞表面的受体结合,但不能进入细胞质。孵育后,细胞以4℃培养液洗涤以移除未结合的病毒。之后,将细胞以trizol处理收集,并提取总rna,合成单链cdna。实时定量pcr法定量寨卡病毒的外壳蛋白基因和看家基因β-actin。具体方法详见acharyad,bastolap,lel,etal.anultrasensitiveelectrogeneratedchemiluminescence-basedimmunoassayforspecificdetectionofzikavirus[j].scientificreports,2016,6:32227。
结果显示,1.0mg/ml、0.1mg/ml浓度的组合物分别能够阻止约80%和40%寨卡病毒与受体结合(见图3)。
实施例3
实施例3的中药组合物配方如下:
蒲公英:310g
百部:200g
山慈菇:190g
白薇:210g
葛根:210g
白术:250g
原料药的来源同实施例1。实施例3的中药组合物制备工艺如下:
(1)取310g蒲公英、200g百部、210g白薇药材,加10倍量60%乙醇提取1个半小时,过滤;然后再加10倍量60%乙醇提取1个半小时,过滤;合并两次所得滤液,即得醇提液;
(2)取所述醇提液的制备中生成的药渣,合并210g葛根、190g山慈菇、250g白术药材,加8倍量水提取2个小时,然后再加8倍量水提取2个小时,过滤,合并两次所得滤液,浓缩成稠膏,加90%乙醇并搅拌直至乙醇终浓度为约80%,静置24小时,取上清液,得水提液;
(3)合并步骤1所得醇提液和步骤2所得水提液,浓缩并喷雾干燥后即得本发明所述中药组合物。所得组合物为棕色粉末状,重量约0.23kg,直接用于下面的体外体内实验。
下面对实施例3所述中药组合物(该组合物在实验中被称为“受试药物”或“受试物”)进行各种药效学研究,以验证其药效。
1.实施例3组合物体外抗禽流感病毒h7n7的药效学研究
1)cpe法测定病毒对mdck细胞的半数毒性浓度(tcid50)
将mdck细胞(犬肾上皮细胞,由北京市农林科学院畜牧兽医研究所畜禽生物制剂高技术研究室提供)接种于96孔板,每孔100μl,含细胞2×104个/孔,37℃培养24h,细胞长成单层,将禽流感病毒h7n7株(由北京市农林科学院畜牧兽医研究所提供)用培养液依次10倍稀释10-3至10-12共10个浓度加至细胞孔内,每浓度8孔,37℃培养。每天用倒置显微镜观察细胞病变(cpe)。记录细胞病变程度(cpe)。用reed-muench法计算病毒半数感染剂量(tcid50)。
细胞感染病毒后肿胀、拉网、皱缩、聚集成团,禽流感病毒h7n7的tcid50为10-4.19/0.1ml。
2)受试物直接灭活禽流感病毒h7n7流感病毒的测定
将mdck细胞接种于96孔板,每孔100μl,含细胞2×104个/孔,37℃,5%co2培养24h,细胞长成单层。抛弃上清液,将不同浓度的药物水溶液与等体积的100tcid50流感病毒在管中混匀,作用6h后再将混合液接种于细胞板。设正常细胞对照组、阳性药对照组(金刚烷胺盐酸盐,购自sigma公司)及病毒对照。吸附2h后,抛上清液,加入细胞维持液,37℃,5%co2培养箱继续培养。记录细胞病变结果,mtt染色法测定细胞活性。试验重复2次。用统计软件spss13.0对数据进行probit回归分析,计算药物半数有效浓度(ic50)。
结果见表3-1,受试药物半数抑制浓度(ic50)分别测定为410μg/ml和447μg/ml,表明受试物具有直接灭活禽流感病毒h7n7的作用。
表3-1受试药物抗h7n7病毒活性
实施例4
实施例4的中药组合物配方如下:
蒲公英:560g
百部:320g
山慈菇:350g
白薇:360g
葛根:380g
白术:460g
原料药的来源同实施例1。实施例4的中药组合物制备工艺如下:
(1)取560g蒲公英、320g百部、360g白薇药材,加10倍量60%乙醇提取1个半小时,过滤;然后再加10倍量60%乙醇提取1个半小时,过滤;合并两次所得滤液,即得醇提液;
(2)取所述醇提液的制备中生成的药渣,合并380g葛根、350g山慈菇、460g白术药材,加8倍量水提取2个小时,然后再加8倍量水提取2个小时,过滤,合并两次所得滤液,浓缩成稠膏,加90%乙醇并搅拌直至乙醇终浓度为约80%,静置24小时,取上清液,得水提液;
(3)合并步骤1所得醇提液和步骤2所得水提液,浓缩并喷雾干燥后即得本发明所述中药组合物。所得组合物为棕色粉末状,重量约0.4kg,直接用于下面的体外体内实验。
下面对实施例4所述中药组合物(该组合物在实验中被称为“受试药物”或“受试物”)进行各种药效学研究,以验证其药效。
1.实施例4中药组合物体外抗基孔肯雅病毒(chikv)药效学研究
vero细胞来源及处理同实施例1,基孔肯雅病毒由美国康涅狄格农业试验站提供。在室温下用新配的浓度分别为2.0、1.0、0.5、0.25、0.125mg/ml的受试物水溶液对基孔肯雅病毒(约150pfu)进行孵化1小时,之后将溶液加入到vero细胞单层中,37℃下继续孵化,1小时后评价蚀斑的形成情况。具体方法见acharyad,paulam,andersonjf,etal.lossofglycosaminoglycanreceptorbindingaftermosquitocellpassagereduceschikungunyavirusinfectivity.[j].plosneglectedtropicaldiseases,2015,9(10):e0004139.
蚀斑中和结果显示,受试物能够抑制基孔肯雅病毒,受试物对基孔肯雅病毒的抑制具有剂量依赖性,半抑制浓度ec50值为282.6ug/ml(图4)。
实施例5
实施例5的中药组合物配方如下:
蒲公英:370g
百部:220g
山慈菇:230g
白薇:270g
葛根:270g
白术:280g
原料药的来源同实施例1。实施例5的中药组合物制备工艺如下:
(1)取370g蒲公英,220g百部,270g白薇药材,加10倍量60%乙醇提取1个半小时,过滤;然后再加10倍量60%乙醇提取1个半小时,过滤;合并两次所得滤液,即得醇提液;
(2)取所述醇提液的制备中生成的药渣,合并270g葛根、230g山慈菇、280g白术药材,加8倍量水提取2个小时,然后再加8倍量水提取2个小时,过滤,合并两次所得滤液,浓缩成稠膏,加90%乙醇并搅拌直至乙醇终浓度为约80%,静置24小时,取上清液,得水提液;
(3)合并步骤1所得醇提液和步骤2所得水提液,浓缩并喷雾干燥后即得本发明所述中药组合物。所得组合物为棕色粉末状,重量约0.28kg,直接用于下面的体外体内实验。
下面对实施例5所述中药组合物(该组合物在实验中被称为“受试药物”或“受试物”)进行各种药效学研究,以验证其药效。
1.实施例5中药组合物体外抗基孔肯雅病毒(chikv)药效学研究
vero细胞来源及处理同实施例1,基孔肯雅病毒来源同实施例4。vero细胞以6×105/孔铺于六孔板中,37℃,5%co2中孵育24小时,形成单层细胞。将基孔肯雅病毒与1.0mg/ml、0.1mg/ml的受试物水溶液混合并加到单层细胞上,4℃孵育1小时。在此温度下,病毒可以与细胞表面的受体结合,但不能进入细胞质。孵育后,细胞以4℃培养液洗涤以移除未结合的病毒。之后,将细胞以trizol处理收集,并提取总rna,合成单链cdna,实时定量pcr法定量基孔肯雅病毒的外壳蛋白基因和看家基因β-actin,实时定量pcr检测方法详见acharyad,paulam,andersonjf,etal.lossofglycosaminoglycanreceptorbindingaftermosquitocellpassagereduceschikungunyavirusinfectivity.[j].plosneglectedtropicaldiseases,2015,9(10):e0004139.
实验结果显示受试物在0.1mg/ml、1.0mg/ml下能够部分抑制chikv与vero细胞受体的结合(见图5)。
实施例6
实施例6的中药组合物配方如下:
蒲公英:480g
百部:290g
山慈菇:290g
白薇:320g
葛根:320g
白术:385g
桑白皮:320g
地骨皮:385g
所用的原料药之中,蒲公英采集自中国河北省,白薇采集自中国河南省,葛根采集自中国河北省,百部采集自中国广西省,山慈菇采集自中国四川省,白术采集自中国浙江省,桑白皮采集自中国山东省,地骨皮采集自中国宁夏回族自治区。
实施例6的中药组合物制备工艺如下:
(1)取480g蒲公英、290g百部、320g白薇、320g桑白皮药材,加8倍量60%乙醇提取1个半小时,过滤;然后再加8倍量60%乙醇提取1个半小时,过滤;合并两次所得滤液,即得醇提液;
(2)取所述醇提液的制备中生成的药渣,合并320g葛根、290g山慈菇、385g白术、385g地骨皮药材,加10倍量水提取2个小时,然后再加10倍量水提取2个小时,过滤,合并两次所得滤液,浓缩成稠膏,加90%乙醇并搅拌直至乙醇终浓度为约70%,静置36小时,取上清液,得水提液;
(3)合并步骤1所得醇提液和步骤2所得水提液,浓缩并喷雾干燥后即得本发明所述中药组合物。所得组合物为棕色粉末状,重量约0.48kg,直接用于下面的体外体内实验。
下面对实施例6所述中药组合物(该组合物在实验中被称为“受试药物”或“受试物”)进行各种药效学研究,以验证其药效。
1.实施例6组合物体外抗禽流感病毒h9n2的药效学研究
1.1cpe法测定病毒对mdck细胞的半数毒性浓度(tcid50)
将mdck细胞(犬肾上皮细胞,由北京市农林科学院畜牧兽医研究所提供)接种于96孔板,每孔100μl,含细胞2×104个/孔,37℃培养24h,细胞长成单层;将禽流感病毒h9n2流感病毒(由北京市农林科学院畜牧兽医研究所提供)原液用培养液依次10倍稀释10-3至10-12共10个浓度加至细胞孔内,每浓度8孔,37℃培养。每天用倒置显微镜观察并记录细胞病变(cpe),用reed-muench法计算病毒半数感染剂量(tcid50)。
实验结果表明:细胞感染病毒后肿胀、拉网、皱缩、聚集成团,禽流感病毒h9n2的tcid50为10-3.5/0.1ml。
1.2mtt法分别测定受试药物对mdck细胞的半数抑制浓度(tc50)
将mdck细胞分别接种于96孔板,每孔100μl,含细胞2×104个/孔,37℃,5%co2培养24h,细胞长成单层。吸去上清,分别加入10000、5000、2500、1250、625、312.5、156.25、78.12、39.06μg/ml受试药物水溶液,每浓度4孔,设细胞对照(细胞+培养基)。设金刚烷胺(购自sigma公司)为阳性对照药,浓度梯度为312.5、156.25、78.12、39.06μg/ml,每浓度4孔,观察3天后加mtt染色4小时,吸去上清加dmso溶解0.5小时,用酶联检测仪测定od570nm吸收值(结果见表6-1)。用统计软件spss13.0对数据进行probit回归分析,计算药物的半数细胞毒性浓度(tc50)。
经spss13.0对数据进行probit回归分析,药物对mdck细胞的半数抑制浓度tc50为1596μg/ml;该药物对mdck细胞的最大无毒浓度为1250μg/ml,在此浓度下细胞形态与对照细胞相同。作为对比,金刚烷胺最大无毒浓度大于312.5μg/ml。
表6-1受试物对mdck细胞的毒性结果
1.3受试物直接灭活禽流感病毒h9n2流感病毒的测定
将mdck细胞接种于96孔板,每孔100μl,含细胞2×104个/孔,37℃,5%co2培养24h,细胞长成单层。抛弃上清液,将不同浓度的药物水溶液与等体积的100tcid50流感病毒在管中混匀,作用6h后再将混合液接种于细胞板。设正常细胞对照组、阳性药(金刚烷胺,购自sigma公司)对照及病毒对照。吸附2h后,抛上清液,加入细胞维持液,37℃,5%co2培养箱继续培养。记录细胞病变结果,mtt染色法测定细胞活性。试验重复2次。用统计软件spss13.0对数据进行probit回归分析,计算药物半数有效浓度(ic50)。
结果见表6-2,受试物的半数抑制浓度(ic50)平均值为380.5μg/ml,表明受试物具有明显直接灭活禽流感病毒h9n2流感病毒的作用。
表6-2受试药物抗h9n2病毒活性
2.实施例6组合物体外抗寨卡病毒(zikv)药效学研究
vero细胞(非洲绿猴肾细胞,购自美国模式培养物保藏所(atcc),ccl-81)以6×105/孔铺于六孔板中,5%co237℃孵育24小时,形成单层细胞;受试物溶解于pbs缓冲液中,过滤除菌,分别稀释到1.0、0.25、0.125、0.0625、0.03125、0.0156mg/ml。寨卡病毒(由美国疾控中心虫媒病毒部门(cdcarbovirusbranch))与用dmem细胞培养液(1%l-谷氨酰胺,1%青霉素/链霉素和10%fbs)稀释到不同浓度的受试物在室温预先混合孵育1小时。之后,将混合物加入单层的vero细胞孔中,于37℃,5%co2孵育1小时让病毒渗透入细胞或被细胞吸收。将病毒移除后,再将细胞覆盖于1%琼脂糖凝胶上,37℃,5%co2孵育4天。用0.3%中性红染色活细胞后,将细胞培养板取出移去染色培养基;再将培养板返回温箱1-2h,然后在白色衬底上清楚地看到红色背景中不着色的蚀斑。计出每一稀释度平均蚀斑数。
体外实验结果显示,受试物能够有效抑制寨卡病毒,受试物抑制寨卡病毒蚀斑形成的半数有效剂量为193.1μg/ml(见图6)。
3.实施例6组合物对寨卡病毒(zikv)感染雌性小鼠体内药效学研究
为研究受试物对小鼠寨卡病毒感染的抑制作用,本实验第一天对c57bl/6雌性小鼠(周龄5周,购自thejacksonlaboratory(barharbor,me))进行称重,同时每只小鼠腹腔注射2mgifnr1抗体(mar1-5a3)。第二天,每只小鼠腹腔注射1x104pfu的寨卡病毒(由美国疾控中心虫媒病毒部门(cdcarbovirusbranch)提供)进行感染,并将小鼠分成三个组(每组10只):安慰剂组(control),中剂量组(medium)和高剂量组(high)。感染后第四个小时,安慰剂组经口灌胃给予无菌水100μl,中剂量组经口灌胃给予100μl的受试物水溶液,给药剂量为0.75g/kg,高剂量组经口灌胃给予100μl的受试物水溶液,给药剂量为1.50g/kg,各组每天给药一次,连续给药6天。
在寨卡病毒感染后的第2天和第4天,对小鼠进行眼眶取血用于寨卡病毒与小鼠β-肌动蛋白的rna提取、cdna合成和mrna的qpcr分析(分析方法同实施例2)。qpcr结果显示,高剂量的受试物在感染后的第2天能够显著抑制寨卡病毒在小鼠血液内的复制(p<0.05),在感染后的第4天有抑制的趋势(见图7)。
试验中每天观察小鼠的发病率与死亡率。除安慰剂组的1只动物在第三天和第四天之间死亡外,所有动物均未见异常。在寨卡病毒感染后的第6天,对所有小鼠进行称重并处死。取小鼠的脾脏、脑和子宫,分离提取脾脏、脑和子宫中的总rna,之后进行寨卡病毒与小鼠β-肌动蛋白的cdna合成以及mrna的qpcr分析(分析方法同实施例2)。结果显示(见图8):受试物高剂量(1.5g/kg)能够显著抑制寨卡病毒在脾脏的感染;同时对寨卡病毒在脑和子宫的感染有抑制趋势,但差异不显著(经分析研究,认为这很可能是由实验异常值引起的)。
为评价受试物对小鼠的潜在毒性作用,通过试验前后的体重对比,结果显示受试物对体重无显著影响,表明受试物对小鼠没有副作用(见图9)。
4.经口给予实施例6组合物对大鼠解热作用的试验研究
4.1试验动物
sd大鼠(spraguedawleyrat)购自成都达硕实验动物有限公司;生产许可证号:scxk(川)2013-24;动物合格证号:0018409。实验中共使用15只雌性和15只雄性大鼠。购入时体重:150-170g,年龄:8-9周,实验时体重:180-200g。
动物入选标准为:
1)动物体重:试验期选择体重范围0.18-0.20kg的动物
2)实验开始前3天,每天同一时间测量动物肛温1次,选取3次肛温检测在37.5-38.5℃之间,且肛温差变化不超过0.5℃的动物作为模型用鼠。
4.2试验设计及周期
适应期3天,给药观察期1天;给药当天以d1表示。详细日程安排见图10。
4.3试验
本次试验采用sd大鼠皮下注射20%干酵母悬液5ml·kg-1作为致热源建立致热模型进行药效评价。选用30只健康的sd大鼠,共随机分为6组:受试物4g·kg-1组、受试物2g·kg-1组、受试物1g·kg-1组,阳性对照阿司匹林100mg·kg-1组,发热模型组,空白对照组,每组5只动物。其中阿司匹林生产单位为bayer公司。注射致热源后分别在0.5h和4.5h灌胃给药1次(共2次)。并于注射致热源前1h及注射致热源后1、2、3、4、5、6、7、8、9h分别测定动物直肠温度一次(测定方法是:动物清醒状态下,用手将大鼠固定,用欧姆龙电子体温计mc-347涂以石蜡插入大鼠直肠4cm测试肛温),记录动物肛温的变化。并观察动物的症状与体征。
数据处理:以注射致热源前1h测得的肛温数据作为基线值,采用配对t检验对给药前和给药后的各组动物肛温变化进行统计学分析,同时采用单因素方差分析对各给药组和发热模型组进行统计学分析,p<0.05即为差异具有统计学意义。
4.4结果与分析
整个试验期间,各组动物的粪便,行为活动,精神状态,体表毛色等未见与给药相关的异常情况。
大鼠的肛温变化情况见表6-3,并总结如下。
空白对照组:各时间点的体温均在正常范围内波动。
发热模型组(5只):与基线值体温比,大鼠注入致热源后1-4小时体温维持在正常范围内,5小时开始肛温呈现极显著上升趋势(p<0.01),第6、7、8、9小时均极显著升高(p<0.01),因此以分析注射致热源后5、6、7、8、9小时动物直肠温度变化作为疗效终点。
阿司匹林100mg·kg-1组(5只,相当于临床剂量2-4倍,0.3g-0.6g/人/次):与基线比,注射致热源后大鼠肛温5小时-8小时(4个时间点)均控制在正常体温范围内,9小时体温开始显著上升(p<0.05);与发热模型组比,注射致热源后5、6、7、8小时大鼠肛温极显著降低(p<0.01),9小时大鼠肛温开始上升。以上结果表明,注射致热源4.5h给药后,阿司匹林100mg·kg-1组解热降低体温疗效能维持4小时。
受试物4g·kg-1组(5只):与基线肛温比,注射致热源后大鼠肛温5小时-9小时(5个时间点)均未升高且控制在正常体温范围内;与发热模型组比,注射致热源后5、6、7、8、9小时动物肛温极显著降低(p<0.01)。以上结果表明,注射致热源4.5h给药后,解热降低体温起效快且疗效能维持5小时,其解热作用强度与阿司匹林100mg·kg-1组相当,疗效维持时间比阿司匹林100mg·kg-1组长(延长1小时)。
受试物2g·kg-1组(5只):与基线值比,大鼠注入致热源后第5小时体温有控制与基线相当,但第6、7、8、9小时均显著或极显著升高(p<0.05或p<0.01);与发热模型组比,注射致热源后5、6、8和9小时体温呈降低趋势,第7小时呈极显著降低(p<0.01)。
受试物1g·kg-1组:与基线值比,注入致热源后第5、6、7、8、9小时体温均显著或极显著升高(p<0.05或p<0.01);与发热模型组比,注射致热源后第5、6、7、8、9小时动物肛温相当。
4.5结论
阿司匹林100mg·kg-1组(相当于人临床剂量2-4倍,0.3g-0.6g/人/次)能显著降低体温(注射致热源后5-8小时),疗效能维持4小时。
受试物4g·kg-1组能显著降低体温(注射致热源后5-9小时),其解热作用强度与阿司匹林100mg·kg-1组相当,起效快且疗效可维持5小时,比阿司匹林100mg·kg-1组延长1小时。受试物2g·kg-1能显著降低体温作用,其作用强度和维持时间比阿司匹林100mg·kg-1组弱。总之,受试物解热降低体温作用有明确的剂量相关性,认为与给药有关。
一方面,本发明的中药组合物的解热作用有助于增强患者本身对病毒的抵抗力,从而进一步增强了本发明的中药组合物的抗病毒效力。另一方面,由于病毒感染通常伴随着发热,本发明的中药组合物的解热作用表明其能在抗病毒的同时也显著改善感染病毒的患者的临床症状。
5.实施例6组合物经口反复给药30天对正常恒河猴的毒性试验
5.1实验动物
品种/品系:恒河猴
等级:普通级。试验前检疫合格,内容包括体检、结核杆菌试验、寄生虫、沙门氏菌、致贺氏菌和b病毒检查
使用数量及性别:3只雄性,5只雌性
体重:2.2-3.5kg
动物标识:采用脖环上戴刻有阿拉伯数字的不锈钢号牌和笼牌进行标识。
供应单位:雅安普莱美生物科技有限公司
生产许可证号:scxk(川)2014-27
动物合格证号:0016929
5.2试验方法
5.2.1试验设计及周期
检疫期39天,鼻饲灌胃给药30天,首次给药当天以d0表示。试验设计见图11。
5.2.2动物分组及剂量设计
分组依据:按体重水平进行分组。
分组方法:分层随机分组。
组别设计:受试物组和安慰剂组,共2组,受试物组3只动物,安慰剂组5只动物。
剂量设计:供试品采用临床剂量猴等效剂量的15倍,同时为药效学有效剂量(小鼠0.75mg/kg)猴等效剂量18倍。
采用小鼠药效剂量,给药采用15倍于人体剂量进行毒性实验,给药剂量为3375mg/kg,详见下表。
表6-4细别设计信息
5.2.3给药信息
给药途径:鼻饲灌胃给药30天。
给药频率:供试品各组每天给药1次,连续30天。
给药量计算:给药后每10天的体重计算下10天的给药量。
给药时间:每天在约在08:00-09:00之间给药,遇采血操作,顺延30分钟。
5.2.4观察指标
5.2.4.1临床症状观察
观察次数:每天观察1次。
观察方法:隔笼观察
观察内容:皮肤、被毛、眼、耳、鼻、口腔、胸部、腹部、泌尿生殖部、四肢等部位,以及呼吸、运动、泌尿、排便和行为改变等。
5.2.4.2摄食量测定
观察期限:检疫期直至给药结束。
给料方法:上午7:45~8:30和下午2:00~3:00各給食一次,给药第一周上午给予150g,下午给予100g,第二周上午给予200g,下午给予150g自由采食,次日上午07:40~08:00撤去剩余饲料。
给料量:200g-400g/只/天。依据:恒河猴平均每天采食量约为200g-400g/只/天,本次试验中采用逐渐增加的方式给予饲料,第一周上午给予150g,下午给予100g,第二周开始上午给予200g,下午给予150g自由采食。
摄食量测定方法:每天记录给食量,丢弃量和食盒剩余量。摄食量=给食量-丢弃量-食盒剩余量。饲料量采用0%,25%,50%,75%和100%五档半定量方法估算,与每日给料量的乘积即为每天摄食量。
5.2.4.3体重测定
称重时间:称重当天喂食前。
测定次数:检疫期2次(分组前),每10天一次,共5次。
测定方法:动物清醒状态下,由技术工人抓取,用大动物秤(tcs-150)称重。
5.2.4.4血液生化学检测
检测次数:给药前2次,给药期每10天一次,共5次。
样品采集方法:动物有采血操作前,禁食过夜,第二天08:00-08:30开始采血,不麻醉,经前臂静脉采血1.0ml,采完后用灭菌干棉球轻压采血部位止血,血样采用促凝管,5000rpm,10min,4℃分离血清,用于生化指标检测。检测指标:总胆固醇(cho)、天门冬氨酸氨基转换酶(ast)、丙氨酸氨基转换酶(alt)、alt/ast、葡萄糖(glu)、总胆红素(tbil)、直接胆红素(dbil)、间接胆红素(ibil)、总蛋白(tp)、白蛋白(alb)、球蛋白(glo)、alb/glo、甘油三酯(tg)、谷氨酰转移酶(γ-ggt)、高密度脂蛋白(hdl-c)、低密度脂蛋白(ldl-c),详见表6-5。检测方法:各项指标均采用罗氏cobasc501检测
表6-5血液生化学检测
5.2.4.5血液学指标检测
检测次数:给药前2次,给药期每10天一次,共5次。
样品采集方法:动物有采血操作前,禁食过夜,第二天08:00-08:30开始采血,不麻醉,经前臂静脉采血1.0ml,采完后用灭菌干棉球轻压采血部位止血,血样采用edtak2抗凝,用于血液学指标检测。检测指标:见表6-6。检测方法:各项指标均采用advia2120i检测
表6-6血液学检测项目
5.2.5数据处理
结果以个体数据形式表示。体重等计量资料采用“mean±sd”(“均值±标准差”)表示。
5.3结果与分析
5.3.1对一般活动状况及摄食量的影响
溶剂安慰剂组动物连续给药后未见异常。
受试物给药后,该组实验动物未见明显异常。动物活动、饮水等未见异常;口、眼、鼻无异常分泌物;毛色、呼吸等未见异常。一般观察状况良好。
5.3.2对体重的影响
受试物给药后对恒河猴体重影响见下表。给药10天后,鼻饲灌胃(3/3)给药初期对鼻饲应激反应,体重出现一过性降低趋势,随后给药期保持体重上升趋势。未见与给药相关的体重变化。
表6-7受试物连续给药30天对体重的影响(kg,mean±sd)
注:1.“a”给药前34天(d-34);
5.3.3对生化指标的影响
受试物给药后对恒河猴生化指标的影响见表6-8至表6-25。安慰剂组动物各项生化指标未见明显异常。受试物组动物各项血生化指标未见与给药相关异常。
表6-8受试物药连续给药30天对alt的影响(mean±sd)
注:“a”给药前34天(d-34)
表6-9受试物药连续给药30天对ast的影响(mean±sd)
注:“a”给药前34天(d-34);
表6-10受试物药连续给药30天对alp的影响(mean±sd)
注:“a”给药前34天(d-34)
表6-11受试物药连续给药30天对ggt的影响(mean±sd)
注:“a”给药前34天(d-34)
表6-12受试物药连续给药30天对tbil的影响(mean±sd)
注:“a”给药前34天(d-34);
表6-13受试物连续给药30天对tp的影响(mean±sd)
注:“a”给药前34天(d-34);
表6-14受试物连续给药30天对alb的影响(mean±sd)
注:“a”给药前34天(d-34);
表6-15受试物连续给药30天对bun的影响(mean±sd)
注:“a”给药前34天(d-34);
表6-16受试物连续给药30天对cr-s的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-17受试物连续给药30天对ck的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-18受试物连续给药30天对uric的影响(mean±sd)
注:“a”给药前34天(d-34)
表6-19受试物连续给药30天对dbil的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-20受试物连续给药30天对fpg的影响(mean±sd)
注:“a”给药前34天(d-34)
表6-21受试物连续给药30天对fra的影响(mean±sd)
注:“a”给药前34天(d-34)
表6-22受试物连续给药30天对tc的影响(mean±sd)
注:“a”给药前34天(d-34)
表6-23受试物连续给药30天对ldl-c影响(mean±sd)
注:“a”给药前34天(d-34)
表6-24受试物连续给药30天对hdl-c影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-25受试物连续给药30天对tg影响(mean±sd)
注:“a”给药前34天(d-34)
5.3.4对血液学指标的影响
受试物连续给药后对恒河猴血液学指标的影响见表6-26至6-53。给药后,安慰剂组及给药组动物各项血液学指标未见明显异常。
表6-26受试物连续给药30天对白细胞的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-27受试物连续给药30天对中性细胞绝对数的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-28受试物连续给药30天对淋巴细胞绝对数的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-29受试物连续给药30天对单核细胞数目的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-30受试物连续给药30天对嗜酸性粒细胞数目的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-31受试物连续给药30天对嗜碱性粒细胞数目的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-32受试物连续给药30天对大未染色大细胞数量的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-33受试物连续给药30天对中性细胞百分比的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-34受试物连续给药30天对淋巴细胞百分比的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-35受试物连续给药30天对单核细胞百分比的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-36受试物连续给药30天对嗜酸性粒细胞百分比的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-37受试物连续给药30天对嗜碱性粒细胞百分比的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-38受试物连续给药30天对大未染色细胞百分比的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-39受试物连续给药30天对红细胞的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-40受试物连续给药30天对血红蛋白浓度的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-41受试物连续给药30天对红细胞压积的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-42受试物连续给药30天对红细胞平均体积的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-43受试物连续给药30天对平均血红蛋白量的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-44受试物连续给药30天对平均血红蛋白浓度的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-45受试物连续给药30天对红细胞分布宽度的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-46受试物连续给药30天对平均hgb分布宽度的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-47受试物连续给药30天对平均rbc血红蛋白浓度的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-48受试物连续给药30天对平均rbc血红蛋白含量的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-49受试物连续给药30天对红细胞ch分布宽度的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-50受试物连续给药30天对血小板的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-51受试物连续给药30天对血小板比积的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-52受试物连续给药30天对血小板分布宽度的影响(mean±sd)
注:1.“a”给药前34天(d-34);
表6-53受试物连续给药30天对平均血小板体积的影响(mean±sd)
注:1.“a”给药前34天(d-34);
5.4结论
在本次试验条件下,受试物采用临床剂量猴等效剂量的15倍,同时为药效学有效剂量(小鼠0.75mg/kg)猴等效剂量18倍(3375mg/kg)下连续给药30天后对恒河猴未产生毒性作用,说明受试物是非常安全的。
实施例7
为了对本发明的中药组合物进行表征和质量控制,发明人经多次尝试,采用超高液相uhplc色谱法,对本发明的中药组合物建立了指纹图谱。分析条件如下:
仪器与试剂:ultimate3000液相色谱系统(thermo)及chromeleon7.2色谱工作站,超纯水机(摩尔1810d细胞型),超声仪(洁盟jp-100st)。
乙腈和甲醇为色谱纯(fisher)、甲酸为色谱纯(fisher)。
供试品溶液的制备:精密称定待测中药组合物的样品,溶于80℃热水,超声提取60min,离心后取上清液,过0.22μm微孔滤膜,配制成浓度为5mg/ml的溶液。
指纹图谱的测定:精密吸取供试品溶液1μl,注入超高效液相色谱仪,记录色谱图。
色谱操作条件如下:
色谱柱:watersacquityuplcbehc182.1×150mm1.7μm色谱柱;
流动相:流动相a:0.05%甲酸水,流动相b:乙腈;
梯度洗脱:
0-18min,3%b-18%b;18-23min,18%b-40%b;23-28min,40%b-100%b;28-30min,100%b-100%b;30-32min,100%b-3%b;
温度:25℃;
流速:0.3ml/min;
色谱图检测波长:254nm。
进样体积:1ul;
用上述色谱条件对实施例1至实施例6的中药组合物样品进行uhplc指纹图谱分析,分析图谱如图12所示。结果表明:在本发明规定的各种原料药相对比例下,本发明的中药组合物的uhplc图谱一致性非常好,其中有5个特征峰比较明显,具体如下:
表7-1实施例1至实施例6的中药组合物的uhplc指纹图谱数据
即,1、2、3、4、5五个特征峰的保留时间分别为约14.5±0.1、15.3±0.1、15.5±0.1、17.2±0.1、18.2±0.1(min)。根据这些特征峰,可以比较简单地鉴别根据本发明的中药组合物并用于质量控制。
尽管上文已经对具体实施例进行了具体描述,本领域的技术人员可以理解的是,在不脱离本发明的精神的范围内可进行形式和细节上的改变和组合。可以理解,在不脱离本文披露的和根据所附权利要求所解释的较宽的范围内,可以对不同实施例的适应性描述做出各种改变。
- 还没有人留言评论。精彩留言会获得点赞!