一种基于SANH的共载siRNA和阿霉素的MSR‑1磁小体复合物及其制备方法与流程
本发明属于生物医用药物载体技术领域,具体涉及一种基于sanh的共载sirna和阿霉素的msr-1磁小体复合物及其制备方法。
背景技术:
近年来,为了更有效的治疗癌症,共载基因和抗癌药物进行肿瘤联合治疗,被证明可实现不同治疗机制的药物的协同作用,比单独治疗更有效。主要优势在于:首先,化疗与基因联合治疗能降低肿瘤细胞变异的可能性,延缓药物多药耐药症状的发生;其次,共载基因和化疗药物用于肿瘤治疗时,一方面基因可以抑制相关靶基因的表达,可提高胞内化疗药物的浓度或诱导细胞凋亡,另一方面在达到协同增效作用时,减少了药物的使用剂量并降低了毒副作用;最后,共载体系可以将基因和抗癌药物两种具有不同药代动力学的物质同时递送至一个细胞内。一个理想的共载系统,结合化疗药物的部分与基因应能起到良好的协同治疗作用,还应具备控制释放的特性。
磁小体(bacterialmagnetosomes,bms)是由趋磁细菌合成的、呈现生物核壳式结构、以无机纳米粒为核心外部包被着磷脂双层膜的天然纳米颗粒,它具备磁性纳米药物载体的性质,并拥有一系列人工合成磁性纳米颗粒没有的特性,在疾病治疗方面表现出极大的应用潜力。不同的趋磁细菌合成的磁小体在数目、形状及表面积等方面不尽相同,具备种属特异性。
目前,共载基因和化疗药物递送系统均能发挥良好的协同治疗作用,为了满足共载用药的需求,我们需要对载体进行不断的开发及优化。磁小体凭借其超顺磁性、表面易修饰及生物膜包被等优势,有望成为共载基因和化疗药物的新型载体。
技术实现要素:
本发明的目的在于克服现有技术的不足之处,提供了一种基于sanh的共载sirna和阿霉素的msr-1磁小体复合物及其制备方法,以具有天然脂质双分子膜层的msr-1磁小体为载体基体材料,利用正常组织、肿瘤微环境和溶酶体ph值的差异,采用ph敏感性腙键合成dox-pei聚合物,再通过静电作用结合bms和sirna,构建得到一种ph敏感的共载sirna和阿霉素的msr-1磁小体复合物。该共载复合物进入生物体后,由于epr效应(实体瘤组织的高通透性和滞留效应)会在肿瘤组织富集,促进细胞摄取,溶酶体的酸性环境诱发腙键断裂,dox释放;而pei的质子海绵效应使得sirna和dox安全释放进入细胞质,进一步sirna发挥基因沉默效应的同时,阿霉素插入dna片段中,起到协同治疗作用。
本发明解决其技术问题所采用的技术方案之一是:
一种基于sanh的共载sirna和阿霉素的msr-1磁小体复合物的制备方法,包括:
1)将浓度为18~22mg/ml的sanh储备液和pei按照质量比1:4~6的比例共同加入到ph7.3~7.5的修饰缓冲液中,室温下在氮气保护下反应46~50h;将反应得到的产物放入截留分子量为8000~14000的透析袋中透析46~50h,保留液冷冻干燥,得到sanh-pei;
2)将dox·hcl和步骤1)得到的sanh-pei按照质量比1:3~5的比例共同溶解在ph5.9~6.1的连接缓冲液中,室温下在氮气保护下避光反应46~50h;将反应得到的产物放入截留分子量为8000~14000的透析袋中透析46~50h,保留液冷冻干燥,得到dox-pei;
3)将步骤2)得到的dox-pei与sirna按照质量比1~2.6:1混合,随后将bms悬液滴加于上述dox-pei和sirna的混合物中,并使bms悬液中的bms与dox-pei和sirna的混合物中的sirna的质量比为1~5:1~5;所述bms来源于magnetospirillumgryphiswaldensemsr-1趋磁细菌;然后旋涡振荡1~3min,室温静置20~30min,得到共载sirna和阿霉素的msr-1磁小体复合物。
一实施例中:所述步骤3)中,dox-pei与sirna的质量比为2.06:1。
一实施例中:所述步骤3)中,bms悬液中的bms与dox-pei和sirna的混合物中的sirna的质量比为1:5。
一实施例中:所述步骤1)中,pei为分子量20~30kd的支化pei。
本发明解决其技术问题所采用的技术方案之二是:
一种根据上述制备方法所制备的共载sirna和阿霉素的msr-1磁小体复合物。
本发明解决其技术问题所采用的技术方案之三是:
一种上述共载sirna和阿霉素的msr-1磁小体复合物在制备抗肿瘤药物上的用途。
本技术方案与背景技术相比,它具有如下优点:
1.本发明制备的基于异源双功能团交联剂sanh交联的共载sirna和阿霉素的msr-1磁小体复合物的特征在于:材料选择上,本专利所采用的磁小体来源于magnetospirillumgryphiswaldensemsr-1趋磁细菌,msr-1磁小体具有天然的外部脂质双分子层和内部矿质晶体(fe3o4或者fe3s4)结构,是一种天然的靶向性载体;琥珀酰亚胺基6-肼基烟酸酯丙酮腙(succinimidyl6-hydrazinonicotinateacetonehydrazine,sanh)为异源双功能团交联剂,可利用ph敏感性腙键合成dox-pei聚合物,再通过静电作用结合bms和核酸,构建得到一种ph敏感的共载sirna和dox的msr-1磁小体复合物,形成磁靶向药物投递系统。
2.本发明制备的共载sirna和阿霉素的msr-1磁小体复合物具有如下优势:(1)能同时负载sirna和化疗药物;(2)制备的复合物粒径满足被动靶向条件,可通过epr效应定位于肿瘤组织间隙,增加药物富集;(3)在细胞质中,于酸性环境下腙键断裂,释放出阿霉素(dox)和sirna;(4)pei发挥质子海绵效应,实现内涵体逃逸,促进dox和sirna进入细胞核发挥作用。本发明的制备方法简单易行,实用性强,在基因治疗、生物医学、药学、生物材料等领域具有广阔的应用前景。
附图说明
下面结合附图和实施例对本发明作进一步说明。
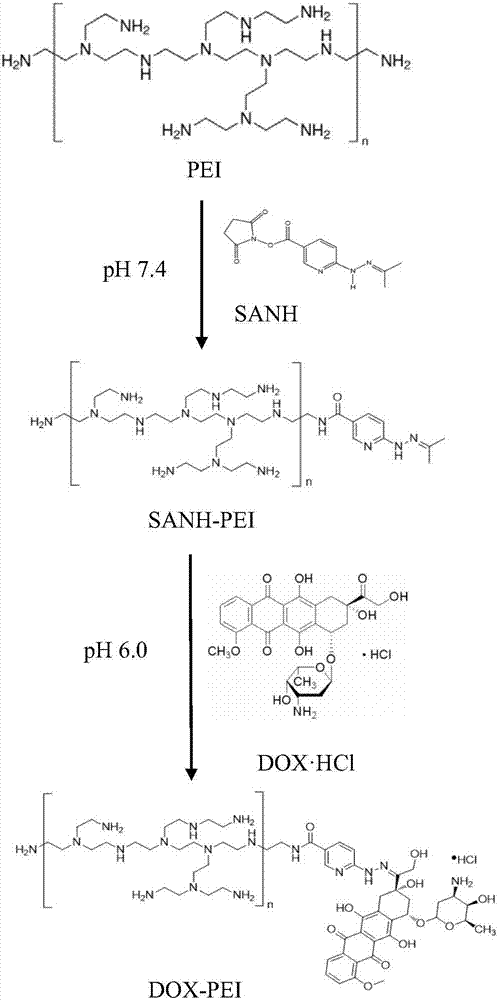
图1为本发明实施例中dox-pei的合成过程原理示意图。
图2为实验例1中不同dp/sirna质量比下制备的bms/dp/sirna复合物的琼脂糖凝胶电泳结果,图中泳道分别为:(1)dp/sirna=0;(2)dp/sirna=0.13:1;(3)dp/sirna=0.26:1;(4)dp/sirna=0.52:1;(5)dp/sirna=1.03:1;(6)dp/sirna=1.29:1;(7)dp/sirna=2.06:1;(8)dp/sirna=2.58:1。
图3为实验例1中不同dp/sirna质量比下制备的bms/dp/sirna复合物的zeta电位结果示意图。
图4为实验例1中不同dp/sirna质量比下制备的bms/dp/sirna复合物的粒径结果示意图,图中:(a)dp/sirna=1.03:1;(b)dp/sirna=1.29:1;(c)dp/sirna=2.06:1;(d)dp/sirna=2.58:1。
图5为实验例2中不同bms/sirna质量比下制备的bms/dp/sirna复合物的琼脂糖凝胶电泳结果,图中泳道分别为:(1)bms/sirna=1:5;(2)bms/sirna=1:2;(3)bms/sirna=1:1;(4)bms/sirna=2:1;(5)bms/sirna=5:1。
图6为实验例2中不同bms/sirna质量比下制备的bms/dp/sirna复合物的zeta电位结果示意图。
图7为实验例2中不同bms/sirna质量比下制备的bms/dp/sirna复合物的粒径结果示意图,图中:(a)bms/sirna=1:5;(b)bms/sirna=1:2;(c)bms/sirna=1:1;(d)bms/sirna=2:1;(e)bms/sirna=5:1。
具体实施方式
下面通过实施例具体说明本发明的内容:
实施例
一种基于sanh的共载sirna和阿霉素的msr-1磁小体复合物的制备方法,基于功能材料dox-pei(dp),构建共载sirna和dox磁小体纳米递送系统。首先阳离子聚合物pei与异源双功能团交联剂sanh交联形成中间物sanh-pei,sanh-pei再与dox通过腙键形成ph敏感聚合物dox-pei(dp),然后利用dp通过静电作用结合bms和sirna得到最终产物。具体包括:
1)将sanh溶解在无水dmso中制成sanh储备液(以100μldmso能溶解2mgsanh的比例配制),然后将该浓度为20mg/ml的sanh储备液和聚乙烯亚胺(pei)液体按照1:5(w/w)的配方比例共同加入到20ml的ph7.4的修饰缓冲液(0.877%氯化钠,1.639%磷酸钠,溶剂为超纯水)中,室温下在氮气保护下反应48h;其中,所述聚乙烯亚胺为分子量25kd的支化聚乙烯亚胺;将反应得到的产物放入截留分子量为8000~14000的透析袋中透析48h,保留液冷冻干燥,得到sanh-pei;
2)将dox·hcl和步骤1)得到的sanh-pei按照1:4(w/w)的配方比例共同溶解在20ml的ph6.0的连接缓冲液(0.877%氯化钠,1.639%磷酸钠,溶剂为超纯水)中,室温下在氮气保护下避光反应48h;将反应得到的产物放入截留分子量为8000~14000的透析袋中透析48h,保留液冷冻干燥,得到dox-pei,产物通过1hnmr(cd3socd3,400mhz)结构表征(4.0ppm处出现了dox上甲氧基氢的特征峰,1.2和2.0ppm处的多重峰表明dox已经成功交联在pei骨架);dp合成过程原理如图1所示;
3)将步骤2)得到的dox-pei与sirna溶液(20μmol/l)混合,随后用depc水将bms形成悬液(0.1mg/ml)滴加于上述dox-pei和sirna的混合物中,所述bms来源于magnetospirillumgryphiswaldensemsr-1趋磁细菌;然后旋涡振荡2min,室温静置25min,得到共载sirna和dox的msr-1磁小体复合物(bms/dp/sirna)。
实验例1:不同dox-pei与sirna的质量比(dp/sirna,w/w)下制备共载sirna和dox的msr-1磁小体复合物(bms/dp/sirna)
参照上述实施例的方法,将步骤3)中dp/sirna质量比设定为:0:1、0.13:1、0.26:1、0.52:1、1.03:1、1.29:1、2.06:1、2.58:1,使用移液枪将6×loadingbuffer(2μl)和10μl样品混合均匀并上样,进行琼脂糖凝胶分析;然后进行粒度与电位考察。
琼脂糖凝胶分析结果见图2。bms/dp/sirna复合物的制备是通过荷正电dp和荷负电bms和sirna分子静电相互作用的结果,从琼脂糖凝胶电泳的结果可看出,随着dp/sirna质量比逐渐增加,条带逐渐减弱至未见显色,表明sirna在bms/dp/sirna中被逐渐包载。当dp/sirna质量比为1.03:1时,未见游离sirna的条带,表明此条件下sirna被完全包封至复合物中。因此本发明中dox-pei与sirna的质量比为1.03~2.58:1。
当dp/sirna质量比为1.03:1时,未见游离sirna条带,说明bms/dp/sirna已经基本形成,因此采用激光粒度仪测量dp/sirna质量比为1.03:1、1.29:1、2.06:1、2.58:1时所形成的复合物的粒径和电位。从图3的粒径分析结果可知,复合物的粒径随着质量比增加而有所减小,表明未完全反应的sirna被完全包封形成更加紧密的复合物。
如图4所示,bms/dp/sirna复合物的zeta电位和粒径范围分别为+29~48mv和118~326nm,研究表明纳米粒粒径小于200nm时,更易在肿瘤细胞中富集。且适当的正电位有利于和带负电的细胞膜接触,进而增加细胞摄取。因此,本发明的制备方法中dox-pei与sirna的质量比为2.06:1为最优条件。
实验例2:不同bms与sirna的质量比(bms/sirna,w/w)下制备共载sirna和dox的msr-1磁小体复合物(bms/dp/sirna)
参照上述实施例的方法,将步骤3)中dp/sirna质量比设定为2.06:1,bms悬液中的bms与dox-pei和sirna的混合物中的sirna的质量比设定为:1:5、1:2、1:1、2:1、5:1,然后进行电泳阻滞实验,于成像系统下观察sirna条带并得电泳图;然后进行粒度与电位考察。
实验结果如图5,采用不同bms用量(bms/sirna质量比1:5、1:2、1:1、2:1、5:1)制备的ph敏感共载sirna和dox的msr-1磁小体复合物在电泳图中未见游离sirna条带,说明bms用量对纳米复合物的形成影响不大。bms与sirna的质量比为1~5:1~5时均可实现bms/dp/sirna复合物的制备。
随后采用激光粒度仪对不同条件下制备的bms/dp/sirna进行粒径分析和电位测定。如图6和7,结果表明,当bms/sirna质量比为1:5时,粒径较小,且电位为正,利于与细胞接触,增加细胞摄取。因此本发明的制备方法中bms/sirna质量比为1:5时效果最优。
实验例3:在dp/sirna质量比为2.06:1、bms/sirna质量比为1:5的条件下制备共载sirna和dox的msr-1磁小体复合物(bms/dp/sirna)
选定dp/sirna质量比为2.06,bms/sirna质量比为1:5时为最优条件制备bms/dp/sirna复合物。此时,bms/dp/sirna的粒径为107.2nm,zeta电位为31.1±1.0mv。
该bms/dp/sirna复合物的血清稳定性和抗酶解能力实验结果表明,裸sirna在血清和核糖核酸酶中易被降解,而bms/dp/sirna复合物能保持一定的完整性,具有一定的血清稳定性和抗酶解能力。
cck-8法考察该bms/dp/sirna复合物对细胞的抑制作用,在抗肿瘤药效方面,bms/dp/sirna复合物对细胞的抑制率明显高于裸sirna,且共载sirna和dox的磁小体纳米粒比单载sirna的纳米粒具有更好的联合治疗效果。
细胞凋亡和细胞摄取实验结果表明,该bms/dp/sirna复合物组大部分细胞处于凋亡晚期,sirna和dox能始终分布在hela细胞核中,取得了良好的联合治疗效果。
以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
- 还没有人留言评论。精彩留言会获得点赞!