MIIPpS303阻断剂在制备抗肿瘤药物中的应用的制作方法
本发明涉及分子生物学和医药技术领域,具体地说,涉及miipps303阻断剂在制备抗肿瘤药物中的应用
背景技术:
核因子κb(nuclearfactor-kb,nf-κb)属于rel家族的重要核蛋白转录因子,其普遍存在于组织细胞中。在静息状态下,这些蛋白通常以同二聚体或异二聚体形式与抑制蛋白结合,存在于胞质中。nf-κb的激活主要有两条通路,由iκb激酶β(iκbkinaseβ,ikkβ)介导的经典通路和由ikkα依赖的非经典通路。激活的nf-κb转移至细胞核,通过调控一系列促炎靶基因的表达,在调控细胞周期、凋亡和代谢等生理病理过程中发挥重要作用。大量研究表明,nf-κb与肿瘤的关系非常密切,可以通过调节各种靶基因,参与多种信号通路,促进肿瘤细胞血管生成、诱导细胞抗凋亡并促进细胞的增殖、侵袭、转移和放化疗抵抗,甚至诱导肿瘤细胞获得“干细胞”特性表型。其中nf-κb与结直肠癌的关系一直颇受重视,可能成为结直肠癌患者疗效监测和预后预测的一个生物标志物以及分子治疗的靶点。
细胞迁移抑制蛋白(migrationandinvasioninhibitoryprotein,miip)也被称为侵袭抑制蛋白45,最初在神经胶质瘤的研究中发现,过表达miip基因可以通过结合胰岛素样生长因子结合蛋白2抗体与组蛋白取乙酰化酶6,进而抑制神经胶质瘤细胞的侵袭与转移。也有研究发现,miip基因与乳腺癌侵袭及转移密切相关,并且该基因的表达情况可以影响非小细胞肺癌与食道癌的预后。
现有技术中,关于针对磷酸化位点miipps303为靶点开发药物,用于治疗egfr/pkcε异常活化这类恶性肿瘤,目前还未见报道。
技术实现要素:
本发明的目的是针对现有技术中的不足,研究发现egfr信号激活后pkcε磷酸化miip蛋白丝氨酸303位(s303),磷酸化的miip能够与nf-kb信号通路中重要功能分子rela结合,从而维持了egfr信号激活后rela的乙酰化水平,进而促进了rela介导的促转移分子的表达,最终促进了结肠癌细胞的转移,并证实了结直肠癌转移和不良预后与miips303磷酸化相关,基于此提供miipps303阻断剂和检测miips303磷酸化水平的试剂的新用途。
本发明的第一个目的是针对现有技术中的不足,提供miipps303阻断剂在制备抗肿瘤药物中的应用。
作为一种具体实施方式,所述的肿瘤为egfr/pkcε异常活化的恶性肿瘤。
作为一种具体实施方式,所述肿瘤为结肠癌。
作为一种具体实施方式,所述药物抑制结肠癌细胞的转移。
本发明的第二个目的是针对现有技术中的不足,提供检测miips303磷酸化水平的试剂在制备结肠癌诊断试剂或试剂盒中的应用。
本发明的第三个目的是针对现有技术中的不足,提供检测miips303磷酸化水平的试剂在制备结肠癌预后试剂或试剂盒中的应用
作为一种具体实施方式,所述的预后具体为预测生存期。
作为一种具体实施方式,所述检测miips303磷酸化水平的试剂为磷酸化miips303特异性抗体。
本发明优点在于:
本发明研究发现了egfr信号激活后pkcε磷酸化miip蛋白丝氨酸303位(s303),磷酸化的miip能够与nf-kb信号通路中重要功能分子rela结合,从而维持了egfr信号激活后rela的乙酰化水平,进而促进了rela介导的促转移分子的表达,最终促进了结肠癌细胞的转移。因此,可以针对此磷酸化位点(miipps303)为靶点开发药物,用于治疗临床上egfr/pkcε异常活化这类恶性肿瘤。此外,本发明还证实了结直肠癌转移和不良预后与miips303磷酸化相关,因此可以使用检测miips303磷酸化水平的试剂来进行结直肠癌的诊断或预后。
附图说明
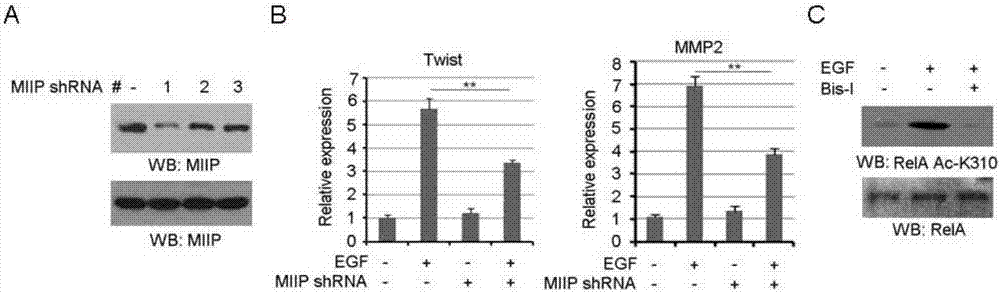
附图1:egf诱导miip和rela之间的相互作用:a,hct116细胞用/不用egf处理。细胞提取物用抗flag抗体进行免疫共沉淀。b,用/不用表达miipshrna的质粒转染的hct116细胞,并且一定时间内用/不用egf处理。用/不用egf(100ng/ml)处理的条件下:用/不用表达miipshrna的质粒转染的hct116细胞(c);用表达野生型rela和relak310r的质粒处理hct116细胞(d)。然后进行细胞侵袭测定。e和f,用/不用egf(100ng/ml)处理的条件下:用/不用表达miipshrna的质粒转染的hct116细胞;用表达野生型rela和relak310r的质粒处理hct116细胞(e,f)。然后通过q-pcr分析相对mrna水平。g,hct116细胞用egf处理(100ng/ml)30分钟之前先用bis-i(2μm),u0126(20μm)预处理1小时。细胞提取物用抗flag抗体进行免疫沉淀。将纯化的gst-miip蛋白与用egf(100ng/ml)处理30分钟的hct116细胞的有丝分裂提取物混合。进行gst下拉分析(左图)。纯化的gst-rela蛋白与用egf(100ng/ml)处理30分钟(右图)的hct116细胞的有丝分裂提取物混合。在a,b,g和h中,使用指定的抗体进行免疫印迹分析,数据代表3个实验中的1个。在c-f中,值以平均值±标准误表示。(n=3独立实验),*p<0.05和**p<0.01。
附图2:egf诱导miip和rela之间的相互作用。在a和c中,使用指定的抗体进行免疫印迹分析。数据表示3个实验中的1个。(a)用/不用表达miipshrna的质粒转染hct116细胞。(b)用/不用表达miipshrna的质粒转染的hct116细胞,用/不用egf处理30分钟。通过q-pcr分析相对mrna水平,其值以平均值±标准误。(n=3独立实验)。*表示p<0.05,**表示指定组之间的p<0.01。(c)在egf处理30分钟之前,用bis-1(10μm)预处理hct116细胞1小时。
附图3:pkcε磷酸化miip并促进miip-rela相互作用:a,hct116细胞用或不用egf处理。细胞提取物用抗flag抗体进行免疫沉淀。b和c,通过在[γ-32p]atp存在下将纯化的活性pkcε与所示纯化的gst-miip蛋白混合来进行体外磷酸化分析。miips303在指定物种中进化保守(c,左图)。d,用wtmiip或miips303a表达的hct116细胞用或不用egf处理30分钟。e,用wtmiip或miips303a表达的hct116细胞用或不用egf(100ng/ml)处理10小时。f,低表达miip的hct116细胞和wtrmiip或rmiips303a表达的hct116细胞,用/不用egf(100ng/ml)处理10小时。通过q-pcr分析twist和mmp2相对rela-k310水平。g,低表达miip的hct116细胞和wtrmiip或rmiips303a表达的hct116细胞,用/不用egf(100ng/ml)处理10小时。通过q-pcr分析twist和mmp2相对mrna水平。h,低表达miip的hct116细胞和wtrmiip或rmiips303a表达的hct116细胞,用/不用egf(100ng/ml)处理。进行细胞侵袭测定。在a-d中,使用指示的抗体进行免疫印迹分析。在e-h中,值以平均值±标准误表示。(n=3独立实验),*p<0.05和**p<0.01。
附图4:pkcε磷酸化miip并促进miip-rela相互作用。(a)对照shrna或miipshrna质粒处理hct116细胞,并用wtrmiip(n)或rmiips303a的质粒处理,使用指定的抗体进行免疫印迹分析。数据表示3个实验中的1个。(b和c)用wtrela或relak310r的质粒处理miip低表达的hct116细胞,wtrmiip或rmiips303a的重组表达的hct116细胞。而后用/不用egf处理细胞30分钟。通过q-pcr分析相对mrna水平(b)。进行细胞侵袭测定(c)。
附图5:pp1介导miip去磷酸化:a,sw480细胞用/不用egf处理。细胞提取物用抗miip进行免疫沉淀。b,用或不用egf(100ng/ml)刺激用冈田酸(pp1和pp2a抑制剂)(30nm)预处理的sw480细胞30分钟。c,用/不用表达pp1的质粒转染hct116细胞,而后用/不用egf(100ng/ml)处理30分钟。d,通过存在/不存在na3vo4/冈田酸的情况下将纯化的活性pp1与p38-磷酸化的gst-miip蛋白混合来进行体外去磷酸化分析。e-g,用/不用表达pp1的质粒转染hct116细胞用或不用egf(100ng/ml)处理10小时。用抗miip的抗体进行细胞提取物免疫沉淀(e)。也进行chip分析。将覆盖rela结合位点的twist或mmp2基因启动子区域的引物用于q-pcr(f,g)。h,用/不用表达pp1的质粒转染hct116细胞,而后用/不用egf(100ng/ml)处理10小时。通过q-pcr分析相对mrna水平。i,用/不用表达pp1的质粒转染hct116细胞,而后用/不用egf(100ng/ml)处理,进行细胞侵袭测定。在a-e中,使用指示的抗体进行免疫印迹分析。在a-e中,使用指示的抗体进行免疫印迹分析,数据代表3个实验中的1个。在f-i中,值以平均值±标准误表示。(n=3独立实验),*p<0.05和**p<0.01。
附图6:pp1介导miip去磷酸化。(a和b)用/不用egf处理所示细胞30分钟。使用指定的抗体进行免疫印迹分析。数据表示3个实验中的1个。进行细胞侵袭测定,其值以平均值±标准误。(n=3独立实验)。**表示指定组之间的p<0.01(b)。
附图7:miip阻止hdac6介导的rela去乙酰化:a,hct116细胞在用/不用4sc-202(0.6μm),fk228(20nm)和nexturastata(5nm)预处理1小时,然后egf(100ng/ml)处理30分钟。进行免疫印迹分析。b,hct116细胞用或不用bis-1预处理1小时,然后egf(100ng/ml)处理30分钟。细胞提取物用抗flag抗体进行免疫沉淀,随后用flag-beads洗涤和用抗miip抗体进行第二次免疫沉淀(左侧泳道1-4)。细胞提取物用抗flag抗体进行免疫沉淀(左侧泳道5-8)。c-e,用wtmiip或miips303a表达的hct116细胞过表达或不过表达hdac6的情况下用/不用egf(100ng/ml)处理细胞10小时。进行免疫印迹分析(c)。并进行了chip分析。将覆盖rela结合位点的twist或mmp2基因启动子区域的引物用于q-pcr(d)。通过q-pcr分析相对mrna水平(e)。在a-c中,使用指示的抗体进行免疫印迹分析,数据代表3个实验中的1个。在d和e中,值以平均值±标准误表示。(n=3独立实验),*p<0.05和**p<0.01。
附图8:miip阻止hdac6介导的rela去乙酰化。用wtrmiip或rmiips303a表达的hct116细胞用或不用egf处理。使用指定的抗体进行免疫沉淀和免疫印迹分析。数据表示3个实验中的1个。
附图9:miip-rela相互作用促进启动子区域h3k9乙酰化:a,wth3或h3k9r表达的hct116细胞,用/不用egf(100ng/ml)处理10小时。通过q-pcr分析相对mrna水平。b和d,wtrela或relak310r表达的hct116细胞,用/不用egf(100ng/ml)处理10小时。进行了chip分析。将包含twist或mmp2基因启动子区域的rela结合位点的引物用于q-pcr。将包含twist或mmp2基因启动子区域的rela结合位点的引物用于q-pcr。c和e,wtmiip或miips303a表达的hct116细胞过表达用或不过表达hdac6,而后用/不用egf(100ng/ml)处理细胞10小时。进行了chip分析。将包含twist或mmp2基因启动子区域的rela结合位点的引物用于q-pcr。f,用/不用表达p300shrna的质粒转染hct116细胞,用/不用egf(100ng/ml)处理10小时。进行chip分析。将包含twist或mmp2基因启动子区域的rela结合位点的引物用于q-pcr。在g中,使用指示的抗体进行免疫印迹分析,数据代表3个实验中的1个。在a-f中,值以平均值±标准误表示。(n=3独立实验),*p<0.05和**p<0.01。
附图10:miip-rela相互作用促进启动子区域h3k9乙酰化。(a)用/不用egf处理wth3或h3k9r表达的hct116细胞。使用指定的抗体进行免疫沉淀和免疫印迹分析。数据表示3个实验中的1个。(b)用/不用egf处理用wth3或h3k9r表达的hct116细胞。进行了chip分析。将包含rela结合位点的mmp2基因启动子区域的引物用于q-pcr。
附图11:结直肠癌转移和预后与miipser303磷酸化相关。a,hct116细胞分别稳定表达wtrmiip,rmiips303a和rmiips303a+hdac6shrna的细胞,将这些细胞经由裸鼠经脾内注射,构建肝转移小鼠模型。具有代表性的移植瘤(左列),统计具有明显肝转移病灶数量,数据表示均数±标准差(n=10,右列)。b在182个结直肠癌患者标本的切片中进行了免疫组化染色分析,检测miips303磷酸化在结肠直肠癌(转移和非转移)及相邻的正常结肠直肠组织中的表达(放大倍数:100×and400×),标尺:100μm。c在结肠直肠癌和相邻的正常结肠直肠组织中miipps303磷酸化表达水平。d在转移(m1)和非转移(m0)结肠直肠癌中miipps303磷酸化表达水平,卡方检验提示miipps303水平与肿瘤转移显著相关。e182例患者中低miips303磷酸化水平(评分<6,蓝色曲线)与高miips303磷酸化水平(评分≥6,红色曲线)的生存期(低表达组,73例患者;高表达组,109例患者)。kaplan-meier和log-ranktests提示miipps303磷酸化水平与生存期具有显著相关性。*表示p<0.05,**表示p<0.01。
附图12:显示miip在pkcε激活的情况下诱导结直肠癌转移的模型示意图。pkcε在ser303磷酸化miip,并促进其与rela的相互作用,其保护rela免受hdac6的去乙酰化;反过来,这导致rela转录活性的增强和与细胞侵袭相关的基因表达的增加。pp1作为能够通过pkcε去磷酸化miip的磷酸酯酶,在癌细胞中,pkcε活性是过度活跃的,而pp1蛋白水平下调;从而pkcε/miip/rela信号传导被加强并且促进肿瘤转移。
具体实施方式
下面结合具体实施方式,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
1、egf诱导miip和rela相互作用
请参见图1-图2,基于nf-κb信号通路和miip基因在肿瘤转移过程中的重要作用,我们首先研究miip基因是否参与了表皮生长因子(egf)诱导的nf-κb信号通路的激活。稳定转染标记了flag的miip基因的结肠癌细胞hct116后,通过免疫共沉淀技术发现,在egf的刺激下,miip和rela在细胞核内的结合明显增加,而这一现象细胞浆内却没有发现。为了检验细胞核内miip在翻译修饰水平对nf-κb活性的影响,我们用shrna敲低miip,有趣的是,miip的减少很大程度上废除了egf诱导的rela蛋白310位赖氨酸的乙酰化,而不是536位丝氨酸的磷酸化,这两个位点是rela在核内转录活性相关位点。我们接下来检测了miip基因是否可以直接调控肿瘤细胞的侵袭以及相关下游基因的转录。与之前研究一致的是,miip表达不足可以导致肠癌细胞hct116侵袭能力水平下降。然而,miip不足可以导致egf诱导的肿瘤细胞侵袭和相关基因twist和mmp2的转录。过表达对乙酰化抵抗的relak310r突变可以将这些效应放大,而野生型的rela却没有这一效果,这些提示了egf诱导的rela活性在肿瘤侵袭中的重要性。此外,染色质共沉淀实验表明,egf诱导明显增加了mmp2和twist基因启动子区的miip和relaack310的聚集,这一现象可以被miip的减少所抑制。
有报道pkcε与egf刺激下rela的活性有关,本研究中一致的是,pkc的抑制剂bis-i可以影响egf诱导的rela磷酸化和乙酰化。同时,我们发现egf诱导的miip和rela的结合可以被pkc抑制剂阻断,而不是mek/erkinhibitoru0126。
同时,我们发现由egf诱导的miip与rela的结合可被pkc抑制阻断,而不是mek/erk抑制剂u0126。这些结果表明egf诱导的rela与miip之间的相互作用将归因于增强的egfr-pkc信号传导,并且驱使我们进一步探索潜在的机制。如图1h的左边所示,将纯化的重组miip蛋白与来自hct116细胞的核提取物孵育后,进行gstpull-down实验,结果表明,不管egf是否处理,miip与rela不能结合。然而,另一种平行的gstpull-down实验显示egf刺激显著促进核miip与纯化的重组rela蛋白结合。这些数据表明,egf诱导的miip和rela之间的相互作用以依赖于miip的状态改变而不是rela。
2、pkcε磷酸化miip并促进miip-rela相互作用
请参见图3-图4,我们进一步研究了在egfr激活状态下miip和rela之间相关性所需的关键调控信号。共免疫沉淀分析显示egf诱导的miip和rela之间的相互作用被小牛肠磷酸酶(cip)消除,显示这一相互作用是磷酸化依赖的。连同来自gstpull-down实验测定的结果,这一发现提出了细胞miip可能通过egfr-pkc途径进行翻译后修饰的可能性。体外蛋白磷酸化测定证明重组miip蛋白被纯化和激活的pkcε所磷酸化,但仅抗磷酸化丝氨酸抗体可以检测到这一磷酸化(放射自显影和免疫印迹分析证实)。此外,scansite分析还显示miip上的ser303和thr158是潜在的pkcε磷酸化残基,放射自显影分析进一步显示进化上保守的ser303突变大大地消除了pkcε介导的miip磷酸化,这也在使用特异性miip-s303磷酸化抗体的免疫印迹分析中所证明。
为了确定pkcε介导的miip-s303磷酸化是否是egf诱导的miip-rela相互作用所必需的,我们耗尽了hct116细胞中的内源性miip,并重建了rnai抗性野生型wtrmiip和重组rmiips303a的表达,然后进行免疫沉淀分析。与其flag标记的野生型对照相反,不受磷酸化的突变miips303a在egf刺激下大大失去其与rela的相互作用。
同时,我们发现rmiips303a,而不是wtrmiip导致由egf刺激诱导的relaack310增强水平和持续时间都降低。根据这些结果,与对照相比,在表达rmiips303a的hct116细胞中,mmp2和twist基因的启动子区域处的由egf诱导的miip募集和relaack310聚集显著被阻断。检测mmp2和twistmrna水平也显示egf诱导的下游基因转录也受到在hct116细胞(图3g)中的重建rmiips303a表达的影响,其镜像,但没有恶化relak310r表达的效应。此外,transwell分析显示rmiips303a表达显著抑制egf诱导的肿瘤细胞侵袭。并且,和对照相比,在hct116细胞中,relak310r和rmiips303a共表达后,没有观察到额外影响侵袭能力。总之,这些结果表明pkcε介导的miip-s303磷酸化促进miip和rela之间的相互作用,这是egf诱导的肿瘤细胞侵袭所需的。
3、pp1介导miip去磷酸化
请参见图5-图6,为了进一步评估pkcε介导的miip磷酸化对肿瘤细胞侵袭的促进作用,我们检查了具有不同侵袭能力的多个结肠直肠癌细胞系中的miip-s303磷酸化水平。显然,免疫印迹分析显示egf的刺激可以导致crc细胞中miip-s303磷酸化增强和更强的侵袭能力,这意味着将存在抵抗pkcε介导的miip磷酸化和限制肿瘤细胞侵袭能力的某些分子。真核蛋白磷酸化的细胞通过磷酸酶介导的去磷酸化可逆地调节。磷酸蛋白磷酸酶超家族(pp)包括pp1,pp2a,并且参与不同的生物过程。我们想知道miippser303是否是pp1的靶标。有趣的是,在egf刺激后,共免疫沉淀分析显示pp1的显著增加,而不是pp2a。相反,egf仅适度诱导hct116细胞中的miip-pp1复合物形成,这将归因于pp1的有限表达。此外,我们发现用冈田酸(oa)(pp1和pp2a的抑制剂)处理显著增强sw480细胞中egf诱导的miip-s303磷酸化。并且pp1的过表达显著下调egf刺激后hct116细胞中miips303磷酸化。为了支持这些发现,去磷酸化测定还显示纯化的pp1有效地消除了来自hct116细胞的纯化miip-s303的磷酸化,这一现象可被抑制剂na3vo4和冈田酸逆转。因此,这些数据证明pp1作为生理性miip磷酸酶的功能。通过共免疫沉淀和chip分析进一步证明pp1对rela-miip复合物的影响,这表明rela和miip之间的相互作用以及在mmp2和twist的启动子区域miip和relak310乙酰化的聚集可被pp1过表达所破坏。因此,mmp2和twist的转录也可被egf诱导的pp1阻断。然而,transwell分析显示,与miips303a的作用相比,hct116细胞中pp1的过表达减弱了egf诱导肿瘤细胞侵袭,表明pp1额外的功能涉及肿瘤细胞侵袭。
4、miip阻止hdac6介导的rela去乙酰化
请参见图7-图8,miip减少对rela去乙酰化的影响意味着miip作用可能是维持rela去乙酰化而不是初始的激活。为了确定这一点,我们用一组hdac抑制剂处理hct116细胞,结果发现,通过用nexturastata(一种针对hdac6的选择性抑制剂)处理,显著逆转了miips303a对egf诱导的relak310乙酰化的抑制,而不是hdaci类抑制剂4sc-202或fk228。一致地,已有研究报道miip能够与hdac6形成复合物参与rela乙酰化的调节。因此,我们想知道miip是否通过抑制hdac6对rela去乙酰化来保护rela乙酰化状态。两步法共免疫沉淀分析显示hdac6能与flag-rela沉淀物中的miip相互作用,这些沉淀物来自egf处理过的hct116细胞。而这种相互作用可以被pkc抑制剂废除。在另一次免疫共沉淀分析中,通过拉出来自egf处理的hct116细胞的等量的flag-rela,我们发现rela的水平和洗涤沉淀后与miip结合的hdac6的量相当。这些数据表明存在以rela-miip-hdac6的顺序形成的复合物,其中miip可以防止hdac6直接结合rela,从而保护rela不受hdac6介导的去乙酰化。
此外,我们发现,不与rela的结合后,miips303a仍保持与hdac6相互作用,并且不受egf影响,揭示miipser303磷酸化仅负责hdac6-miip-rela复合物形成,miip还可能额外参与hdac6其他方面功能的调节。重要的是,在egf处理的hct116细胞中,重建rmiips303a的表达所导致的relak310乙酰化的下调现象可以被shrna所介导的hdac6的减少而阻断。据此,chip分析进一步显示,在egf处理过的hct116细胞中,hdac6的耗尽,可以大大逆转由rmiips303a引起的mmp2和twist的启动子区域relaac310的聚集。一致地,q-pcr分析显示hdac6的消耗消除了rmiips303a对egf诱导的mmp2和twist转录的抑制作用。这些结果表明磷酸化的miip保护rela免受hdac6介导的去乙酰化。
5、miip-rela相互作用促进启动子区h3k9的乙酰化
请参见图9-图10,增加rela的k310乙酰化促进下游基因表达的转录活性,并且通常与基因启动子区的h3乙酰化的上调相关。过表达野生型h3或h3k9r的hct116细胞中,赖氨酸突变成精氨酸,chip分析显示egf刺激h3k9乙酰化在mmp2启动子区域的显著增加,并可被h3k9r突变消除。同时,q-pcr分析显示egf诱导的twist和mmp2上调被h3k9r表达极大地抑制。我们接下来检查在mmp2启动子区域的miip和rela相互作用是否参与组蛋白h3乙酰化的调节。结果,与野生型对照相比,relak310r或rmiips303a阻断了mmp2启动子处egf诱导的h3-k9乙酰化。此外,我们发现rmiips303a(而不是relak310r)诱导的mmp2启动子上组蛋白h3-k9乙酰化下调在hdac6缺失的hct116细胞中被阻断,这表明维持miip介导rela乙酰化是启动子区h3-k9乙酰化聚集的关键。
为了进一步研究miip-rela调节的组蛋白h3乙酰化的机制,我们用针对p300的抗体进行chip分析,p300是熟知的负责h3-k9乙酰化的乙酰转移酶。结果,与对照相比,egf促进了hct116细胞中mmp2启动子处的p300聚集,而relak310r或miips303a的过表达可以抑制这种聚集。与其对h3赖氨酸9乙酰化的影响相一致的是,hdac6不足恢复了表达miips303a的hct116细胞中mmp2启动子处的p300积累。重要的是,p300的消耗大大消除了egf诱导的hct116细胞中mmp2启动子区域的h3-k9乙酰化。这些结果表明miip-rela相互作用是由启动子区p300介导的h3-k9乙酰化所需的。
6、结直肠癌转移和预后与miipser303磷酸化相关
请参见图11,为了确定miips303磷酸化是否促进结肠直肠癌细胞转移,用表达有活化egfrviii突变体的hct116细胞为载体,分别稳定表达wtrmiip,rmiips303a和rmiips303a+hdac6shrna的细胞,将这些细胞经由裸鼠经脾内注射,构建肝转移小鼠模型。结果,具有wtmiip表达的肿瘤细胞表现出强的转移能力。相比之下,miips303a的表达显著地废除了其肝转移能力。然而,miips303a抑制的肝转移能力被降低hdac6的表达显著逆转。
为了检查pkcε介导的miips303磷酸化的临床作用,我们在182个结直肠癌患者标本的切片中进行了免疫组化染色分析。结果,miips303磷酸化在结肠直肠癌细胞中表达,但很少在相邻的正常结肠直肠细胞中表达。此外,miips303磷酸化水平与结直肠癌转移显著相关。值得注意的是miips303磷酸化表达高的肠癌患者具有比那些不表达或者低表达miips303磷酸化的患者总生存期更短。这些结果表明pkcε依赖性miips303磷酸化在人类结直肠癌的临床生物学行为中重要的指示性作用。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!