一种治疗腹水的植物提取物及其制备方法与流程
本发明涉及医药领域,具体涉及一种植物提取物及其制备方法和应用,特别涉及枸杞提取物及其制备方法和应用。
背景技术:
正常状态下,人体腹腔内有少量液体(一般少于200ml),对肠道蠕动起润滑作用。任何病理状态下导致腹腔内液体量增加,超过200ml时,称为腹水(ascites)。腹水仅是一种病征,产生腹水的病因很多,比较常见的有心血管病、肝脏病、腹膜病、肾脏病、营养障碍病、恶性肿瘤腹膜转移、卵巢肿瘤、结缔组织疾病等。
腹水癌细胞(ascitestumor)是以肿瘤细胞在腹水中处于漂浮状态下进行繁殖为特征的肿瘤。属于细胞同基质(在此为腹水)最易分离的液状瘤,具有恶性肿瘤的明显特征。
腹水肿瘤有两种,即从开始就出现腹水型的肿瘤和认为将原有的固态肿瘤转变成为腹水型的肿瘤,前者有如吉田肉瘤(白鼠),后者有如埃利希氏腹水癌(鼷鼠)和腹水肝癌(白鼠)。腹水肿瘤除在移植后任何时期均可采取腹水进行细胞的个别观察和数量计算外,动物因肿瘤致死的时间亦短,这些在研究上有许多优点,作为肿瘤的生物学研究对象及治疗癌症基础有很大利用价值。有关染色体数异常的个别性以及对抗癌物质的抵抗性因肿瘤的种类和系统而不同,而且每一个性可由其后裔肿瘤所保持。癌性胸腹水,也叫恶性胸腹腔积液,是中晚期癌症常见的并发症之一,也是部分患者的主要临床症状或体征,严重的胸、腹水甚至可危及生命。恶性胸水的疾病常见于肺癌、乳腺癌,其次为恶性淋巴瘤、卵巢癌、恶性胸膜间皮癌、食管癌、胃癌、贲门癌及病因不明的恶性肿瘤。如果腹水比较严重的话,可以配合一些利尿的食物服用,多排尿,对身体的帮助会比较大。癌性胸腹水,也叫恶性胸腹腔积液,是中晚期癌症常见的并发症之一,也是部分患者的主要临床症状或体征,严重的胸、腹水甚至可危及生命。外科治疗手段如:抽水、放水等,有效地控制消除癌性胸、腹水对延长、拯救患者的生命有重要的现实意义。癌性胸腹水往往是血性的,内含大量红白细胞。①恶性胸水的疾病常见于肺癌、乳腺癌,其次为恶性淋巴瘤、卵巢癌、恶性胸膜间皮癌(多为血性积液)、食管癌、胃癌、贲门癌及病因不明的恶性肿瘤。常见症状:呼吸困难、胸痛、胸闷、气喘、咳嗽、血痰、体重下降、厌食、不适等,少数患者起初无症状。②恶性腹水:引起癌性腹水的疾病:卵巢癌、肝癌、胃癌及胰腺癌。
癌性腹水缺乏有效的治疗方法,比较常见的治疗方法有腹腔内化疗、排放腹水等,但是疗效有限,化疗的副作用比较大。
因此,目前急需一种有效治疗癌性腹水的药物以解癌症患者的燃眉之急。
枸杞,产自河北、内蒙古、山西、陕西、甘肃、青海、四川西部。常生于海拔800-3600米温带地区向阳的山脊、谷地、干涸河床地或山坡,多砾石或沙质土壤或黄土上。中国黄土高原极为普遍。性味归经:性温,味酸涩;人肝、胃、大小肠经,无毒。枸杞具有很好的保健作用,大量的研究表明枸杞多糖具有降血脂、降血糖、保肝、抗肿瘤及抗衰老等作用。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种疗效好的用于治疗癌性腹水的枸杞提取物。
本发明的另一个目的在于提供一种枸杞生物碱及其应用。
本发明所采取的技术方案是:
一种枸杞萃取物,其制备方法如下:
1)取枸杞干燥后粉碎,加入5~15倍的水,40~70℃搅拌浸出完全;
2)去除浸出液中的不溶物,干燥得到枸杞的水萃取物。
作为上述枸杞萃取物的进一步改进,固液分离后去除浸出液中的不溶物,滤液接着使用0.45μm的滤膜初滤,之后使用0.22μm的滤膜再次过滤,进一步去除不溶物。
作为上述枸杞萃取物的进一步改进,干燥时使用冷却干燥。
每kg枸杞萃取物中含有60~65g枸杞生物碱。
一种枸杞生物碱,其制备方法如下:
1)取上述的枸杞萃取物,500~700℃灰化完全,得灰化物;
2)将灰化物与水混合,搅拌溶解,去除不溶物,精滤后取滤液,干燥得到枸杞生物碱。
作为上述枸杞生物碱的进一步改进,精滤的操作为使用0.45μm的滤膜初滤,之后使用0.22μm的滤膜再次过滤。
枸杞萃取物在制备治疗癌性腹水药物中的应用,其中,枸杞萃取物如上所述。
一种治疗癌性腹水的药物,其起效成分为上述的枸杞萃取物。
药物为口服制剂。口服制剂包括但不限于片剂、颗粒剂、胶囊剂、口服液等常见的口服制剂。更进一步的,口服制剂为肠溶口服制剂。特别的,口服制剂为缓释制剂。
功能与主治:主要用于治疗癌性腹水。
用法用量:冻干粉或者喷雾干燥,颗粒剂及冲剂,标准/粒500mg,成人日服4-5次,四小时服/次,一次5-10克,30天一疗程,温开水空腹服药。
副作用:未观察到明显的毒副作用,无药物依赖性。
禁忌:孕妇及哺乳期间禁服。
本发明的有益效果是:
发明人经多年的攻克首次发现,1000克枸杞水萃取物(干重)中含有60~65g枸杞生物碱,至今尚无相关文献报道,确证枸杞萃取物(枸杞生物碱和枸杞多糖的混合物)可锁定并能选择性地治疗癌性腹水,枸杞萃取物有望成为极具吸引力的治疗癌性腹水药物。枸杞生物碱和枸杞多糖的混合物对癌性腹水的有效率达到100%,可治疗腹水及腹水癌。可能的作用机制是通过抑制细胞增殖、诱导细胞凋亡和抑制血管生成而发挥抗癌性腹水作用。对治疗癌性腹水有较强的靶向性,并不产生耐药性,与传统化疗药无交叉耐药。枸杞萃取物安全而无毒,有望成为一种新的治疗癌性腹水的植物新药。
枸杞萃取物具有新颖性,治疗癌性腹水呈现多靶点、多环节、多效应等特点,无毒副作用等进行深入研究,可能成为具有临床价值的治疗癌性腹水新药。
枸杞萃取物是目前治疗癌性腹水最快最迅速的一种植物药,它的问世必将给治疗癌性腹水带来一次突破。同时它能迅速挽救数以万计的患者生命,治癌性腹水植物药口服制剂。细胞学毒性实验结果显示,枸杞萃取物对正常细胞基本没有抑制作用,对癌细胞具有选择性杀伤作用。
本发明的枸杞提取物,对癌性腹水细胞增殖具有明显的抑制作用,其ic50为s180(17.032mg/ml),对癌性腹水细胞具有明显促凋亡作用,且具有浓度-效应关系;可以将癌性腹水细胞的细胞周期阻滞于g0/g1期,且具有浓度-效应关系。口服后可以有效地治疗癌性腹水。
本发明的枸杞生物碱提取方法,无需使用有机溶剂,操作安全简便,提取效率高,得到的枸杞生物碱纯度高达99.9%以上。
附图说明
图1是枸杞萃取物水溶液在200nm~600nm波长下的吸光度曲线;
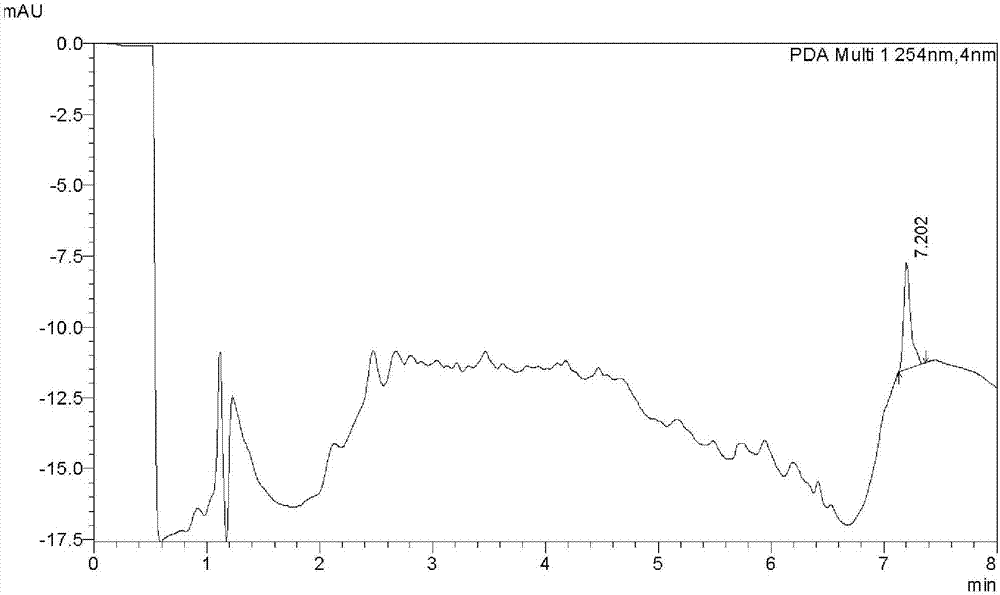
图2是枸杞萃取物的液相色谱图;
图3是枸杞萃取物的另一液相色谱图及其主峰的质谱图;
图4是枸杞生物碱的hplc色谱图;
图5是枸杞萃取物对s180细胞的浓度-抑制率曲线;
图6是枸杞萃取物对小鼠腹水瘤细胞s180增殖的影响;
图7是不同浓度枸杞萃取物对小鼠腹水瘤细胞s180凋亡的影响;
图8是枸杞萃取物对小鼠腹水瘤细胞s180凋亡的影响;
图9是枸杞萃取物对小鼠腹水瘤细胞s180细胞周期的影响。
具体实施方式
枸杞萃提物的制备:
1)将枸杞55~65℃干燥后粉碎至80~120目,加入5~15倍的水,于45~55℃下搅拌萃取4h;
2)去除不溶物,使用0.45μm的滤膜初滤,之后使用0.22μm的滤膜二滤,收集得到的滤液冷冻干燥,得到枸杞萃取物。
取上述的枸杞萃取物进行检测,检测结果如图1~3所示。其中,图1是枸杞萃取物水溶液(300mg/ml),在200nm~600nm波长下的吸光度曲线,显示其在283nm处具有一个峰值,其吸光度达1.048;图2是枸杞萃取物的液相色谱图;图3是枸杞萃取物的另一液相色谱图及其主峰的质谱图。
经检测,每1000g枸杞萃取物(干重)中含有60~65g枸杞生物碱,余量为枸杞多糖及极少量(少于0.5%)的杂质。
枸杞生物碱的提取:
1)取前述的提取物(每1000g干重中含有60~65g枸杞生物碱),500℃~700℃高温溶解2~3h,得到投料重量30~35%左右的灰色粉末;
2)将灰色粉末与3~4倍的水混合,搅拌溶解,去除不溶物,得滤液;
3)使用0.45μm的滤膜初滤,之后使用0.22μm的滤膜再次过滤,得到精滤液;
4)将精滤液冷冻干燥得到枸杞生物碱。
枸杞生物碱为纯白色透明细针状晶体,委托上海张江药谷公共服务平台有限公司检测其纯度,检验依据为中国药典2010版一部,附录vid高效液相色谱法。其hplc色谱图如图4所示。根据面积归一化法,其主峰含量为99.93%,是一种高纯的提取物。
下面结合实验,进一步说明本发明的技术方案。
以下实验中,xl-010指上述方法制备得到的干燥枸杞萃取物。
植物药xl-010癌性腹水细胞生长抑制对照试验
实验委托湖南省实验动物中心(湖南省药物安全评价研究中心)进行。
1实验材料
1.1受试物:植物药编号:xl-010,批号:20170410,由湖南晓林生物科技发展有限公司提供。植物药配制:称取xl-0109g,加入0.9%氯化钠注射液15ml,并振荡至全部溶解,即得600mg/ml植物药溶液,此为最高浓度工作液,将母液进行除菌处理后备用。用0.9%氯化钠注射液将母液依次配制成200、60、20、6、2、0.6mg/ml的工作液。
1.2阳性对照药:顺铂(ddp),批号:sjjmi-ie,东京化成工业株式会社;5-氟尿嘧啶(5-fu),批号:hfbm160120325008,amresco公司。阳性对照药配制:称取ddp或5-fu2mg,用新鲜完全培养基配制成100mm的母液,再用新鲜完全培养基将母液依次配制成200、60、20、6、2、0.6μm的工作液。
1.3主要材料:
1.4主要仪器:
2试验方法
2.1细胞培养
取已长满的s180细胞,采用含10%fbs的rpmi-1640完全培养基,于37℃、5%co2培养箱中培养,根据细胞生长情况,1~2d传代或换液,至对数生长期备用。
2.2cck-8法检测细胞增殖试验
取对数期生长的s180细胞以每孔5×103个细胞接种于96孔细胞培养板中,培养12h后,设置溶媒对照组、阳性对照药(ddp)组、阳性对照药(5-fu)组、植物药xl-010组(0.3-300mg/ml),每组5个复孔。溶媒对照组以新鲜完全dmem培养基孵育细胞,植物药组分别以含终浓度为0.3-300mg/ml植物药的新鲜完全dmem孵育细胞,ddp和5-fu组分别以含终浓度为100、30、10、3、1、0.3μm植物药的新鲜完全dmem孵育细胞。按上述处理方式孵育细胞72h后在每孔中加入cck-810μl,继续培养1h后使用酶标仪在450nm处测量各孔的吸光度。以溶媒对照组od值为100%细胞活力,其余各组od值与溶媒对照组od值的比值为相对活力。以细胞增殖抑制率评价植物药对s180细胞的毒性,若出现有细胞增殖抑制率>100%时,判为仪器的系统误差,按100%计。
2.3细胞凋亡的检测
2.3.1annexinv-fitc和pi双染法检测细胞凋亡
取处于对数生长期的s180细胞,常规消化收集细胞,以5×105/孔的密度接种至6孔板中,培养12h后,设置溶媒对照组、植物药xl-010组(10、30、100mg/ml),每组5个复孔。溶媒对照组以新鲜完全dmem培养基孵育细胞,植物药组分别以含终浓度为10、30、100mg/ml植物药的新鲜完全dmem孵育细胞。6h后,常规消化收集细胞,加入500μlbindingbuffer缓冲液重悬细胞,将细胞转入1.5mlep管中,加入5μl的annexinv-fitc、5μl的pi,在室温避光条件下孵育15min,用流式细胞仪检测凋亡情况。
2.3.2荧光染色法检测细胞凋亡
按照2.3.1方法处理细胞,在植物药处理6h后,在6孔板中每孔加入hoechst33342染色液1ml,充分覆盖住细胞,置于37℃培养20-30min。弃去染色液,用pbs洗涤2-3次后在荧光显微镜下进行荧光检测。
2.4流式细胞术检测植物药对小鼠腹水瘤细胞s180周期的影响
取处于对数生长期的s180细胞,常规消化收集细胞,以5×105/孔的密度接种至6孔板中,待12h细胞贴壁后,设置溶媒对照组、植物药xl-010组(100、30、10mg/ml),每组5个复孔。溶媒对照组以新鲜完全dmem培养基孵育细胞,植物药组分别以含终浓度为10、30、100mg/ml植物药的新鲜完全dmem孵育细胞。6h后,常规消化收集细胞,用70%冷乙醇固定过夜,加5μl的pi,室温避光孵育30min,用流式细胞仪检测细胞周期。
2.5统计学分析
采用spss16.0统计软件对数据进行处理,计量资料以
结果评价
3.1植物药xl-010对小鼠腹水瘤细胞s180增殖的影响
显微镜下观察不同浓度的植物药处理细胞后,出现细胞增殖速度减慢,细胞碎片增多、细胞间隙增大、细胞出现沙粒状空泡等现象。细胞状态与共培养时间有明确相关性,约在共培养12h后,细胞出现变圆、皱缩的现象;在共培养24h后,出现部分细胞胀大,细胞透光性变差,细胞间间隙增大;在共培养48h后,细胞出现沙粒状空泡,出现细胞破裂等情形;在共培养72h后,沙粒状空泡样细胞基本完全破裂,在300、100、30mg/ml浓度条件下无完整细胞形态的细胞,只见少量浓缩成黑点状。细胞与供试品或阳性对照药ddp和5-fu共培养72h后,细胞增殖受到明显抑制,且具有浓度-效应关系,与溶媒对照组比较具有显著性差异(p<0.01)。细胞增殖抑制结果详见表1。
表1、植物药xl-010对小鼠腹水瘤细胞s180增殖的影响
注:*表示与溶媒对照组比较,p<0.05,**表示与溶媒对照组比较,p<0.01。ic50表示抑制50%肿瘤细胞的浓度,emax表示对肿瘤细胞的最大抑制率。
xl-010对s180细胞的浓度-抑制率曲线如图5所示。
植物药xl-010对小鼠腹水瘤细胞s180增殖的影响如图6示,箭头表示坏死细胞。从图中可以看出,植物药xl-010可以很好地促进小鼠腹水瘤细胞s180坏死。
3.2植物药xl-010对小鼠腹水瘤细胞s180凋亡的影响
采用浓度为10、30、100mg/ml的植物药干预小鼠腹水瘤细胞s1806h后,收集细胞,annexinv-fitc/pi双染后检测细胞凋亡。流式细胞仪可将双染后的细胞分成4组:q1-ul代表机械损伤细胞(annexinv-/pi+);q1-ur晚期凋亡细胞(annexinv+/pi+);q1-ll存活细胞(annexinv-/pi-);q1-lr早期凋亡细胞(annexinv+/pi-)。
表2、植物药xl-010对小鼠腹水瘤细胞s180凋亡的影响
注:*表示与溶媒对照组比较,p<0.05,**表示与溶媒对照组比较,p<0.01。
结果表明:经植物药xl-010处理的s180细胞晚期凋亡及坏死细胞数明显高于溶媒对照组(p<0.05),并具有浓度-效应关系。
不同浓度植物药xl-010对小鼠腹水瘤细胞s180凋亡的影响如图7所示,图中,a为溶媒对照组,b为植物药10mg/ml组,c为植物药30mg/ml组,d为植物药100mg/ml组。
植物药xl-010对小鼠腹水瘤细胞s180凋亡的影响如图8所示,箭头表示细胞核皱缩,提示为凋亡细胞。从图中可以清楚地看出xl-010可以促使小鼠腹水瘤细胞s180凋亡。
3.3植物药xl-010对小鼠腹水瘤细胞s180周期的影响
采用浓度为10、30、100mg/ml的植物药干预小鼠腹水瘤细胞s18024h后,收集细胞,用70%冷乙醇固定后,pi染色后,流式细胞仪分析细胞周期。实验结果如表3所示:
表3、植物药xl-010对小鼠腹水瘤细胞s180细胞周期的影响
注:*表示与溶媒对照组比较,p<0.05,**表示与溶媒对照组比较,p<0.01
结果表明:在使用植物药xl-010后,g0/g1细胞比例明显增加,g2/m期比例明显减少,表明其对小鼠腹水瘤细胞s180增殖抑制作用主要是将小鼠腹水瘤细胞s180阻滞在g0/g1期,阻止其进入s期。
植物药xl-010对小鼠腹水瘤细胞s180细胞周期的影响如图9所示,图中,a为溶媒对照组,b为植物药10mg/ml组,c为植物药30mg/ml组,d为植物药100mg/ml组。
4结论与讨论
综上所述,在本实验条件下,植物药xl-010可显著抑制1种小鼠腹水瘤细胞s180增殖,并且具有浓度-效应关系,在高浓度条件下,随着时间的延长,可将癌细胞完全杀死,其可将细胞周期阻滞在g0/g1期,诱导细胞凋亡。本植物药发挥抑制癌细胞浓度较高,为mg/ml级,可能与其特有的作用机制相关。
以上所述仅是本发明的优选实施方式,应当指出的是,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!