一种用于联合用药的喜树碱前药负载双药物超分子水凝胶的制备方法与流程
本发明涉及一种喜树碱前药的联合用药方法,尤其涉及一种喜树碱前药负载双药物超分子水凝胶的制备,属于生物医药技术领域。
背景技术:
癌症是一种多因素疾病,单一药物的治疗效果不明显。因此,具有不同作用机制的多药物联合疗法逐渐受到了重视。联合用药疗法旨在通过控制不同药物剂量、给药顺序等利用药物之间的协同效应实现提高疗效、降低毒性的效果。联合用药策略目前已成为临床肿瘤治疗的首选策略,并取得了很好的治疗效果。然而,联合用药策略中单个抗癌药物的水溶性差、肿瘤选择性低及毒副作用大等问题却依然存在于联合疗法中。药物控释策略旨在通过设计、制备药物载体改善药物的水溶性、实现其在病灶部位的有效富集,从而达到提高疗效、降低毒性的目的。自从药物控释概念被提出后,迄今已发展了大批针对单个抗癌药物的性能优越的药物载体,而且已有很多载体已在临床广泛使用。因此,上述联合用药策略中所存在的问题理论上也可通过构筑基于联合用药理念的多药物控释载体来改善。然而,目前针对多药物控释体系构建的报道却很少(c.sawyers,nature,2004,432,294–297;a.m.bode,etal.nat.rev.cancer,2009,9,508–516;m.e.fox,etal.acc.chem.res.,2009,42,1141–1151;h.meng,etal.acsnano,2013,7,994–1005.)。
水凝胶是一类高度亲水的、具有三维网状结构的材料,其结构与细胞外基质类似。水凝胶能感知外界微小刺激从而引发结构发生溶胀/收缩或凝胶-溶胶转变,因此非常适合所负载药物的靶向控释。水凝胶在局部可注射给药、药物精准释放及生物相容性等方面相对其它载体具有很大优势,因此以水凝胶为药物载体开展针对联合用药策略的多药物控释体系的研究成为目前的难点、热点,同时也将是多药物控释体系研究的重要发展趋势。然而,水凝胶高度亲水的结构仅适用于水溶性药物的负载,不利于疏水性较强药物的负载,而临床使用的化疗药物大多为疏水性药物,因此构建可同时负载亲水、疏水药物的水凝胶药物载体具有重大意义。此外,依据联合用药策略,实现两类药物在时间、空间上的分阶段释放也是必须解决的难题(t.r.hoare,etal.polymer,2008,49,1993-2007;c.m.nelson,etal.curr.opin.biotechnol.,2006,17,518-523;j.h.park,etal.biomaterials,2002,23,1797-1808.)。
在前期研究中,我们构筑了peg修饰的两亲性前药,进而与α-cd进行自组装成功制备了以两亲性前药为原料的超分子水凝胶,并进一步实现了另外一种水溶性药物的高效负载。该类水凝胶具有制备方法简单,生物相容性优良、两类药物剂量可控及具有可注射性等优点。但是该类水凝胶中缺乏两种药物在时间和空间上分阶段释放机制,也难以实现药物的靶向释放,因此不能完全遵循临床联合用药原则。二硫键由于具有氧化还原可逆性和在血液中的稳定性而在药物传递系统设计中受到广泛关注。其在还原性物质,如谷胱甘肽的存在下会发生可逆反应而断开,而细胞内外(细胞外谷胱甘肽远远小于细胞内)及肿瘤细胞和正常细胞(肿瘤细胞中谷胱甘肽浓度是正常细胞4倍)中谷胱甘肽浓度的巨大差异使得二硫键在控制药物,尤其是多药物在时间、空间上分阶段方面及肿瘤靶向方面具有很大优势。因此将以二硫键连接的两亲性高分子前药及我们前期研究基础相结合可为设计以联合用药策略为依据的多药物水凝胶提供了基础和新思路,即利用谷胱甘肽敏感的二硫键制备peg修饰的两亲性前药,同时以该两亲性前药作为原料与α-cd和另外一种水溶性抗癌药物自组装制备负载双药物的超分子水凝胶。该类水凝胶不仅可实现剂量可控的两类不同亲疏水性质、不同抗癌机制的药物的负载,又可利用不同的负载机制实现药物在肿瘤细胞内外时间、空间上的分阶段释放。(w.ha,etal.j.mater.chem.b,2013,1,5532–5538;y.f.zhang,etal.chem.commun.,2015,51,6948-6951.d.c.wu,etal.j.am.chem.soc.,2010,132,15140-15143.)。
技术实现要素:
本发明的目的是提供一种用于联合用药的喜树碱前药超分子水凝胶体系;
本发明的另一目的是提供一种上述超分子水凝胶体系的制备方法;
本发明的更一目的是提供上述超分子水凝胶水作为多药物控释载体的应用。
一、喜树碱前药的制备
本发明喜树碱前药的制备方法,包括以下几个步骤:
(1)mpeg-cooh的合成:无水二氯甲烷为溶剂,氮气保护下,吡啶作为催化剂,mpeg(聚乙二醇单甲醚)和琥珀酰酐回流反应72h;反应液减压浓缩,重结晶,得到mpeg-cooh;其反应式如下:
mpeg的分子量在500~10000之间(对应n=10-225);mpeg和琥珀酰酐的摩尔比为1:2;mpeg和吡啶的摩尔比为1:2。
(2)还原性响应喜树碱前药单体cpt-ss的制备:先将喜树碱(cpt)分散于二氯甲烷,再加入dmap(4-二甲氨基吡啶,催化剂),然后加入三光气,在冰浴条件下搅拌反应2h后,向其中滴加含有双(2-羟基乙基)二硫醚的四氢呋喃溶液,室温搅拌10~12h,过滤除去固体杂质,滤液经减压浓缩后用乙酸乙酯溶解,水和饱和食盐水洗涤,无水硫酸镁干燥,减压浓缩,柱层析分离,得到淡黄色粉末即为cpt-ss。cpt-ss的合成反应式如下:
喜树碱与dmap的摩尔比为1:3;喜树碱与三光气的摩尔比为1:0.33;喜树碱与双(2-羟基乙基)二硫醚的摩尔比为1:1.8。
(3)还原性响应喜树碱前药cpt-s-s-mpeg的制备:二氯甲烷为溶剂,二甲氨基吡啶为催化剂,二环己基碳二亚胺为缩合剂,在冰浴条件下,cpt-ss与mpeg-cooh室温搅拌反应12h,过滤除去固体杂质,有机相减压浓缩,柱层析分离,得到cpt-s-s-mpeg。cpt-s-s-mpeg的合成反应式如下:
cpt-ss与mpeg-cooh的摩尔比为1:1.5;cpt-ss与二甲氨基吡啶的摩尔比为1:1.5;cpt-ss与二环己基碳二亚胺的摩尔比为1:2。
对得到的产物cpt-s-s-mpeg进行核磁共振分析(400mhz),所使用的核磁共振仪为brukeravanceш-400,溶剂为氘代氯仿,其1h-nmr谱图如图1所示:5.27-8.38ppm处的峰显示出了喜树碱骨架中的氢信号峰;2.84-2.89ppm,4.19-4.24ppm处的峰显示出了2-羟乙基二硫化物中亚甲基的特征质子峰;3.3-3.80ppm处的峰显示出了mpeg中重复亚甲基和甲氧基的特征质子峰;1.5-2.5ppm处的峰显示处了琥珀酰酐上的亚甲基信号。证明cpt-s-s-mpeg的结构式如上式所示:其中peg通过二硫键与cpt相连接。
二、负载双药物的喜树碱前药超分子水凝胶制备
本发明用于联合用药的喜树碱前药超分子水凝胶的制备,包括如下步骤:
将α-cd和水溶性抗癌药物加入到cpt-s-s-mpeg的水溶液中,超声分散后静置,通过cpt-s-s-mpeg疏水聚合和基于α-cd与peg链的主-客体作用自组装交联形成超分子水凝胶,实现两种药物的负载。
水溶性抗癌药物为去氧氟尿苷、氟尿嘧啶、阿糖胞苷、阿霉素、表阿霉素、顺铂、卡铂、奥沙利铂、秋水仙碱中的任意一种。
混合溶液中,α-cd的质量浓度为4%~16%(优选8%~12%);cpt-s-s-mpeg的质量浓度为0.5%~5%(优选1%~3%);水溶性抗癌药物的质量浓度为0.05%~1%(优选0.1%~0.5%)。
上述超声分散的温度为4°c~40°c(优选4°c~25°c),超声时间为1min~30min(优选5~10min)。
静置形成水凝胶的时间为20s~3h,形成水凝胶时的ph值为5~9(优选6~8)。
三、超分子水凝胶性能测定
1、cpt-s-s-mpeg释放cpt的能力
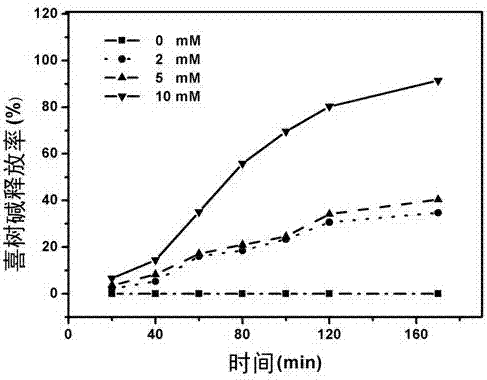
为了考察cpt-s-s-mpeg在还原剂存在下(以二硫苏糖醇为例),二硫键断裂从而释放cpt的能力,我们做了以下实验:分别称取10mgcpt-s-s-mpeg至四个小玻璃瓶中,分别加入5毫升pbs溶液(ph7.4),置于37℃水浴中。分别加入0,2,5,10mm二硫苏糖醇(dtt),每隔10min取一次样品,每次取出0.1ml,用色谱纯甲醇稀释至2ml,超滤,用hplc进行检测。结果如图2所示:在3h内,cpt的释放速度随着dtt(二硫苏糖醇)浓度增加而增大,3h后,2mm、5mmdtt样品中cpt释放了约30%、40%,而10mmdtt样品cpt释放超过了90%,说明cpt-s-s-mpeg具有氧化还原敏感特性,在还原剂存在下,可发生二硫键的断裂和分子内环化反应从而释放cpt。
2、凝胶化
cpt-s-s-mpeg可溶解在水中形成均一的水溶液。当引入α-cd后,在超声条件下,cpt-s-s-mpeg水溶液逐渐变浑浊,随后可转化为可注射的水凝胶。凝胶的形成速度、强度取决于cpt-s-s-mpeg和α-cd的浓度、比例。实验显示,cpt-s-s-mpeg在浓度范围在0.5wt%-2wt%时均可形成超分子水凝胶(见图3)。当cpt-s-s-mpeg浓度为2wt%时,α-cd浓度在4wt%-12wt%时均可形成超分子水凝胶。超分子水凝胶在温和条件下即可生成,无需其他试剂或条件。这主要是因为cpt-s-s-mpeg前药中cpt的疏水聚集及α-cd和peg链的主-客体包合作为双交联点促使超分子水凝胶的形成。
3、双药物负载
为了进一步负载另外一种亲水药物,选择5-氟尿嘧啶(5-fu)作为模型药物,0.5wt%的5-fu和2wt%cpt-s-s-mpeg共同溶解于水中,加入10wt%α-cd,在超声条件下即可得到负载双药物的超分子水凝胶。
使用旋转流变仪(haakers6000)测量形成的超分子水凝胶的流变学性质,测试条件:35mm平行盘,测试温度20°c,盘间距1mm,振荡应力1pa;凝胶测试之前需室温静置72h。如图4a所示,2wt%cpt-s-s-mpeg/10wt%α-cd超分子水凝胶样品在整个测量范围内的储能模量(g’)远远大于其损耗模量(g”),说明形成了超分子水凝胶并且超分子水凝胶具有永久的交联网络。此外,g’和g”随角频率变化很小,说明凝胶具有典型的高度非共价交联的超分子水凝胶特征。如图4b所示,超分子水凝胶还显示出了可注射水凝胶所具有的典型的剪切变稀性质。
4、对还原剂敏感的凝胶-溶胶转变行为
为了研究超分子水凝胶对还原剂敏感的凝胶-溶胶转变行为,做以下实验:将10mm的dtt、谷胱甘肽(gsh)分别加入到2wt%cpt-s-s-mpeg/10wt%α-cd超分子水凝胶样品中,分别在0.5h和2h内,加入dtt和gsh的凝胶都发生了明显的凝胶-溶胶转变行为(见图5)。说明加入dtt和/或gsh可有效断裂cpt-s-s-mpeg中的二硫键,从而破坏超分子水凝胶的两个交联点,即cpt的疏水聚合和α-cd与纳米胶束外壳中peg链的主-客体包合,使超分子水凝胶具有还原剂敏感(包括但不仅限于dtt、gsh)的凝胶-溶胶转变行为。
实验表明,上述水凝胶体系中存在谷胱甘肽的浓度在10µm~50mm之间,均可观测到凝胶-溶胶转变现象。
5、负载双药物的cpt-s-s-mpeg/α-cd超分子水凝胶的体外cpt、5-fu释放能力测试
每份样品均将总计1ml的混合液(2wt%cpt-s-s-mpeg/10wt%α-cd/0.5%5-fu)注射至4ml瓶内,超声形成凝胶后放置72h。随后将小瓶倒置在100ml试管内,分别在试管内加入pbs缓冲液(30ml,ph7.4,两份样品,一份加入10mmgsh)或醋酸缓冲液(30ml,ph5.0,两份样品,一份加入10mmgsh)作为释放介质,随后置于37℃水浴中。根据预先设定好的时间点,从试管内取出5ml上清液,然后加入5ml新鲜缓冲液,维持其体积在30ml。利用hplc对不同时间点取出的溶液进行分析,cpt-s-s-mpeg和cpt的最大检测波长为372nm,5-fu的最大检测波长为265nm。
27h内,在ph7.4的pbs溶液中,在无gsh存在情况下,5-fu和cpt-s-s-mpeg前药缓慢释放了约5%和2%,无cpt释放(见图6a),说明超分子水凝胶在正常生理环境下非常稳定,只依靠扩散作用缓慢释放物理包埋的5-fu;在有gsh存在情况下,5-fu的释放显著增快,在27h内释放了近50%,cpt在70h内也缓慢释放了近10%(见图6b),这主要是由于体系中存在的gsh可选择性断裂cpt-s-s-mpeg中的二硫键,致使凝胶瓦解从而导致5-fu的快速释放和cpt的持续释放。在ph5.0的醋酸缓冲液中,在无gsh存在情况下,5-fu和cpt-s-s-mpeg前药在27h内几乎全部释放(见图6c),而在有gsh存在情况下,5-fu在27h内释放完全,而cpt也释放了超10%(见图6d),这说明凝胶在肿瘤微酸环境中具有更快速的双药物释放能力,且cpt和5-fu具有分阶段释放行为,第一阶段通过扩散或凝胶瓦解释放出5-fu和cpt-s-s-mpeg前药,第二阶段cpt-s-s-mpeg前药进入肿瘤细胞后,肿瘤细胞内高含量的gsh断裂前药中的二硫键从而释放出cpt。
实验表明,上述水凝胶体系中存在谷胱甘肽的浓度在10µm-50mm之间,均可观测到cpt-s-s-mpeg前药中二硫键的断裂和所负载的喜树碱药物与任意一种水溶性抗癌药物的分阶段释放现象。
6、cpt、cpt-s-s-mpeg、cpt-s-s-mpeg与5-fu联合用药的mtt实验
体外抗肿瘤实验采用mtt比色法。收集处于指数生长期的hl-60细胞,1000rpm离心5min,弃上清,加入2ml培养基重悬细胞,吸取10μl细胞悬液至血细胞计数板,在倒置显微镜下计数。调整细胞密度至1×104/ml,以1×104/孔密度接种于细胞96孔培养板,每孔100μl,37℃,5%co2饱和湿度培养4小时。加入不同浓度的药物溶液,每个药物考察点设6~8个复孔,37℃,5%co2饱和湿度培养48小时。每孔加入20μl浓度为5mg/ml的mtt溶液,37℃,5%co2饱和湿度条件下反应4小时。终止反应:小心地吸取96孔板每孔的反应液,加入100μl浓度为10%的sds溶液,37℃,5%co2饱和湿度条件下过夜。利用酶标仪测定每个反应孔在490nm处的光密度od值,从而计算不同药物对hl-60细胞的抑制率。如图7所示,在0.03~0.5μm范围内,cpt-s-s-mpeg前药与cpt具有相似细胞毒活性,说明cpt-s-s-mpeg前药在进入肿瘤细胞后,肿瘤细胞内高浓度的gsh会断裂二硫键从而释放出cpt。在整个浓度范围内,cpt-s-s-mpeg和5-fu的联合使用相对cpt-s-s-mpeg和5-fu的单独使用具有更好的细胞毒活性。利用中效原理进行计算显示针对hl-60细胞,cpt-s-s-mpeg和5-fu联用具有典型的协同抗癌活性(ci<1)。
综上所述,本发明与现有技术相比具有以下有益效果:
1、本发明利用两亲性喜树碱前药在水中的自组装行为和α-cd与peg链的可逆主-客体包合制备超分子水凝胶,作为抗肿瘤联合用药的药物载体,负载水溶性抗肿瘤药物,以形成负载两种抗肿瘤药物的载药水凝胶,并依靠α-环糊精与peg链的可逆主-客体包合和肿瘤细胞内还原性物质对二硫键的还原,实现其对两种药物在肿瘤细胞内外不同时间、不同部位的分阶段释放,符合临床联合用药策略对药物载体的需求;
2、本发明的水凝胶所用原料生物相容性优良,且具有可注射性,可通过注射的方式植入到病灶部位,避免了手术植入的痛苦和繁琐,并且有利于填充不规则的损伤部位;
3、本发明的水凝胶可以作为两种不同药物的载体,用于抗肿瘤联合用药,并可调控两种药物的种类、剂量,以实现药物的协同治疗。
附图说明
图1是cpt-s-s-mpeg前药的核磁共振谱图;
图2是cpt-s-s-mpeg前药在不同二硫苏糖醇浓度下喜树碱释放情况图;
图3是在不同cpt-s-s-mpeg浓度下与10wt%α-环糊精自组装形成凝胶图;
图4是2wt%cpt-s-s-mpeg/10wt%α-环糊精超分子水凝胶流变动力学测试图;
图5是2wt%cpt-s-s-mpeg/10wt%α-环糊精超分子水凝胶谷胱甘肽和二硫苏糖醇敏感凝胶-溶胶转化图;
图6是2wt%cpt-s-s-mpeg/10wt%α-cd/0.5%5-fu超分子水凝胶在ph7.4和ph5下对谷胱甘肽敏感的体外cpt-s-s-mpeg、5-fu、cpt的释放图;
图7是cpt、cpt-s-s-mpeg、cpt-s-s-mpeg与5-fu联合用药针对hl-60细胞的细胞毒活性图。
具体实施方式
下面通过具体实施例对本发明喜树碱前药cpt-s-s-mpeg的制备、喜树碱前药超分子水凝胶的制备,以及作为多药物载体的应用做进一步说明。
实施例1:喜树碱前药的制备
(1)mpeg-cooh的合成:在50ml圆底烧瓶中,称取mpeg(10.0g,5mmol,mw=1900)和琥珀酰酐(1.0g,10mmol),加入25ml无水二氯甲烷,搅拌使其溶解,随后缓慢滴加吡啶(0.8ml,10mmol),滴加完毕后,氮气保护下回流3天。将反应液减压浓缩,重结晶,得到mpeg-cooh(8.9g,产率:88%)。
(2)还原性响应喜树碱前药单体cpt-ss的制备:在150ml的圆底烧瓶中加入cpt(2g,5.74mmol)后,加入二氯甲烷75ml搅拌呈浑浊状,再加入dmap(2.11g,17.3mmol),冰浴5min后加入三光气(0.567g,1.92mmol),冰浴搅拌2h后向上述反应液中滴加含有双(2-羟基乙基)二硫醚(90%)的四氢呋喃溶液(1.77g,10.3mmol,溶解在在5ml四氢呋喃中)。室温搅拌过夜后,有大量沉淀析出,过滤除去固体杂质,收集滤液并减压浓缩,然后用乙酸乙酯溶解,分别用水和饱和食盐水洗涤三次,无水硫酸镁干燥后减压浓缩,柱层析分离,得到淡黄色粉末即为cpt-ss(1.8g,产率59%)。
(3)还原性响应喜树碱前药cpt-s-s-mpeg的制备
取cpt-ss(0.532g,1mmol)于圆底烧瓶中,加入50ml的二氯甲烷使其溶解,之后在冰浴条件下依次加入mpeg-cooh(3g,1.5mmol)、二甲氨基吡啶(0.183g,1.5mmol)和二环己基碳二亚胺(0.412g,2.0mmol),室温搅拌过夜后过滤除去固体杂质,有机相减压浓缩,柱层析分离,得到cpt-s-s-mpeg(2.1g,产率89%)。
实施例2、负载5-氟尿嘧啶的喜树碱前药超分子水凝胶制备
取cpt-s-s-mpeg(20mg,8µmol)溶于1ml水中,形成均一的水溶液;取水溶性抗癌药物5-fu(5mg,38µmol),加入到cpt-s-s-mpeg的水溶液中,室温下超声溶解;取α-cd(100mg,0.1mmol),加入到cpt-s-s-mpeg和5-fu的混合水溶液中,室温下超声分散5min,静置1min,形成超分子水凝胶,该水凝胶时的ph值为6~8。
实施例3、负载顺铂的喜树碱前药超分子水凝胶制备
取cpt-s-s-mpeg(20mg,8µmol)溶于1ml水中,形成均一的水溶液;取水溶性抗癌药物顺铂(3mg,10µmol),加入到cpt-s-s-mpeg的水溶液中,室温下超声溶解,取α-cd(100mg,0.1mmol),加入到cpt-s-s-mpeg和顺铂的混合水溶液中,室温下超声分散5min,静置30min,形成超分子水凝胶,该水凝胶时的ph值为6~8。
实施例4、负载阿霉素的喜树碱前药超分子水凝胶制备
取cpt-s-s-mpeg(20mg,8µmol)溶于1ml水中,形成均一的水溶液;取水溶性抗癌药物阿霉素(2mg,3.7µmol)和α-cd(100mg,0.1mmol),加入到cpt-s-s-mpeg水溶液中,室温下超声分散10min,静置1h,形成超分子水凝胶,该水凝胶时的ph值为6~8。
实施例5、负载秋水仙碱的喜树碱前药超分子水凝胶制备
取cpt-s-s-mpeg(20mg,8µmol)溶于1ml水中,形成均一的水溶液;取水溶性抗癌药物秋水仙碱(4mg,10µmol)和α-cd(100mg,0.1mmol),加入到cpt-s-s-mpeg水溶液中,4°c下超声分散10min,静置2h,形成超分子水凝胶,该水凝胶时的ph值为6~8。
该类超分子水凝胶具有可注射性,可用于局部注射(包括但不限于瘤内注射、瘤旁注射等)治疗肿瘤。
实验还显示,该类超分子水凝胶对于所负载的喜树碱药物与水溶性抗癌药物具有分阶段释放现象。
上述水溶性抗癌药物还可以是去氧氟尿苷、阿糖胞苷、表阿霉素、卡铂、奥沙利铂、中的任意一种。
- 还没有人留言评论。精彩留言会获得点赞!