2型糖尿病的治疗方案的制作方法
本申请是申请日为2012年10月26日、中国申请号为201280065132.1、发明名称为“2型糖尿病的治疗方案”的发明申请的分案申请。
发明领域
本发明的主题是用于2型糖尿病患者中的血糖控制的药物组合,其中所述2型糖尿病通过至少一种口服抗糖尿病药物不足以控制,所述组合包含(a)despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐,(b)甘精胰岛素或/和其药学可接受盐,和(c)二甲双胍(metformin)或/和其药学可接受盐,其中所述2型糖尿病患者的治疗包括步骤:(i)至少四周化合物(b)和(c)的施用,和(ii)继续通过化合物(a),(b)和(c)的施用的治疗,其中调节步骤(i)或/和步骤(ii)中所施用化合物(b)的量使得达到或至少接近预定的空腹血糖水平或/和预定的自监测血糖水平。
背景技术:
在健康人中,胰腺的胰岛素释放与血液葡萄糖浓度严格相关。血液葡萄糖水平升高(就像餐后出现的那样)通过胰岛素分泌的相应增加而快速抵消。在空腹条件中,血浆胰岛素水平下降到基础水平,其足以确保葡萄糖对胰岛素敏感性器官和组织的连续供应以及在夜间以低水平保持肝葡萄糖生成。
与1型糖尿病形成对比,在2型糖尿病中一般不缺乏胰岛素,但是在许多病例中,特别是在进行性病例中,认为用胰岛素治疗是最合适的疗法(若需要的话,与口服施用抗糖尿病药物组合)。
在没有初始症状的情况下,数年里血液葡萄糖水平升高代表一项重大的健康风险。在美国的大规模dcct研究(thediabetescontrolandcomplicationstrialresearchgroup(1993)n.engl.j.med.329,977-986)可以清楚显示,血液葡萄糖水平的长期升高是形成糖尿病并发症的一项主要原因。糖尿病并发症的例子是微和大血管损伤,其可能在视网膜病变、肾病或神经病中显现自身,并且导致盲、肾衰竭和四肢损失(lossofextremities),而且伴随升高的心血管疾病风险。如此,可以推断改善的糖尿病疗法主要必须瞄准将血液葡萄糖尽可能接近地保持在生理学范围中。
对于患有2型糖尿病的超重患者,例如体重指数(bmi)≥30的患者存在着特别的风险。在这些患者中,糖尿病风险与超重风险重叠,导致例如与正常重量的2型糖尿病患者相比心血管疾病增加。如此,特别有必要在降低超重的情况下治疗这些患者中的糖尿病。
二甲双胍是一种在治疗不响应饮食改良的非胰岛素依赖性糖尿病(2型糖尿病)中使用的双胍降血糖剂。二甲双胍通过改善胰岛素敏感性以及降低葡萄糖的肠吸收来改善血糖控制。二甲双胍通常口服施用。然而,通过二甲双胍可能不足以控制肥胖患者中的2型糖尿病。如此,在这些患者中,可能需要别的措施来控制2型糖尿病。
技术实现要素:
胰岛素是一种具有51个氨基酸残基的多肽。胰岛素由具有21个氨基酸残基的a链和具有30个氨基酸残基的b链组成。所述链通过2个二硫化物桥偶联。已经长时间使用胰岛素配制剂来治疗1和2型糖尿病。最近,已经使用胰岛素衍生物和胰岛素类似物。
化合物despro36exendin-4(1-39)-lys6-nh2(ave0010,利西拉来)是一种exendin-4衍生物。利西拉来在wo01/04156中以seqidno:93披露:
seqidno:1:利西拉来(44as)
h-g-e-g-t-f-t-s-d-l-s-k-q-m-e-e-e-a-v-r-l-f-i-e-w-l-k-n-g-g-p-s-s-g-a-p-p-s-k-k-k-k-k-k-nh2
seqidno:2:exendin-4(39as)
h-g-e-g-t-f-t-s-d-l-s-k-q-m-e-e-e-a-v-r-l-f-i-e-w-l-k-n-g-g-p-s-s-g-a-p-p-p-s-nh2
exendin是一组可以降低血液葡萄糖浓度的肽。exendin类似物利西拉来以天然exendin-4序列的c端截短为特征。利西拉来包含不存在于exendin-4中的6个c端赖氨酸残基。
在本发明的上下文中,利西拉来包括其药学可接受盐。本领域技术人员已知利西拉来的药学可接受盐。本发明中采用的一种优选的利西拉来药学可接受盐是乙酸盐。
本发明中,令人惊讶地发现如果仅以甘精胰岛素和二甲双胍的组合(具有任选地另外的抗糖尿病药物,例如噻唑烷二酮)的施用开始治疗,可以提高甘精胰岛素,二甲双胍和利西拉来组合的效力。所述准备期(run-inphase)后,施用甘精胰岛素,二甲双胍和利西拉来的组合(具有任选地另外的抗糖尿病药物,例如噻唑烷二酮)。本发明的实施例中,12周的准备期期间,甘精胰岛素导致平均hba1c值从每组中的8.6%显著降低至利西拉来组中的7.56%和安慰剂组中的7.60%。在24周随机化治疗期期间,两个治疗组中均观察到另外的平均hba1c值的显著降低。令人惊讶的是,利西拉来组中(甘精胰岛素,二甲双胍和利西拉来的施用)的作用比安慰剂组中(甘精胰岛素,二甲双胍和安慰剂的施用)的更大。利西拉来组中,hba1c在利西拉来组中降低至6.96%而在安慰剂组中降低至7.30%。此外,通过该治疗方案,令人惊讶的是利西拉来组中达到hba1c值<7%的患者数比安慰剂组中的更大。在第24周,利西拉来组中56.3%的患者和安慰剂组中38.5%的患者达到hba1c值<7%(p=0.0001)。
本发明实施例的24周试验期期间两个组中的每日甘精胰岛素剂量逐渐增加。令人惊讶的是,利西拉来组中的患者显示每日甘精胰岛素剂量更少的增加而实现hba1c更大的降低(ls平均差对比安慰剂的2.24u,p值=0.0300)。因此,如本文所述的,通过2型糖尿病患者的所述治疗方案,每日胰岛素剂量可以降低。所述降低指明了通过本文所述的治疗方案提高的血浆胰岛素浓度。
如本文所述的该治疗方案另一个令人惊奇的作用指如通过2-小时餐后血浆葡萄糖(ppg)和餐后葡萄糖偏移所测定的,通过用利西拉来的治疗明显改善餐后血糖控制。相比安慰剂组,利西拉来组中实现了从基线到24周的标准试验餐后2-小时ppg的统计上显著的降低。相对地,相比用安慰剂治疗的患者,用利西拉来治疗的患者中观察到葡萄糖偏移的实质上的降低。
此外,用利西拉来的治疗证实了相比安慰剂组,7-点自-监测血浆葡萄糖(smpg)概要的平均值统计上显著的改善。
本发明的第一个方面是用于2型糖尿病患者治疗的药物组合,其中所述2型糖尿病通过至少一种口服抗糖尿病药物不足以控制,所述组合包含:
(a)despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐,
(b)甘精胰岛素或/和其药学可接受盐,和
(c)二甲双胍或/和其药学可接受盐,
其中所述2型糖尿病患者的治疗包括步骤:
(i)至少四周化合物(b)和(c)的施用,和
(ii)继续通过化合物(a),(b)和(c)的施用的治疗,其中调节步骤(i)或/和步骤(ii)中所施用化合物(b)的量使得达到或至少接近预定的空腹血糖水平或/和预定的自监测血糖水平。
二甲双胍是1,1-二甲基双胍的国际非专属名称(cas号657-24-9)。在本发明中,术语“二甲双胍”包括任何其药学可接受盐。
在本发明中,二甲双胍可以口服施用。技术人员知道适合于通过口服施用治疗2型糖尿病的二甲双胍配制剂。可以以足以诱导治疗效果的量对有此需要的受试者施用二甲双胍。可以以至少1.0g/天或至少1.5g/天的剂量施用二甲双胍。对于口服施用,可以将二甲双胍配制为固体剂量形式,诸如片剂或丸剂。可以将二甲双胍与合适的药学可接受载体、佐剂和/或辅助物质一起配制。
甘精胰岛素(lantus)是gly(a21)-arg(b31)-arg(b32)-人胰岛素。在本发明中,甘精胰岛素包括其药学可接受盐。
可以胃肠外,例如通过注射(诸如通过肌肉内或者通过皮下注射)施用甘精胰岛素或/和其药学可接受盐。技术人员知道甘精胰岛素合适的液体配制剂,其包含合适的药学可接受载体、佐剂或/和辅助物质。合适的注射装置,例如所谓的“笔”是已知的,所述笔包括装有活性成分的药筒和注射针。在本发明中,可以以有效诱导治疗效果的量对有此需要的受试者施用甘精胰岛素或/和其药学可接受盐。甘精胰岛素或/和其药学可接受盐可以以例如范围为每剂15至80u的量施用。
在本发明中,甘精胰岛素或/和其药学可接受盐可以以范围为15至80u的日剂量施用。可以每日一次施用甘精胰岛素或/和其药学可接受盐,例如通过每日一次注射进行。
步骤(i)中,本发明药物组合的化合物(b)和(c)可以施用至少4周,至少8周,至少12周或至少16周。优选,步骤(i)包括化合物(b)和(c)的施用至少约12周。
步骤(i)可以在最多约8周,最多约12周,最多约16周,最多约20周或最多约24周时完成。优选的为步骤(i)持续约12周。
步骤(i)可以在没有施用化合物(a)的条件下完成。如通过本发明的实施例证实的,如果仅仅用甘精胰岛素和二甲双胍的施用开始治疗的话,用甘精胰岛素,二甲双胍和利西拉来组合的治疗可以改善餐后血糖控制,hba1c值和smpg。通过该治疗方案,可以减少甘精胰岛素的剂量。
步骤(i)或/和步骤(ii)可以包括另外的噻唑烷二酮施用。噻唑烷二酮(也称为格列酮类)例如吡格列酮为通过使肌肉,肝脏和脂肪组织变得敏感而降低胰岛素抗性的抗高血糖药剂(dormandy等.,lancet2005,366:1270-89,yki-jarvinen,nengljmed2004,351:1106-18)。本发明的上下文中,如此处所用的,“噻唑烷二酮”包括其药学可接受盐。所述格列酮可以选自吡格列酮,曲格列酮和罗格列酮和其药学可接受盐。所述噻唑烷二酮,尤其是吡格列酮,可以以至少10mg/日,至少20mg/日,至少30mg/日或至少40mg/日的剂量施用。噻唑烷二酮,尤其是吡格列酮的最大日剂量可以是50mg/日或60mg/日。优选的剂量范围为10mg/日至50mg/日或30mg/日至40mg/日。更优选的剂量为约30mg/日。罗格列酮可以以2mg/日至10mg/日,或3mg/日至8mg/日的剂量施用。罗格列酮更优选的剂量为约4mg/日。用于口服,噻唑烷二酮,尤其是吡格列酮,可以配制为固体剂型,例如片剂或丸剂。噻唑烷二酮,尤其是吡格列酮,可以与合适的药学可接受载体,佐剂或/和辅助物质一起配制。
之前权利要求任何一项的药物组合,其中步骤(i)或/和(ii)中的施用每天完成。二甲双胍,利西拉来和甘精胰岛素可以在24h的时间间隔内施用。二甲双胍,利西拉来和甘精胰岛素的每种可以以一日一次剂量施用。二甲双胍,利西拉来和甘精胰岛素可以通过不同的施用途径施用。二甲双胍可以口服施用,以及利西拉来和甘精胰岛素可以肠胃外施用。
在本发明中,可以在施用基础胰岛素和任选地二甲双胍的附加疗法中施用despro36exendin-4(1-39)-lys6-nh2或/和药学可接受盐。在本发明中,术语“附加”、“附加治疗”和“附加疗法”指用二甲双胍、利西拉来和甘精胰岛素治疗2型糖尿病。如本文所述,所述附加治疗可以包括噻唑烷二酮的施用。
患有2型糖尿病且要通过本发明的药物治疗的受试者可以是患有2型糖尿病的受试者,其中2型糖尿病通过仅用至少一种口服抗糖尿病药物(例如,用至少1.0g/日二甲双胍或至少1.5g/日二甲双胍,例如3个月,或用此处所述的噻唑烷二酮,例如3个月,或二甲双胍和噻唑烷二酮的组合)的治疗没有适当控制。在本发明中,没有适当控制其2型糖尿病的受试者可以具有范围为7%至10%,甚至更大的hba1c值。
本发明的药物组合物中,调节步骤(i)或/和(ii)中施用的化合物(b)的量使得达到或至少接近预定的空腹血糖水平或/和预定的自监测血糖水平。可以在血浆葡萄糖浓度的每日测量基础上调节步骤(i)或/和(ii)中施用的化合物(b)的量。尤其,调节步骤(i)或/和(ii)中施用的化合物(b)的量使得达到或至少接近空腹血糖水平为约4.4mmol/l至约5.6mmol/l或/和自监测血浆葡萄糖水平(smpg)为约8mmol/l(或约140mg/dl)。
如此处所用的,“自我-监测血浆葡萄糖(smpg)”尤其是“7-点自我监测的血浆葡萄糖”。“7-点自我监测的血浆葡萄糖”尤其指一天七个时间血浆葡萄糖的测量及从中平均血浆葡萄糖浓度的计算值。所述“7-点自我监测血浆葡萄糖”值尤其是包括禁食和餐后情形的平均血浆葡萄糖浓度。特别地,血浆葡萄糖浓度的测量在早餐前,早餐后,午餐前,午餐后,晚餐前,晚餐后,和睡眠时完成(也参见图6)。如本文所述,通过本发明组合的治疗可以改善自我监测的血浆葡萄糖。
如通过本文公开的实施例证实的,本文所述的组合可以用于改善2型糖尿病患者中的血糖控制。血糖控制尤其是餐后血糖控制。更具体的餐后血糖控制为餐后血浆葡萄糖或/和餐后葡萄糖偏移控制。
本发明中,“血糖控制的改善"或“血糖控制”包括葡萄糖耐受性的改善,餐后血浆葡萄糖浓度的改善,餐后葡萄糖偏移的改善,空腹血糖浓度的改善,hba1c值的改善或/和空腹血浆胰岛素浓度的改善。
尤其,葡萄糖耐受性的改善包括餐后血浆葡萄糖浓度的改善,餐后葡萄糖偏移的改善或/和空腹血浆胰岛素浓度的改善。更具体的,葡萄糖耐受性的改善包括餐后血浆葡萄糖浓度的改善。
葡萄糖偏移的改善尤其为葡萄糖偏移的降低。所述葡萄糖偏移在本文所述治疗之前可以是至少2mmol/l,至少3mmol/l,至少4mmol/l或至少5mmol/l。
尤其,餐后血浆葡萄糖浓度的改善为餐后血浆葡萄糖浓度的降低。降低尤其指血浆葡萄糖浓度达到血糖量正常的值或至少接近这些值。
尤其,空腹血糖浓度的改善为空腹血糖浓度的降低。降低尤其指血浆葡萄糖浓度达到血糖量正常的值或至少接近这些值。
尤其,hba1c值的改善为hba1c值的降低。hba1c值的降低尤其指hba1c值降低得低于6.5%或7%,例如通过如本文所述的步骤(i)或/和(ii)治疗至少两个月,至少三个月,至少四个月,至少五个月,至少六个月或至少一年后。
尤其,空腹血浆胰岛素浓度的改善为空腹血浆胰岛素浓度的降低。本发明的实施例中,如本文所述的,与仅仅施用甘精胰岛素和二甲双胍相比,令人惊讶地发现当与利西拉来和二甲双胍一起施用时可以降低甘精胰岛素的剂量。血浆胰岛素浓度与血浆葡萄糖浓度相关联。在如本文所述的治疗下,空腹条件中血浆胰岛素可以达到或至少接近确保葡萄糖连续供给至胰岛素-感觉器官和组织或/和保持晚上低水平肝葡萄糖产生的值。空腹条件时,胰岛素浓度可以达到或至少接近与血糖量正常有关的值或接近血糖量正常的血浆葡萄糖浓度。
患有2型糖尿病且要通过本发明的药物治疗的受试者可以是肥胖受试者。在本发明中,肥胖受试者可以具有至少30kg/m2的体重指数。
患有2型糖尿病且要通过本发明的药物治疗的受试者可以具有正常的体重。在本发明中,具有正常的体重的受试者可以具有范围为17kg/m2至25kg/m2,或17kg/m2至<30kg/m2的体重指数。
要通过本发明的药物治疗的受试者可以是成年受试者。受试者可以具有至少18岁的年龄或者可以具有范围为18至80岁、18至50岁、或40至80岁、或50至60岁的年龄。受试者可以比50岁年轻。
要通过本发明的药物治疗的受试者可以患上2型糖尿病至少1年或至少2年。特别地,在要治疗的受试者中,在通过本发明的药物开始治疗前至少1年或至少2年已经诊断出2型糖尿病。
要治疗的受试者在步骤(i)开始时可以具有至少约8%或至少约7.5%的hba1c值。受试者还可以具有约7至约10%的hba1c值。本发明的实施例证明了通过利西拉来治疗导致2型糖尿病患者中hba1c值降低。
在本发明的又一个方面,如本文中描述的组合可以用于改善患有2型糖尿病的患者中的hba1c值。改善hba1c值意味着hba1c值降低得低于6.5%或7%,例如在治疗至少一个月、至少两个月、或至少三个月后。
在本发明中,正常血糖数值是具体为60-140mg/dl(对应于3.3至7.8mm/l)的血液葡萄糖浓度。具体地,此范围指空腹条件和餐后条件下的血液葡萄糖浓度。
要治疗的受试者在步骤(i)开始时可以具有至少10mmol/l、至少12mmol/l、或至少14mmol/l的餐后2小时血浆葡萄糖浓度。这些血浆葡萄糖浓度超出正常血糖浓度。
要治疗的受试者在步骤(i)开始时可以具有至少2mmol/l、至少3mmol/l、至少4mmol/l或至少5mmol/l的葡萄糖偏移。在本发明中,具体地,葡萄糖偏移是餐后2小时血浆葡萄糖浓度和进餐测试前30分钟血浆葡萄糖浓度的差。
“餐后”是糖尿病学领域技术人员公知的术语。具体地,术语“餐后”描述了进餐或/和实验条件下暴露于葡萄糖后的阶段。在健康人中,此阶段以血液葡萄糖浓度升高及随后的降低为特征。术语“餐后”或“餐后阶段”通常在进餐或/和暴露于葡萄糖后长至2小时结束。
要如本文中公开的那样治疗的受试者在步骤(i)开始时可以具有至少8mmol/l、至少8,5mmol/l或至少9mmol/l的空腹血浆葡萄糖浓度。这些血浆葡萄糖浓度超出正常血糖浓度。
要如本文中公开的那样治疗的患者在步骤(i)开始时优选没有接受用胰岛素或/和其药物可接受盐的抗糖尿病治疗。
如本文所述,本发明的治疗能够诱导2型糖尿病患者中的重量减轻或/和预防重量增加。在本发明的实施例中令人惊奇地发现如本文所述的治疗能够预防重量增加。在24-周治疗时期期间,两组中体重略有增加,利西拉来治疗的患者的ls平均变化值为0.28kg,安慰剂治疗的患者的为1.16kg。利西拉来组中的体重增加统计学上显著低于安慰剂组中的。
如本文所述,本发明的治疗能够预防2型糖尿病患者中的低血糖。特别地,所述药物组合用于预防2型糖尿病患者中的症状性低血糖或/和重度症状性低血糖。
在本发明中,低血糖是如下的状况,其中2型糖尿病患者经历低于60mg/dl(或低于3.3mmol/l)、低于50mg/dl、低于40mg/dl、或低于36mg/dl的血浆葡萄糖浓度。
通过本发明的方法,可以将低血糖降低至接受如本文中描述的利西拉来或/和其药学可接受盐、甘精胰岛素或/和其药学可接受盐和任选地二甲双胍或/和其药学可接受盐的组合的2型糖尿病患者的低于12%、低于11%、低于10%、低于9%、低于8%、低于7%、低于6%或低于5%。
在本发明中,“症状性低血糖”是与源自低血糖的临床症状有关的状况,其中血浆葡萄糖浓度低于60mg/dl(或低于3.3mmol/l)、低于50mg/dl、或低于40mg/dl。临床症状可以例如是出汗(sweating)、心悸(palpitation)、饥饿(hunger)、坐立不安(restlessness)、焦虑(anxiety)、疲劳(fatigue)、易激惹(irritability)、头痛(headache)、集中力缺失(lossofconcentration)、嗜眠(somnolence)、精神障碍(psychiatricdisorder)、视觉障碍(visualdisorder)、短暂感觉缺陷(transientsensorydefect)、短暂运动缺陷(transientmotordefect)、意识错乱(confusion)、惊厥(convulsion)、和昏迷(coma)。在本发明中,可以选择如本文中指示的症状性低血糖的一种或多种临床症状。
症状性低血糖可以与口服碳水化合物施用后立刻恢复有关。
在本发明中,“重度症状性低血糖”是具有源自低血糖的如本文中指示的临床症状的状况,其中血浆葡萄糖浓度低于36mg/dl(或低于2.0mmol/l)。重度症状性低血糖可以与源自低血糖事件的急性神经病学损伤有关。在重度症状性低血糖中,如果例如患者由于急性神经病学损伤而不能自治或自助,那么患者可能需要别人的帮助。重度症状性低血糖的定义可以包括神经病学损伤严重得足以阻止自治且如此认为使患者对他们自己或其他人有损害风险的所有事件。急性神经病学损伤可以是选自下组的至少一项:嗜眠、精神障碍、视觉障碍、短暂感觉缺陷、短暂运动缺陷、意识错乱、惊厥、和昏迷。
重度症状性低血糖可以与口服碳水化合物、静脉内葡萄糖、或/和胰高血糖素施用后立刻恢复有关。
在本发明中,可以以足以诱导治疗效果的量对有此需要的受试者施用despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐。
在本发明中,可以与合适的药学可接受载体、佐剂或/和辅助物质一起配制despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐。
可以胃肠外,例如通过注射(诸如通过肌肉内或者通过皮下注射)施用化合物despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐。合适的注射装置,例如所谓的“笔”是已知的,所述笔包括装有活性成分的药筒和注射针。化合物despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐可以以合适的量,例如以范围为每剂10至15μg或每剂15至20μg的量施用。
在本发明中,可以以范围为10至20μg,范围为10至15μg,或范围为15至20μg的日剂量施用despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐。可以通过每日一次注射施用despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐。
在本发明中,可以以液体组合物提供despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐。技术人员知道适合于胃肠外施用的利西拉来的液体组合物。本发明的液体组合物可以具有酸性或生理ph。优选地,酸性ph范围为ph1-6.8,ph3.5-6.8,或ph3.5-5。优选地,生理ph范围为ph2.5-8.5,ph4.0-8.5,或ph6.0-8.5。可以通过药学可接受的稀释酸(通常为hcl)或药学可接受的稀释碱(通常为naoh)调节ph。
包含despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐的液体组合物可以包含合适的防腐剂。合适的防腐剂可以选自:酚、间甲酚、苯甲醇和对羟基苯甲酸酯。一种优选的防腐剂是间甲酚。
包含despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐的液体组合物可以包含张度剂。合适的张度剂可以选自:甘油、乳糖、山梨糖醇、甘露醇、葡萄糖、nacl、含有钙或镁的化合物诸如cacl2。甘油、乳糖、山梨糖醇、甘露醇和葡萄糖的浓度可以在100-250mm的范围内。nacl的浓度可以高达150mm。一种优选的张度剂是甘油。
包含despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐的液体组合物可以包含0.5μg/ml至20μg/ml,优选1μg/ml至5μg/ml的甲硫氨酸。优选地,液体组合物包含l-甲硫氨酸。
本发明的另一个方面是用于2型糖尿病患者治疗的方法,其中所述2型糖尿病通过至少一种口服抗糖尿病药物不足以控制,所述方法包括组合的施用,所述组合包含:
(a)despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐,
(b)甘精胰岛素或/和其药学可接受盐,和
(c)二甲双胍或/和其药学可接受盐,
其中所述组合的施用包括步骤:
(i)至少四周化合物(b)和(c)的施用,和
(ii)继续通过化合物(a),(b)和(c)的施用的治疗,其中调节步骤(i)或/和步骤(ii)中所施用化合物(b)的量使得达到或至少接近预定的空腹血糖水平或/和预定的自监测血糖水平。
具体的,在本发明的方法中,可以施用如本文所述的组合。更具体的,化合物(a)、(b)和(c)为本文定义的化合物。具体的,所述患者为本文定义的患者。进一步,步骤(i)和(ii)具体地如本文定义的完成。此外,步骤(i)和(ii)中施用的化合物(b)的调节具体地如本文所公开的完成。
本发明还另一个方面是组合在制备用于2型糖尿病患者治疗的药物中的用途,所述组合包含:
(a)despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐,
(b)甘精胰岛素或/和其药学可接受盐,和
(c)二甲双胍或/和其药学可接受盐,
其中所述2型糖尿病通过至少一种口服抗糖尿病药物不足以控制,且其中通过所述组合的治疗包括步骤:
(i)至少四周化合物(b)和(c)的施用,和
(ii)继续通过化合物(a),(b)和(c)的施用的治疗,其中调节步骤(i)或/和步骤(ii)中所施用化合物(b)的量使得达到或至少接近预定的空腹血糖水平或/和预定的自监测血糖水平。
具体的,在本发明的用途中,可以施用如本文所述的组合。更具体的,化合物(a)、(b)和(c)为本文定义的化合物。具体的,本文定义的患者可以通过所述药物治疗。进一步,步骤(i)和(ii)具体地如本文定义的完成。此外,步骤(i)和(ii)中施用的化合物(b)的调节具体地如本文所公开的完成。
本发明还涉及如下各项:
1.一种用于2型糖尿病患者治疗的药物组合,其中所述2型糖尿病通过至少一种口服抗糖尿病药物不足以控制,所述组合包括
(a)despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐,
(b)甘精胰岛素或/和其药学可接受盐,和
(c)二甲双胍(metformin)或/和其药学可接受盐,其中所述2型糖尿病患者的治疗包括步骤:
(i)至少四周化合物(b)和(c)的施用,和
(ii)继续通过化合物(a),(b)和(c)的施用的治疗,其中调节步骤(i)或/和步骤(ii)中所施用化合物(b)的量使得达到或至少接近预定的空腹血糖水平或/和预定的自监测血糖水平。
2.项1的药物组合,其中步骤(i)包括至少4周,至少8周,至少12周或至少16周化合物(b)和(c)的施用。
3.项2的药物组合,其中步骤(i)包括至少约12周的施用。
4.项1或3的药物组合,其中步骤(i)在没有施用化合物(a)的条件下进行。
5.之前项任何一项的药物组合,其中步骤(i)或/和(ii)进一步包括噻唑烷二酮的施用。
6.之前项任何一项的药物组合,其中步骤(i)或/和(ii)中的施用每天进行。
7.之前项任何一项的药物组合,其中基于血浆葡萄糖浓度的每日测量值调节步骤(i)或/和(ii)中施用的化合物(b)的量。
8.之前项任何一项的药物组合,其中调节步骤(i)或/和(ii)中施用的化合物(b)使得达到或至少接近约4.4mmol/l至约5.6mmol/l的空腹血糖水平或/和约8mmol/l的自监测血浆葡萄糖水平。
9.之前项任何一项的药物组合,其中2型糖尿病患者的治疗改善2型糖尿病患者中的血糖控制。
10.项9的药物组合,其中血糖控制为餐后血糖控制。
11.项10的药物组合,其中餐后血糖控制为餐后血浆葡萄糖或/和餐后葡萄糖偏移的控制。
12.之前项任何一项的药物组合,其中所述2型糖尿病患者的治疗改善自监测血浆葡萄糖。
13.之前项任何一项的药物组合,其中所述2型糖尿病患者的治疗诱导重量减轻或/和预防重量增加。
14.之前项任何一项的药物组合,其中所述2型糖尿病患者的治疗预防低血糖症。
15.根据之前项任何一项的药物组合,其中要治疗的患者是肥胖的。
16.根据之前项任何一项的药物组合,其中要治疗的患者具有至少30kg/m2的体重指数。
17.根据之前项任何一项的药物组合,其中要治疗的患者是成年患者。
18.根据之前项任何一项的药物组合,其中要治疗的患者在步骤(i)开始时没有接受通过胰岛素或/和其药学可接受的盐的治疗。
19.之前项任何一项的药物组合,其中在要治疗的患者中,在开始治疗前至少1年或至少2年已经诊断出2型糖尿病。
20.根据之前项任何一项的药物组合,其中要治疗的患者具有约7至约10%的hba1c值。
21.之前项任何一项的药物组合,其中步骤(i)开始时,所述患者具有至少8mmol/l的空腹血浆葡萄糖浓度。
22.之前项任何一项的药物组合,其中步骤(i)开始时,所述患者具有至少10mmol/l、至少12mmol/l、或至少14mmol/l的餐后2小时血浆葡萄糖浓度。
23.之前项任何一项的药物组合,其中步骤(i)开始时,所述患者具有至少2mmol/l、至少3mmol/l、至少4mmol/l或至少5mmol/l的葡萄糖偏移,其中所述葡萄糖偏移是餐后2小时血浆葡萄糖浓度和进餐测试前30分钟的血浆葡萄糖浓度的差。
24.之前项任何一项的药物组合,其中所述despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐制备用于胃肠外施用。
25.根据之前项任何一项的药物组合,其中所述甘精胰岛素或/和其药学可接受其制备用于胃肠外施用。
26.根据之前项任何一项的药物组合,其中所述despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐制备用于以选自10μg至20μg范围的日剂量施用。
27.之前项任何一项的药物组合,其中所述二甲双胍或/和其药学可接受盐制备用于口服施用。
28.一种用于2型糖尿病患者治疗的方法,其中所述2型糖尿病通过至少一种口服抗糖尿病药物不足以控制,其中所述方法包括组合的施用,所述组合包括
(a)despro36exendin-4(1-39)-lys6-nh2或/和其药学可接受盐,
(b)甘精胰岛素或/和其药学可接受盐,和
(c)二甲双胍(metformin)或/和其药学可接受盐,其中所述2型糖尿病患者的治疗包括步骤:
(i)至少四周化合物(b)和(c)的施用,和
(ii)继续通过化合物(a),(b)和(c)的施用的治疗,其中调节步骤(i)或/和步骤(ii)中所施用化合物(b)的量使得达到或至少接近预定的空腹血糖水平或/和预定的自监测血糖水平。
本发明通过以下实施例和图进一步例示。
附图简述
图1:研究设计。对于准备期,利用访问2日期作为参照,±3日的访问窗口是可接受的。在随机双盲治疗时期期间,利用访问13当天作为参照,±3日直至访问15(第2周)和访问15后±5日是可接受的。对于利用访问22当天作为参照的治疗后跟踪访问,1日或+3日的访问窗口是可接受的。*体积匹配安慰剂。
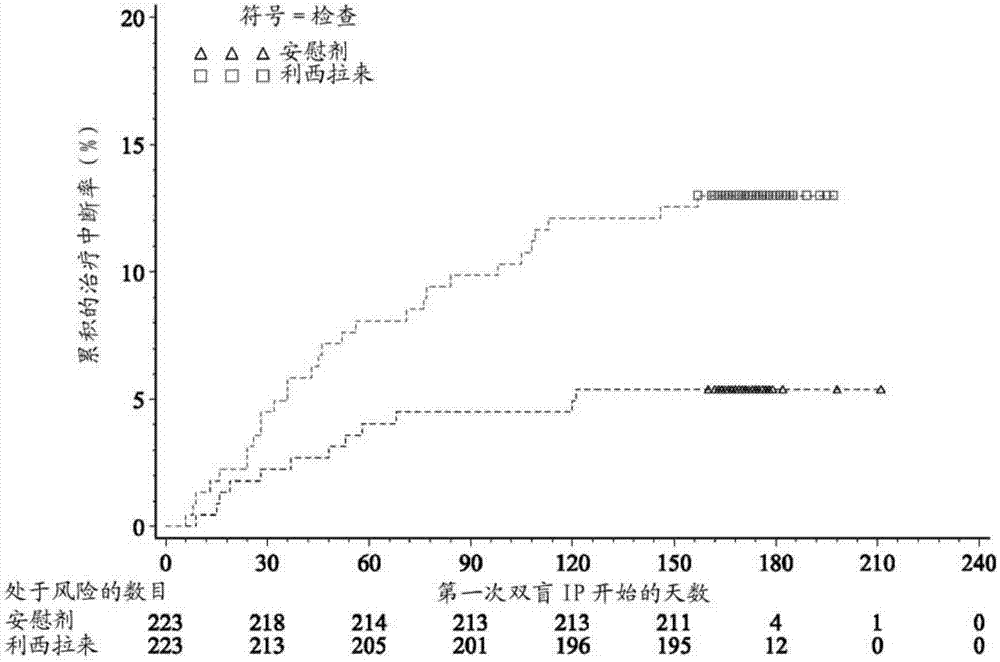
图2:由于任何原因所致的治疗中断前的时间的kaplan-meier图-随机化群体。
图3:从基线到访问的hba1c(%)的均值变化的图-mitt群体。locf=向前进行的最后一次观察。注意:该图排除了拯救药疗法引入后和/或治疗中断加14日后获得的测量值。
图4:访问之前hba1c(%)均值的图-mitt群体。locf=向前进行的最后一次观察。注意:该图排除了拯救药疗法引入后和/或治疗中断加14日后获得的测量值。
图5:从基线到访问的平均7点自身监测血浆葡萄糖(smpg)(mmol/l)的均值变化的图-mitt群体。locf=向前进行的最后一次观察。注意:该图排除了拯救药疗法引入后和/或治疗中断后获得的测量值。
图6:基线和第24周(locf)每个时间点的平均7点自身监测血浆葡萄糖(smpg)(mmol/l)的均值变化的图-mitt群体。注意:所述基线值定义为双盲试验品第一次注射之前最后一个可得到的值。该图排除了拯救药疗法引入后和/或治疗中断后获得的测量值。
图7:从基线到访问的体重(kg)的均值变化的图-mitt群体。locf=向前进行的最后一次观察。注意:该图排除了拯救药疗法引入后和/或治疗中断加3日后获得的测量值。
图8:从基线到访问的甘精胰岛素剂量(u)的均值变化的图-mitt群体。locf=向前进行的最后一次观察。bas=基线。注意:该图排除了拯救药疗法引入后和/或治疗中断后获得的测量值。
图9:从基线到访问的空腹血糖(mmol/l)的均值变化的图-mitt群体。locf=向前进行的最后一次观察。注意:该图排除了拯救药疗法引入后和/或治疗中断加1日后获得的测量值。
实施例
概述
实施例涉及一项随机化的、双盲的、以安慰剂为对照的、2分支、平行组、多国研究,其在2型糖尿病患者中评估与安慰剂相比利西拉来作为与或不与二甲双胍组合的甘精胰岛素的附加治疗的效力和安全性。每名患者的大致最大研究持续时间是39周[长达14周筛选期(包括长达2周筛选期和12周准备期)+24周双盲的、以安慰剂为对照的治疗期+3天随访]。在15个国家的140个中心进行研究。研究的主要目的是在24周时段里就hba1c变化而言与安慰剂相比评估利西拉来作为甘精胰岛素和二甲双胍的附加治疗对血糖控制的效力。
将总共446名患者随机化至两个治疗组之一(利西拉来组中223名和安慰剂组中223名),并且将所有随机化患者暴露于调查产品(ip)。人口统计状况和基线特征在治疗组间总体是相似的。没有患者从用于效力分析的mitt群体排除。在整个研究治疗期期间,29名(13.0%)用利西拉来治疗的患者过早中断ip,而12名(5.4%)用安慰剂治疗的患者中断ip。对于这两个治疗组,治疗中断的主要原因是“不利事件”(对于利西拉来为8.5%对对于安慰剂为4.0%),接着是“其它原因”(对于利西拉来为3.6%对对于安慰剂为1.3%)。值得注意的是,gi相关的ae是导致利西拉来ip中断(10名患者[4.5%])的主要teae。
hba1c值在两治疗组中降低,在利西拉来组中从基线的7.56%至第24周(locf)的6.96%,在安慰剂组中从7.60%至7.30%。相比安慰剂,利西拉来hb1ac的降低明显更大:从基线至第24周的hba1c最小二乘方(ls)均值变化分别是-0.71%和-0.40%,相对于安慰剂的ls均值差=-0.32%;p值<0.0001。值得注意的是,按照每个方案,整个研究的两治疗组中允许胰岛素剂量的调节以维持目标空腹血浆葡萄糖。
与安慰剂组中85名患者(38.5%)相比,利西拉来组中总共121名患者(56.3%)在第24周时实现hba1c<7%,且与36名(16.3%)用安慰剂治疗的患者相比,69名(32.1%)用利西拉来治疗的患者具有hba1c≤6.5%。使用cochran-mantel-haenszel(cmh)法的hba1c响应者分析(在第24周时hba1c≤6.5或<7%)显示利西拉来组与安慰剂之间的显著的治疗差异(分别为p值<0.0001和p值=0.0001)。
用利西拉来的治疗还显著改善餐后血糖控制,如通过餐后2小时血浆葡萄糖(ppg)和葡萄糖偏移评估的结果显示的。与安慰剂组相比,从基线到底24周,利西拉来组中展现测试餐后2小时ppg的统计学显著改善,ls均值差为-3.16mmol/l(p值<.0001)。相应地,相比用安慰剂治疗的患者,用利西拉来治疗的患者中观察到葡萄糖偏移的实质降低(ls均值差=-3.09mmol/l,95%ci=-3.842至-2.331)。
此外,与安慰剂组相比,利西拉来治疗展现7点自身监测血浆葡萄糖(smpg)概况平均值的统计学显著改善(ls均值差为-0.39mmol/l;p值为0.0071)。
相比安慰剂组中,利西拉来组中观察到统计学显著更小的体重增加(从基线至第24周ls均值体重变化为利西拉来治疗患者的0.28kg和安慰剂治疗患者的1.16kg;相对于安慰剂的ls均值差=-0.89kg,p值=0.0012)。
整个24周治疗期间,两组中,逐渐增加每日胰岛素剂量,其由所述方案允许以维持fpg在100和80mg/d之间(5.6和4.4mmmol/l)(从基线的ls均值变化,利西拉来组中为3.10u,安慰剂组中为5.34)。然而,利西拉来组中的患者显示每日甘精胰岛素剂量显著更少的增加,然而获得更大的hba1c的降低(相对于安慰剂的ls均值差=-2.24u;p值=0.0300)。
对于空腹血浆葡萄糖,在治疗组间没有观察到统计学显著差异(相对于安慰剂的ls均值差=-0.12mmol/l;p值=0.5142)。总共2名患者(每组1名[0.4%])接受挽救疗法。
利西拉来是耐受良好的。相比安慰剂组[152(68.2%)],虽然利西拉来组中[178(79.8%)]具有治疗紧急不利事件(teae)的患者数稍微高些,但利西拉来组和安慰剂组在安全性方面总体是相当的。具有teae的患者数的不均衡主要由gi相关的ae驱动(利西拉来39.9%对比安慰剂16.1%)。
利西拉来组中没有患者和安慰剂组中的两名患者具有导致死亡的teae。
具有严重teae的患者的数目是利西拉来组中的17名(7.6%)和安慰剂组中的10名(4.5%),在任何特定系统器官类别(soc)中没有显著增加的事件。
50名(22.4%)用利西拉来治疗的患者和安慰剂组中的30名(13.5%)患者在治疗期期间报告具有方案中定义的症状性低血糖事件。利西拉来组的1名患者(0.4%)和安慰剂组中没有患者经历按照方案定义的重度症状性低血糖事件。
除低血糖外,最常报告的teae是恶心(27.4%)(对于利西拉来组)和流感(6.3%)(安慰剂组)。
总共4名患者(3名[1.3%]用利西拉来治疗的患者和1名[0.4%]用安慰剂治疗的患者)报告4例teae,其由变应性反应评估委员会(arac)判定为变应性反应,并且这些事件中的3例(利西拉来组中的2例过敏性反应事件和安慰剂组中的1例血管性水肿)判定为可能与ip相关。利西拉来组中15名患者(6.7%)和安慰剂组中5名患者经历注射部位反应ae。
安慰剂组中,1名患者报告疑是胰腺炎的1例teae,2名患者报告血液降钙素升高的2例teae,然而利西拉来组中没有患者报告所述teae。
1目的
1.1主要目的
本研究的主要目的是在24周的时段里就hba1c变化而言作为甘精胰岛素和二甲双胍的附加治疗与安慰剂相比评估利西拉来对血糖控制的效力。
1.2次要目的
次要目的是:
·评估利西拉来对下列各项的影响:
—达到hba1c<7%和≤6.5%的患者的百分比,
—血浆葡萄糖(空腹、标准化膳食考验测试后餐后、7点自身监测概况)
—体重
—甘精胰岛素剂量
·评估作为甘精胰岛素和二甲双胍的附加治疗的利西拉来安全性和可耐受性(包括抗利西拉来抗体评价)
·利用糖尿病治疗满意度问卷(状态)(dtsq)评价经确认的参与国中利西拉来对治疗满意度的影响。
2试验设计
这是一项多中心的、多国家的、双盲的、1:1随机化的、以安慰剂为对照的、2分支、平行组3期研究。就活性和安慰剂治疗而言,研究是双盲的。研究药物体积(即,活性药物或匹配安慰剂的剂量)不是盲的。所述研究设计通过图1说明。
通过安排在准备期结束前一周的访问12收集的糖基化血红蛋白a1c(hba1c)的筛选数值(<8%,≥8%)和噻唑烷二酮类(tzd)使用(是,否)将患者分层。
tzd是可以在研究期间持续的甘精胰岛素和二甲双胍的唯一被允许的伴随附加糖尿病治疗。在准备期结束时,经由交互式声音响应系统(interactivevoiceresponsesystem,ivrs)将合格的患者在中心以1:1比率随机化至利西拉来或安慰剂。不允许强制的随机化。
所述研究由3个时期组成:(1)长达14周的筛选期,其包括长达2周的筛选期和12周的准备期,其中甘精胰岛素紧接着二甲双胍+/-tzd引入和滴定;患者以每日一次甘精胰岛素开始,且通过治疗-目标方案滴定胰岛素剂量以实现准备期期间fpg100-80mg/dl(5.6-4.4mmol/l)的血糖目标。(2)对其hba1c(集中分析)为≥7%且≤9%和在访问12之前7天期间其均值空腹自我监测血浆葡萄糖(smpg)为≤140mg/dl(7.8mmol)的患者的24周双盲随机治疗期;和(3)在治疗访问结束后3天(-1/+3)用安全性电话访问(最后研究访问)的随访期。
过早中断研究治疗的患者在研究中继续,直到研究完成的安排日期。依照方案中规定的研究规程对他们进行随访(除了膳食考验测试和治疗满意度评价外)。
3主要和关键的次要终点
3.1主要终点
主要效力变量是从基线至第24周的hba1c绝对变化,其定义为第24周的hba1c-基线时的hba1c。
若患者过早中断治疗或者在主要24周双盲治疗期期间接受挽救疗法或者在第24周访问时没有hba1c值,则使用治疗期期间的最后一次基线后hba1c测量作为第24周的hba1c值(向前进行的最后一次观察[lastobservationcarriedforward,locf]规程)。
3.2次要终点
3.2.1效力终点
对于次要效力变量,与对于主要变量一样应用用于处理缺少评估/早期中断的相同规程。
连续变量
·从基线至第24周在标准化膳食后餐后2小时血浆葡萄糖(mmol/l)的变化
·从基线至第24周在标准化膳食考验测试后葡萄糖偏移(餐后2小时血浆葡萄糖–研究药物施用前在膳食测试前30分钟的血浆葡萄糖)(mmol/l)的变化;
·从基线至第24周的7点smpg概况(mmol/l)(即7点的平均值和每个时间点)的变化;
·从基线至第24周的fpg(mmol/l)的变化
·从基线至第24周的体重(kg)的变化
·从基线至第24周的甘精胰岛素日剂量(u)和胰岛素总剂量(u)的变化;
·从基线至第24周的治疗满意度得分(来自dtsq的项目1、4、5、6、7和8的总计)的变化;
·从基线至第24周的每个单独项目(项目1-8)的变化。
分类变量
·在第24周时具有hba1c<7%的患者的百分比
·在第24周时具有hba1c≤6.5%的患者的百分比
·在治疗期期间需要挽救疗法的患者的百分比。
3.2.2安全性终点
安全性分析基于报告的teae和其它安全性信息,包括症状性低血糖和重度症状性低血糖、注射部位的局部可耐受性、变应性事件(如由arac判定的)、可疑的胰腺炎、增加的降钙素、生命征、12导联ecg和实验室测试。
根据所述方案:
·症状性低血糖定义为伴随血浆葡萄糖<60mg/dl(3.3mmol/l)或如果没有可获得的血浆葡萄糖测量值,与口服碳水化合物施用后立刻恢复有关的临床症状事件。
·重度症状性低血糖定义为其中因为患者由于急性神经功能损伤而直接导致低血糖事件而不能自治,而患者需要别人的帮助的临床症状事件,且低血糖事件的一种如下:
—所述事件与血浆葡萄糖水平低于36mg/dl(2.0mmol/l)有关。
—如果没有可获得的血浆葡萄糖测量值,则所述事件与口服碳水化合物、静脉内葡萄糖、或/和胰高血糖素施用后立刻恢复有关。
还将主要心血管事件收集并发送,以由心血管判定委员会(cardiovascularadjudicationcommittee,cac)判定。在必要时将来自此研究和其它利西拉来3期研究的由cac判定且确认的事件合并以进行分析,并基于利西拉来的总体心血管评估的统计学分析计划在不同报告中汇总。krm/csr不会呈现来自此研究的判定且确认的cv事件的汇总。
4样品大小计算假设
基于主要变量,即从基线至第24周的hba1c变化实施样品大小/功效(power)计算。
假设常见标准差(sd)在2侧检验的情况中在5%的显著性水平是1.3%,预期450名患者(每组225名)的样品大小提供98%的功效来检测利西拉来和安慰剂之间从基线至第24周的hba1c变化的0.5%的差异或90%的功效来检测0.4%的差异。
5统计学方法
5.1分析群体
mitt群体由所有如下的患者组成,所述患者是随机化的,接受至少一剂双盲调查产品(ip),并且具有任何主要或次要效力变量的基线评估和至少一次基线后评估两者(不管对研究方案和规程的顺从性)。
安全性群体为全部的治疗群体,其定义为所有随机化患者(经由按照方案的中心随机化系统)且暴露于至少一剂双盲ip,而不论施用的治疗量。
5.2主要效力分析
用治疗组(利西拉来或安慰剂),访问12hba1c(<8.0,≥8.0%)的随机化层、tzd使用(是,否)的随机化层和国家作为固定效应并且使用基线数值作为协变量使用协方差分析(ancova)模型分析主要效力变量(从基线至第24周的hba1c变化)。在ancova的框架内评估利西拉来和安慰剂之间的差异和双侧95%置信区间以及p值。
主要效力变量的基线为双盲ip(利西拉来或安慰剂)首次注射之前的最后一个变量值。
通过采用最后一次可用的基线后治疗hba1c测量(在挽救疗法事件中启动新药疗前)作为第24周hba1c值来使用locf规程。
基于mitt群体和在用于效力变量的治疗期期间获得的测量实施对主要效力变量的主要分析。用于效力变量的治疗期定义为从第一剂双盲ip直到hba1c14天;由中心实验室进行的fpg1天;膳食考验参数、7点smpg、甘精胰岛素剂0天;和最后一剂双盲ip之后体重和治疗满意度得分的3天或直至引入挽救疗法的时间,以最早者为准。
5.3次要效力分析
一旦主要变量在α=0.05时是统计学显著的,实施测试规程以按以下优先考虑次序测试以下次要效力变量。一发现终点在α=0.05时不是统计学显著的,就停止测试。
1.从基线至第24周的标准化膳食测试后餐后2小时血浆葡萄糖(mmol/l)的变化,
2.从基线至第24周的7点smpg平均值的变化,
3.从基线至第24周的体重(kg)的变化,
4.从基线至第24周的平均日甘精胰岛素剂量(u)的变化,
5.从基线至第24周的fpg(mmol/l)的变化,
6.治疗期期间需要挽救疗法的患者的百分比。
不会对上文没有提及的其它次要效力变量做出多重性调节。
次要效力变量的基线为双盲ip(利西拉来或安慰剂)首次注射之前的最后一个变量值,除了甘精胰岛素剂量外(基线处的平均日剂量为在第1周发生的访问12之前该周的平均日剂量)。
使用与上文对主要效力终点的主要分析的描述类似的方法和ancova模型分析如第3.2.1节中描述的第24周的所有连续次要效力变量。提供了利西拉来和安慰剂之间的治疗均值差的估值和双侧95%置信区间。
使用按随机化层(访问12hba1c[<8.0,≥8%]和tzd使用[是,否])分层的cochran-mantel-haenszel(cmh)法分析第24周的以下分类次要效力变量:
·在第24周时具有hba1c<7.0%的患者的百分比,
·在第24周时具有hba1c≤6.5%的患者的百分比,
·在治疗期期间需要挽救疗法的患者的百分比。
治疗组呈现在第24周时相对于基线具有≥5%重量减轻的患者的数目和百分比。
5.4安全性分析
安全性分析主要基于治疗期。用于安全性分析的治疗期定义为不管挽救状态的引入,从第一剂双盲ip直到最后一剂ip施用后3天的时间。基于双盲ip的半衰期选择3天时间间隔(半衰期的约5倍)。
呈现治疗组的安全性结果的汇总(描述性统计或频率表)。
6结果
6.1研究患者
6.1.1患者可计算性(accountability)
在25个国家(阿根廷、巴西、加拿大、智利、台湾、哥伦比亚、捷克共和国、丹麦、爱沙尼亚、法国、德国、匈牙利、印度、以色列、意大利、马来西亚、墨西哥、荷兰、波兰、罗马尼亚、俄罗斯联邦、南非、瑞典、乌克兰和美国)的140个中心筛选总共1470名患者。1470名患者中,898名进入准备期的12周。筛选失败的主要原因是筛选访问时的hba1c值在方案定义的范围外(1470名筛选患者中的354名[24.1%])。
总计446名患者随机化入两个治疗组中的一组。筛选失败的主要原因是访问12时的hba1c值在方案定义的范围外(1470名筛选患者中的304名[20.7%])。所有446名随机化患者暴露于ip。没有患者从供效力分析用的mitt群体排除。表1提供了每个分析群体中包括的患者数目。
表1:分析群体-随机化群体
注意:安全性患者依照实际接受的治疗(为治疗的)制成表格。
对于效力群体,患者依照其随机化治疗(为随机化的)制成表格。
6.1.2研究布置
表2提供了每个治疗组的患者布置的汇总。
在24周研究治疗期期间,29名(13.0%)用利西拉来治疗的患者过早中断ip,而12名(5.4%)用安慰剂治疗的患者中断ip。对于这两个治疗组,治疗中断的主要原因是“不利事件”(对于利西拉来为19名患者[8.5%],对于安慰剂为9名患者[4.0%])。值得注意的是,gi相关的ae是导致利西拉来ip过早中断的主要teae(10名患者[4.5%])。治疗过早中断的第二最常见的原因为“其它原因”(对于利西拉来为8名患者[3.6%],对于安慰剂为3名患者[1.3%]),其主要是个人原因,但也包括错误随机化的不合格患者的撤消(利西拉来组中3名患者,安慰剂组中1名患者)。研究过程中3名患者死亡:治疗后时期中安慰剂组中2名死于teae,利西拉来组中1名死于非teae。
图2中描绘了由于总体治疗期的任何原因所致的治疗中断的发作前时间(time-to-onset)。对利西拉来组观察到较高的中断率。
表2:患者布置-随机化群体
注意:使用随机化患者数目作为分母计算百分比。
6.1.3人口统计状况和基线特征
人口统计和患者基线特征在安全性群体的两个治疗组之间总体是相似的(表3)。研究群体的中值年龄是57.0岁。大多数患者是高加索裔(74.4%)。
表3:筛选或基线时的人口统计状况和患者特征-安全性群体
bmi=体重指数。tzd=噻唑烷二酮类
疾病特征(包括糖尿病史)汇总在表4、5和6中。糖尿病的均值持续时间利西拉来组(8.12年)略高于安慰剂组(7.28年)。糖尿病慢性并发症包括糖尿病神经病变、视网膜病和肾病通常与每个治疗组中患者比例的小的变化相一致。值得注意的是,11名患者(利西拉来组8名和安慰剂组3名)在研究前接受glp-1受体激动剂。
甘精胰岛素基线(v12,第1周)的平均日剂量(参见5.3节)对于利西拉来组为43.44u,安慰剂组为44.24u。两个治疗组中随机化的平均剂量保持几乎不变(利西拉来组44.08u和安慰剂组44.95u)。
两个治疗组之间二甲双胍的使用持续时间和平均日剂量非常相似;基线处,研究群体的平均剂量为2048.7mg。在筛选访问时使用tzd的72名患者外,两个治疗组中54名患者以相同的比例继续基线处的tzd(12.1%,表7)。由于随机化层误差(表7),在“tzd使用的随机化层”与“实际的基线处tzd使用”之间在患者数目上不一致。利西拉来组中3名患者未使用随机化tzd,但以层‘tzd=是’随机化。8名患者使用随机化tzd(利西拉来中6名,安慰剂中2名),但以层‘tzd=否’随机化。
表4:筛选或基线时的疾病特征-安全性群体
glp-1=胰高血糖素样肽-1。
使用cockroft和gault方程得到肌酸酐清除率数值。
表5:疾病特征-基线时和随机化时平均日甘精胰岛素剂量(u)-安全性群体
a基线时的甘精胰岛素平均日剂量是在第1周发生的访问12之前那周的平均日剂量。
表6:疾病特征-基线时的二甲双胍-安全性群体
表7:疾病特征-筛选时和基线时的噻唑烷二酮类(tzd)-安全性群体
基线效力变量在安全性群体的两个治疗组之间总体是相当的(表8)。两组中的安全性群体在基线血糖参数方面,包括hba1c、fpg、ppg和7-点smpg是很好地匹配的,仅有均值的微小差异。
表8:基线效力变量-安全性群体
fpg=空腹血浆葡萄糖。smpg=自身监测血液葡萄糖。dtsq=糖尿病治疗满意度问卷(状况)。葡萄糖偏移=餐后2小时血浆葡萄糖-膳食测试前30分钟的血浆葡萄糖,研究药物施用前。
a来自dtsq的项目1、4、5、6、7和8的总计。
注意:次要效力变量的基线为双盲ip(利西拉来或安慰剂)首次注射之前的最后一个变量值,除了甘精胰岛素剂量外(基线处的平均日剂量为在第1周发生的访问12之前该周的平均日剂量)。
6.1.4剂量和持续时间
平均ip(利西拉来或安慰剂)治疗暴露是155.8天(22.3周)(对于利西拉来组)和163.4天(23.3周)(对于安慰剂组)(表9)。在446名患者中,利西拉来组中的143名(64.1%)患者和安慰剂组中的151名(67.7%)患者接受至少169天(24周)的治疗。
对于利西拉来组,196名(87.9%)患者在24周双盲治疗期结束时处于20μg的目标总每日剂量(表10)。对于安慰剂组,215名(96.4%)患者在24周双盲治疗期结束时处于20μg的目标总每日剂量(表10)。
表9:暴露-安全性群体
暴露持续时间=(最后一次双盲调查产品注射的日期-第一次双盲调查产品注射的日期)+1。
表10:依照治疗结束时最终总每日剂量的患者数目(%)-安全性群体
剂量=活性药物或体积匹配安慰剂的剂量。
注意:使用安全性患者的数目作为分母计算百分比。
6.2效力
6.2.1主要效力终点
主要分析
表11汇总了主要效力参数的结果,即从基线至第24周(locf)的hba1c变化,使用ancova分析。
12周准备期期间的甘精胰岛素治疗导致平均hba1c值从每个组的8.6%显著降低(表34)至利西拉来组的7.56%,安慰剂组的7.60%。平均hba1c值在24周随机治疗期期间在两个组中进一步降低至利西拉来组的6.96%,安慰剂组的7.30%。从随机化基线至第24周hba1c的最小平方(ls)均值变化对于利西拉来组是-0.71%,对于安慰剂组是-0.40%。预先规定的主要分析显示了与安慰剂组相比,用利西拉来治疗导致统计学显著的从基线至第24周的hba1c降低(相对于安慰剂组的ls均值差=-0.32%;p值<0.0001)。值得注意的是,按照每个方案,整个研究的两治疗组中允许胰岛素剂量的调节以维持目标空腹血浆葡萄糖。
表11:从基线至第24周的hba1c(%)的均值变化-mitt群体
locf=向前进行的最后一次观察。
a用治疗组(利西拉来和安慰剂)、访问12(第1周)hba1c(<8.0,8.0%)的随机化层、tzd使用(是,否)的随机化层、国家作为固定效应和基线hba1c值作为协变量的协方差分析(ancova)模型。
注意:分析排除了在引入挽救药物后,和/或治疗中断+14天后获得的测量。
包括具有基线和第24周(locf)测量两者的患者。
图3和4显示了在24周双盲治疗期期间hba1c自基线起的均值(±se)变化和均值(±se)hba1c值。
如图3所示,两个治疗组均实现从第8周至第16周的血糖平衡,且在治疗期至结束的后期观察到hba1c升高。
表12汇总了在第24周时分别具有hba1c≤6.5%或<7%的治疗响应的患者的比例。在两个hba1c分类中,使用cmh法对hba1c响应者的分析对用利西拉来治疗的组显示了相对于安慰剂的显著治疗差异(分别为p值<0.0001和p值=0.0001)。第24周时,32.1%用利西拉来治疗的患者和16.3%用安慰剂治疗的患者已经实现hba1c值≤6.5%;利西拉来组中56.3%的患者和安慰剂组中38.5%的患者已经实现hba1c值<7%。
表12:在第24周时分别具有hba1c值≤6.5%或<7%的患者的数目(%)-mitt群体
tzd=噻唑烷二酮类。
a通过访问12(第1周)hba1c(<8.0或≥8.0%)的随机化层和tzd使用(是或否)的随机化层分层的cochran-mantel-haenszel(cmh)法。
注意:分析排除了在引入挽救药物后,和/或治疗中断+14天后获得的测量。
包括具有基线和第24周(locf)测量两者的患者。
6.2.2次要效力终点
表13-16和表18、19和21分别汇总了对餐后2小时血浆葡萄糖、葡萄糖偏移、平均7点smpg、和dtsq得分的ancova分析。图5、7-9显示了在24周双盲治疗期期间随时间的自基线的平均7点smpg、体重、甘精胰岛素剂量和fpg均值(±se)变化。
标准测试膳食后的餐后2小时血浆葡萄糖结果显示与安慰剂组相比,利西拉来组中从基线至第24周的统计学显著改善(相对于安慰剂的ls均值差=-3.16mmol/l;p值<.0001,表13)。此外,与用安慰剂治疗相比,用利西拉来治疗实质性降低从基线至第24周的餐后血浆葡萄糖偏移(ls均值差=-3.09mmol/l,95%ci=-3.842至-2.331)(表14)。
表13:从基线至第24周的餐后2小时血浆葡萄糖(mmol/l)均值变化-mitt群体
locf=向前进行的最后一次观察。
a用治疗组(利西拉来和安慰剂)、访问12(第1周)hba1c(<8.0,8.0%)的随机化层、tzd使用(是,否)的随机化层、国家作为固定效应和基线餐后2小时血浆葡萄糖数值作为协变量的协方差分析(ancova)模型。
注意:分析排除了在引入挽救药物后,和/或治疗中断后获得的测量。
包括具有基线和第24周(locf)测量两者的患者。
表14:从基线至第24周的葡萄糖偏移(mmol/l)均值变化-mitt群体
locf=向前进行的最后一次观察。tzd=噻唑烷二酮类。葡萄糖偏移=餐后2小时血浆葡萄糖-在膳食测试前30分钟的血浆葡萄糖,研究药物施用前。
a用治疗组(利西拉来和安慰剂)、访问12(第1周)hba1c(<8.0,8.0%)的随机化层、tzd使用(是,否)的随机化层、国家作为固定效应和基线葡萄糖偏移值作为协变量的协方差分析(ancova)模型。注意:分析排除了在引入挽救药物后,和/或治疗中断后获得的测量。
包括具有基线和第24周(locf)测量两者的患者。
对于平均7点smpg,与安慰剂组相比,在利西拉来组中观察到从基线至第24周的统计学显著改善(相对于安慰剂的ls均值差=-0.39mmol/l;p值=0.0071)(表15)。通过7-点smpg测量的两个组的全部血糖过多与24周治疗期整个过程的hba1c趋势相一致(图4)。
表15:从基线至第24周的平均7点自身监测血浆葡萄糖(smpg)(mmol/l)均值变化-mitt群体
locf=向前进行的最后一次观察。tzd=噻唑烷二酮类。
a用治疗组(利西拉来和安慰剂)、访问12(第1周)hba1c(<8.0,8.0%)的随机化层、tzd使用(是,否)的随机化层、国家作为固定效应和7-点smpg值作为协变量的协方差分析(ancova)模型。
注意:分析排除了在引入挽救药物后,和/或治疗中断后获得的测量。
包括具有基线和第24周(locf)测量两者的患者。
如图6所示,其通过基线和终点每个时间点显示了7-点smpg,相比安慰剂组,利西拉来组观察到从基线至第24周的明显减少和午餐后的适度降低;然而,显示餐后葡萄糖降低在整个晚餐后和睡时衰退。
从基线至第24周的ls均值体重变化是0.28kg(对于用利西拉来治疗的患者)和1.16kg(对于用安慰剂治疗的患者)。观察到利西拉来组中相比安慰剂组中统计学显著更少的体重增加(相对于安慰剂的ls均值差=-0.89kg,p值=0.0012)(表16)。比用安慰剂治疗的患者(3.2%)略多的用利西拉来治疗的患者(5.1%)具有5%或更多的从基线至第24周的重量减轻(表17)。
表16:从基线至第24周的体重(kg)均值变化-mitt群体
locf=向前进行的最后一次观察。tzd=噻唑烷二酮类。
a用治疗组(利西拉来和安慰剂)、访问12(第1周)hba1c(<8.0,8.0%)的随机化层、tzd使用(是,否)的随机化层、国家作为固定效应和基线体重作为协变量的协方差分析(ancova)模型。
注意:分析排除了在引入挽救药物后,和/或治疗中断后获得的测量。
包括具有基线和第24周(locf)测量两者的患者。
表17:从基线至第24周具有>=5%体重减轻的患者的数目(%)-mitt群体
a此分类中包括具有小于5%重量减轻的患者,所述分类包括增加重量的患者。
注意:分析排除了在引入挽救药物后,和/或治疗中断后加3天获得的测量。
包括具有基线和第24周(locf)测量两者的患者。
24周治疗期期间,两组中的日胰岛素剂量逐步增加,其由方案所允许以维持fpg在100和80mg/d之间(5.6和4.4mmmol/l)。然而,利西拉来组中的患者显示甘精胰岛素剂量相当少的增加(图8)但实现更大的hba1c的降低。与安慰剂组相比,利西拉来组在终点(第24周)时的胰岛素剂量均值变化达到统计学显著的差异(相对于安慰剂的ls均值差=-2.24u;p值=0.0300)(表18)。
表18:从基线至第24周的胰岛素剂量(u)均值变化-mitt群体
locf=向前进行的最后一次观察。tzd=噻唑烷二酮类。
a用治疗组(利西拉来和安慰剂)、访问12(第1周)hba1c(<8.0,8.0%)的随机化层、tzd使用(是,否)的随机化层、国家作为固定效应和基线平均日甘精胰岛素作为协变量的协方差分析(ancova)模型。
注意:分析排除了在引入挽救药物后,和/或治疗中断后获得的测量。
包括具有基线和第24周(locf)测量两者的患者。
这两个治疗组中的患者显示从基线至第24周的fpg略微提高(ls均值0.34mmol/l(对于利西拉来)对0.46mmol/l(对于安慰剂)),在利西拉来和安慰剂组之间没有观察到统计学显著差异(相对于安慰剂的ls均值差=-0.12mmol/l;p值=0.5142)(表19)。
表19:从基线至第24周的空腹血浆葡萄糖(mmol/l)均值变化-mitt群体
locf=向前进行的最后一次观察。tzd=噻唑烷二酮类。
a用治疗组(利西拉来和安慰剂)、访问12(第1周)hba1c(<8.0,8.0%)的随机化层、tzd使用(是,否)的随机化层、国家作为固定效应和基线空腹血浆葡萄糖值作为协变量的协方差分析(ancova)模型。
注意:分析排除了在引入挽救药物后,和/或治疗中断后加1天获得的测量。
包括具有基线和第24周(locf)测量两者的患者。
按照调节多重性的测试策略,第24周时需要挽救疗法的患者的百分比的推论性测试是探索性的,因为前述测试(fpg)不能显示统计学显著的组差异。共2名患者(安慰剂组和利西拉来组每组各1名[0.4%])接受了挽救治疗(表20)。
表20:在24周治疗期期间需要挽救疗法的患者的数目(%)-mitt群体
tzd=噻唑烷二酮类。
a通过访问12(第1周)hba1c(<8.0或≥8.0%)和tzd使用(是或否)的随机化层分层的cochran-mantel-haenszel(cmh)法。
表21:从基线至第24周的糖尿病治疗满意度问卷(dtsq)得分的均值变化-mitt群体
locf=向前进行的最后一次观察。tzd=噻唑烷二酮类。dtsq=糖尿病治疗满意度问卷(状况)。
a用治疗组(利西拉来和安慰剂)、访问12(第1周)hba1c(<8.0,8.0%)的随机化层、tzd使用(是,否)的随机化层、国家作为固定效应和基线治疗满意度得分作为协变量的协方差分析(ancova)模型。
注意:分析排除了在引入挽救药物后,和/或治疗中断后加3天获得的测量。
dtsq得分:来自dtsq的项目1、4、5、6、7和8的总计。
包括具有基线和第24周(locf)测量两者的患者。
6.3安全性
表22中提供了整个研究的治疗期期间观察到的不利事件的概述。具有治疗紧急不利事件(teae)的患者的比例对于利西拉来为79.8%,对于安慰剂为68.2%。利西拉来组中不成比例的teae患者数主要由gi相关ae驱动(对于利西拉来39.9%对比安慰剂16.1%)。2名患者(均在安慰剂中)具有导致死亡的teae。经历严重teae的患者的百分比在利西拉来组中(7.6%)比在安慰剂组中(4.5%)高,在任何特定的系统器官类别(soc)中没有显著提高的发生率。与安慰剂组中的3.6%相比,具有导致治疗中断的teae的患者的百分比在利西拉来组中是8.5%。导致治疗中断的最常见的teae在利西拉来组中为恶心和呕吐(9名患者[4.0%]),而安慰剂组中没有患者由于恶心和呕吐中断治疗。表23、24、和25汇总了根据主要soc、高水平组项(hlgt)、高水平项(hlt)和优选项(pt),导致死亡的teae、严重teae、和导致治疗中断的teae。
表35在附录中呈现了在整个研究的治疗期期间在任何治疗组中以至少1%的患者发生的teae发生率。对于两治疗组,低血糖是最常报告的teae(利西拉来(61人[27.4%])和安慰剂(43人[19.3%])。除了低血糖外,利西拉来组中最常见的teae是恶心(对于利西拉来为61名患者[27.4%],对于安慰剂为11名患者[4.9%]),接着是头痛(对于利西拉来为22名患者[9.9%],对于安慰剂为8名[3.6%])和呕吐(对于利西拉来为21名患者[9.4%],对于安慰剂为3名[1.3%])。
表22:不利事件概况的概述:整个研究的治疗期期间的治疗紧急不利事件-安全性群体
teae:治疗紧急不利事件。
n(%)=具有至少一例不利事件的患者的数目和百分比。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
表23:依照主要soc、hlgt、hlt、和pt,在整个治疗期期间经历导致死亡的teae的患者的数目(%)-安全性群体
teae:治疗紧急不利事件,soc:系统器官类别,hlgt:高水平组项,hlt:高水平项,pt:优选项。
meddra版本:14.0。
n(%)=具有至少一例导致死亡的teae的患者的数目和百分比。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
表按soc国际上一致的次序和hlgt、hlt、pt字母次序分类。
表24:依照主要soc、hlgt、hlt、和pt呈现的在整个治疗期期间经历严重teae的患者的数目(%)-安全性群体
teae:治疗紧急不利事件,soc:系统器官类别,hlgt:高水平组项,hlt:高水平项,pt:优选项。
meddra版本:14.0。
n(%)=具有至少一例严重teae的患者的数目和百分比。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
表按soc国际上一致的次序和hlgt、hlt、pt字母次序分类。
表25:依照主要soc、hlgt、hlt、和pt,在整个治疗期期间经历导致永久治疗中断的teae的患者的数目(%)-安全性群体
teae:治疗紧急不利事件,soc:系统器官类别,hlgt:高水平组项,hlt:高水平项,pt:优选项。
meddra版本:14.0。
n(%)=具有至少一例导致永久治疗中断的teae的患者的数目和百分比。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
表按soc国际上一致的次序和hlgt、hlt、pt字母次序分类。
依照方案定义进一步分析低血糖(参见3.2.2节)。在整个治疗期期间,50名22.4%)利西拉来治疗的患者报告87例低血糖事件和30名(13.5%)安慰剂治疗的患者报告53例低血糖事件(表26)。症状性低血糖的发病率对于利西拉来为每100患者年的89.8,对于安慰剂为每100患者年的52.2。由bg<60mg/dl证实的症状性低血糖的发病率对于利西拉来为每100患者年的79.5,对于安慰剂为每100患者年的44.3。
此外,报告为低血糖teae的24名患者(利西拉来11名,安慰剂13名),由于不满足方案定义而未包括在表26中;在其中,23名报告为具有高于60mg/dl(3.3mmol/l)血糖值的低血糖,且1名患者未测试血糖且在未经任何碳水化合物的治疗而自然恢复。
表26:在整个治疗期期间的症状性低血糖的汇总-安全性群体
a以(具有事件的患者的数目乘以100除以总暴露+3天,以患者年为单位)计算。
b以(事件的数目乘以100除以总暴露+3天,以患者年为单位)计算。
症状性低血糖=按方案定义的症状性低血糖。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
在整个治疗期期间,在整个安全性群体中的1名患者[利西拉来(0.4%)]报告1例按照方案定义的重度症状性低血糖(参见3.2.2节)。该71岁的女性患者具有重度低血糖无意识teae(表24&27)。在首次ip施用后5天,约13:30,散步时,其经历了与出汗和嘴唇麻木相关的意识丧失。她接受了旁边经过的人的帮助,吃了巧克力且随后在14:00检查其血糖为134mg/dl。该事件前她的最后一餐是同一天的8:50。研究者评估了可能与ip相关的该事件,且提示延迟的进餐可以是低血糖的可选择的解释。由于该事件,永久中断ip。
表27:在整个治疗期期间的重度症状性低血糖的汇总-安全性群体
a以(具有事件的患者的数目乘以100除以总暴露+3天,以患者年为单位)计算。
b以(事件的数目乘以100除以总暴露+3天,以患者年为单位)计算。
症状性低血糖=按方案定义的症状性低血糖。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
来自利西拉来组的15名患者(6.7%)和来自安慰剂组的5名患者(2.2%)在整个治疗期期间经历注射部位反应ae(表28)。在调查者报告的aept或在变应性反应判定后来自arac诊断的pt中搜索术语“注射部位”来鉴定注射部位反应ae。反应无一是强度上严重或重度的。尽管如此,利西拉来组的2名患者具有注射部位相关的导致ip中断的teae。
表28:在整个治疗期期间经历注射部位反应的患者的数目(%)-安全性群体
arac=变应性反应评估委员会。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
在整个治疗期期间,调查者对来自19名患者的25例事件报告为可疑的变应性事件,并将其送到arac进行判定。这些之中,arac将来自4名患者(3名1.3%]利西拉来治疗的患者和1名[0.4%]安慰剂治疗的患者)的4例事件判定为变应性反应,且将这些事件中的3例(2例来自利西拉来组和1例来自安慰剂组)判定为可能与ip相关(表29):
患者840212004(利西拉来):1名51岁龄女性患者报告在2010年5月30日(ip后的4天)的中度荨麻疹teae,该患者具有血脂障碍、甲状腺功能减退和药物过敏的医学史。患者抱怨局部痒以及注射部位(下腹)的肿胀,其恶化且在2010年6月4日的现场访问期间由研究者发现。在2010年6月4日办公室给予ip注射后,该患者突然出现全身性的疹子,伴随局部肿胀和局部和全身性的痒。该反应期间测量的bp为110/68mmhg和hr68bpm,其在她生命体征的记录范围内。在现场接受倍他米松i.m.和口服苯海拉明治疗后,她迅速完全恢复。在2010年6月4日中断ip。原因评估根据调查者叙述。arac将变应性反应判定为荨麻疹且可能与ip相关。
患者616206009(利西拉来):1名49岁龄女性患者报告在2011年1月27日(ip后的22天)的过敏性反应teae,该患者具有高血压、血脂障碍医学史,而无过敏史。在施用ip后,该患者表现出手臂和腿的疹子,她抱怨全身性的痒和潮红(flushing)。ip暂停6天且该患者在无根治疗法时恢复。ip以最低剂量重新引入且滴定至20ug目标剂量。该患者在无另外的过敏性反应报告下完成所述研究。按照调查员,原因评估与ip相关。arac将变应性反应判定为荨麻疹且可能与ip相关。
患者170201023(安慰剂):1名69岁龄男性患者报告在2010年11月8日(ip后的4天)的皮疹teae,该患者具有双侧圆锥角膜、通风、白癜风医学史,而无过敏史。该患者表现出右臂、左腹部区和左肘的皮疹红斑病灶。他也抱怨注射部位的痒和肿胀。用炉甘石和樟木洗液治疗,在3周内2011年11月25日逐步恢复。该患者完成所述研究,且按照调查员,原因评估与ip相关。arac将变应性反应判定为皮炎且可能与ip相关。
表29:在整个治疗期期间具有由arac判定为变应性反应的事件的患者的数目(%)-安全性群体
arac=变应性反应评估委员会。ip=调查产品。pt=优选项。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
按方案,要监测已经通过重复测量确认的高于正常范围上限(uln)两倍的任何淀粉酶和/或脂肪酶增加,并记录于预先规定的表:“可疑胰腺炎的不利事件表”。在整个研究的治疗期期间,5名(2.2%)用利西拉来治疗的患者和10名(4.5%)用安慰剂治疗的患者用预先规定的ae表报告34例teae(表30)。在这些患者中,安慰剂组中报告了1例中度“可疑胰腺炎”的teae。此外,4名患者(2名安慰剂2名利西拉来)具有在正式ae表格中报告为teae的未证实的脂肪酶的升高(表35)。
表31中汇总了治疗期期间具有至少一例≥3个uln的脂肪酶或淀粉酶数值的患者。观察到13名具有升高的脂肪酶(≥3个uln)的患者(利西拉来组中4名[1.8%]患者和安慰剂组中9名[4.1%])。利西拉来组中的1名患者具有升高的淀粉酶(≥3个uln),并且安慰剂组中无一如此。
表30:整个治疗期期间具有以规定的不利事件形式报告的teae可疑胰腺炎的患者的数目(%)-安全性群体
n(%)=在用于可疑胰腺炎的ae表以及补充表上报告的任何病例的患者的数目和百分比。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
表31:胰腺酶:依照基线状态,在整个治疗期期间具有至少一例基线后pcsa的患者的数目(%)-安全性群体
pcsa:潜在临床有意义的异常,uln=正常的上限。
*不管基线如何。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
数目(n)代表至少一次满足所讨论的标准的患者的总数的子集。治疗组内的每个参数的分母(/n1)是依照基线pcsa状态在基线后评估的所述参数的治疗组患者的数目。基线状态仅呈现每名患者的最坏情况的恶化。
按照方案,要监测通过重复测量确认的≥20pg/ml的任何降钙素数值,并报告于“增加的降钙素≥20pg/ml”的预先规定的不利事件表。在整个治疗期期间,安慰剂组2名患者,利西拉来组没有患者报告2例血液降钙素增加的teae(表32)。此外,2名安慰剂组的患者以正式ae形式报告(表35)2例降钙素增加的teae,其为<20ng/l。
表32:整个治疗期期间具有以规定的不利事件形式报告的teae增加的降钙素(≥20ng/l)的患者的数目(%)-安全性群体
n(%)=具有在用于增加的降钙素≥20pg/ml的ae表上报告的任何病例的患者的数目和百分比.
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
依照基线时4种降钙素水平在表33中汇总了具有整个治疗期期间测量的至少一例血清降钙素的患者。整个治疗期期间利西拉来组中没有患者具有≥20ng/l的降钙素数值(表33)。
表33:血清降钙素:依照基线种类在整个治疗期期间依照预先限定的种类的患者的数目(%)-安全性群体
uln=正常上限。
*不管基线如何。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
分子代表每个基线种类中在预先规定的种类中的患者的数目。治疗组内的每个参数的分母是具有依照基线状态在基线后评估的所述参数的治疗组患者的数目。
患者仅在最坏种类中计数。
表35:依照主要soc、hlgt、hlt和pt呈现的在整个治疗期期间经历常见的teae(在任何治疗组中pt≥1%)的患者的数目(%)-安全性群体
teae:治疗紧急不利事件,soc:系统器官类别,hlgt:高水平组项,hlt:高水平项,pt:优选项。
meddra版本:14.0。
n(%)=具有至少一例eae的患者的数目和百分比。
注意:整个研究的治疗期=从第一剂双盲研究药物直到最后一剂施用后3天的时间。
表按soc国际上一致的次序和hlgt、hlt、pt字母次序分类。
仅呈现在至少一个组中具有至少一种pt≥1%的soc。
序列表
<110>赛诺菲-安万特德国有限公司
<120>2型糖尿病的治疗方案
<130>51977pep
<140>ep11187169.5
<141>2011-10-28
<160>2
<170>patentinversion3.5
<210>1
<211>44
<212>prt
<213>人工序列
<220>
<223>ave0010
<220>
<221>mod_res
<222>(44)..(44)
<223>酰胺化
<400>1
hisglygluglythrphethrseraspleuserlysglnmetgluglu
151015
glualavalargleupheileglutrpleulysasnglyglyproser
202530
serglyalaproproserlyslyslyslyslyslys
3540
<210>2
<211>39
<212>prt
<213>人工序列
<220>
<223>exendin-4
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>2
hisglygluglythrphethrseraspleuserlysglnmetgluglu
151015
glualavalargleupheileglutrpleulysasnglyglyproser
202530
serglyalaproproproser
35
- 还没有人留言评论。精彩留言会获得点赞!