一种以间充质干细胞为载体通过层层自组装负载VEGF缓释体系及其制备方法与流程
本发明涉及一种以间充质干细胞(mscs)为载体通过层层自组装技术负载vegf缓释体系及其制备方法,属于生物医药领域。
背景技术:
随着胶体晶体研究的火热,人们发现了一种不借助外力就能完成组装和构筑结构的方法—自组装技术,由于这种方法简便、结构多样、重复性好等优点,他已在物理、化学、生物、材料、医学等领域获得很大运用,而且越来越受到重视。多层载药体系是近年来生物医药研究的热点,它不同于普通的单层载药体系,具有载药种类多、突释率低、缓释效果好等优点。其中应用最广泛的为层层自组装技术(lbl),是基于聚电解质阴阳离子所带正负电荷间相互作用的一种自组装超分子技术。由于其具有简单、快速、高效,制备条件温和、负载药物种类及方式多样、负载量可控、智能响应释放药物等优点,成为目前构建多层药物控释体系的重要方法。而凝胶是一种具有三维网络结构的高分子材料。因其具有粘弹性、高含水性和环境响应性等特性。因此,凝胶常被用来作为层层自组装的表面材料,在药物缓释以及生物传感等方面发挥着重要作用。
大部分生长因子类药物由于不具有靶向性以及生物稳定性差,体内半衰期短,因此无法达到局部持久、稳定的效应浓度。如血管内皮生长因子(vegf),它是最重要的血管生成的因子。vegf可以通过结合高亲和力受体包括高亲和性受体酪氨酸激酶受体flk-1和酪氨酸激酶受体fit-1来刺激内皮细胞增殖从而促进血管生成,并且它主要在内皮细胞中表达。vegf可以用于心肌梗死后对心脏功能的改善,但直接静脉注射vegf对心脏微血管的重建和增强心脏功能只有轻微影响,部分原因是由于血液中vegf的半衰期很短(约几分钟),到达病变部位后就失去了产生稳定效应的浓度。增加vegf的剂量确实能够增加对目标组织的治疗效果,然而这会增加其它疾病发生的风险,如肿瘤,糖尿病视网膜病变,类风湿性关节炎和动脉粥样硬化。因此,药物靶向递送和药物缓释成为了解决上述问题的关键。
研究发现,组织病变会引起一些细胞向组织病变部位迁移。例如,急性心肌梗死引起的无菌炎症,就可以招募mscs细胞到心肌梗死区域。sdf-1/cxcr4对受损心脏中mscs的趋化、归巢和移植起着非常重要的作用。sdf-1被细胞分泌在缺血心肌部位和控制msc招募。mscs通过表面的cxcr4结合sdf-1从而沿着sdf-1的浓度梯度迁移至心肌梗死组织。因为mscs来自于血液,因此具有良好的生物相容性。
技术实现要素:
基于以上研究,为了解决传统载药体系存在的不足,实现药物的缓释和靶向运输,在保证疗效的前提下减少给药剂量,降低药物毒性。我们利用凝胶具有吸附和缓释效果,将药物吸附于凝胶,通过层层自组装技术将凝胶包裹在具有趋化功能的细胞表面,从而制备出一种新型的,具有良好生物相容性和生物学功能的载药体系,最终实现药物的缓释和靶向运输。
为了实现上述目的本发明采用的技术方案是:一种以间充质干细胞为载体通过层层自组装负载vegf缓释体系由以下制备方法获得:
(1)分离并培养具有趋化功能的细胞;
(2)制备层层自组装负载生长因子缓释体系;
①将步骤(1)获得的具有趋化功能的细胞置于15ml的离心管中离心,去除上清液;
②在离心管中加入负载了生长因子的明胶溶液,将离心管置于37℃条件下震荡孵育5~10分钟,然后在2000rpm条件下离心5分钟,去除上清液,用pbs进行清洗,再次离心并去上清液。
③在离心管中加入负载了生长因子的海藻酸盐溶液,将离心管置于37℃下震荡孵育5~10分钟,2000rpm条件下离心5分钟,去除上清液,用pbs进行清洗,再次离心并去上清液;
④重复所述步骤②、③过程几次便获得具有层层自组装结构的具有趋化功能的细胞负载生长因子缓释体系。
所述具有趋化功能的细胞选自间充质干细胞、单核细胞和其祖细胞及由其分化而得的细胞、成骨细胞、脂肪细胞、软骨细胞、纤维母细胞、上皮细胞、成肌细胞、肌腱细胞、单核造血干细胞和其祖细胞以及由其分化而得的细胞、免疫细胞、多核细胞、巨细胞、巨噬细胞和破骨细胞。
所述生长因子选自血管内皮生长因子(vegf)、胰岛素样生长因子(igf)、转移生长因子(tgf)、血小板源生长因子(pdgf)、表皮生长因子(egf)、纤维母细胞生长因子(fgf)、肝细胞生长因子(hgf)、白细胞介素、神经生长因子(ngf)以及红细胞生成素。
上述分离并培养所述间充质干细胞的步骤包括:
1)取健康的sd大鼠,断颈处死后置于超净工作台,酒精浸泡清洗,解剖暴露出骨髓腔;
2)用含有肝素的完全培养基反复冲洗骨髓腔,并收集骨髓细胞悬浮液,将悬浮液贴壁加入msc生长培养基中进行培养;
3)待原代细胞生长接近铺满瓶底80%时,进行传代培养。
所述msc生长培养基为含有10%的fbs和抗生素的α-mem培养基,所用的培养方法为全骨髓贴壁法,培养条件为置于37℃,5%co2,95%饱和湿度培养箱中培养。
所述负载了vegf的明胶溶液的用量为5~10ml,制备方法是将5~15μg的vegf与0.05%~0.1%明胶溶液进行混合,使vegf吸附在明胶中;所述负载了vegf的海藻酸盐溶液的用量为5~10ml,制备方法是将5~15μg的vegf与0.05%~0.1%海藻酸盐溶液进行混合,使vegf吸附在海藻酸盐中。
本发明的自组装载药缓释体系具有良好的生物相容性和明显的生物学功能。由其制备的vegf包封mscs缓释体系能有效迁移至心肌梗死区域,并缓释vegf,从而增强心肌功能,灌注梗死区域并促进血管再生,这有可能成为一种心肌梗死的有效的微创治疗方法。可以将mscs更换为其它细胞作为载体,将vegf更换为其它负载药物,从而实现向其它疾病病变区域的迁移和治疗,这在多种重大疾病的临床治疗中具有良好的应用前景。
附图说明
图1为lbl-mscs和mscs的透射电镜图。图中a.lbl-mscs不同放大倍数的透射电镜图;图中b.mscs不同放大倍数的透射电镜图。图中箭头所指表示mscs表面的层层自组装薄层。
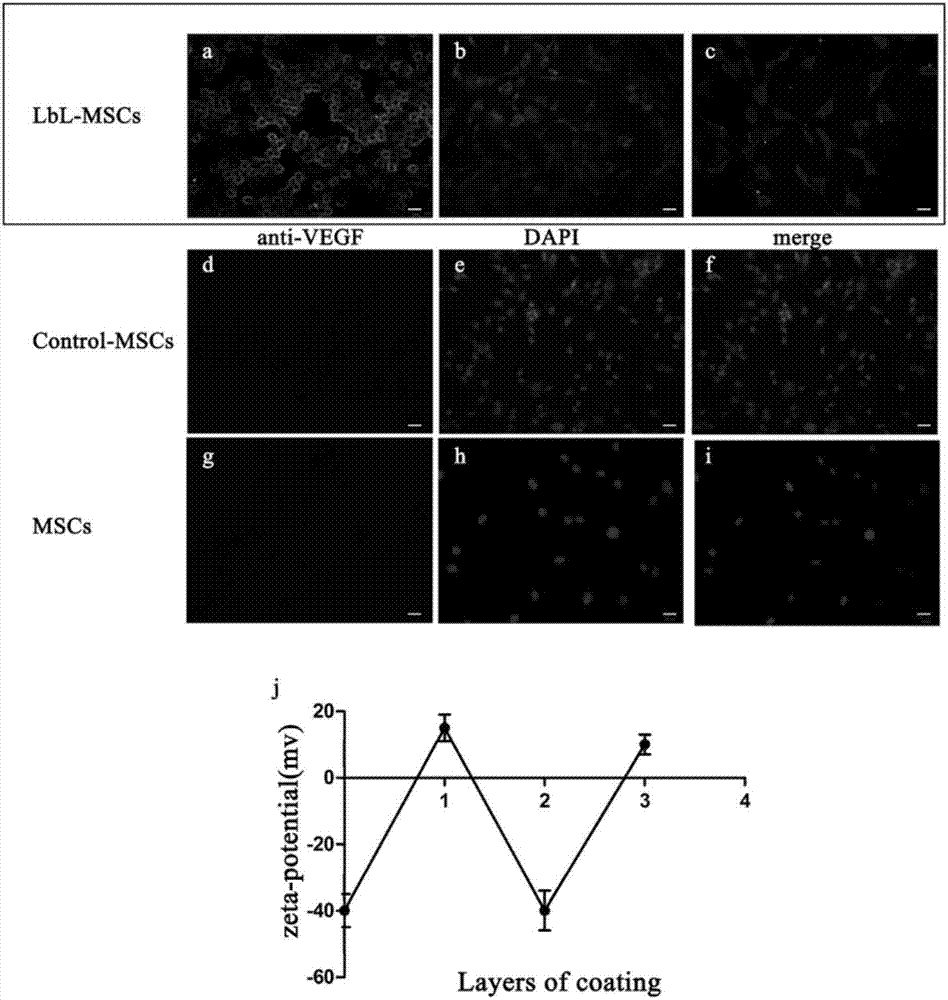
图2为lbl-mscs中vegf检测图及电位分析图。其中a,b,c分别表示lbl-mscs组的anti-vegf染色图、dapi染色图、merge图;d,e,f分别表示control-mscs组的anti-vegf染色图、dapi染色图、merge图;g,h,i分别表示mscs组的anti-vegf染色图、dapi染色图、merge图;图中j表示mscs表面的电位变化情况。
图3为lbl-mscs和mscs的扫描电镜图。图中a.为lbl-mscs和mscs在第1,3,7天时的扫描电镜图。图中b.为lbl-mscs和mscs在第1,3,7天时的鬼笔环肽染色的f肌动蛋白细胞骨架扫描电镜图。图中c.为用扫描电镜对lbl-mscs和mscs中单个细胞展开面积的定量比较。
图4为灌注心肌梗死区域的micro-ct检测图。图中a.为未处理组;图中b.为lbl-mscs组;图中c.为control-mscs组;图中d.为vegf组;图中e.为各组心肌梗死区域的灌注比率。
图5为血管生成的免疫组化分析图。图中a,b,c分别为4周时control-mscs组、vegf组和lbl-mscs组的缺血心肌中血管密度情况;图中d,e,f分别为4周时control-mscs组、vegf组和lbl-mscs组的缺血心肌中心肌细胞群的面积情况;图中的柱状图分别为各组缺血心肌的血管密度定量比较和心肌细胞群面积比较。
图6为超声心动图评价心脏功能图。图中a,b,c,d分别为control-mscs组、空白对照组、vegf组和lbl-mscs组的心脏收缩功能的检测;图中e,f,g,h分别为control-mscs组、空白对照组、vegf组和lbl-mscs组的心脏收舒张能的检测;折线图从上到下依次为fs(短轴缩短率)、ef(射血分数)、e/a(e峰值与a峰值比率),其中,黑色方块是vegf组,空心圆圈为lbl-mscs组,黑色三角为control-mscs组。
具体实施方式
本发明提供了一种以间充质干细胞(mscs)为载体通过层层自组装技术负载vegf缓释体系及其制备方法。该载药体系具有良好的生物相容性和明显的生物学功能。由其制备的vegf包封mscs缓释体系能有效迁移至心肌梗死区域,并缓释vegf,灌注梗死区域并促进血管再生,从而改善和增强心肌功能。下面结合实施例对本发明做进一步详细的描述。
实施例1本发明缓释体现的制备
(1)间充质干细胞(mscs)的分离与培养
①取健康的sd大鼠,断颈处死后置于超净工作台,酒精浸泡清洗,解剖暴露出骨髓腔。
②用含有肝素培养基反复冲洗骨髓腔,并收集骨髓细胞悬浮液。将悬浮液贴壁加入含有10%的fbs和抗生素的α-mem培养基中,利用全骨髓贴壁法进行培养,培养条件为置于37℃,5%co2,95%饱和湿度培养箱中培养。
③待原代细胞生长接近铺满瓶底约80%时,进行传代培养。
(2)层层自组装mscs负载vegf缓释体系的制备
①取步骤(1)中传代培养至第三代的mscs细胞,将浓度为5×106/ml的mscs细胞置于15ml的离心管中2000rpm离心5分钟,去除上清液。
②将5~15μg的vegf加入5~10ml的0.05%~0.1%明胶溶液进行混合,使vegf吸附在明胶中。吸附了vegf的明胶溶液加入离心管中,将离心管置于37℃条件下震荡孵育5~10分钟,然后在2000rpm条件下离心5分钟,去除上清液。用浓度为0.1~0.3m的pbs进行清洗,再次离心并去上清液。
③将5~15μg的vegf加入5~10ml的0.05%~0.1%海藻酸盐溶液进行混合,使vegf吸附在海藻酸盐中。在离心管中加入负载了vegf的海藻酸盐溶液,将离心管置于37℃下震荡孵育5~10分钟,2000rpm条件下离心5分钟,去除上清液,用0.1~0.3m的pbs进行清洗,再次离心并去上清液。
④重复上述步骤②、③过程几次便获得具有层层自组装结构的mscs负载vegf缓释体系(注:实验对照组的mscs按照上述方法用明胶和海藻酸盐进行层层自组装制备,但明胶和海藻酸盐中没有负载vegf)。
通过以上步骤即可得到mscs负载vegf缓释体系。以下通过实施例来说明lbl-mscs载药体系的检测和应用。
实施例2本发明lbl-mscs载药体系的性质检测
1.lbl-mscs的透射电镜
(1)取上述实施例1制备的mscs和lbl-mscs固定在2.5%的戊二醛溶液中1小时。mscs为对照组,是用不含有vegf的明胶和海藻酸盐进行层层自组装制备的缓释体系,lbl-mscs是实验组,是负载vegf的缓释体系。
(2)样品用5%的蔗糖溶液清洗三次,每次5分钟,置于4℃冰箱过夜保存。
(3)样品中加入细胞样品量1%的四氧化锇进行快速固定2小时并用不同浓度的乙醇和甲醇进行脱水处理,然后将它们嵌入环氧树脂中。
(4)用切片机将样品切成薄的切片,并且这些切片被马上放在铜的网格中,最后样品用2%的乙酸双氧铀和1%的柠檬酸铅进行染色。
(5)处理后的lbl-mscs置于透射电镜下进行观察分析。
2.vegf的检测
(1)取上述实施例1制备的lbl-mscs置于玻璃片上用4%的聚四氟乙烯进行固定,放于4℃条件下过夜。
(2)样品用0.1m的pbs清洗三次(每次5分钟)。在含1%bsa的tbst溶液中浸泡30分钟防止mscs表面的非特异性结合。
(3)细胞用vegf抗体进行孵育,并用dpbs清洗三次(每次5分钟)。
(4)用荧光显微镜随机选择10个区域进行拍照。阳性细胞用ipp6.0软件进行量化。
3.lbl-mscs的电位分析
(1)用上述实施例1的步骤分别用明胶、明胶/海藻酸盐、2倍明胶/海藻酸盐作为包封材料制备lbl-mscs。
(2)取上述制备的浓度为2×106/ml的mscs和lbl-mscs用电位分析仪进行电位分析。
4.lbl-mscs的扫描电镜
(1)取上述实施例1制备的mscs和lbl-mscs用0.1m的sorensen缓冲液进行固定2小时。
(2)样品用0.1m的sorensen缓冲液(含有5%的蔗糖)清洗三次(每次5分钟)。
(3)在样品中加入1%的四氧化锇于4℃放置4小时,清洗三次后用不同浓度梯度的酒精进行脱水干燥处理。
(4)样品进行喷金处理并用扫描电镜进行观察。
检测结果:
1.透射电镜显示:与未处理的mscs相比,处理过的mscs表面包裹着层层自组装薄膜镀层,这个细胞表面包裹的材料层大约5.8±2.2nm(如图1所示)。
2.vegf检测显示:用荧光显微镜观察到在lbl-mscs表面存在绿色荧光的vegf,它们被负载在包裹着的明胶和海藻酸盐中,而在对照mscs和mscs表面没有观察到vegf的存在(如图2所示)。
3.电位检测显示:用不同的材料层包裹细胞,它的电位也会因此而获得改变。当mscs用明胶和海藻酸盐通过层层自组装技术进行包裹时,lbl-mscs的电位发生了变化(5mv-40mv),带相反电荷的聚电解质聚集在一起并且彼此互补(如图2所示)。
4.扫描电镜显示:lbl-mscs的附着比mscs要慢,并且lbl-mscs在1,3,5天是表现为类球状体形态。在第7天,lbl-mscs的类球状体形态就像第1天时mscs的类球状体形态。与mscs相比,lbl-mscs的细胞支架受到更多的约束(如图3所示)。
实施例3本发明lbl-mscs载药体系用于注射治疗心梗模型
1.大鼠心肌梗死模型和lbl-mscs注射治疗
(1)取重量在250~300g的雄性sd大鼠,用水合氯醛(10g/kg)和阿托品(1mg/kg)通过腹腔注射麻醉并固定在无菌操作台上。
(2)用静脉插管留针和使用动物呼吸机进行60次/分钟的频率和3毫升/100克体重的呼吸容量进行机械呼吸。
(3)在无菌条件下,打开左胸腔,切除心包。左冠状动脉用脯氨酸阻塞45分钟来使心脏局部缺血,然后移除再灌注,移除插管后自主呼吸。
(4)上述制备的心肌梗死模型大鼠放回动物培养箱中提供饲料和谁进行喂养。
(5)第二天将心肌梗死模型大鼠随机分成三组进行不同处理,每组12只。lbl-mscs组:取上述实施例1中制备的5x107/ml的lbl-mscs通过尾部静脉注射进心肌梗死模型大鼠体内;mscs组:取上述实施例1中制备的5x107/ml的mscs和10μg的vegf通过尾部静脉注射进心肌梗死模型大鼠体内;vegf组:将10μg的vegf通过尾部静脉注射进心肌梗死模型大鼠体内
(6)将处理后的大鼠放回恒温动物房中并继续提供饲料和水进行喂养。
2.通过micro-ct对心脏的灌注交界区进行评价
(1)用水合氯醛(4%,1ml/100g)通过腹腔注射对大鼠进行麻醉,碘苯六醇通过尾部静脉注射进大鼠体内。
(2)将大鼠仰卧放置在micro-ct扫描机上进行扫描。
3.免疫荧光检测
(1)大鼠在心肌梗死后的1,2,3,7天通过过量麻醉进行处死。
(2)处死后立即将心脏取出,并对心肌梗死区域进行tissueteko.c.t.冷冻包埋切片。
(3)用cd31和驴抗鼠的抗体在室温条件下对心肌梗死区域的样品染色1小时。
(4)将切片放置在荧光显微镜下观察mscs细胞的存活和分布以及心肌梗死区域的血管生成情况。
4.通过超声心动图来评价心脏功能
(1)将上述心梗模型大鼠分别在3天、1周、2周、3周和4周时通过腹腔注射麻醉,用超声系统在13mhz的频率和100mm/s的速率下测试其左心室的lvdd(左心室舒张末内径)和lvsd(左心室收缩末内径)。
(2)计算左室短轴缩短率,计算公式为(lvdd-lvsd)/lvdd]×100%,其中lvdd为左心室舒张末内径,lvsd为左心室收缩末内径。
(3)计算ef(左室射血分数),计算公式为ef=(edv-esv)/edv]×100%,其中edv为左心室舒张末期容量,esv为左心室收缩末期容量,ef值反映心室的收缩功能。
(4)通过多普勒脉冲波测量二尖瓣口血流速度,分别测量左室舒张早期快速充盈的充盈峰(e峰)和舒张晚期(心房收缩)充盈的充盈峰(a峰),e/a的比率反映心室舒张功能。
注:上述所有的测量值都是三个连续心脏循环的平均值。
结果分析:
1.micro-ct检测显示:在第4周时,lbl-mscs组的心肌梗死区的灌注比率明显增加,高达70%,而mscs组的灌注率为49%,vegf组为47%。同时,还观察到在正常的心肌组织中,lbl-mscs对血管灌注的修复(如图4所示)。
2.免疫荧光检测血管的生成情况,检测结果显示:在心肌梗死4周后,与mscs组和vegf组相比,lbl-mscs组心肌梗死区的血管密度有显著的增加,mscs组和lbl-mscs组缺血心肌的血管密度分别为3.6±1.9和25.6±5.4。此外,通过注射治疗后,lbl-mscs组(0.09±0.02mm2)的梗死组织中具有活性的心肌区域平均面积比mscs组(0.03±0.01mm2)和vegf组(0.04±0.01mm2)明显要大。这表明lbl-mscs可以有效增加心肌梗死后梗死区的血管密度(如图5所示)。
3.通过心脏超声来评价心脏功能。分别在3天、1周、2周、3周和4周时测量lbl-mscs组,mscs组,vegf组心梗模型大鼠的lvsd,lvdd,edv和esv等参数,测量结果显示四组数据之间存在显著的差异。计算结果表明与mscs组和vegf组相比,lbl-mscs组的fs(左室短轴缩短率)和ef(射血分数)等指标具有显著的恢复,这表明lbl-mscs可以有效改善心肌梗死后的心脏功能(如图6所示)。
- 还没有人留言评论。精彩留言会获得点赞!