一种基于黑磷的水凝胶近红外光可控释药系统及其制备方法与流程
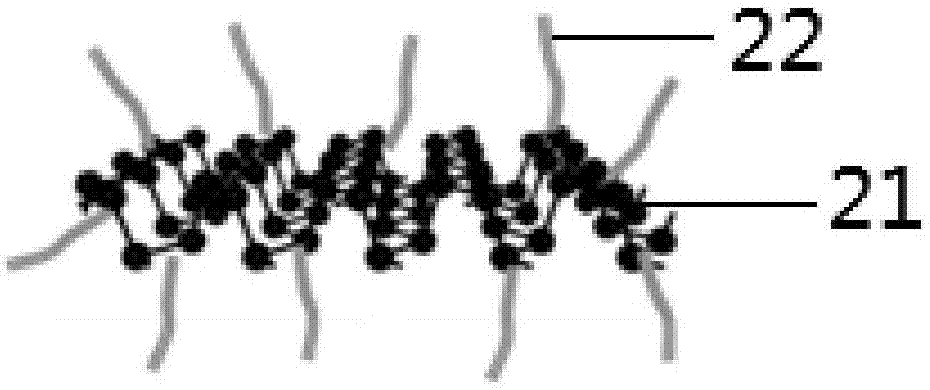
本发明涉及生物医用纳米材料技术领域,特别是涉及一种基于黑磷的水凝胶近红外光可控释药系统及其制备方法。
背景技术:
癌症严重危害着人类的生命健康,而目前针对癌症的临床治疗,无论是化学治疗、手术治疗或放射治疗都对身体有极大副作用,且在发生恶性转移以后,无论采用上述何种方式都难以彻底治愈。虽然已有大量的人力、物力、财力已经投入到癌症的研究,但进展十分有限、癌症的有效治疗仍然是人类面对的极大考验。
有研究表明,将生物大分子与纳米技术应用到癌症诊断治疗领域,具有广阔的前景及临床价值。其中,具有光控释放的水凝胶药物载体是一种新型的癌症治疗方式,利用激光照射可控释放药物、对病灶部分进行局域给药,其照射用的激发光一般采用近红外光,是一种非侵入性的癌症治疗方式,能够有效穿透人体正常组织到达癌症部位,极大程度地减少对正常组织的损害。然而目前用于光控释放的光敏纳米粒子(如金纳米颗粒)的光热转化效率较低、不可降解,给临床应用带来困难。
近期研究发现,黑磷二维材料由于具有低毒性、高生物相容性、高消光系数和高光热转换效率,在生物医用领域,尤其是癌症治疗方面具有极大的应用潜力,因此,有必要开发一种基于黑磷的水凝胶光控释药系统,解决现有水凝胶药物载体临床应用困难的问题。
技术实现要素:
鉴于此,本发明提供了一种基于黑磷的水凝胶近红外光可控释药系统,其具有近红外光响应,可通过近红外光照射在体内实现胶凝状态到溶胶状态的转变,从而实现局部光控释药,有效杀死病灶部位肿瘤细胞,并且同时具备可控降解特性。
具体地,第一方面,本发明提供了一种基于黑磷的水凝胶近红外光可控释药系统,包括琼脂糖水凝胶载体、以及负载在所述琼脂糖水凝胶载体中的黑磷纳米薄片和抗癌药物。
本发明提供的近红外光可控释药系统,以琼脂糖水凝胶作为药物控释载体,以黑磷作为光敏剂,由于黑磷具有非常高的光热转化效率,因此在近红外光的作用下,黑磷将产生大量热使得胶凝状态的琼脂糖水凝胶溶解呈溶胶状态,从而实现抗癌药物的可控释放,同时黑磷自身在高强度的近红外光作用下发生降解,因此本发明释药系统可同时实现药物载体和光敏剂的可控降解,从而有望显著提高癌症治疗的临床疗效。
本发明中,所述琼脂糖水凝胶载体的溶胶温度为40℃-50℃,所述释药系统在40℃以下为胶凝状态,而在40℃-50℃转变为溶胶状态。具体地,溶胶温度可以是40℃、42℃、45℃、48℃、50℃。选择溶胶温度较低的琼脂糖,一方面可以使得释药系统在没有近红外光作用的时候为胶凝状态,将抗癌药物和黑磷束缚住,有利于实现对病灶部位进行局部给药,同时提高抗癌药物的利用率,避免抗癌药物对正常组织细胞的伤害;另一方面可使得释药系统在有近红外光作用时,能够借助黑磷纳米薄片的光热转换效应产生的热量溶解,实现体内光控释药。
本发明中,所述释药系统中,所述黑磷纳米薄片的含量为0.01-1mg/ml,所述抗癌药物的质量含量为0.01-1mg/ml。进一步地,黑磷纳米薄片的含量为0.2-0.5mg/ml,所述抗癌药物的质量含量为0.2-0.5mg/ml。所述适合的黑磷纳米薄片含量有利于提高近红外光可控释药系统的稳定性和可控释药能力。抗癌药物的质量含量可根据具体抗癌药物种类和用药量需求进行合理设定。
本发明中,所述琼脂糖水凝胶载体由琼脂糖与水构成,具有交织的网络结构,所述琼脂糖水凝胶载体中琼脂糖的质量含量为0.5%-2%,进一步地,琼脂糖的质量含量为0.8%-1.5%或1.0%-1.2%。琼脂糖的质量含量直接影响着凝胶的网孔尺寸和机械强度。
本发明中,所述黑磷纳米薄片的长宽尺寸为50nm-200nm;所述黑磷纳米薄片的厚度为1nm-5nm。可选地,黑磷纳米薄片的尺寸为50nm-150nm、100nm-150nm、120nm-180nm、160nm-200nm。可选地,厚度为1-3nm或2-4nm。适合的黑磷纳米薄片长宽尺寸和厚度有利于其在琼脂糖水凝胶中的均匀分散及对近红外辐射的吸收。
由于黑磷纳米薄片表面具有强负电性,因此所述抗癌药物部分吸附在所述黑磷纳米薄片表面,部分独立分散于所述琼脂糖水凝胶载体形成的网络结构中。
本发明中,所述黑磷纳米薄片表面包覆有聚乙二醇胺,所述黑磷纳米薄片与聚乙二醇胺的质量比为1∶0.5-2。进一步地,所述黑磷纳米薄片与聚乙二醇胺的质量比为1∶0.8-1.5或1∶1-1.2。所述聚乙二醇胺包括甲基聚乙二醇胺(ch3-peg-nh2)、甲氧基聚乙二醇胺(ch3o-peg-nh2,简称为mpeg-nh2)和聚乙二醇二胺(nh2-peg-nh2)中的至少一种。所述聚乙二醇胺通过静电引力吸附在所述黑磷纳米薄片表面,所述聚乙二醇胺的重均分子量为2000-30000。聚乙二醇胺可以提高黑磷纳米薄片的生物相容性,有效避免黑磷纳米薄片发生聚集并提高黑磷纳米片在水溶液中的稳定性,因此可使黑磷纳米薄片均匀稳定分散在所述水凝胶载体中,实现良好的光控释药。
所述抗癌药物包括目前常用的治疗癌症的药物,如阿霉素。
本发明的基于黑磷的水凝胶近红外光可控释药系统的尺寸可依据实际应用环境而定,体积可从微纳米级别到厘米级别。本发明的基于黑磷的水凝胶近红外光可控释药系统在常温下为固态,当进行体内注射时,加热使其转变成溶胶状态,待注入体内后在生理环境温度下又迅速转化成胶凝状态,后续再通过近红外光作用转变成溶胶状态,实现药物释放。
本发明中,所述黑磷纳米薄片和琼脂糖均具有很好的生物相容性,可通过生物降解或者正常的生理途径排出体外,对生物体无毒副作用、生物安全性高。
本发明第一方面提供的基于黑磷的水凝胶近红外光可控释药系统,其具有近红外光(700-1500nm)响应,兼具黑磷光热材料的光热杀死肿瘤和化疗药物的化疗治疗肿瘤的功效,对于癌症(如乳腺癌等)治疗具有极高的临床价值。
第二方面,本发明提供了一种基于黑磷的水凝胶近红外光可控释药系统的制备方法,包括以下步骤:
提供黑磷纳米薄片,将所述黑磷纳米薄片分散到水相中,得到黑磷纳米薄片分散液;向上述分散液中加入抗癌药物,混合均匀后得到混合溶液,将所述混合溶液加热至50-70℃,再加入琼脂糖,冷却后形成水凝胶,即得到基于黑磷的水凝胶近红外光可控释药系统。
本发明中,所述黑磷纳米薄片的长宽尺寸为50nm-200nm;所述黑磷纳米薄片的厚度为1nm-5nm。可选地,黑磷纳米薄片的尺寸为50nm-150nm、100nm-150nm、120nm-180nm、160nm-200nm。可选地,厚度为1-3nm或2-4nm。所述黑磷纳米薄片的获得方式不限,例如可以是以块状黑磷为原料,采用溶液剥离结合探针超声法制备,并采用离心管离心方式收集、纯化得到,所述探针超声的超声时间为12-18小时,所述探针超声过程中,持续超声45秒-1小时,及等待15秒-1小时为一个周期,功放为20%-30%,所述离心的速率为1000rpm-2000rpm,时间为6-15分钟,温度为4℃。
本发明中,加热的温度可具体根据琼脂糖的溶胶温度而定,例如可以是50℃、60℃、70℃等。所述琼脂糖的溶胶温度为40℃-50℃,所述释药系统在40℃以下为胶凝状态,而在40℃-50℃转变为溶胶状态。具体地,溶胶温度可以是40℃、42℃、45℃、48℃、50℃。
本发明中,所述释药系统中,所述黑磷纳米薄片的含量为0.01-1mg/ml,所述抗癌药物的质量含量为0.01-1mg/ml。进一步地,黑磷纳米薄片的含量为0.2-0.5mg/ml,所述抗癌药物的质量含量为0.2-0.5mg/ml。
本发明中,所述琼脂糖水凝胶中琼脂糖的质量含量为0.5%-2%,进一步地,琼脂糖的质量含量为0.8%-1.5%或1.0%-1.2%。
本发明中,所述抗癌药物包括目前常用的治疗癌症的药物,如阿霉素。
本发明中,在加入所述抗癌药物之前,进一步包括在所述黑磷纳米薄片分散液中加入聚乙二醇胺,在搅拌作用下或超声结合搅拌的作用下得到聚乙二醇胺包覆的黑磷纳米薄片。所述搅拌的转速为800rpm-1200rpm,持续时间为2-4小时。所述超声的频率为3000-4500hz,持续时间为0.5-2小时。所述超声和搅拌可以是依次进行,例如可以是先超声0.5小时,再搅拌3小时。所述聚乙二醇胺包括甲基聚乙二醇胺(ch3-peg-nh2)、甲氧基聚乙二醇胺(ch3o-peg-nh2,简称为mpeg-nh2)和聚乙二醇二胺(nh2-peg-nh2)中的至少一种。所述聚乙二醇胺的重均分子量为2000-30000。
本发明第二方面提供的基于黑磷的水凝胶近红外光可控释药系统的制备方法,制备过程简单易操作,适于工业化生产。
附图说明
图1为本发明实施例1制备的基于黑磷的水凝胶近红外光可控释药系统的结构示意图;
图2为本发明实施例1中制备得到的聚乙二醇胺包覆的黑磷纳米薄片的结构示意图;
图3为本发明实施例1中制备得到的聚乙二醇胺包覆的黑磷纳米薄片的eds(energydispersivespectrometer,能谱)图;
图4为本发明实施例的基于黑磷的水凝胶近红外光可控释药系统的释药和降解示意图;
图5为本发明实施例1制备的基于黑磷的水凝胶近红外光可控释药系统在hela细胞中,光照不同时间下的体外细胞荧光成像;
图6为本发明实施例的基于黑磷的水凝胶近红外光可控释药系统随温度变化的药物释放曲线;
图7为本发明实施例1制备的基于黑磷的水凝胶近红外光可控释药系统在不同癌症细胞(hela、mcf-7、a549和pc3)中的细胞毒性结果;
图8为不同凝胶体系作用下的细胞活性随时间变化的结果图。
具体实施方式
以下所述是本发明实施例的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明实施例原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明实施例的保护范围。
实施例1
一种基于黑磷的水凝胶近红外光可控释药系统的制备方法,包括以下步骤:
(1)采用溶液剥离结合探针超声法制备黑磷纳米薄片:取50mg块状黑磷材料,置于100ml超纯水中,进行探针超声,所述探针超声法的超声时间为12小时,过程为持续超声45秒,等待15秒为一个周期,功放为20%;超声结束后,取棕黑色剥离液置于离心管中,1000rpm离心10分钟,温度为4℃,沉淀未被剥离的块状黑磷,并小心分离沉淀的块状黑磷和上清液中的黑磷纳米薄片,以进一步提纯分离黑磷纳米薄片;
(2)将上述所得黑磷纳米薄片分散到水中,依次采用超声与磁力搅拌的方式,在黑磷纳米薄片的表面包覆聚乙二醇胺,得到包含有聚乙二醇胺包覆的黑磷纳米薄片的溶液;其中黑磷纳米薄片和聚乙二醇胺的质量比为1:2,超声的频率为4000hz,持续时间为2小时,磁力搅拌转速为800rpm,持续时间为4小时;所述聚乙二醇胺为甲基聚乙二醇胺、甲氧基聚乙二醇胺和聚乙二醇二胺中的至少一种,聚乙二醇胺的重均分子量为2000-30000;
(3)向上述所得包含有聚乙二醇胺包覆的黑磷纳米薄片的溶液中加入抗癌药物阿霉素,得到混合溶液;
(4)将所述混合溶液加热至50℃,再向其中加入溶胶温度为40℃的琼脂糖,待琼脂糖完全溶解,冷却后形成水凝胶,即得到基于黑磷的水凝胶近红外光可控释药系统。
图1为本发明实施例1制备的基于黑磷的水凝胶近红外光可控释药系统的结构示意图,包括琼脂糖水凝胶载体10,均匀分布在所述琼脂糖水凝胶载体10中的黑磷纳米薄片20和抗癌药物30。本实施例制备得到的基于黑磷的水凝胶近红外光可控释药系统,黑磷纳米薄片的含量为0.5mg/ml(相当于500ppm),琼脂糖水凝胶载体中琼脂糖的质量浓度为1%,阿霉素的质量含量为0.1mg/ml。
图2和图3分别为本发明实施例1中步骤(2)制备得到的聚乙二醇胺包覆的黑磷纳米薄片的结构示意图和eds能谱图;图中21为黑磷纳米薄片,22为聚乙二醇胺。从图3中c、o、n的峰位可以获知黑磷上包覆了聚乙二醇胺。
本发明实施例制备得到的基于黑磷的水凝胶近红外光可控释药系统可实现对病灶部位进行局部给药,给药完成后,通过808nm近红外波段激光激发,黑磷纳米薄片将发挥其超强的光热转换性能,提供大量热量使得胶凝态的琼脂糖水凝胶软化,提高抗癌药物在水凝胶中的扩散系数,从而快速释放药物;然后进一步提高激光功率,比如从开始的1w提高到2w,使水凝胶溶解,加快其降解,并加快内部的黑磷纳米薄片的降解,从而实现抗癌药物的可控释放,最终有效杀死病灶部位癌细胞。图4为本发明实施例制备的基于黑磷的水凝胶近红外光可控释药系统的释药和降解示意图。
图5中,a)、b)、c)、d)分别为本发明实施例1制备的基于黑磷的水凝胶近红外光可控释药系统在hela细胞中,光照不同时间下的体外细胞荧光成像。从图中0min,5min,10min,15min的不同光照时间结果可以看出,随着光照时间的增加,释放出的阿霉素越多,正常癌细胞的数量不断减少,光照15min后,癌细胞基本全部死亡。
图6为本发明实施例1的基于黑磷的水凝胶近红外光可控释药系统随温度变化的药物释放曲线。图中曲线1代表温度曲线,曲线2代表释放到溶液中的药物的浓度,on表示加热,off表示停止加热。从图中结果可以看到,每次加热升温都会导致药物快速的释放出来,而停止加热的时候,药物释放速度很低。
实施例2
一种基于黑磷的水凝胶近红外光可控释药系统的制备方法,包括以下步骤:
(1)采用溶液剥离结合探针超声法制备黑磷纳米薄片:取50mg块状黑磷材料,置于100ml超纯水中,进行探针超声,所述探针超声法的超声时间为18小时,过程为持续超声1小时,等待1小时为一个周期,功放为20%。超声结束后,取棕黑色剥离液置于离心管中,2000rpm离心6分钟,温度为4℃,沉淀未被剥离的块状黑磷,并小心分离沉淀的块状黑磷和上清液中的黑磷纳米薄片,以进一步提纯分离黑磷纳米薄片;
(2)将上述所得黑磷纳米薄片分散到水中,依次采用超声与磁力搅拌的方式,在黑磷纳米薄片的表面包覆聚乙二醇胺,得到包含有聚乙二醇胺包覆的黑磷纳米薄片的溶液;其中黑磷纳米薄片和聚乙二醇胺的质量比为1:1,超声的频率为3500hz,持续时间为0.5小时,磁力搅拌转速为1000rpm,持续时间为4小时;所述聚乙二醇胺为甲基聚乙二醇胺、甲氧基聚乙二醇胺和聚乙二醇二胺中的至少一种,聚乙二醇胺的重均分子量为2000-30000;
(3)向上述所得包含有聚乙二醇胺包覆的黑磷纳米薄片的溶液中加入抗癌药物阿霉素,得到混合溶液;
(4)将所述混合溶液加热至60℃,再向其中加入溶胶温度为45℃的琼脂糖,待琼脂糖完全溶解,冷却后形成水凝胶,即得到基于黑磷的水凝胶近红外光可控释药系统。本实施例制备得到的基于黑磷的水凝胶近红外光可控释药系统,黑磷纳米薄片的含量为1mg/ml,琼脂糖水凝胶载体中琼脂糖的质量浓度为0.5%,阿霉素的质量含量为0.1mg/ml。
实施例3
一种基于黑磷的水凝胶近红外光可控释药系统的制备方法,包括以下步骤:
(1)采用溶液剥离结合探针超声法制备黑磷纳米薄片,取50mg块状黑磷材料,置于100ml超纯水中,进行探针超声,所述探针超声法的超声时间为16小时,过程为持续超声1小时,等待1小时为一个周期,功放为25%。超声结束后,取棕黑色剥离液置于离心管中,1000rpm离心15分钟,温度为4℃,沉淀未被剥离的块状黑磷,并小心分离沉淀的块状黑磷和上清液中的黑磷纳米薄片,以进一步提纯分离黑磷纳米薄片;
(2)将上述所得黑磷纳米薄片分散到水中,依次采用超声与磁力搅拌的方式,在黑磷纳米薄片的表面包覆聚乙二醇胺,得到包含有聚乙二醇胺包覆的黑磷纳米薄片的溶液;其中黑磷纳米薄片和聚乙二醇胺的质量比为1:0.5,超声的频率为4000hz,持续时间为1小时,磁力搅拌转速为1200rpm,持续时间为4小时;所述聚乙二醇胺为甲基聚乙二醇胺、甲氧基聚乙二醇胺和聚乙二醇二胺中的至少一种,聚乙二醇胺的重均分子量为2000-30000;
(3)向上述所得包含有聚乙二醇胺包覆的黑磷纳米薄片的溶液中加入抗癌药物阿霉素,得到混合溶液;
(4)将所述混合溶液加热至70℃,再向其中加入溶胶温度为50℃的琼脂糖,待琼脂糖完全溶解,冷却后形成水凝胶,即得到基于黑磷的水凝胶近红外光可控释药系统。本实施例制备得到的基于黑磷的水凝胶近红外光可控释药系统,黑磷纳米薄片的质量浓度为0.2mg/ml,琼脂糖水凝胶载体中琼脂糖的质量浓度为2%,阿霉素的质量含量为0.5mg/ml。
实施例4
一种基于黑磷的水凝胶近红外光可控释药系统的制备方法,包括以下步骤:
(1)采用溶液剥离结合探针超声法制备黑磷纳米薄片,取50mg块状黑磷材料,置于100ml超纯水中,进行探针超声,所述探针超声法的超声时间为14小时,过程为持续超声0.5小时,等待0.5小时为一个周期,功放为30%。超声结束后,取棕黑色剥离液置于离心管中,2000rpm离心10分钟,温度为4℃,沉淀未被剥离的块状黑磷,并小心分离沉淀的块状黑磷和上清液中的黑磷纳米薄片,以进一步提纯分离黑磷纳米薄片;
(2)将上述所得黑磷纳米薄片分散到水中,依次采用超声与磁力搅拌的方式,在黑磷纳米薄片的表面包覆聚乙二醇胺,得到包含有聚乙二醇胺包覆的黑磷纳米薄片的溶液;其中黑磷纳米薄片和聚乙二醇胺的质量比为1:1,超声的频率为4500hz,持续时间为1.5小时,磁力搅拌转速为1000rpm,持续时间为3小时;所述聚乙二醇胺为甲基聚乙二醇胺、甲氧基聚乙二醇胺和聚乙二醇二胺中的至少一种,聚乙二醇胺的重均分子量为2000-30000;
(3)向上述所得包含有聚乙二醇胺包覆的黑磷纳米薄片的溶液中加入抗癌药物阿霉素,得到混合溶液;
(4)将所述混合溶液加热至55℃,再向其中加入溶胶温度为45℃的琼脂糖,待琼脂糖完全溶解,冷却后形成水凝胶,即得到基于黑磷的水凝胶近红外光可控释药系统。本实施例制备得到的基于黑磷的水凝胶近红外光可控释药系统,黑磷纳米薄片的质量浓度为0.05mg/ml,琼脂糖水凝胶载体中琼脂糖的质量浓度为1.5%,阿霉素的质量含量为1mg/ml。
图7为本发明实施例制备的不同黑磷浓度的基于黑磷的水凝胶近红外光可控释药系统在不同癌症细胞(a549、hela、pc3和mcf-7)中的毒性结果;图中共有四组不同黑磷浓度(0mg/ml、0.05mg/ml、0.2mg/ml、0.5mg/ml)的实验,每组实验中,从左至右每个柱子依次记为1、2、3、4,其中1代表a549,2代表hela、3代表pc3,4代表mcf-7。从图中可以看出,本发明实施例的基于黑磷的水凝胶近红外光可控释药系统在无激光照射情况下不具备细胞毒性,生物安全性好、无毒副作用。
图8为不同凝胶体系作用下的细胞活性随时间变化的结果图。其中纵坐标代表细胞活性,100%表示细胞活性最高,0表示细胞全部凋亡;横坐标代表细胞由不同凝胶体系作用的时间,图中具体显示了作用时间分别为0min、5min、10min、15min的四组实验结果,每组结果中,从左至右每个柱子依次记为1、2、3、4,其中1代表只采用激光照射的情况;2代表加入本发明实施例1的基于黑磷的水凝胶近红外光可控释药系统,但没有激光照射的情况;3代表加入本发明实施例1的基于黑磷的水凝胶近红外光可控释药系统的情况(黑磷浓度为0.5mg/ml,琼脂糖质量含量为1%);4代表加入本发明实施例2的基于黑磷的水凝胶近红外光可控释药系统的情况(黑磷浓度为1mg/ml,琼脂糖质量含量为0.5%)。图中结果显示,采用本发明实施例提供的基于黑磷的水凝胶近红外光可控释药系统的实验组3和4,随着时间的推移,癌细胞明显减少,且实验组4的效果优于实验组3。
- 还没有人留言评论。精彩留言会获得点赞!