用于促进生发的生物移植用移植物的制作方法
本发明涉及生发促进用移植物。
背景技术:
毛发在人体中起着多种作用,如保护毛发、对外向的影响、维持头部温度等,虽然不是对生命维持重要的器官,但是既是健康状态的衡量尺度,也是决定外貌的身体的重要的一部分。脱发被认为是一系列老化现象,但是最近表明,由各种遗传要素与如压力、西方化的饮食习惯、营养不均衡、社会活动的变化等多种原因一同导致脱发。
毛发在毛囊中产生,上述毛囊是因头皮基部的基质细胞的持续性的增殖而皮肤陷进去的结构,具有包括多种生长步骤的毛发周期。毛发根据占据正常毛发的90%的生长期(anagen,growingphase)、生长停滞且毛根萎缩的退行期(catagen,transitionalphase)、毛球干燥且形成杵状毛的休止期(telogen,restingphase)及脱落期(exogen)的4种步骤的生长周期反复进行生长和脱发。
脱发原因为遗传性要素和压力及老化等,其代表性的机制之一是作为雄激素的睾酮(testosterone,t)基于5α-还原酶(5α-reductase,rd)转化为二氢睾酮(dihydrotestosterone,dht),从而通过萎缩头皮的毛囊来诱发脱发。随着年龄的增长,二氢睾酮增加,延迟毛囊细胞的蛋白质合成,由此,可以认为休止期的毛囊比率增加而导致脱发进行得很快。并且,随着老化,从毛囊的乳头部分分泌角蛋白的干细胞被破坏,因此干细胞的供给减少。从而,促进脱发。
毛发的形成具有周期性循环模式。即,经过占据正常毛发的90%的生长期、生长停滞且毛根萎缩的退行期、毛球干燥且形成杵状毛的休止期及脱落期等4种步骤的毛发周期(haircycle),毛发不断进行生长和脱发。尤其,在退行期期间,许多毛囊进行细胞凋亡(apoptosis),由此进入休止期,从而毛囊的大小减小。
为了改善、治疗这些脱发症状而开发的方法包括涂抹促进生发的物质(合成物质、天然物质、细胞培养液或其提取物等)、移植毛发的方法、注射自己的干细胞的方法等。例如,作为脱发治疗剂,广泛使用米诺地尔(minoxidil)涂覆剂,在韩国授权专利10-1498201号中公开了包含縊叉松藻提取物作为有效成分的防脱发或生发改善用组合物,在韩国授权专利10-1484033中公开了包含花生皮提取物的防脱发或生发促进用组合物。
并且,最近对利用干细胞培养液的治疗越来越关注,但是它是基于在利用间充质干细胞的培养液中丰富地包含有促进毛发生长的生长因子的。
然而,这些方法在因毛根消失而需要重新形成毛囊的情况下,存在其效果有限或需要反复涂抹并注射的困难。并且,为了重新形成毛发,重要的是持续供给多个相关生长因子,但是注射或涂抹的方法只是一次性的,难以持续供给,间充质干细胞在持续性生长中也存在局限性。
为此,本发明人在研究在生物体内持续供给生长所需的生长因子的方法的过程中,在将在特定条件下培养的干细胞利用移植用移植物来进行移植的情况下,在体内持续供给如碱性成纤维细胞生长因子(bfgf)等多个干细胞生长促进因子,在毛囊的乳头部分诱导干细胞的生长,从而确认可实现干细胞的长期有效作用,由此完成了本发明。
技术实现要素:
本发明要解决的技术问题
本发明的目的在于,提供用于促进生发和/或改善及治疗脱发的生物移植用移植物。
技术方案
为了实现上述目的,本发明提供包含具有生发功能性细胞因子分泌能力的干细胞的生物移植用移植物。
有益效果
本发明的移植物通过移植于生物体来分泌具有生发功能性的多种成分,从而可长时间促进生发及改善/治疗脱发。
附图说明
图1为示出利用贴壁细胞培养来培养af-n的方法(图1的(a)部分)及将af-n注入特拉赛特(theracyte)来培养的方法(图1的(b)部分)。
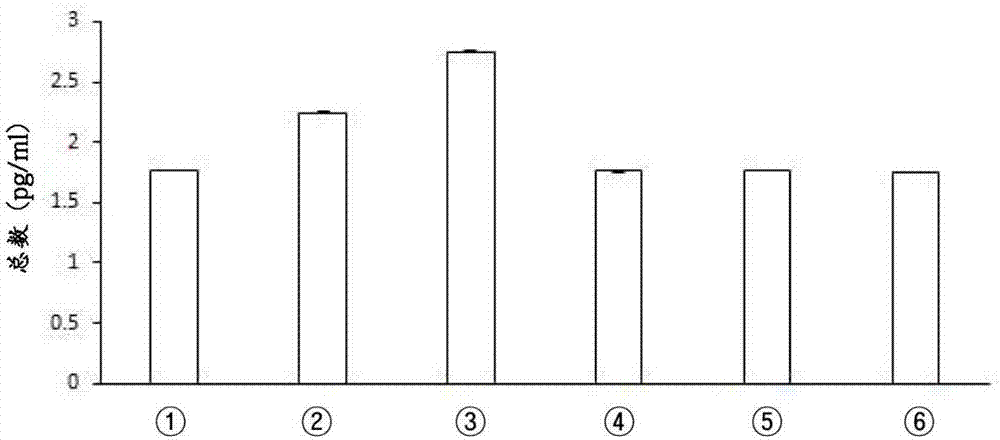
图2为示出根据培养方法的条件培养基内碱性成纤维细胞生长因子的浓度(1:贴壁细胞培养的af-n1.0×105个;2:贴壁细胞培养的af-n4×105个;3:贴壁细胞培养的af-n1.0×106个;4:theracyte注入培养的af-n1.0×105个;5:theracyte注入培养的af-n4×105个;6:theracyte注入培养的af-n1.0×106个)。
图3至图6为示出分别根据培养方法的条件培养基内碱性成纤维细胞生长因子(图3)、血小板衍生生长因子-aa(pdgf-aa)(图4)、胰岛素样生长因子(igf)(图5)及无翅型mmtv整合位点家族成员7a(wnt7a)(图6)的浓度(1:贴壁细胞培养的af-n1.0×105个;2:贴壁细胞培养的af-n4×105个;3:贴壁细胞培养的af-n1.0×106个;4:theracyte注入培养的af-n1.0×105个;5:theracyte注入培养的af-n4×105个;6:theracyte注入培养的af-n1.0×106个)。
图7为示出将实施例1至实施例4的干细胞注入theracyte时的细胞存活率。
图8为示出利用小鼠来确认注入有干细胞的theracyte的生物功能性的过程的示意图。
图9为在第一次拔毛(plucking)后移植theracyte来确认生发诱导效果的图片。
图10为在第二次拔毛后移植theracyte来确认生发诱导效果的图片,此时,仅对确认到生发效果的多个低氧培养干细胞进行比较。
图11为在第三次拔毛后移植theracyte来确认生发诱导效果的图片,此时,仅对确认到生发效果的多个低氧培养干细胞进行比较。
图12为添加对照组在第一次拔毛后移植theracyte来确认生发诱导效果的图片。
图13为在老化小鼠模型中在第一次拔毛后移植theracyte来对毛发生长期诱导进行比较的图片。
图14为在老化小鼠模型中在第二次拔毛后移植theracyte来对毛发生长期诱导进行比较的图片。
图15为在移植组织内9天后示出theracyte内部的逆分化羊水干细胞的形态。
图16为分析每组皮肤组织的毛囊形成差异的结果。
图17为通过每组皮肤组织的ap染色来测定hfdp细胞活性的结果。
具体实施方式
本发明涉及包含具有生发功能性细胞因子分泌能力的干细胞的生物移植用移植物。
并且,本发明涉及用于改善脱发的生物移植用移植物的制备方法,包括将具有生发功能性细胞因子分泌能力的干细胞注入生物移植用移植物内的步骤。
并且,本发明涉及用于治疗脱发的生物移植用移植物的制备方法,包括将具有生发功能性细胞因子分泌能力的干细胞注入生物移植用移植物内的步骤。
并且,本发明涉及用于促进生发的生物移植用移植物的制备方法,包括将具有生发功能性细胞因子分泌能力的干细胞注入生物移植用移植物内的步骤。
并且,本发明涉及脱发改善方法,包括将本发明的移植物移植于生物的步骤。
并且,本发明涉及脱发治疗方法,包括将本发明的移植物移植于生物的步骤。
并且,本发明涉及生发促进方法,包括将本发明的移植物移植于生物的步骤。
并且,本发明涉及包含用于治疗脱发、改善脱发或促进生发的具有生发功能性细胞因子分泌能力的干细胞的生物移植用移植物的用途。
以下,对本发明进行详细说明。
具有生发功能性细胞因子分泌能力的干细胞
优选地,本发明的具有生发功能性细胞因子分泌能力的干细胞为羊水来源干细胞。这是因为羊水内细胞分泌生长激素。并且,优选地,本发明的具有生发功能性细胞因子分泌能力的干细胞为逆分化羊水干细胞。并且,优选地,本发明的具有生发功能性细胞因子分泌能力的干细胞为胚胎来源间充质干细胞。更优选地,本发明的具有生发功能性细胞因子分泌能力的干细胞为胚胎来源逆分化间充质干细胞。
上述逆分化干细胞利用以往公知的逆分化方法制成,对此没有特别的限制。例如,本发明的逆分化干细胞可通过将逆分化因子导入间充质干细胞来制成。对这种逆分化因子也没有特别的限制,但是优选地,考虑安全性及效率,利用已被验证的。例如,本发明的逆分化干细胞可利用作为逆分化因子的oct4、klf、myc、sox、nanog等来可制备而成,优选地,本发明的逆分化干细胞可利用nanog基因制成。与未逆分化的干细胞相比,本发明的逆分化干细胞的特征在于,增加生长时间、增加生长分裂次数、促进生长因子分泌。
上述生发功能性细胞因子是指具有生发促进功效、脱发治疗功效、脱发抑制功效、脱发改善功效的多种细胞因子。上述细胞因子可选自由碱性成纤维细胞生长因子、血小板衍生生长因子-aa、胰岛素样生长因子及无翅型mmtv整合位点家族成员7a组成的组中。
优选地,上述干细胞为低氧条件下培养的干细胞。此时,低氧条件是指在大气压下低于氧浓度的氧条件,优选地,指氧浓度为0.01%至8%的条件,更优选地,指0.05%至5%的条件,进一步优选地,指0.10%至3%的条件。
此时,培养可以为生物移植用移植物内培养,也可以是一般的贴壁细胞培养,优选为一般的贴壁细胞培养。
生物移植用移植物
本发明的生物移植(transplantation)用移植物为由生物相容性膜制备的薄膜聚合物腔体。上述生物移植用移植物为用于生物内移植的容器,即,作为生物移植容器,具有可注入干细胞的空间,通过薄膜向移植物外分泌由干细胞制成的多种物质,尤其是多个细胞因子。上述移植物保护拒绝接受干细胞移植的对象,当移植于皮下时,优选地,具有诱导接近于膜的毛细血管的形成的血管新生功能。通过上述血管新生功能,移植物向薄膜内干细胞提供营养及血液。优选地,上述移植物由生物环保性的材料制备,即,由不引起免疫反应的材料制备。这种材料是公知材料,例如,聚氨酯等。优选地,上述移植物具有多个细孔位于表面的多孔性表面,此时,优选地,孔的大小为不能使如细胞等大小大的物质通过但可使蛋白质或营养素出入的大小。因此,可通过上述孔注入于移植物内的干细胞无法向植入物外出去,防止因干细胞诱发的癌,另一方面,作为干细胞分泌物的多个生长促进因素释放到血液中,由此在周围形成血管,将氧及营养素向移植物内供给。由此,干细胞的存活期间显著增加。并且,在移植后经过长时间后也容易地去除上述移植物。上述移植物使用购自满足上述条件的市场销售产品。例如,优选地,上述移植物为theracyte(theracytetm)。
本发明的生物移植用移植物用于治疗或改善脱发。并且,本发明的生物移植用移植物用于促进生发。此时,本发明的生物移植用移植物可用于治疗或改善由老化引起的脱发。并且,对于由老化引起的脱发而受痛苦的患者,本发明的生物移植用移植物可用于促进生发。
本发明的生物移植用移植物可包含1.0×103个至1.0×1010个本发明的干细胞,此时,将培养的干细胞本身注入移植物内。然而,本发明是使干细胞自身在生物内长时间工作,而不是将干细胞的培养液注入移植物内的。将本发明的干细胞注入具有渗透膜的移植物内来进行移植,是因为可通过被移植的对象的血液接收对存活所需的氧及营养。并且,因为与向移植物内注入培养液相比,注入更多的干细胞对促进生发及防止/改善/治疗脱发更有效。
本发明可通过注入本发明的生物移植用移植物的本发明的干细胞来进行种植,从而可增进头发形成,而不会有产生免疫排斥反应或产生癌细胞的风险。
优选地,将本发明的生物移植用移植物种植于生物体,优选地,种植于头皮下(皮下)。此时,接受移植本发明的生物移植用移植物的对象为包括人在内的动物,尤其是因脱发遇到困难的人。
将具有生发功能性细胞因子分泌能力的干细胞注入生物移植用移植物内的步骤
本发明涉及用于促进生发/治疗脱发/改善脱发/抑制脱发的生物移植用移植物的制备方法,包括将具有生发功能性细胞因子分泌能力的干细胞注入生物移植用移植物内的步骤。上述注入方法本身使用现有的移植物内细胞注入方法,并没有特别的限制。
参照后述的实施例会让本发明的优点、特征及实现这些优点和特征的方法更加明确。但是,本发明并不局限于以下所公开的实施例,能够以互不相同的各种方式实施,本实施例使本发明的公开完整,用于使本发明所属技术领域的普通技术人员完整地理解本发明的范畴,本发明仅由发明要求保护范围定义。
<材料及方法>
实验动物
作为实验动物,使用了6周龄的c57bl/6小鼠。另一方面,为了老化模型试验而使用了13周龄以上的老化的c57bl6小鼠模型。
导入nanog羊水来源逆分化再活化间充质干细胞
通过导入nanog基因确立的羊水来源逆分化再活化间充质干细胞(reprogrammedamnioticfluid-derivedmesenchymalstemcellwithnanog;以下为af-n)的制备如下,即,利用逆转录病毒载体将nanog基因导入在羊水来源胚胎的间充质干细胞,并诱导nanog基因的过表达。以下,通过导入上述nanog基因确立的羊水来源逆分化再活化间充质干细胞称为“af-n”。
干细胞的培养
羊水干细胞培养在包含dmem、10%的fbs、1%的p/s、1%的l-谷氨酰胺(l-glutamine)、4ng/ml的碱性成纤维细胞生长因子、5ng/ml的硒(selenium)、50ug/ml的维生素c(vitaminc)的培养基中。
羊水干细胞的theracyte内注入
在100mm的细胞培养皿中,对各个的羊水干细胞组进行培养,直到覆盖70~80%的贴壁培养容器的表面为止后,对细胞数进行计数并将1.0×107个细胞悬浮于20μl的低葡萄糖(low-glucose)dmem,利用22g针(needle)注入(injection)于theracyte内。然后,用强力粘结剂密封入口。
theracyte移植(transplantation)
麻醉小鼠后,在背部右侧打10mm左右的孔后,向其内部插入theracyte。然后,用缝合用丝线缝合或使用创缘夹(woundclip)缝合伤口。
细胞计数试剂盒(cellcountingkit,cck)
通过使包括在实验组的小鼠牺牲来分泌出被移植的theracyte后,用pbs清洗后侧外部。然后,混合(mix)af生长培养基与100ul的细胞计数试剂盒后培养30分钟。回收(harvest)培养的培养基后在450nm的波长下测定吸光度(absorbance)。
<实施例1>
在常规的有氧条件下(normoxia)培养未导入nanog基因的羊水干细胞并获得羊水干细胞。
<实施例2>
在常规的有氧条件下培养af-n(通过导入nanog基因来确立的逆分化羊水干细胞)并获得羊水干细胞。
<实施例3>
氧浓度为1%的氧不足(hypoxia)(低氧)条件下培养未导入nanog基因的羊水干细胞并获得羊水干细胞。
<实施例4>
氧浓度为1%的氧不足(低氧)条件下培养af-n(通过导入nanog基因来确立的逆分化羊水干细胞)并获得羊水干细胞。
<实验例1>确认注入于theracyte的af-n的细胞因子碱性成纤维细胞生长因子分泌
对基于af-n的培养方法的所获得的条件培养基内生发功能性细胞因子碱性成纤维细胞生长因子的浓度差异进行了评价。具体地,分别改变af-n干细胞为1.0×105个、4×105个、1.0×106个,在利用作为它们的一般的干细胞培养方法的贴壁细胞培养进行培养的情况(图1的(a)部分)和将af-n注入theracyte内进行培养的情况(图1的(b)部分)下,利用酶联免疫吸附剂测定(elisa)分析方法测定各个的条件培养基内碱性成纤维细胞生长因子的浓度。
其结果,在利用贴壁细胞培养(attachedcellculture)进行培养的情况下,碱性成纤维细胞生长因子的浓度随着细胞数的增加而增加,但是将af-n注入theracyte进行培养的情况下,碱性成纤维细胞生长因子的分泌量没有随着细胞数的增加而增加,条件培养基(conditionedmedia)内碱性成纤维细胞生长因子的浓度保持恒定(图2)。
在将af-n注入theracyte进行培养的情况下,与通常一般性的利用贴壁细胞培养进行细胞培养类似,意味着在theracyte内部的被注入的干细胞分泌的生发功能性细胞因子通过theracyte的膜向外部分泌。因此,确认theracyte不限制生发功能性,可用作生发剂的传递单元。
另一方面,将af-n注入theracyte进行培养的情况下,碱性成纤维细胞生长因子的分泌量保持恒定而没有大的变化的理由在于,1)由于干细胞生长于所谓theracyte内部的限制的空间,因此细胞的物质代谢与贴壁细胞培养的情况相比可能存在差异,或者2)theracyte不仅在空间上受到限制,而且可释放细胞因子的通道也受到限制,由于通道的瓶颈现象,在给定时间内可通过的量可能受到限制。
因此,将af-n注入theracyte进行培养的情况下,通过进一步实验确认,碱性成纤维细胞生长因子的条件培养基内浓度恒定的原因是否因为细胞因子通过theracyte膜可通过的量的饱和。
<实验例2>确认注入于theracyte的af-n的生发功能性细胞因子分泌
在上述实验例1中,在将af-n注入theracyte进行培养的情况下,确认碱性成纤维细胞生长因子的条件培养基内浓度恒定的原因是否因为细胞因子通过theracyte膜可通过的量的饱和,当移植于小鼠时,为了确定将注入于theracyte的干细胞的数,与上述实验例1相同的方法培养af-n,测定所获得的条件培养基内多个生发功能性细胞因子的浓度。众所周知,此时,所测定的多个细胞因子作为碱性成纤维细胞生长因子、血小板衍生生长因子-aa、胰岛素样生长因子及无翅型mmtv整合位点家族成员7a,它们是促进生发的生长因子。
其结果,血小板衍生生长因子-aa及无翅型mmtv整合位点家族成员7a的情况也与碱性成纤维细胞生长因子的情况类似,在贴壁细胞培养的情况下,随着注入的细胞数的增加,释放的细胞因子的量增加,但是在培养在theracyte内的情况下,确认虽然观察到了细胞因子量增加,但是与贴壁细胞培养相比,增加幅度相对少。
与此相反,在胰岛素样生长因子的情况下,与碱性成纤维细胞生长因子、血小板衍生生长因子-aa、无翅型mmtv整合位点家族成员7a不同,在贴壁细胞培养条件下,与细胞数的增加无关,可观察到浓度保持恒定之后减少,在培养在theracyte内的条件下,确认随着被注入的细胞数的增加,条件培养基内胰岛素样生长因子的浓度不断增加(图3:碱性成纤维细胞生长因子;图4:血小板衍生生长因子-aa;图5:胰岛素样生长因子;图6:无翅型mmtv整合位点家族成员7a)(1:贴壁细胞培养的af-n1.0×105个;2:贴壁细胞培养的af-n4×105个;3:贴壁细胞培养的af-n1.0×106个;4:theracyte注入培养的af-n1.0×105个;5:theracyte注入培养的af-n4×105个;6:theracyte注入培养的af-n1.0×106个)。
因此,可判断可从theracyte内释放的细胞因子的通道没有达到饱和状态。因此,认为条件培养基内细胞因子的浓度没有随着注入于theracyte的细胞数的增加而增加,是因为所谓theracyte的空间性限制不影响干细胞的代谢。
综合上述,在体外环境条件下,随着注入于theracyte的细胞数增加,一些毛发功能性细胞因子的测定值增加,并且在体内(invivo)状态下,血清通过theracyte膜向干细胞供给,由此使干细胞的代谢活性化且可释放更多的细胞因子,因此,将注入于theracyte的细胞数设定成建议量中最多的1.0×107个,进行以后实验。即,在之后的体内试验中,将1.0×107个的干细胞注入theracyte后,移植于小鼠后进行试验。
<实验例3>theracyte内细胞存活能力评价
将实施例1至实施例4的干细胞分别注入theracyte中1.0×107个后,移植于c57bl/6小鼠模型的皮肤。而且,在移植14天后,回收被移植的theracyte并利用细胞计数试剂盒对注入的个别干细胞进行评价。
细胞计数试剂盒可通过具有高的水溶性的四唑(tetrazolium)盐(wst-8)被烟酰胺腺嘌呤二核苷酸磷酸/还原型烟酰胺腺嘌呤二核苷酸磷酸脱氢酶(nadp/nadphdehydrogenase)还原并释放的甲月替染料(formazandye)而发生的颜色变化,测定细胞的存活能力(viability)。
并且,使用(1)在利用theracyte(生物移植容器)测定的情况(标记为theracyte)及(2)在theracyte中放入1.0×107个羊水来源间充质干细胞(af)后直接测定的情况(作为阳性对照组,标记为阳性(positive))进行比较。上述情况(1)是将af放入theracyte并没有移植于小鼠,而将af放入theracyte之后直接测定干细胞存活能力的,上述情况(2)是未导入nanog基因,而将在常规的有氧条件下培养的羊水干细胞放入theracyte的。即,上述情况(1)及(2)是未移植于小鼠的组。
其结果,与没有注入细胞而仅利用theracyte测定的情况相比,实施例1至实施例4的羊水干细胞具有高的细胞存活能力测定值,这是意味着在移植14天后干细胞还存活。并且,这是意味着被注入的干细胞受到theracyte膜的保护,由此不受免疫排斥反应。
另一方面,分别比较实施例1至实施例4的结果,逆分化羊水干细胞具有高于羊水干细胞的存活能力,与常规的氧浓度相比,在低浓度的有氧条件下培养的干细胞具有更高的存活能力。
在实施例3的羊水干细胞的情况下,即使在移植14天后进行了测定,但是与在常规的有氧条件下培养的实施例1相比,没有什么大的区别。因此,判断在低氧条件下培养的逆分化羊水干细胞最适合开发成脱发治疗剂(图7)。
<实验例4>
在主要利用在用于确认毛发功能性的c57bl/6小鼠中,由于形成色素的黑色素细胞仅存在于毛囊,而不存在于表皮,因此具有由黑色素的量决定肤色的特性。在毛囊中的黑色素合成仅在生长期进行,因此在生长期肤色呈黑色,而在不合成黑色素的退行期及休止期呈粉红色,具有不进行组织检查也可通过肤色确认毛发周期的优点。
在本发明中,在theracyte中注入1.0×107个实施例1至实施例4的羊水干细胞,在进行第一次拔毛后,在进行第二次毛发生长期(anagenphase)的c57bl/6小鼠中移植上述theracyte并对生发功能性进行评价。此时,将未进行任何试样处理的小鼠(未处理组)作为对照组,观察毛发的生长动态。图8为确认这种小鼠体内功能性过程的示意图。
其结果显示,与其他多个实验组(实施例1及实施例2、作为对照组的未处理组)相比,将实施例3及实施例4的羊水干细胞注入theracyte进行移植的情况下,生发功能性效果更大(图9)。
可解释成,因为在低氧条件下细胞因子的分泌量的增加组合性地影响生发功能性。另一方面,因theracyte的移植对动物模型有了很大的伤口,并且这是因为可影响生发功能性的部分,因此在伤口愈合后进行拔毛,然后再对生发功能性进行评价。
如上所决定的,在伤口愈合后,进行拔毛后观察的结果确认,在第二次拔毛后,与对照组相比,与第一次拔毛一样,从第7天开始将实施例3及实施例4的羊水干细胞注入theracyte进行移植的情况下,出现明显的生长期诱导(anageninduction)(图10)。
并且,进行第三次拔毛,观察了毛发诱导效果,出现与进行第一次拔毛及第二次拔毛类似的结果。即,与对照组相比,将实施例3及实施例4注入theracyte进行移植的情况下,从移植第8天开始出现生长期诱导差异,在第12天后,更明显。并且,与进行第一次拔毛及第二次拔毛后移植的情况相比,观察到进行生长期(anagen)的区域(area)大小变宽,尤其,与实施例3相比,在注入实施例4的逆分化羊水干细胞的情况下,确认生长期区域(anagenarea)增加的更大(图11)。
综合这些结果,可确认若将干细胞注入theracyte并进行移植,则可持续保持生发功能性效果。尤其,在注入实施例4的低氧条件下培养的逆分化羊水干细胞的情况下,确认生发功能性效果最优秀。
<实验例5>
上述实验例4的多个实验组中添加几种对照组来以相同的方式进行实验。具体地,将未注入干细胞而仅移植theracyte的情况设定为额外的阴性对照组(仅移植theracyte(theracyteonly)),以使可确认因theracyte的移植而产生的伤口对生发功能性的影响。并且,每天将逆分化羊水干细胞培养液(干细胞数:1.0×107个)涂抹于小鼠的皮肤的情况作为对照组来使用(涂抹)。并且,利用对大伤口的缝合合适的创缘夹,以使能够进行有效的伤口缝合。除此之外,与上述实验例5相同的条件及方法进行实验。实施例1至实施例4的干细胞也与实验例4相同,通过计算来进行,以使注入于theracyte的细胞数为约1.0×107个。在进行第一次拔毛后进行第二次毛发生长期的c57bl/6小鼠中进行如上所述的移植。
其结果,与实验例4相同,当利用theracyte时,可持续保持干细胞的生发功能性效果,尤其,再将实施例4的逆分化羊水干细胞注入于theracyte进行移植的情况下,确认生发效果最优秀(图12)。
<实验例6>
基于上述实验结果,注入于theracyte的逆分化羊水干细胞可具有生发功能性。因此,利用具有与实际上发生很多脱发现象的高龄脱发患者类似的特性的老化的小鼠脱发模型对生发能力进行评价。
为此,准备了13周龄以上的老化的c57bl6小鼠。未处理上述小鼠模型也具有自行进行脱发的特征,同时由于毛发生长周期及判定容易,因此判断出适合本实验。(mcmahonwm,sundbergjp.animalmodelsandbiomedicaltools,ed.sundbergjp,pp.493–497.crcpress,bocaraton,fl,1994.)。
具体的实验方法与上述实验例4及实验例5相同。在本实验中,将未注入干细胞而仅移植theracyte的情况设定为额外的阴性对照组(仅移植theracyte),以使可确认因theracyte的移植而产生的伤口对生发功能性的影响。并且,将实施例4的干细胞培养液(干细胞数:1.0×107个)涂抹于小鼠的皮肤的情况用作对照组(实施例4-涂抹)。而且,与实施例4相同,通过计算来进行,以使将实施例2及实施例4的干细胞注入theracyte的细胞数为约1.0×107个。在进行第一次拔毛后进行第二次毛发生长期的c57bl/6小鼠中进行如上所述的移植。
其结果,与之前多个实验例的结果相同,与只有涂抹theracyte及实施例4的组相比,在注入于theracyte的实施例2及实施例4的情况下,确认生长期诱导进行得很快(图13)。这是意味着与羊水干细胞相比,逆分化羊水干细胞的生发功能性更高。
<实验例7>
由上述实验例6的结果确认,包含本发明的逆分化羊水干细胞的theracyte还在老化的模型中是有效的。因此,为了了解在更老化的模型中的生长期的功能性差异,利用进行上述实验例6的老化模型经过6周后的19周龄(现有13周龄的模型实验后生长期重新开始的6周后的19周龄)小鼠模型进行第二次拔毛实验。
其结果,与实验例6的情况相比,结果更显著,因小鼠模型的老化在对照组的情况下,与随着脱发的进行而出现生长期诱导的部分发展缓慢现象相比,在种植theracyte的组的情况下,判断到因生发细胞因子的持续性的分泌及功能性的表达,随着时间的经过而出现大的差异。其结果暗示,与将条件培养基涂抹于皮肤相比,存在于theracyte内部的细胞的分泌物(secretome)效果更大。这种生发效果与实施例6中的结果相同,实施例3(theracyte)及实施例4(theracyte)的组效果最好,其次是实施例4-涂抹组,仅移植theracyte组的效果最差(图14)。
<实验例8>
如上所述,通过细胞计数试剂盒确认了羊水干细胞组的存活。为了再次确认,进行了确认羊水干细胞组在theracyte内部以何种形态存活的试验。此时,theracyte样品使用了实施例7中的第7天的样品,通过切割(section)theracyte内部进行了h&e染色。
其结果,在仅移植theracyte的组织中,内部什么也不存在。与此相反,在注入实施例2及实施例4的干细胞的theracyte内部中确认到干细胞被组织化(图15)。由此,认证了细胞生长及存活约6周以上并持续发挥功能性。
<实验例9>
在实验例6及实验例7中,认证了通过老化小鼠模型的外部部分生长期诱导。因此,通过组织分析,确认实际形成了毛囊。为此,在实施例7的试验进行第5天,通过对老化小鼠模型的皮肤组织取样并进行分析。
其结果,在theracyte组(实施例2及实施例4)的皮肤组织内确认大量的毛囊组织,确认与前期的生长期的形态相比,生长期也是分布有大量的后期生长期的毛囊形态。与此相反,实施例4涂抹组中存在大量的可成为毛囊的hfdp细胞组,但是在生长期中相对处于前期,因此判断在功能性上与theracyte组相比,相对较差(图16)。
<实验例10>
为了再次确认上述实验例9的结果,对各组织进行ap染色,测定hfdp细胞的活性度。在此试验中,对于毛发形成的活性度越高,由ap染色出现的阳性部分大且明显。
其结果,可肉眼确认与仅移植theracyte的组、涂抹实施例4的干细胞的组相比,注入实施例2及实施例4的干细胞的theracyte组的hfdp细胞活性度更优秀(图17)。
因此,可确认theracyte可使干细胞免受免疫反应,同时,通过旁分泌作用(paracrineeffect)增加其功能性。
- 还没有人留言评论。精彩留言会获得点赞!