雄黄微生物浸出液在制备抑制血管生成药物中的应用的制作方法
本发明涉及医药技术领域,具体地说,是雄黄微生物浸出液在制备抑制血管生成药物中的应用。
背景技术:
血管生成(angiogenesis)指新生血管通过重塑和扩展形成各级成熟血管的过程。往往从已存在的成熟组织中发芽生长出新的血管,或从庞大的血管系统中分裂出较小的子代血管。血管生成在胚胎发育、生殖、创伤修复以及女性的生理周期等机体正常生理过程中发挥着重要作用[1]。血管生成是一个涉及多种细胞的多种分子的复杂过程。目前,抑制血管生成分子和促进血管生成分子间的动态平衡被认为是调控血管生成的“开关”。正常的生理条件下,两者处于平衡,血管生成机制关闭;而当二者的平衡被破坏时,血管生成机制被打开,从而导致疾病的发生与发展[2]。一些疾病如各种原因引起的肿瘤、眼部新血管形成、关节炎、皮肤疾患等疾病的发生与发展,都与血管生成有关[3]。
恶性肿瘤是严重威胁人类健康的重大疾病。研究表明,实体肿瘤需要功能性的血管系统以运输营养成分,并排出细胞代谢的相关废物。肿瘤中这种血管系统网络的形成有部分依赖于已经存在的宿主血管,但导致肿瘤的扩张则是依赖于新生血管的形成[4]。因此,肿瘤治疗中抗血管生成治疗被认为是治疗恶性肿瘤具有重大医学价值的策略之一。
矿物药雄黄具有抗肿瘤的作用,由于雄黄难溶于水,因此为了解决雄黄的溶解性问题,专利授权公告号为cn1116028c的专利《纳米雄黄及其制备方法》涉及一种纳米雄黄,该纳米雄黄目前来说是相对于其他雄黄制品抑制肿瘤血管生成较好的雄黄制品,但其由于纳米雄黄只是在物理性状上进行的改变,未能将雄黄中的有效化学成分溶出或转化,因此纳米雄黄抑制血管的效果还是不理想,且毒性较大。本发明中的雄黄微生物浸出液可以更好地解决上述问题。
本发明主要涉及微生物处理的雄黄浸出液在抑制血管生成方面的应用。实验表明:雄黄微生物浸出液可有效抑制血管内皮细胞的增殖、迁移、侵袭和微管形成,减少鸡胚绒毛尿囊膜中的血管生成,并显著抑制h22实体瘤小鼠瘤体的血管生成从而抑制肿瘤生长。由于经过微生物的溶解与转化,雄黄中的多种有效成分得到有效的溶解,因此与纳米雄黄相比该雄黄微生物浸出液能够在极低的浓度范围内(微克级)对血管生成起到明显的抑制作用,使用量的大大降低也明显改善了雄黄微生物浸出液在血管生成相关疾病治疗中的毒性问题,总的来说起到了减毒增效的作用。
参考文献:
[1]nikolicl.[angiogenesis][j].srpskiarhivzacelokupnolekarstvo,1996,124(5-6):147-9.
[2]roguina,levyap.angiogenesis--anupdate[j].pediatricendocrinologyreviews:per,2005,2(3):391-8.
[3]carmelietp.angiogenesisinlife,diseaseandmedicine[j].nature,2005,438(7070):932-6.
[4]sasanoh,suzukit.pathologicalevaluationofangiogenesisinhumantumor[j].biomedicine&pharmacotherapy=biomedecine&pharmacotherapie,2005,59suppl2(s334-6.
技术实现要素:
本发明的目的是针对雄黄浸出液的现有用途的限制,提供雄黄微生物浸出液的一种新用途。
为实现上述目的,本发明采取的技术方案是:提供一种雄黄微生物浸出液在制备抑制血管生成药物中的应用。
其中,所述雄黄微生物浸出液是由下述方法制备的:取含1g/lfe2+硫酸亚铁的0k培养基90ml,加入雄黄粉末0.5g,接种10ml驯化的氧化亚铁硫杆菌,于30℃、ph1.8、130rpm恒温振荡摇瓶培养浸出25-30天,过滤弃沉淀,得滤液,取含有2mol/ledta-2na的naoh溶液调节滤液ph值为7.0,即得雄黄微生物浸出液。
其中,所述的氧化亚铁硫杆菌为驯化氧化亚铁硫杆菌,驯化流程为:取氧化亚铁硫杆菌,用200μg亚砷酸钠/100ml9k培养基、400μg亚砷酸钠/100ml9k培养基、600μg亚砷酸钠/100ml9k培养基、800μg亚砷酸钠/100ml9k培养基、1600μg亚砷酸钠/100ml9k培养基梯度驯化,然后再取0.1g雄黄/100ml9k培养基、0.2g雄黄/100ml9k培养基、0.3g雄黄/100ml9k培养基、0.5g雄黄/100ml9k培养基、1.0g雄黄/100ml9k培养基梯度驯化,之后逐步减少培养基中硫酸亚铁的量,当硫酸亚铁的量为3k时,得到驯化氧化亚铁硫杆菌。
其中,所述的血管生成为肿瘤血管新生,所述的肿瘤为实体肿瘤,所述的实体肿瘤为原发性或继发性实体肿瘤。
其中,所述的肿瘤血管新生为肿瘤病变组织的血管新生或肿瘤导致的血管新生。
其中,所述的肿瘤血管新生为白血病、淋巴瘤或骨髓瘤血液癌症的血管新生。
其中,所述的血管生成为银屑病病变组织血管新生、paget’s疾病血管新生、良性血管增生疾病的血管新生、关节炎病变组织的血管新生、动脉粥样硬化病变处的血管新生或新生血管性眼病的血管生成,所述的新生血管性眼病为原发性或继发性新生血管性眼病。
其中,雄黄微生物浸出液作为单独成分或与其它药学上可接受的成分构成组合物在制备抑制血管生成的药物中的应用,所述的其它药学上可接受的成分是与雄黄微生物浸出液没有拮抗作用的药物,或药学上允许的一种或多种辅料。
雄黄微生物浸出液是一种可溶性的药物,因此可以单独或与其它药物配伍及添加药学上可以接受的辅料,很容易制成各种制剂,包括栓剂、丸剂、颗粒剂、膜剂、微囊剂、滴丸剂、气雾剂、酒剂、糖浆剂、口服液、注射液或注射粉针剂等,这是本领域的研究人员可以理解的。
其中,所述的药物的给药方式为注射、口服、吸入式喷雾或透皮给药。
本发明优点在于:本发明提供了雄黄微生物浸出液的一种新的用途。首次发现雄黄微生物浸出液具有抗血管生成作用,首次发现雄黄微生物浸出液可有效抑制血管内皮细胞的增殖、迁移、侵袭和微管形成,减少鸡胚绒毛尿囊膜中的血管生成,并显著抑制h22实体瘤小鼠瘤体的血管生成从而抑制肿瘤生长。雄黄微生物浸出液可作为血管生成抑制剂使用,能够应用于抑制血管生成药物的制备以治疗肿瘤、关节炎、银屑病、眼科疾病、动脉粥样硬化等新生血管依赖性和新生血管相关性疾病。
附图说明
图1:比较不同砷浓度的雄黄微生物浸出液与纳米雄黄对huvec细胞活力的影响。
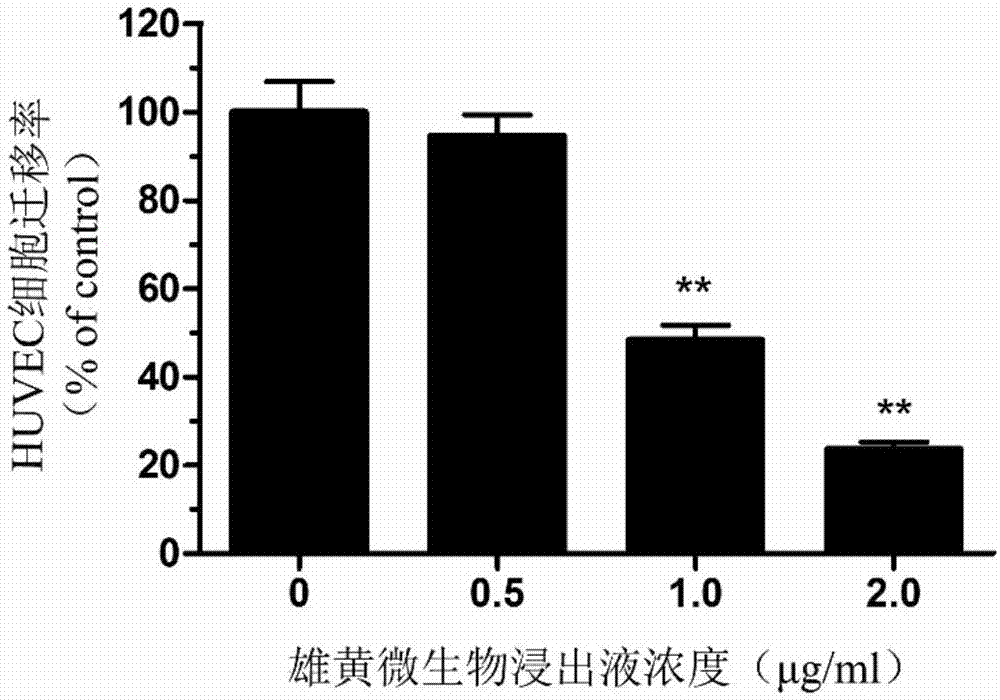
图2:不同浓度的雄黄微生物浸出液抑制huvec细胞的水平迁移。
图3:不同浓度的雄黄微生物浸出液抑制huvec细胞的侵袭。**:与对照组(雄黄微生物浸出液的浓度为0μg/ml)相比具有极显著性差异(p<0.005)。
图4:不同浓度的雄黄微生物浸出液抑制huvec细胞的微管形成。**:与对照组(雄黄微生物浸出液的浓度为0μg/ml)相比具有极显著性差异(p<0.05)。
图5:不同浓度的雄黄微生物浸出液抑制鸡胚绒毛尿囊膜血管生成。**:与对照组(雄黄微生物浸出液的浓度为0μg/ml)相比具有极显著性差异(p<0.005)。
图6:不同浓度的雄黄微生物浸出液治疗组和对照组的荷瘤小鼠肿瘤体积统计。**:与对照组(生理盐水)相比具有显著性差异(p<0.01)。
图7:不同浓度的雄黄微生物浸出液治疗组和对照组的荷瘤小鼠肿瘤质量统计。**:与对照组(生理盐水)相比具有显著性差异(p<0.01)。
图8:不同浓度的雄黄微生物浸出液治疗组和对照组的荷瘤小鼠肿瘤坏死面积统计。**:与对照组(生理盐水)相比具有显著性差异(p<0.01)。
图9:不同浓度的雄黄微生物浸出液治疗组和对照组的荷瘤小鼠肿瘤组织中微血管密度统计。**:与对照组(生理盐水)相比具有显著性差异(p<0.01)。
具体实施方式
下面结合附图对本发明提供的具体实施方式作详细说明。
下列实施例中未注明具体条件的实验方法,通常按照常规条件,所用的试剂均可以在市场上购买。
1.生物材料
氧化亚铁硫杆菌(thiobacillusferrooxidansby3-1)于2004年7月23日保藏于中国典型培养物保藏中心,保藏编号:cctcc-m204057,保藏名称:氧化亚铁硫杆菌(thiobacillusferrooxidansby3-1),保藏单位地址:中国武汉武汉大学。
人脐静脉内皮细胞(huvec)购自江苏凯基生物技术股份有限公司。
2.药品
9k液体培养基(g/l):(nh4)2so43.0g,k2hpo40.5g,kcl0.1g,mgso4·7h2o0.5g,ca(no3)20.01g,feso4·7h2o44.78g,用蒸馏水定容至1l。
3k液体培养基(g/l):(nh4)2so43.0g,k2hpo40.5g,kcl0.1g,mgso4·7h2o0.5g,ca(no3)20.01g,feso4·7h2o14.93g,用蒸馏水定容至1l。
0k液体培养基(g/l):(nh4)2so43.0g,k2hpo40.5g,kcl0.1g,mgso4·7h2o0.5g,ca(no3)20.01g,用蒸馏水定容至1l。
实施例1雄黄微生物浸出液的制备
取氧化亚铁硫杆菌(于2004年7月23日保藏于中国典型培养物保藏中心,保藏编号:cctcc-m204057,保藏名称:氧化亚铁硫杆菌(acidithiobacillusferrooxidansby3-1),用200μg亚砷酸钠/100ml9k培养基、400μg亚砷酸钠/100ml9k培养基、600μg亚砷酸钠/100ml9k培养基、800μg亚砷酸钠/100ml9k培养基、1600μg亚砷酸钠/100ml9k培养基梯度驯化,然后再取0.1g雄黄/100ml9k培养基、0.2g雄黄/100ml9k培养基、0.3g雄黄/100ml9k培养基、0.5g雄黄/100ml9k培养基、1.0g雄黄/100ml9k培养基梯度驯化,之后逐步减少培养基中硫酸亚铁的量,当硫酸亚铁的量为3k时,得到驯化氧化亚铁硫杆菌。
取含1g/lfe2+硫酸亚铁的0k培养基90ml,加入雄黄粉末0.5g,接种10ml驯化的氧化亚铁硫杆菌,于30℃、ph1.8、130rpm恒温振荡摇瓶培养浸出25-30天,过滤弃沉淀,得滤液,取含有2mol/ledta-2na的naoh溶液调节滤液ph值为7.0,即得雄黄微生物浸出液。
雄黄微生物浸出液中砷含量为最重要的质量标准,在实施例2、实施例3、实施例4、实施例5、实施例6、和实施例7中,雄黄微生物浸出液浓度皆为砷含量,砷含量采用毛细管电泳间接紫外检测方法进行测定。
实施例2比较不同砷浓度的雄黄微生物浸出液与纳米雄黄对huvec细胞活力的影响
目的和原理:采用mtt法检测huvec的增殖。mtt(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)是一种可接受氢离子的黄色染料,可作用于活细胞线粒体中的呼吸链,在琥珀酸脱氢酶和细胞色素c的作用下四唑环开裂,生成蓝色的甲臜结晶(formazan),甲臜结晶的生成量仅与活细胞数目成正比(死细胞中琥珀酸脱氢酶消失,不能将mtt还原)。还原生成的甲臜结晶可在含10%(m/v)十二烷基硫酸钠、5%(m/v)异丁醇和0.012mol/l盐酸的mtt溶解液中溶解,利用酶标仪测定570nm处的光密度od值,可间接反映活细胞数量。通过该方法可评价药物对huvce活力的影响。
方法:纳米雄黄的制备方法参照专利纳米雄黄及其制备方法(专利授权公告号:cn1116028c,公告日;2003.07.30)。将huvec细胞接种于96孔板中培养。待80%细胞生长达到融合度后,将雄黄微生物浸出液和纳米雄黄分别以以下砷浓度:0.2、0.4、0.8、1.0、1.5、2.0和2.5μg/ml加入孔中(未加雄黄微生物浸出液和纳米雄黄的组为空白对照control),作用48h后每孔加10μlmtt溶液(5mg/ml),置于37℃培养箱继续孵育4h,再加入100μl的mtt溶解液,置于37℃培养箱孵育12h,最后用可调波长式微孔酶标仪在570nm处检测od值。以细胞培养液和mtt溶液及溶解液但不含细胞的孔作为空白对照blank。按如下公式计算细胞活力:
细胞活力(%)=(odcontrol-odblank)/(odcontrol-odsample)×100%
结果与结论:如图1所示,当砷浓度达到1μg/ml后,在相同的砷浓度作用48h后,雄黄微生物浸出液对huvec细胞活力的抑制作用明显高于纳米雄黄的抑制作用。
实施例3雄黄微生物浸出液抑制huvec细胞迁移实验
目的与原理:细胞划痕实验是一种操作简易,且价格低廉的研究细胞迁移的体外实验方法,通过在融合的单层细胞上人为造成一道空白区域(称为划痕)。划痕边缘细胞逐渐迁移进入空白区域会使该划痕“愈合”。
方法:将huvec细胞接种于6孔板内,待80%细胞生长达到融合度后。用枪头在每孔中间位置轻轻划一道痕。加入含0、0.5、1.0和2.0μg/ml的雄黄微生物浸出液的细胞培养液,置于co2细胞培养箱中培养12h后更换新鲜培养基。在显微镜下拍照观察并统计huvec迁移的情况。按如下公式计算细胞迁移率:
细胞迁移率(%)=实验组细胞迁移数/对照组细胞迁移数×100%
结果与结论:如图2所示,雄黄微生物浸出液在1.0-2μg/ml范围内可显著抑制huvec细胞的迁移。
实施例4雄黄微生物浸出液抑制huvec细胞侵袭实验
目的和原理:transwell实验技术,这项技术的主要材料是transwell小室(transwellchamber),小室的底层有一层通透性的膜(一般常用的是聚碳酸酯膜,polycarbonatemembrane),这层膜带有孔径大小0.1~12.0μm的微孔。聚碳酸酯膜上室侧铺上一层基质胶,用以模仿体内细胞外基质。实验中细胞置于小室上,在小室下含有的趋化因子或生长因子的作用下,细胞欲进入下室,先要分泌基质金属蛋白酶(mmps)将基质胶(matrigel)降解,方可通过聚碳酸酯膜。计数进入下室的细胞量可反映细胞的侵袭能力。
方法:用50mg/lmatrigel1:8稀释液包被transwell小室底部膜的上室面,4℃风干。下室加入600μl含有20ng/ml的vegf165)的huvec培养液。上室中加入100μl含有0、0.5、1.0和2.0μg/ml的雄黄微生物浸出液的huvec细胞悬液(细胞密度为2×105/ml),置于co2细胞培养箱中培养24h。未加雄黄微生物浸出液的组为对照。24h后,从培养箱取出培养板,弃去孔中培养液,用棉签轻轻擦去上室未侵袭的细胞,然后加入600μl0.1%(m/v)结晶紫染色,最后用pbs漂净多余的结晶紫染料。在显微镜下拍照观察并统计huvec侵袭的情况。按如下公式计算细胞侵袭率:
细胞侵袭率(%)=实验组细胞侵袭数/对照组细胞侵袭数×100%
结果与结论:侵袭后的细胞经结晶紫染色后显紫色。由图3所示,与对照组相比,雄黄微生物浸出液的浓度在1.0-2μg/ml范围内,huvec的侵袭能力被显著抑制。
实施例5雄黄微生物浸出液抑制huvec细胞形成微管实验
目的和原理:人工基膜matrigel胶是从小鼠ehs肉瘤提取的基膜成分,在37℃下可自发形成凝胶状的人工基膜,具有天然基膜的生物学作用。人脐静脉内皮细胞可以在matrigel胶上粘附形成微管,从而可用于研究药物对内皮细胞形成微管作用的影响。
方法:取60μlmatrigel胶溶液加入到预冷的96孔培养板中,然后放置于37℃培养箱孵育30min,使胶充分固化。将含有0、0.5、1.0和2.0μg/ml的雄黄微生物浸出液的huvec细胞悬液100μl(细胞密度为1×105/ml)分别加入铺有matrigel的96孔板中,置于co2细胞培养箱中培养5h。未加雄黄微生物浸出液的组为对照。5h后在倒置光学显微镜下观察微管形成并统计结果。按如下公式计算微管形成率:
微管形成率(%)=实验组微管形成数/对照组微管形成数×100%
结果与结论:huvec可在matrigel上延伸生长呈管状并相互连接,形成三维网状结构。由图4所示,与对照组相比,雄黄微生物浸出液的浓度在0.5-2μg/ml范围内,huvec细胞形成微管的能力被显著抑制,且2μg/ml时,huvec细胞分散排布,未见完整的微管形成,huvec细胞的微管形成能力几乎被抑制。
实施例6雄黄微生物浸出液抑制鸡胚绒毛尿囊膜上血管生成实验
目的和原理:鸡胚绒毛尿囊膜(chickchorioallantoicmembrane,cam)具有丰富的血管网,对于刺激或抑制血管生成的药物敏感,是较为理想的研究抗血管生成药物的体内实验模型。
方法:将受精蛋置于温度为38℃相对湿度为65-70%的培养箱内孵育8天后,在鸡蛋气室上方开一个直径为2cm左右的窗口,揭去蛋壳和外膜,暴露cam。将含有0、10、20和40μg/ml的雄黄微生物浸出液的醋酸纤维素膜(药物载体,直径6mm)轻轻放置于cam表面无血管的位置。以不加药的生理盐水组作为对照。用无菌封口膜封好气室上方开口,将鸡蛋继续孵育72h后,暴露cam进行观察拍照,计算血管数量。
结果:由图5所示,雄黄微生物浸出液浓度在10-40μg/ml范围内,与对照组相比能显著抑制cam的血管新生。
实施例7雄黄微生物浸出液抗血管生成抑制h22小鼠肿瘤生长实验
目的和原理:通过观察荷瘤小鼠的肿瘤生长情况,以及对肿瘤组织的染色和免疫组化分析(he染色:肿瘤坏死面积,cd31:微血管密度),考察药物对于荷瘤小鼠的抗血管生成抑制肿瘤生长的疗效。
方法:将h22细胞(1×106/只)皮下接种于18-20g重量的雄性昆明种小鼠右侧腋下。将21只小鼠随机分成三组(每组7只),即对照组(生理盐水)、1.25mg/kg雄黄微生物浸出液组和2.50mg/kg雄黄微生物浸出液组。接种第二天后开始腹腔注射给药,各组每天给药一次,连续给药9天。于最后一次给药后次日处死小鼠,剥离肿瘤组织,记录肿瘤体积和质量。10%(v/v)的甲醛溶液常温下固定组织一周,将组织石蜡包埋,进行he染色和免疫组化染色。he染色用于肿瘤坏死面积分析,肿瘤血管采用cd31抗体标记。将切片置于显微镜下拍照,并统计肿瘤坏死面积和肿瘤内微血管密度(mvd)。
结果与结论:如图6和7所示,雄黄微生物浸出液有效抑制肿瘤生长。免疫组化分析表明,雄黄微生物浸出液能显著抑制肿瘤微血管密度(图9),从而增加肿瘤坏死面积(图8),表明雄黄微生物浸出液能通过抗血管生成发挥抗肿瘤活性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!