二苯乙烯二聚体在制备治疗肝脏相关疾病的药物中的应用的制作方法
本发明涉及式(ⅰ)所示的化合物二苯乙烯二聚体(gnetulin,gns-1)的新医药用途,其具体为gns-1在制备治疗和/或预防肝脏相关疾病方面的用途。
背景技术:
肝病是世界性疾病,我国是肝病大国。当前我国各种原因引起的肝损伤及肝脏炎症患者数量庞大,以病毒性肝炎为主,近年来,药物性肝病、酒精性及非酒精性脂肪性肝病、自身免疫性肝病等的发病率亦呈逐年增加趋势。众所周知,肝病为进展性疾病,已有多种证据提示,肝脏炎症见于几乎所有原因所致的肝病,且常贯穿肝病病程始终。但长期以来,有关肝脏炎症防治研究特别是抗炎保肝方面进展不理想,致使临床应用手段与方法有限,并存在诸多不同意见。针对上述问题,2014年“中华医学会感染病学分会肝脏炎症及其防治专家共识专家委员会”发表“肝脏炎症及其防治专家共识”[1],“共识”指出:“肝脏炎症及其所致肝纤维化、肝硬化及肝衰竭等是肝脏疾病进展的主要病理生理学和病理组织学基础;抗炎保肝治疗是肝脏炎症综合治疗的重要组成部分,对于肝脏炎症,无论是否存在有效的病因疗法,均应考虑实施抗炎保肝治疗;对于缺乏有效病因治疗或暂时不能进行病因治疗的部分患者,更应考虑抗炎保肝治疗”。抗炎保肝药物在肝病治疗中的重要性得到进一步肯定。但是如上提及,长期以来,抗炎保肝方面的进展并不理想,临床可供选择的抗炎保肝药物有限,中国原创或具有中国自主知识产权的品种更少。
二苯乙烯二聚体(gnetulin,gns-1),是从小叶买麻藤(gnetumparvifolium)、闭苞买麻藤(gnetumcleistostachyum)等买麻藤属植物中分离得到的具有独特茚型结构的二苯乙烯二聚体,现已可化学合成,其结构式如式(ⅰ)所示。文献中对gns-1的相关报道较少,尤其是其在治疗和/或预防肝脏相关疾病方面的活性未见文献报道。
技术实现要素:
本发明解决的技术问题在于提供化合物gns-1在制备治疗和/或预防与肝脏相关疾病产品中的应用。
为解决本发明的技术问题,本发明提供如下技术方案:
本发明技术方案的第一方面是提供了如式(ⅰ)所示化合物gns-1及其药学上可接受的盐在制备治疗和/或预防与肝脏有关疾病产品中的应用,其中所述的与肝脏有关疾病选自病毒性肝炎、化学品或药物引发的肝损伤等肝病,包括:甲肝、乙肝、丙肝、药物性肝病、酒精性肝病、非酒精性肝病、自身免疫性肝病、肝病进展的肝纤维化、肝硬化、肝衰竭、肝癌。所述的产品包括药物或保健品。
为验证本发明的技术方案,本发明提供了两个体外肝细胞损伤模型和两个体内肝损伤动物模型。
本发明提供的体外肝损伤模型:第一个体外模型为扑热息痛(apap)诱导的肝细胞损伤模型,apap为常用解热镇痛药,其过量使用是国外急性肝损伤的主要原因。第二个体外模型为雷公藤甲素(tpl)诱导的肝细胞损伤模型,tpl为常用自身免疫性疾病治疗中药雷公藤中的主要活性成分和毒性成分,雷公藤是临床报道最多的三大肝毒性中药之一,中药肝毒性是临床药物性肝损伤及保健品等肝损伤的主要原因之一,已引起越来越多的重视。
本发明提供的体内肝损伤动物:第一个是利用植物凝集素(cona)诱导的急性免疫性肝损伤模型,该模型与临床肝炎病毒如乙肝病毒、丙肝病毒等引起的免疫性肝损伤发病机制相似。第二个是利用四氯化碳(ccl4)诱导的急性中毒性肝损伤模型,该模型发病机制主要为氧化性肝损伤,而氧化损伤几乎为所有肝毒性物质引起肝损伤的共同机制之一。
本发病利用上述4个模型评价了gns-1抗炎保肝活性。
本发明技术方案的第二方面是提供一种药物组合物在制备治疗和/或预防与肝脏相关疾病产品中的应用,其特征在于,所述的药物组合物包含式(i)所示的gns-1或其药学上可接受的盐和药学上可接受的载体或赋形剂;所述的药物组合物中,其有效成分除了第一方面所述的化合物gns-1外,还可以含有其他成分,所述的其他成分包括抗病毒药物、抗肿瘤药物、抗结核药物、免疫抑制剂、保肝药物、营养物质中的一种或多种。所述的产品包括药物或保健品。
其中,所述药物组合物包括片剂、胶囊剂、颗粒剂、丸剂、滴丸剂、预乳剂、微乳剂、混悬剂、糖浆剂、肠溶制剂、注射剂。
为达到用药目的,增强治疗效果,本发明的药物或药物组合物可用任何的给药方式给药。
本发明的化合物或药物组合物的给药剂量依照所要预防或治疗疾病的性质和严重程度,患者或动物的个体情况,给药途径和剂型等可以有大范围的变化。一般来讲,本发明化合物每天的合适剂量范围为5-200mg/kg体重。上述剂量可以一个剂量单位或分成几个剂量单位给药,这取决于医生的临床经验以及包括运用其它治疗手段的给药方案。
本发明的化合物或组合物可单独服用,或与其他治疗药物或对症药物合并使用。当本发明的化合物与其它治疗药物存在协同作用时,应根据实际情况调整它的剂量。
有益技术效果
在本发明中,gns-1在体内外均表现出明显的肝保护活性,其对药物性肝损伤、免疫性肝损伤和中毒性肝损伤(氧化损伤)均具有显著阻抑活性。在cona诱导的免疫性肝损伤,gns-1整体活性优于双环醇,在ccl4诱导的中毒性肝损伤模型,gns-1对肝组织病理的改善作用优于双环醇,在apap及tpl诱导的药物性肝损伤模型,gns-1活性与双环醇相当或优于双环醇。鉴于肝炎肝损伤存在于几乎所有类型肝病,综合以上信息,gns-1用于肝脏相关疾病的治疗有效。
附图说明
图1:gns-1对cona引起的急性免疫性肝损伤保护作用的肝组织病理结果(h.e.×200)
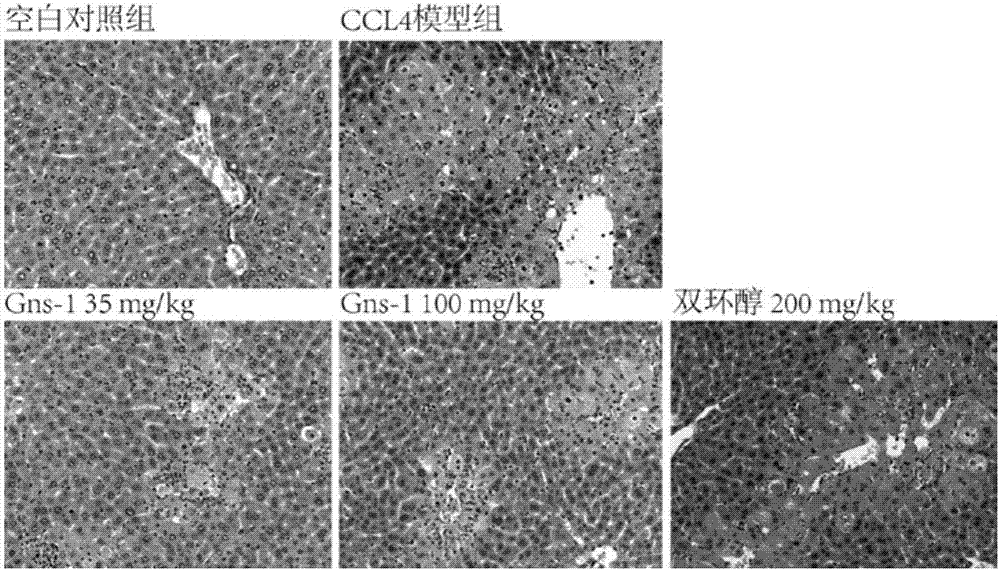
图2:gns-1对ccl4引起的急性中毒性肝损伤保护作用的肝组织病理结果(h.e.×200)
具体实施方式
本发明提供了gns-1在制备治疗和/或预防肝脏相关疾病药物中的应用,下面列举实施例进一步对本发明予以说明,但不以任何方式限制本发明。
实施例1利用apap引起体外肝细胞损伤模型对gns-1进行检测
1.实验方法:采用mtt方法。hepg2细胞为人肝癌细胞,其保留了大部分人正常肝细胞的特性,常用于肝细胞损伤研究。hepg2细胞接种于96孔细胞培养板中,培养24h后,加入无毒浓度的gns-1及扑热息痛(apap,终浓度8mm),同时设阳性药物双环醇对照组、溶剂对照组及模型组。继续作用细胞48h。弃去培养液,每孔加入mtt(0.5mg/ml)液100μl,继续培养4h,弃去mtt液,每孔加入dmso150μl,混和振荡器振荡,于酶标仪570nm波长处测定吸光度值。细胞存活率(%)=100×给药组od平均值/空白对照组od平均值。实验重复3-4次。
2.实验结果:0.1-50μm的gns-1作用hepg2细胞48h,对细胞无明显毒性,细胞存活率均大于90%,与空白对照组比较均无统计学差异(数据未显示),选择5,10,50μm无毒浓度的gns-1评价其对apap引起肝细胞损伤的保护作用。结果见表1。apap8mm作用hepg2细胞48h,对hepg2细胞产生显著损伤,细胞存活率仅为37.54%。gns-15μm,10μm和50μm对apap引起的肝细胞损伤均有抑制作用,具有一定的剂量效应关系,其中10μm和50μmgns-1能显著抑制apap对hepg2细胞的损伤,提高细胞存活率,与模型组比较有统计学差异。阳性对照药双环醇10μm对apap引起的肝细胞损伤亦有显著保护作用,10μmgns-1活性与双环醇相当,50μmgns-1活性优于双环醇。
表1gns-1对apap引起体外肝细胞损伤的保护作用(n=3-4)
***p<0.001,与空白对照组比较;#p<0.05,##p<0.01,与apap模型组比较。
实施例2利用雷公藤甲素引起体外肝细胞损伤模型对gns-1进行检测
1.实验方法:采用mtt方法。hepg2细胞接种于96孔细胞培养板中,培养24h后,加入无毒浓度的gns-1及雷公藤甲素(tpl,终浓度180nm),同时设阳性药物双环醇对照组、溶剂对照组及模型组。继续作用细胞48h。弃去培养液,每孔加入mtt(0.5mg/ml)液100μl,继续培养4h,弃去mtt液,每孔加入dmso150μl,混和振荡器振荡,于酶标仪570nm波长处测定吸光度值。细胞存活率(%)=100×给药组od平均值/空白对照组od平均值。实验重复3-4次。
2.实验结果:结果见表2,tpl180nm作用hepg2细胞48h,对hepg2细胞产生显著损伤,细胞存活率仅为19.19%。gns-110μm,50μm能抑制tpl对hepg2细胞的损伤,其中gns-150μm浓度能显著抑制tpl造成的体外肝细胞损伤,与模型组比较有统计学差异。对照药双环醇10μm对tpl引起的体外肝细胞损伤在目前实验方案下未显示良好保护作用。gns-110μm浓度活性较双环醇10μm浓度强。
表2gns-1对雷公藤甲素(tpl)引起体外肝细胞损伤的保护作用(n=3-4)
***p<0.001,与空白对照组比较;#p<0.05,与tpl模型组比较。
实施例3利用刀豆素a(cona)引起的小鼠急性免疫性肝损伤模型对gns-1进行检测
1.实验方法及检测指标
1.1cona诱导的小鼠急性免疫性肝损伤模型建立及给药方法
spf级雄性icr小鼠(20~22g),适应环境后随机分为4组,空白对照组,cona模型组,gns-1灌胃给药100mg/kg组,阳性对照药双环醇灌胃给药200mg/kg组。gns-1给药组于造模前3天开始给药,每天给药1次,共给药3天,双环醇组于造模前一天的下午,当天的上、下午各灌胃给药一次,空白对照组及模型组动物给予相同量的0.5%cmc-na液。于末次给药后2h,除空白对照组,各组小鼠尾静脉注射20mg/kgcona一次。小鼠禁食不禁水16h后,处理动物。
1.2生化指标测定
小鼠断头取血,血液样本室温静置1h,4000rmp离心10min,分离血清,全自动生化分析仪检测血清中alt、ast、ldh含量。
1.3肝脏病理检测
取相同部位肝大叶标本,经10%甲醛固定,常规脱水透明、石蜡包埋、切片后,进行h.e.染色,光镜检查肝脏病理状态并照相。
1.4统计学分析
数据以均数平均值±标准差
2.实验结果
2.1gns-1对cona诱导的急性免疫性肝损伤小鼠血清肝功能指标的影响
结果见表3,cona单次注射能引起小鼠显著肝损伤,血清肝功能指标alt、ast和ldh含量较空白对照组显著升高。gns-1灌胃给药每天1次,连续3天,对cona引起的肝损伤有显著保护作用,血清alt、ast及ldh含量较模型组均显著降低,有极显著统计学差异。在该模型中,gns-1100mg/kg灌胃给药活性优于双环醇200mg/kg灌胃给药。
表3gns-1对cona引起肝损伤小鼠血清alt、ast、ldh含量的影响(n=9-10)
#p<0.05,###p<0.001,与空白对照组比较;*p<0.05,***p<0.001,与模型组比较。
2.2gns-1对cona诱导的急性免疫性肝损伤小鼠肝脏病理组织学观察
病理结果见表4、表5和图1,cona能致小鼠肝脏显著损伤,肝组织病理表现为肝细胞大量(呈片状)凋亡坏死,肝细胞固缩,胞核固缩,炎细胞浸润,胆小管增生,汇管区纤维组织增生,门静脉内皮细胞损伤、脱落、坏死。gns-1100mg/kg给药组肝脏组织病理损伤较模型组显著减轻,主要表现为肝细胞坏死程度减轻,坏死区肝组织肝窦扩张和充血改善。双环醇给药组与模型组比较肝脏病理亦有所改善,但不及gns-1组明显,即,在肝组织病理改善方面,gns-1活性优于双环醇。
表4各组动物肝细胞病理变化发生例数和程度观察比较(n=9-10)
a注:肝细胞坏死细胞学特征改变为胞浆着色呈浅粉红色,胞浆空虚,胞膜薄,胞核多崩解,碎裂或降解,呈液化性坏死,部分肝细胞固缩胞浆深红染,胞核固缩,呈凝固性坏死。病变范围在肝小叶<1/3为轻度(+),病变占肝小叶2/3左右为中度(++);病变>肝小叶2/3为重度(+++)。
表5各组动物肝细胞病理变化发生例数和程度观察比较(n=9-10)
实施例4利用四氯化碳(ccl4)引起的小鼠急性中毒性肝损伤模型对gns-1进行检测
1实验方法及检测指标
1.1ccl4诱导的小鼠急性中毒性肝损伤模型建立及给药方法
spf级雄性icr小鼠(20~22g),适应环境后随机分为6组,空白对照组,cona模型组,gns-1灌胃给药10mg/kg、35mg/kg、100mg/kg组,阳性对照药双环醇灌胃给药200mg/kg组。gns-1给药组于造模前3天开始给药,每天给药1次,共给药3天,双环醇组于造模前一天的下午,当天的上、下午各灌胃给药一次,空白对照组及模型组动物给予相同量的0.5%cmc-na。于末次给药后2h,除空白对照组,各组小鼠腹腔注射0.2%ccl4(植物油配置)一次。小鼠禁食不禁水16h后,处理动物。
1.2生化指标测定
小鼠断头取血,血液样本室温静置1h,4000rmp离心10min,分离血清,全自动生化分析仪检测检测血清中alt、ast含量。
1.3抗氧化活性测定
取肝脏,用4℃生理盐水冲洗,剪取小块肝组织,制备成10%肝组织匀浆,4℃3500rmp离心15min,取上清液,根据检测试剂盒说明书方法测定肝组织mda、t-sod含量。
1.4肝脏病理检测
取相同部位肝大叶标本,经10%甲醛固定,常规脱水透明、石蜡包埋、切片后,进行h.e.染色,光镜检查肝脏病理状态并照相。
1.5统计学分析
数据以均数平均值±标准差
2.实验结果
2.1gns-1对ccl4引起的急性肝损伤小鼠血清alt、ast含量的影响
gns-1对ccl4诱导的急性中毒性肝损伤小鼠血清alt、ast含量的影响见表6。结果显示,ccl4能引起小鼠急性肝损伤,血清alt、ast含量较空白对照组显著升高。gns-1各给药组均能降低ccl4引起的血清alt、ast升高水平,其中gns-110mg/kg和35mg/kg能显著降低血清alt的含量。阳性对照药双环醇极显著降低血清中alt含量。在该模型,gns-1对血清alt的降低作用弱于双环醇,但对ast的降低作用略优于双环醇。
表6gns-1对ccl4引起肝损伤后小鼠血清中alt、ast含量(n=9-10)
#p<0.05,###p<0.001,与空白对照组比较;*p<0.05,***p<0.001,与模型组比较。
2.2gns-1对ccl4诱导的急性肝损伤小鼠肝组织匀浆mda、sod含量的影响
结果见表7。与空白对照组相比,ccl4模型组动物肝组织mda含量显著升高,sod含量显著降低。gns-110mg/kg,35mg/kg,100mg/kg各给药组能降低肝匀浆mda含量,升高sod含量,对抗氧化的sod的升高作用非常显著(***p<0.001)。双环醇给药组有降低肝组织匀浆中mda含量、增加sod含量的趋势,但与模型组比较无统计学差异。
表7gns-1对ccl4引起肝损伤小鼠肝组织中mda、sod含量的影响(n=8~10)
#p<0.05,###p<0.001,与空白对照组比较;*p<0.05,***p<0.001,与模型组比较。
2.3gns-1对ccl4诱导的急性肝损伤小鼠肝脏病理组织学观察
结果见表8、表9和图2。ccl4诱导的急性肝损伤组动物肝脏组织肝细胞以中央静脉为中心呈现明显变性和坏死,肝细胞气泡样变,细胞境界不清,细胞索解离,有明显的点、灶状坏死,坏死肝小叶汇管区结构破坏,炎细胞呈中度浸润。gns-135mg/kg,100mg/kg给药组动物肝组织肝细胞变性、坏死及炎症程度均较模型组显著减轻,无动物出现严重的肝细胞坏死(+++),即模型组动物肝细胞严重坏死的比例为60%,而gns-1给药组动物肝细胞严重坏死的比例为0%。双环醇给药组动物肝组织病理亦较模型组有所改善,gns-1对肝组织病理的改善作用优于双环醇。
表8各组动物肝细胞病理变化发生例数和程度观察比较
a注:肝细胞坏死细胞学特征改变为胞浆着色呈浅粉红色,胞浆空虚,胞膜薄,胞核多崩解,碎裂或降解,呈液化性坏死,部分肝细胞固缩胞浆深红染,胞核固缩,呈凝固性坏死。病变范围在肝小叶<1/3为轻度(+),病变占肝小叶2/3左右为中度(++);病变>肝小叶2/3为重度(+++)。
表9各组动物肝细胞病理变化发生例数和程度观察比较
a注:肝细胞变性表现为肝细胞浊肿、脂肪变或空泡变性。根据同一视野中观察到的肝细胞变性程度分为四级:无肝细胞变性(-);病变范围在肝小叶<1/3为轻度(+);病变占肝小叶2/3左右为中度(++);病变>肝小叶2/3为重度(+++)。
- 还没有人留言评论。精彩留言会获得点赞!