用于经粘膜施用肽类抗糖尿病药的膜状剂型的制作方法
本发明涉及膜状剂型,特别是用于经由粘膜来施用肽类抗糖尿病药的膜状剂型。
糖尿病(diabetesmellitus)是一种代谢疾病,其以长期升高的血糖值为特征。糖尿病由于胰岛素这种激素的缺乏(1型糖尿病)或者由于体细胞对于胰岛素的作用的降低的敏感性(2型糖尿病)而引起。
胰岛素对于控制血液中的糖浓度(血糖水平)是重要的,并且是可以降低血糖水平的身体中的唯一激素。长期升高的血糖在糖尿病患者中引起极深的后果损害,包括视网膜的损害(糖尿病性视网膜病变)、神经的感觉障碍(神经病)以及酮症酸中毒(由于葡萄糖利用不足而引起的酸过多)。但是,由于过低的血糖水平(“低血糖”),也可以发生昏厥(糖尿病性休克)。因此,为了患者的健康,一直保持均衡的血糖水平是非常重要的。这可以通过施用胰岛素来争取达到。
因为在经口施用的情况下胰岛素在消化道中被蛋白水解酶迅速降解,因而胰岛素,还有胰岛素类似物以及其他肽类抗糖尿病药的施用在具有糖尿病的患者中通常借助于注射来进行。然而,许多患者感到该施用方式大大地损害了他们的生活质量,也因为由于与注射相关联的疼痛所引起的不舒服和/或害怕或者由于注射所必需的裸露而引起的不自在。
尽管存在有阻碍口服施用胰岛素的问题,但是进行了努力以开发出用于胰岛素的经口剂型。l.heinemann和y.jaques(heinemann,l.和jaques,y.(2009)oralinsulinandbuccalinsulin:acriticalreappraisal.journalofdiabetesscienceandtechnology3,第568-584页)的综述文章提供了关于这些努力的概览。
原则上,对于胰岛素的口服施用,还考虑膜状剂型,用其可以经由口腔粘膜来施用胰岛素。例如,wo2012/104834a1公开了粘附在粘膜上的膜状剂型,其包含:具有水溶性聚合物的第一聚合物配制剂,其使得活性物质能够在20分钟或更短内被溶解和释放;包含亲水的生物粘附性聚合物的第二聚合物配制剂,其使得活性物质能够在大约1小时直至大约20小时的时间段内进行连续释放;和作为活性物质的胰岛素或胰岛素类似物,其中所述剂型不厚于0.5mm。在该文献中具体描述的膜状剂型至少在用颊细胞模型的体外试验中能够释放胰岛素。然而,未公布体内研究。
在专利申请文件wo2009/048945a1中,公开了用于胰岛素的全身施用的膜状配制剂,其可以粘附在粘膜上。取决于其助剂,所述膜应当在少于30秒至半小时的时间段内溶解或释放胰岛素。所述配制剂包含人胰岛素、锌螯合剂和溶解剂。如果所述膜状配制剂为多层膜,那么一方面胰岛素和另一方面锌螯合剂和/或溶解剂存在于分开的层中,从而使得所述活性物质与所述助剂分开存放,以便改善活性物质的持久性。
在公开号wo98/17251a1下公布的国际专利申请涉及用于在粘膜表面上施用药学活性物质的膜状载体。该配制剂应当适合于众多活性物质(包括胰岛素)的施用。
在上述现有技术的背景下,作为本发明基础的任务为提供膜状剂型,用其可以经由口腔粘膜来施用肽类抗糖尿病药,其中配制剂在口腔粘膜上的停留时间应当为至少30分钟至一小时或更长,以便可以在该时间段内将治疗有效量的肽类抗糖尿病药经由口腔粘膜施用至患者的血液循环。在此情况下要考虑的是,该膜状剂型在口腔粘膜上的施加不应当导致对于使用者来说不可接受的口感。同时,该剂型应当是可连续制备的,以便使得尽可能有效率的和因此成本合适的制备成为可能。
令人惊讶地,所述任务通过这样的膜状剂型而得到解决,所述膜状剂型包含至少一个含活性物质的层,在所述层中作为活性物质的肽类抗糖尿病药被包含在基于至少两种在其粘度方面彼此不同的羟丙基甲基纤维素的基质中。
根据第一个方面,本发明涉及用于经由口腔粘膜来施用至少一种肽类抗糖尿病药的膜状剂型。
根据第二个方面,本发明涉及用于制备用于经由口腔粘膜来施用至少一种肽类抗糖尿病药的膜状剂型的方法。
根据第三方面,本发明涉及用于经由口腔粘膜来施用至少一种肽类抗糖尿病药的膜状剂型的用途。
根据一个进一步的方面,本发明包括用于经由口腔粘膜来施用至少一种肽类抗糖尿病药的方法。
根据另外一个进一步的方面,本发明包括用于治疗需要施用肽类抗糖尿病药的患者的方法。
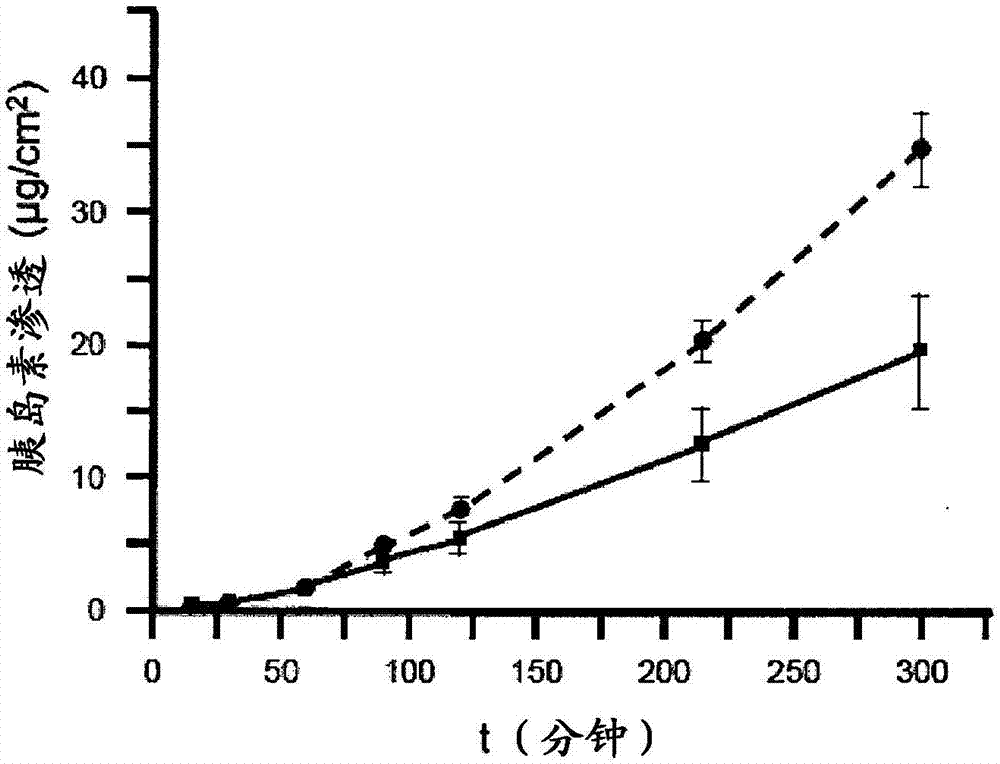
图1显示了这样的图,其图解说明了在体外渗透测定法中胰岛素或胰岛素类似物从两种不同的膜状剂型中的渗透。
图2显示了这样的图,其图解说明了在体外渗透测定法中胰岛素类似物从三种不同的膜状剂型中的渗透。
图3显示了这样的图,其图解说明了在体外渗透测定法中胰岛素类似物从一种膜状剂型中的渗透。
图4显示了这样的图,其图解说明了在体外渗透测定法中胰岛素类似物从一种膜状剂型中的渗透。
图5显示了这样的图,其图解说明了在体外渗透测定法中胰岛素类似物从一种膜状剂型中的渗透。
根据第一个方面的膜状剂型包含至少一个含活性物质的层,其包含至少一种肽类抗糖尿病药作为活性物质,并且其在正确施加所述剂型的情况下与口腔粘膜相接触,以便经由口腔粘膜放出在其中所包含的活性物质。
所述至少一个含活性物质的层具有至少一种肽类抗糖尿病药的含量。在施加所述膜状剂型的情况下,所述至少一个含活性物质的层与口腔粘膜相接触并粘附在口腔粘膜上。在所述至少一个含活性物质的层中所包含的肽类抗糖尿病药从所述至少一个含活性物质的层中经由口腔粘膜被放出到使用者的血液循环中。
术语“肽类抗糖尿病药”在本公开内容的范围内是指作为“抗糖尿病药”(即作为用于治疗糖尿病的活性物质)来说有效的肽。术语“肽类抗糖尿病药”包括胰岛素和胰岛素类似物,而且还包括肠降血糖素和肠降血糖素模拟物。
所述胰岛素优选地为人胰岛素,但是也可以使用猪胰岛素或牛胰岛素。所述胰岛素类似物包括短效型和速效型胰岛素类似物例如门冬胰岛素、赖脯胰岛素和格鲁辛胰岛素,但是也包括长效型胰岛素类似物例如地特胰岛素、甘精胰岛素、德谷胰岛素(insulindegludec)和低精蛋白胰岛素。
胰岛素是对于所有脊椎动物来说生命攸关的蛋白激素,其在胰腺的β-细胞中产生。胰岛素由两条肽链组成,即具有21个氨基酸的a-链和具有30个氨基酸的b-链,它们通过两个分子间二硫桥而共价连接(cys-a7与cys-b7,和cys-a20与cys-b19)。第三个分子内二硫桥连接a-链的位置6和11的半胱氨酸残基。
天然地,胰岛素被合成为前胰岛素原。前胰岛素原是具有110个氨基酸的多肽分子,其由下述部分组成:长度为24个氨基酸的信号序列,2个氨基酸残基,紧接其后的长度为30个氨基酸的b-链,随后的长度为31个氨基酸的c-肽,随后是两个另外的氨基酸残基和具有21个氨基酸的a-链。
通过形成三个二硫桥(两个在a-肽和b-肽之间,和一个在a-肽之内),前胰岛素原得以折叠。信号序列和c-肽被从经折叠的前肽原上裂解下来。在前胰岛素原穿过er的膜时,信号序列被裂解下来,由此产生胰岛素原。胰岛素原被接纳在高尔基体中并贮存在那里。在需要时,c-链被特异性蛋白酶裂解下来,从而所得的胰岛素达到其最终的结构。
猪胰岛素是来自猪的胰腺的经纯化的、天然的、具有抗糖尿病作用的物质。它具有与人胰岛素相同的结构,除了b-链的位置b30之外,在那里它具有丙氨酸而不是苏氨酸。
牛胰岛素(c254h377n65o75s6,mr=5734g/mol)是来自牛胰腺的经纯化的、天然的、具有抗糖尿病作用的物质。牛胰岛素与人胰岛素的差异在于三个氨基酸。
门冬胰岛素(c256h381n65o79s6,mr=5825.8g/mol)的一级结构与人胰岛素的一级结构是相同的,除了在b-链的位置28处为天冬氨酸(=天门冬氨酸,因此“门冬”)而不是脯氨酸外。该氨基酸的替换在皮下施用后导致更好地被吸收到血液中和更快地被去除。
赖脯胰岛素(c257h383n65o77s6,mr=5808g/mol)具有与人胰岛素相同的一级结构,除了在b-链的位置28和29处相互交换的氨基酸外。
格鲁辛胰岛素(c258h384n64o78s6,mr=5823g/mol)的一级结构与人胰岛素的一级结构是相同的,除了下面的例外:
在b-链的位置29处为谷氨酸而不是赖氨酸;
在b-链的位置3处为赖氨酸而不是天冬酰胺。
地特胰岛素(c267h402o76n64s6,mr=5916.9g/mol)具有与人胰岛素相同的一级结构,除了被去除的在b-链的位置b30处的苏氨酸和添加在位置b29处的赖氨酸上的肉豆蔻酸分子外。
甘精胰岛素(c267h404n72o78s6,mr=6063g/mol)具有与人胰岛素相同的一级结构,除了下面的例外:
a-链:在位置21处为甘氨酸而不是天冬酰胺;
b-链:另外在位置31和32处具有两个精氨酸。
德谷胰岛素具有与人胰岛素基本上相同的结构,除了下面的例外:
b-链的最后一个氨基酸(苏氨酸b30)被去除;
在赖氨酸b29上附着有谷氨酸和16-c-脂肪酸。
低精蛋白胰岛素(=nph-胰岛素)是与硫酸鱼精蛋白或另一种合适的鱼精蛋白相复合的胰岛素。鱼精蛋白是碱性的肽,其通过提取从鱼类(通常为鲑鱼或鲱鱼)的精子或卵中获得。低精蛋白胰岛素具有比通常的胰岛素更晚的作用开始和更长的作用持续时间,并且属于延迟型胰岛素。
肠降血糖素属于胃肠激素,其控制胰岛素从胰腺的β细胞中的食物依赖性分泌。肠降血糖素包括胰高血糖素样肽(glp-1)和葡萄糖依赖性胰岛素释放肽(gip)。
胰高血糖素样肽1是其氨基酸序列由胰高血糖素原基因决定的多肽。胰高血糖素样肽可以以两种不同的生物学活性形式存在,即具有由30个氨基酸组成的一级结构的glp-1-(7-37)和具有由31个氨基酸组成的一级结构的glp-1-(7-36)。除了其他作用外,胰高血糖素样肽1还刺激胰腺中的胰岛素合成,它降低胰高血糖素水平、延迟胃排空并抑制饥饿感和口渴感。
葡萄糖依赖性胰岛素释放肽实际上在十二指肠和空肠的k-细胞中产生。它是其一级结构由42个氨基酸组成的多肽。gip促进胰岛素从胰腺b-细胞中的释放。它抑制胃运动机能和胃液分泌。
肠降血糖素模拟物是降低血糖和抗糖尿病的活性物质,其作用相应于内生的肠降血糖素。肠降血糖素模拟物也被称为glp-1-激动剂、glp-1-类似物或glp-1-受体激动剂。适合于经粘膜施用的肠降血糖素模拟物包括艾塞那肽、利拉糖肽和利西那肽(lixisenatide)。
艾塞那肽是由39个氨基酸组成的合成肽。该物质最初来源于吉拉毒蜥(钝尾毒蜥(helodermasuspectum))的毒液。该天然肽被称为毒蜥外泌肽-4。艾塞那肽与胰高血糖素样肽-1(glp-1)这种肠降血糖素相近,并且具有53%的序列一致性。艾塞那肽具有比glp-1长得多的半寿期和作用持续时间,因为它不被二肽基肽酶-4(dpp-4)降解。
利拉糖肽或γ-l-谷氨酰基(n-α-十六烷酰基)-lys26,arg34-glp-1(7-37)是支化链肽。它是glp-1这种肠降血糖素的类似物。序列一致性为97%。lys34被arg替代,并且在lys26上通过glu-间隔子附着了c16-脂肪酸。通过这些修饰,可以将glp-1的半寿期(2分钟)延长至13小时。
利西那肽是由44个氨基酸组成的肽,并且是如艾塞那肽那样从毒蜥外泌肽-4开始开发出的glp-1类似物。利西那肽具有比天然底物glp-1更长的半寿期和更高的结合亲和力。然而,它具有比利拉糖肽短的半寿期。
根据一个另外的和/或备选的实施方案,所述至少一种肽类抗糖尿病药以相对于所述包含肽类抗糖尿病药的层的总重量而言至少5重量%,特别地至少5.6重量%,优选地至少10重量%,特别优选地至少12重量%,和十分特别优选地至少15重量%的量被包含在所述含活性物质的层中。优选地,所述肽类抗糖尿病药以相对于所述包含肽类抗糖尿病药的层的总重量而言不多于20重量%的量,特别优选地以相对于所述包含肽类抗糖尿病药的层的总重量而言不多于16重量%的量被包含在所述含活性物质的层中。根据一个另外的和/或备选的实施方案,所述至少一种肽类抗糖尿病药以相对于所述包含肽类抗糖尿病药的层的总重量而言大约20重量%的量被包含在所述含活性物质的层中。
所述至少一个含活性物质的层包含至少两种羟丙基甲基纤维素(第一羟丙基甲基纤维素和第二羟丙基甲基纤维素)的混合物,其中包含所述至少一种肽类抗糖尿病药。根据一个另外的和/或备选的实施方案,所述至少一个含活性物质的层包含三种羟丙基甲基纤维素(第一羟丙基甲基纤维素、第二羟丙基甲基纤维素和第三羟丙基甲基纤维素)。所述不同的羟丙基甲基纤维素在其粘度方面彼此不同。
根据一个另外的和/或备选的实施方案,所述第一羟丙基甲基纤维素为具有高粘度的羟丙基甲基纤维素。具有高粘度的羟丙基甲基纤维素是指具有在大约3,000mpa·s至大约5,600mpa·s的范围内的布鲁克菲尔德(brookfield)粘度的羟丙基甲基纤维素,所述布鲁克菲尔德粘度是在布鲁克菲尔德lv型粘度计中在20℃的温度下用在水中的2%溶液测量的。这样的羟丙基甲基纤维素也被称为hpmc4000。
根据一个另外的和/或备选的实施方案,所述第二羟丙基甲基纤维素为具有中等粘度的羟丙基甲基纤维素。具有中等粘度的羟丙基甲基纤维素是指具有在大约75mpa·s至大约140mpa·s的范围内的布鲁克菲尔德(brookfield)粘度的羟丙基甲基纤维素,所述布鲁克菲尔德粘度是在布鲁克菲尔德lv型粘度计中在20℃的温度下用在水中的2%溶液测量的。这样的羟丙基甲基纤维素也被称为hpmc100。
根据一个另外的和/或备选的实施方案,所述第三羟丙基甲基纤维素为具有低粘度的羟丙基甲基纤维素。具有低粘度的hpmc是指具有在大约3mpa·s的范围内的布鲁克菲尔德(brookfield)粘度的羟丙基甲基纤维素,所述布鲁克菲尔德粘度是在布鲁克菲尔德lv型粘度计中在20℃的温度下用在水中的2%溶液测量的。这样的羟丙基甲基纤维素也被称为hpmc3。
根据一个另外的和/或备选的实施方案,所述不同的羟丙基甲基纤维素以1:6-10:0-6(第一hpmc:第二hpmc:第三hpmc)的比例存在。在一个特别的实施方案中,第一hpmc:第二hpmc的比例为1:9。根据其他实施方案,第一hpmc:第二hpmc:第三hpmc的比例为1:6.46-6.52:4.07-5.18。根据另一个实施方案,第一hpmc:第二hpmc:第三hpmc的比例为大约1:7.31:4.5。
所述各种具有不同粘度的羟丙基甲基纤维素的组合(特别是以上述比例的)导致柔韧的膜,其粘附在口腔粘膜上并且不引起令人不快的异物感。
根据一个另外的和/或备选的实施方案,所述各种羟丙基甲基纤维素的混合物(各自相对于所述含活性物质的层的总重量而言)以至少49重量%,优选地至少55重量%,特别优选地至少58重量%和十分特别优选地至少60重量%的量被包含在所述至少一个含活性物质的层中。所述各种羟丙基甲基纤维素的混合物以不多于74重量%的量,优选地以不多于65重量%的量,特别优选地以不多于62重量%的量,和十分特别优选地以不多于61重量%的量被包含在所述至少一个含活性物质的层中。根据一个另外的和/或备选的实施方案,所述各种羟丙基甲基纤维素的混合物以大约51重量%的量被包含在所述至少一个含活性物质的层中。
根据一个另外的和/或备选的实施方案,所述至少一个含活性物质的层包含至少一种软化剂。所述至少一种软化剂提高所述膜状剂型的柔韧性,从而所述剂型可以更容易地紧贴在口腔粘膜的表面上并因此不引起令人不快的异物感。
所述至少一种软化剂可以选自包括下列各项的软化剂组:中链甘油三酯、甘油和柠檬酸酯,例如柠檬酸三乙酯。中链甘油三酯为包含中链脂肪酸残基的甘油三脂。中链脂肪酸残基具有长度为6至12个碳原子的碳链。
根据一个另外的和/或备选的实施方案,所述至少一种软化剂或所述软化剂以至少4重量%,优选地至少5重量%,特别优选地至少6重量%和十分特别优选地至少9重量%的量被包含在所述至少一个含活性物质的层中。所述至少一种软化剂或所述软化剂优选地以不多于20重量%的量,特别优选地以不多于16.5重量%的量,和十分特别优选地以不多于11重量%的量被包含在所述至少一个含活性物质的层中。根据一个另外的和/或备选的实施方案,所述至少一种软化剂或所述软化剂以大约16重量%的量被包含在所述至少一个含活性物质的层中。
根据一个另外的和/或备选的实施方案,所述至少一个含活性物质的层包含至少一种增强剂。所述至少一种增强剂改善活性物质穿过口腔粘膜的渗透性。
所述至少一种增强剂可以选自包括下列各项的组:β-环糊精、聚氧乙烯(23)十二烷基醚、肉豆蔻酸异丙酯、大豆卵磷脂、海藻糖和甘油、亚油酸、油酸、辛基十二烷醇、聚乙二醇和胆汁盐。
所述至少一种增强剂或全部所述增强剂可以以至少1重量%,优选地至少1.5重量%,特别优选地至少4重量%和十分特别优选地至少5重量%的量被包含在所述含活性物质的层中。所述至少一种增强剂或所述增强剂以不多于22重量%的量,优选地以不多于18重量%的量,特别优选地以不多于16重量%的量被包含在所述含活性物质的层中。根据一个另外的和/或备选的实施方案,所述至少一种增强剂或全部所述增强剂以大约16重量%的量被包含在所述至少一个含活性物质的层中。
根据一个另外的和/或备选的实施方案,所述至少一个含活性物质的层包含至少一种稳定剂。所述至少一种稳定剂改善所述活性物质在所述含活性物质的层中的稳定性,特别是在该膜状配制剂的贮存期间,并因此增加保存期。
所述至少一种稳定剂可以选自包括下列各项的组:β-环糊精、乙二胺四乙酸二钠、泊洛沙姆188和海藻糖。
所述至少一种稳定剂或全部所述稳定剂可以以至少0.1重量%,优选地至少1.4重量%,特别优选地至少3.5重量%的量被包含在所述含活性物质的层中。所述至少一种稳定剂或全部所述稳定剂以不多于23重量%,优选地不多于16重量%,特别优选地不多于11重量%,十分特别优选地不多于8重量%的量被包含。根据一个另外的和/或备选的实施方案,该稳定剂或全部所述稳定剂以2.5重量%的量被包含在所述至少一个含活性物质的层中。
根据一个另外的和/或备选的实施方案,所述至少一个含活性物质的层包含至少一种防腐剂。所述防腐剂改善该膜状配制剂的保存期,特别是在贮存期间。
所述至少一种防腐剂可以选自包括4-羟基苯甲酸甲酯的组。
所述至少一种防腐剂以大约0.1重量%的量被包含。
根据一个另外的和/或备选的实施方案,所述至少一个含活性物质的层包含至少一种染料。
所述染料可以选自包括二氧化钛和氧化铁的组。
所述染料优选地以至少0.1重量%,优选地至少0.5重量%,特别优选地至少1重量%的量,和优选地以不多于2重量%的量被包含。根据一个另外的和/或备选的实施方案,所述染料以大约0.5重量%的量被包含在所述至少一个含活性物质的层中。
根据一个另外的和/或备选的实施方案,所述至少一个含活性物质的层包含至少一种另外的在药学上可接受的助剂。所述至少一种另外的在药学上可接受的助剂可以为缓冲物质,例如磷酸盐缓冲物质或柠檬酸盐缓冲物质,na2hpo4,nah2po4,柠檬酸三钠,酸化剂例如盐酸或柠檬酸,和/或酸度调节剂例如氢氧化钠。
所述磷酸盐缓冲物质可以以直至大约4.5重量%的量被包含在所述至少一个含活性物质的层中。根据一个另外的和/或备选的实施方案,na2hpo4可以以直至大约1.0重量%的量被包含在所述至少一个含活性物质的层中。根据一个另外的和/或备选的实施方案,nah2po4可以以直至大约3.5重量%的量被包含在所述至少一个含活性物质的层中。
所述柠檬酸盐缓冲物质可以以直至11.7重量%的量被包含在所述至少一个含活性物质的层中。根据一个另外的和/或备选的实施方案,柠檬酸三钠可以以直至大约8.7重量%的量被包含在所述至少一个含活性物质的层中。根据一个另外的和/或备选的实施方案,柠檬酸可以以直至大约3.0重量%的量被包含在所述至少一个含活性物质的层中。根据一个另外的和/或备选的实施方案,柠檬酸三钠以大约5.8重量%的量和/或柠檬酸以大约3.0重量%的量被包含在所述至少一个含活性物质的层中。
所述酸度调节剂可以以直至大约1.0重量%的量被包含在所述至少一个含活性物质的层中。
根据一个另外的和/或备选的实施方案,所述至少一个含活性物质的层具有下述组成:
根据一个另外的和/或备选的实施方案,所述膜状剂型包含覆盖层。所述覆盖层被布置在所述含活性物质的层或由至少两个含活性物质的层组成的叠层体的两个面之一上,并且在将所述剂型正确施加在口腔粘膜上的情况下面向口腔。
所述膜状剂型的覆盖层是基本上无活性物质的,并且导致所述至少一种肽类抗糖尿病药向口腔粘膜的定向放出,因为它阻止在所述剂型中所包含的活性物质释放到口腔中。为此目的,所述覆盖层在唾液中是不可溶的,或者比所述含活性物质的层慢得多地在唾液中溶解或崩解。优选地,所述覆盖层对于在所述含活性物质的层中所包含的活性物质来说是基本上不可渗透的。
根据一个另外的和/或备选的实施方案,所述至少一个覆盖层包含有聚合物的含量,优选地乙基纤维素的含量,因为由乙基纤维素构成的聚合物膜是非常柔韧的。在所述覆盖层中聚合物(特别是乙基纤维素)的含量相对于所述覆盖层的总重量而言为至少50重量%,优选地至少55重量%,特别优选地至少60重量%,和十分特别优选地至少65重量%。在所述覆盖层中聚合物(特别是乙基纤维素)的含量相对于所述覆盖层的总重量而言为最大99重量%,优选地最大95重量%,特别优选地最大94重量%,和十分特别优选地最大93.5重量%。
根据一个特别的实施方案,所述乙基纤维素为具有在90至110mpa·s(cp)的范围内的粘度的乙基纤维素,所述粘度是用乌伯娄德(ubbelohde)粘度计在25℃下对于在由80体积%的甲苯和20体积%的乙醇组成的溶剂混合物中的5%溶液测量的。这样的乙基纤维素也被称为乙基纤维素100。
根据一个另外的和/或备选的实施方案,所述覆盖层包含至少一种软化剂。在所述覆盖层中软化剂的含量相对于所述覆盖层的总重量而言为优选地至少5重量%,特别优选地至少10重量%,和十分特别优选地至少15重量%。在所述覆盖层中软化剂的含量相对于所述覆盖层的总重量而言为优选地不多于34重量%,特别优选地不多于30重量%,和十分特别优选地不多于20重量%。
在所述覆盖层中的软化剂可以选自包括下列各项的组:中链甘油三酯、甘油和柠檬酸酯(例如柠檬酸三乙酯)。中链甘油三酯为包含中链脂肪酸的甘油三酯。中链脂肪酸包括具有有着6至12个c-原子的碳链的脂肪酸,例如己酸(c6:0)、辛酸(c8:0)、癸酸(c10:0)和月桂酸(c12:0)。
根据一个另外的和/或备选的实施方案,所述覆盖层具有染料。在所述覆盖层中染料的含量相对于所述覆盖层的总重量而言在大约0.5重量%和大约2重量%之间,优选地大约1重量%或大约1.5重量%。
所述染料可以选自由二氧化钛和氧化铁组成的组。
根据一个另外的和/或备选的实施方案,所述覆盖层和所述至少一个含活性物质的层在颜色方面彼此不同。由此,患者可以将所述含活性物质的层与所述覆盖层区分开来并且以正确的方向施加所述膜状剂型,从而所述覆盖层不是紧贴在口腔粘膜上,而是面向口腔。
根据第二个方面,本发明涉及用于制备上面所描述的膜状剂型的方法。
根据所述方法的一个实施方案,通过将用于含活性物质的层的组分溶解或悬浮在溶剂中来制备所述膜状剂型。将所得的粘性物料用合适的膜拉制装置(例如刮板)以规定的厚度涂覆在平面载体上。随后,使如此获得的活性物质条痕进行干燥。
所述方法包括下列步骤:
将用于含活性物质的层的组分溶解和/或悬浮在溶剂中;
将该溶液或悬浮液以规定的厚度涂覆在载体上;和
随后进行干燥。
根据一个实施方案,用于含活性物质的层的溶剂选自包括下列各项的组:乙醇、水以及由水和乙醇组成的混合物,特别是由大约96体积%的乙醇和大约4体积%的水组成的混合物(96%的乙醇)。根据一个另外的实施方案,所述由水和乙醇组成的混合物具有80%:20%(水:乙醇)的体积比。令人惊讶地,通过使用所述的由水和乙醇组成的混合物,关于胰岛素获得了比在使用水作为溶剂的情况下更好的从所得的膜状剂型中的活性物质渗透。
根据另一个实施方案,所述载体为平面载体,例如塑料薄膜,优选地聚对苯二甲酸乙二酯薄膜,预制的含活性物质的层,预制的覆盖层,预制的包含至少一个含活性物质的层的叠层体,或预制的包含覆盖层和至少一个含活性物质的层的叠层体。
根据一个实施方案,在不大于80℃的温度下,优选地在不大于50℃的温度下,特别优选地在大约50℃的温度下进行干燥。通过干燥,将溶剂从所述层中去除。通过相对低的干燥温度,确保了所述肽类抗糖尿病药在干燥期间不被破坏。
根据一个另外的和/或备选的实施方案,通过下述方式来将至少一个另外的含活性物质的层涂覆在已经经干燥的活性物质条痕上:将用于该另外的含活性物质的层的组分溶解和/或悬浮在溶剂中;将该溶液或悬浮液以规定的厚度涂覆在经干燥的活性物质条痕上;和使如此获得的另外的活性物质条痕进行干燥。就这点而言,在其上涂覆用于该另外的活性物质条痕的溶液或悬浮液的经干燥的活性物质条痕构成了平面载体。
优选地,为了制备所述另外的含活性物质的层,使用与为了制备第一含活性物质的层相同的溶剂。
优选地,在不大于80℃的温度下,优选地在不大于50℃的温度下,特别优选地在大约50℃的温度下进行所述另外的含活性物质的层的干燥。
根据一个另外的和/或备选的实施方案,为了制备具有覆盖层的根据本发明的膜状剂型,将用于覆盖层的组分溶解或悬浮在溶剂中。将如此获得的粘性物料用合适的膜拉制装置(例如刮板)涂覆在作为平面载体的最后的经干燥的活性物质条痕上,并且同样进行干燥。
在该实施方案中,所述用于制备所述膜状剂型的方法包括:
将用于覆盖层的组分溶解和/或悬浮在溶剂中,
将该用于覆盖层的溶液或悬浮液涂覆在最后的经干燥的活性物质条痕上,和
使所述覆盖层进行干燥。
根据一个实施方案,用于覆盖层的溶剂选自包括下列各项的组:水以及由水和乙醇组成的混合物。根据一个另外的实施方案,所述由水和乙醇组成的混合物具有80%:20%(水:乙醇)的体积比。根据一个备选的实施方案,所述用于覆盖层的溶剂为乙醇(96%的)。
根据一个实施方案,所述覆盖层在不大于80℃的温度下,优选地在不大于50℃的温度下,特别优选地在大约50℃的温度下进行干燥。通过干燥,将溶剂从所述层中去除。通过相对低的干燥温度,确保了所述肽类抗糖尿病药在干燥期间不被破坏。
根据一个备选的实施方案,为了制备具有覆盖层的根据本发明的膜状剂型,首先通过下述方式来制备覆盖层:将具有用于覆盖层的组分的溶液或悬浮液以规定的厚度涂布在平面载体(优选地塑料薄膜,特别优选地聚对苯二甲酸乙二酯薄膜)上,和使如此获得的材料条痕进行干燥。随后,将至少一个含活性物质的层以规定的厚度涂覆在作为用于该含活性物质的层的载体的预制的覆盖层上,并进行干燥。
对于该制备变化形式,将用于覆盖层的组分溶解或悬浮在溶剂中,优选地在水、乙醇或由水和乙醇组成的混合物,特别是由80体积%的水和20体积%的乙醇组成的混合物,或乙醇(96%的)中。将如此获得的粘性物料用合适的装置(例如刮板)以规定的厚度涂覆在载体,优选地塑料薄膜,例如聚对苯二甲酸乙二酯薄膜上。使如此获得的材料条痕进行干燥,优选地如上面所描述的那样。因为在该干燥中没有活性物质会被升高的干燥温度所不利地影响,因此也可能的是,在更高的温度下干燥所述用于覆盖层的材料条痕。由此,可以缩短干燥时间并总体加快制备方法。
在干燥后,将含活性物质的层涂覆在预制的覆盖层上。为此,将用于含活性物质的层的组分溶解或悬浮在溶剂中,优选地在水、乙醇或由水和乙醇组成的混合物中,特别是由80体积%的水和20体积%的乙醇组成的混合物,或乙醇(96%的)中。将所得的粘性的含活性物质的物料用合适的膜拉制装置(例如刮板)以规定的厚度涂覆在预制的覆盖层的未占用的面上。
随后,使如此获得的活性物质条痕进行干燥。根据一个实施方案,在不大于80℃的温度下,优选地在不大于50℃的温度下,特别优选地在大约50℃的温度下进行干燥。
因此,根据该实施方案的方法包括下列步骤:
将用于覆盖层的组分溶解和/或悬浮在溶剂中;
将该溶液以规定的厚度涂覆在平面载体上;
使所述覆盖层进行干燥;
将用于含活性物质的层的组分溶解或悬浮在溶剂中;
将该含活性物质的溶液涂覆在预制的覆盖层上;和
使如此获得的活性物质条痕进行干燥。
通过预制覆盖层和接着涂覆所述至少一个含活性物质的层来制备用于施用肽类抗糖尿病药的膜状剂型对于所述活性物质来说是更体贴的,因为所述肽类抗糖尿病药仅必须经历一个干燥阶段,并且可以避免所述活性物质受到覆盖层的干燥的进一步的不利影响。该对于所述活性物质来说更体贴的制备方法是有利的,因为在所述剂型中的活性物质的效力尽可能少地受到不利影响。
在另一个实施方案中,可以将至少一个另外的含活性物质的层涂覆在已经经干燥的且涂覆在预制的覆盖层上的活性物质条痕上,优选地如上面对于所述活性物质条痕和/或所述至少一个另外的活性物质条痕所描述的那样。
根据另一个的制备方法的实施方案,将由含活性物质的膜或所得的含活性物质的叠层体(其包含多个含活性物质的层或至少一个含活性物质的层和覆盖层)组成的剂型分开,例如通过切割或冲孔。随后,将经分开的剂型进行包装,优选地单个地进行包装。
根据另一个的制备方法的实施方案,将含活性物质的膜或所得的叠层体(其包含多个含活性物质的层或至少一个含活性物质的层和覆盖层)切割成一个或多个具有预先确定的宽度和长度的条带。将如此获得的含活性物质的条带作为卷式产品或以经对称折叠(leporello-folded)的方式进行包装。这样的包装工艺提供了优点,即患者自己可以依据个人需要撕下一段具有所需要的活性物质量的含活性物质的条带,从而他或她可以用以这种方式分开的剂型给自己施用按照其个人需要衡量的活性物质量。
根据一个另外的实施方案,所述具有预先确定的长度的条带具有标记,其涉及在该含活性物质的条带中预先确定的活性物质的量。优选地,在该含活性物质的条带上以相同的相互间距来布置所述标记。所述标记可以是线条、图案、穿孔、表面结构、凹痕、弱化区等。这样的标记使得使用者通过撕下包含所希望的活性物质量的节段来准确地分配活性物质的剂量变得容易。
根据一个另外的和/或备选的实施方案,将所述含活性物质的条带包装在供给器中。将所述含活性物质的条带包装在供给器中是有利的,因为在该实施方案中的含活性物质的条带可立即供患者使用,该含活性物质的条带本身不需要由患者进行操作(打开、填装供给器等),但是仍然以下述这样的形式存在,所述形式提供特别地对用户友好的使用,例如因为该供给器使得能够特别精确地分配剂量和/或特别容易地撕下所希望的节段。
备选地,也可以单个地包装所述含活性物质的条带,而不是包装在供给器中。在该实施方式中,经单个包装的含活性物质的条带可以用作用于相应的供给器的再填装包装物。
根据第三个方面,本发明涉及上面所描述的膜状剂型用于经粘膜施用肽类抗糖尿病药,特别是用于至少经由口腔粘膜来进行施用的用途。因此,本发明还涉及用于经由口腔粘膜来施用至少一种肽类抗糖尿病药的方法,以及涉及用于治疗需要施用肽类抗糖尿病药的患者的方法。
根据所述膜状剂型的用途或者更确切地说所述用于施用至少一种肽类抗糖尿病药的方法或者所述用于借助于该膜状剂型来治疗需要施用肽类抗糖尿病药的患者的方法的一个优选的实施方案,在牙龈的粘膜上进行该膜状剂型的施用(牙龈施用)。令人惊讶地,用于根据本发明的剂型的该施用位点经证明是特别有利的,特别是鉴于肽类抗糖尿病药经由粘膜的渗透。
根据一个实施方案,所述膜状剂型包含胰岛素或胰岛素类似物作为活性物质,并且被用于治疗糖尿病(1型糖尿病或2型糖尿病)。
经粘膜施用,特别是口部施用和随后的肽类抗糖尿病药经由口腔粘膜的吸收,对于使用者来说是特别舒适的。活性物质通过粘膜直接扩散入血流中,由此通常还避免了“首过”代谢。该施用方法容易施行,并因此也适合于具有残缺的视力和/或有限的协调能力的患者。
下面将借助于实施例和参考附图来阐明本发明。在此,实施例和附图均不限制所要求保护的发明,而是仅充当范例。
实施例1
将用于含活性物质的层的组分溶解在掺有0.141重量%的37%盐酸的水中,并用膜拉制装置涂覆在聚对苯二甲酸乙二酯薄膜上。随后,使该活性物质条痕在80℃的温度下进行干燥。
随后,用膜拉制装置将一个另外的活性物质条痕涂覆在上面所描述的含活性物质的层上。随后,使该叠层体在80℃的温度下进行干燥。从所得的膜冲压出具有4.11cm2的单剂量。
将在根据实施例9的体外渗透测试中用根据该实施例的膜状剂型可达到的渗透率以用-■-标示的曲线描绘在图1中。
实施例2
将用于含活性物质的层的组分溶解在由20重量%的乙醇和80重量%的水组成的溶剂混合物中,并用膜拉制装置涂覆在聚对苯二甲酸乙二酯薄膜上,并随后在50℃的温度下进行干燥。
含活性物质的层的组成:
将用于覆盖层的组分溶解在乙醇(96%的)中,并用膜拉制装置涂覆在上面所描述的含活性物质的层上。随后,使该叠层体在50℃的温度下进行干燥。
在所得的两层的膜的情况下,经干燥的覆盖层具有48.0g/m2的单位面积重量,和含活性物质的层具有114g/m2的单位面积重量。从所述膜冲压出具有4.11cm2的单剂量。
覆盖层的组成:
将在根据实施例9的体外渗透测试中用根据该实施例的膜状剂型可达到的渗透率以用-●-标示的曲线描绘在图1中。
实施例3
将用于含活性物质的层的组分溶解在由20重量%的乙醇和80重量%的水组成的溶剂混合物中,并用膜拉制装置涂覆在聚对苯二甲酸乙二酯薄膜上,并随后在50℃的温度下进行干燥。
含活性物质的层的组成:
将用于覆盖层的组分溶解在乙醇(96%的)中,并用膜拉制装置涂覆在上面所描述的含活性物质的层上。随后,使该叠层体在50℃的温度下进行干燥。
在所得的两层的膜的情况下,经干燥的覆盖层具有48.0g/m2的单位面积重量,和含活性物质的层具有114g/m2的单位面积重量。从所述膜冲压出具有4.11cm2的单剂量。
覆盖层的组成:
将在根据实施例9的体外渗透测试中用根据该实施例的膜状剂型可达到的渗透率以用-●-标示的曲线描绘在图2中。
实施例4
含活性物质的层的组成:
将用于含活性物质的层的组分溶解在由20重量%的乙醇和80重量%的水组成的溶剂混合物中,并用膜拉制装置涂覆在聚对苯二甲酸乙二酯薄膜上,并随后在50℃的温度下进行干燥。
覆盖层的组成:
将用于覆盖层的组分溶解在乙醇(96%的)中,并用膜拉制装置涂覆在上面所描述的含活性物质的层上。随后,使该叠层体在50℃的温度下进行干燥。
在所得的两层的膜的情况下,经干燥的覆盖层具有48.0g/m2的单位面积重量,和含活性物质的层具有114g/m2的单位面积重量。从所述膜冲压出具有4.11cm2的单剂量。
将在根据实施例9的体外渗透测试中用根据该实施例的膜状剂型可达到的渗透率以用-◆-标示的曲线描绘在图2中。
实施例5
将用于含活性物质的层的组分溶解在由20重量%的乙醇和80重量%的水组成的溶剂混合物中,并用膜拉制装置涂覆在聚对苯二甲酸乙二酯薄膜上,并随后在50℃的温度下进行干燥。
含活性物质的层的组成:
将用于覆盖层的组分溶解在乙醇(96%的)中,并用膜拉制装置涂覆在上面所描述的含活性物质的层上。随后,使该叠层体在50℃的温度下进行干燥。
覆盖层的组成:
在所得的两层的膜的情况下,经干燥的覆盖层具有48.0g/m2的单位面积重量,和含活性物质的层具有114g/m2的单位面积重量。从所述膜冲压出具有4.11cm2的单剂量。
将在根据实施例9的体外渗透测试中用根据该实施例的膜状剂型可达到的渗透率以用-▲-标示的曲线描绘在图2中。
实施例6
将用于覆盖层的组分溶解在乙醇(96%的)中,用膜拉制装置涂覆在聚对苯二甲酸乙二酯薄膜上,并随后在50℃的温度下进行干燥。
覆盖层的组成:
将用于含活性物质的层的组分溶解在由20重量%的乙醇和80重量%的水组成的溶剂混合物中,并用膜拉制装置涂覆在聚对苯二甲酸乙二酯薄膜上,并随后在50℃的温度下进行干燥。
含活性物质的层的组成:
在所得的两层的膜的情况下,经干燥的覆盖层具有48.0g/m2的单位面积重量,和含活性物质的层具有114g/m2的单位面积重量。从所述膜冲压出具有4.11cm2的单剂量。
将在根据实施例9的体外渗透测试中用根据该实施例的膜状剂型可达到的渗透率以图解方式描绘在图3中。
实施例7
将用于覆盖层的组分溶解在乙醇(96%的)中,并用膜拉制装置涂覆在上面所描述的含活性物质的层上。随后,使该叠层体在50℃的温度下进行干燥。
覆盖层的组成:
将用于含活性物质的层的组分溶解在由20重量%的乙醇和80重量%的水组成的溶剂混合物中,并用膜拉制装置涂覆在聚对苯二甲酸乙二酯薄膜上,并随后在50℃的温度下进行干燥。
含活性物质的层的组成:
在所得的两层的膜的情况下,经干燥的覆盖层具有48.0g/m2的单位面积重量,和含活性物质的层具有114g/m2的单位面积重量。从所述膜冲压出具有4.11cm2的单剂量。
将在根据实施例9的体外渗透测试中用根据该实施例的膜状剂型可达到的渗透率以图解方式描绘在图4中。
实施例8
将用于覆盖层的组分溶解在乙醇(96%的)中,并用膜拉制装置涂覆在上面所描述的含活性物质的层上。随后,使该叠层体在50℃的温度下进行干燥。
覆盖层的组成:
将用于含活性物质的层的组分溶解在由20重量%的乙醇和80重量%的水组成的溶剂混合物中,并用膜拉制装置涂覆在聚对苯二甲酸乙二酯薄膜上,并随后在50℃的温度下进行干燥。
在所得的两层的膜的情况下,经干燥的覆盖层具有48.0g/m2的单位面积重量,和含活性物质的层具有114g/m2的单位面积重量。从所述膜冲压出具有4.11cm2的单剂量。
含活性物质的层的组成:
将在根据实施例9的体外渗透测试中用根据该实施例的膜状剂型可达到的渗透率以图解方式描绘在图5中。
实施例9:胰岛素/胰岛素类似物的渗透的体外测定
借助于使用skinethic公司(lyon,fr)的关于人口腔上皮的模型的体外模型,研究了胰岛素或胰岛素类似物的释放和经粘膜渗透。在该模型中,将细胞系tr146的人角质形成细胞在聚碳酸酯过滤器上进行培养,从而在化学成分确知的培养基中在与空气的液体界面上形成上皮组织,其不具有角质层并因此至少在组织学上相应于口腔粘膜。
将单个的、具有模型组织的聚碳酸酯滤过滤器的放入扩散室中,以便将供者区室和接受者区室相互分隔开,其中使所述上皮朝向供者区室的内腔。将膜状剂型施加在所述上皮上,并且以预先设定的时间间隔测定在接受者区室中的活性物质的含量。将关于在实施例1至4中所描述的配制剂的结果以图解方式描绘在图1和2中。
- 还没有人留言评论。精彩留言会获得点赞!