缓释丁丙诺啡微球(SRBM)及其使用方法与流程
本申请要求2016年2月23日提交的美国临时申请no.62/298,777的优先权,其全部内容通过参考引入本文。
背景技术:
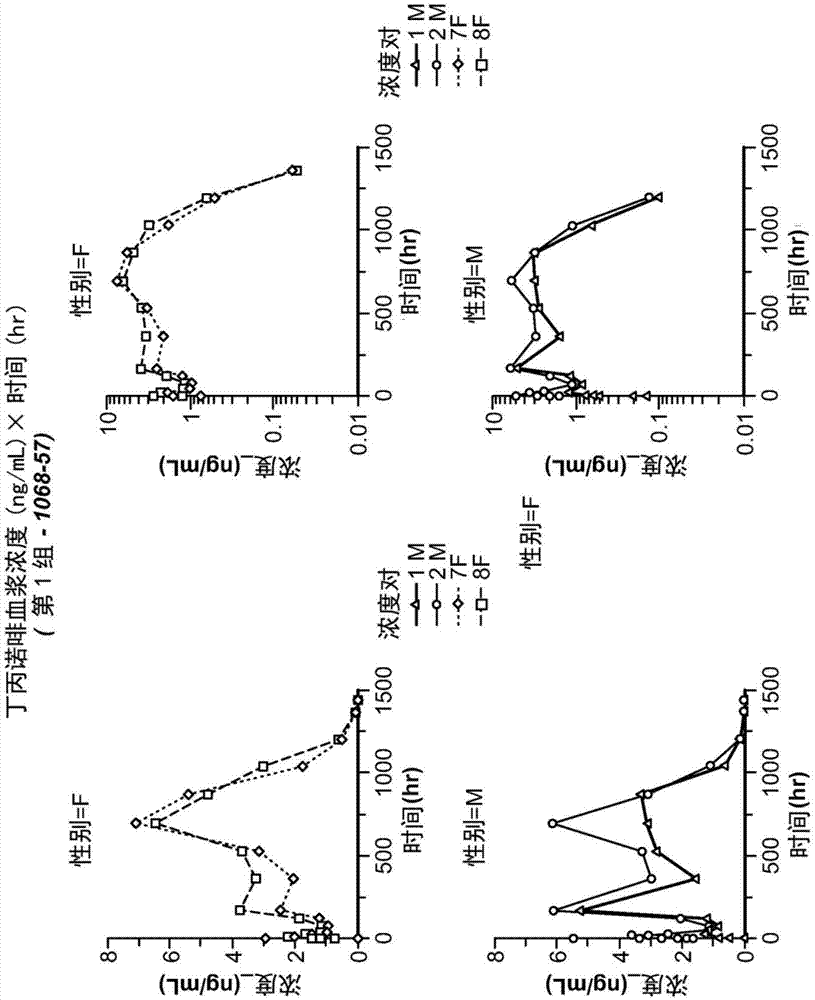
丁丙诺啡在数种商品名下销售,其中一种为用于阿片样物质依赖的维持治疗。盐酸丁丙诺啡的分子式为c29h41no4hcl,并且分子量为504.10。其为白色或灰白色结晶粉末,微溶于水,易溶于甲醇,溶于乙醇,并且几乎不溶于环己烷。丁丙诺啡已经用于治疗阿片样物质依赖和疼痛。存在可用的片剂制剂、舌下口腔膜(sublingualoralfilm)和口腔含化膜(buccalfilm)制剂以及7天透皮贴剂。口服制剂被批准用于每天给药一次或两次,但是在一些情况下可以每天给药三次,并且透皮贴剂由于可变的药物代谢动力学而经常不提供7天的疼痛控制。因此,存在对给予具有短期和长期稳定的释放动力学的丁丙诺啡的方法的需求。技术实现要素:本文中提供的是使用提供治疗水平的药物活性剂长达30天以上的缓释制剂治疗阿片样物质依赖和/或疼痛的方法。在一个实施方案中,在给药后即刻和第一个12小时,没有释放出实质性的突释的药物活性剂。本文中提供的是用于在受试者中治疗阿片样物质依赖和/或疼痛的方法,其包括给予治疗有效量的缓释丁丙诺啡微球(srbm)制剂,其中所述制剂包含丁丙诺啡和mw为24,000-38,000的聚(d,l-丙交酯-共-乙交酯),其中血浆浓度在给药后12小时内不超过10ng/ml。在某些实施方案中,所述血浆浓度在给药后12小时内不超过8ng/ml。在某些实施方案中,所述血浆浓度在给药后12小时内不超过7.5ng/ml。在某些实施方案中,所述血浆浓度在给药后12小时内不超过约5ng/ml至约8ng/ml。本文中提供的是用于在受试者中治疗阿片样物质依赖和/或疼痛的方法,其包括给予治疗有效量的缓释丁丙诺啡微球(srbm)制剂,其中所述制剂包含:丁丙诺啡和mw为7,000-17,000的聚(d,l-丙交酯-共-乙交酯),其中丁丙诺啡的血浆浓度在给药后12小时内不超过10ng/ml。本文中提供的是用于在受试者中治疗阿片样物质依赖和/或疼痛的方法,其包括给予治疗有效量的缓释丁丙诺啡微球(srbm)制剂,其中所述srbm制剂包含:丁丙诺啡、mw为24,000-38,000的聚(d,l-丙交酯-共-乙交酯)和mw为7,000-17,000的聚(d,l-丙交酯-共-乙交酯)。在一个实施方案中,丁丙诺啡的血浆浓度在给药后12小时内不超过10ng/ml。在一个实施方案中,srbm制剂进一步包含聚乙烯醇。在一个实施方案中,srbm制剂进一步包含乙酸乙酯。在一个实施方案中,疼痛为慢性疼痛。在一个实施方案中,疼痛为阿片样物质依赖的受试者中的慢性疼痛。在一个实施方案中,丁丙诺啡的血浆浓度在31天中的27天基本上保持在治疗范围内。在一个实施方案中,丁丙诺啡的血浆浓度基本上保持在治疗范围内大于28天。在一个实施方案中,治疗范围包括约1ng/ml至约8ng/ml。在一个实施方案中,对于阿片样物质依赖的治疗,治疗范围包括约1ng/ml至约8ng/ml。在一个实施方案中,对于疼痛的治疗,治疗范围包括约1ng/ml至约5ng/ml。对于在阿片样物质依赖的受试者中的疼痛的治疗,治疗范围包括约1ng/ml至约8ng/ml。在一个实施方案中,其中组合物srbm制剂包含约1毫克至约600毫克的丁丙诺啡。在一个实施方案中,丁丙诺啡为游离碱的形式或药学上可接受的盐的形式。在一个实施方案中,srbm制剂给药后,丁丙诺啡的血浆浓度基本上保持在治疗范围内7天。在一个实施方案中,srbm制剂给药后,丁丙诺啡的血浆浓度基本上保持在治疗范围内3至7天。在一个实施方案中,所述方法包括将srbm制剂通过注射约每7天一次给予受试者。在一个实施方案中,所述方法包括将srbm制剂通过注射约每30天一次给予受试者。在一个实施方案中,所述方法包括将srbm制剂通过注射约每60天一次给予受试者。在一个实施方案中,所述方法包括将srbm制剂通过注射约每120天一次给予受试者。在一个实施方案中,所述方法包括将srbm制剂通过注射约每180个月一次给予受试者。在一个实施方案中,在给药至受试者之后,srbm制剂具有持续30天的基本上线性的释放特征。在一个实施方案中,在给药后至少约15天、30天、45天、60天、90天、120天或180天第二次给予治疗有效剂量的srbm制剂。在一个实施方案中,第二次给药将具有与受试者的来自先前给药的血浆浓度相加的突释。在一个实施方案中,在给予第二剂量时,突释超过受试者的血浆浓度小于10ng/ml。在一个实施方案中,在给予第二剂量时,突释超过受试者的血浆浓度小于9ng/ml。在一个实施方案中,在给予第二剂量时,突释超过受试者的血浆浓度小于8ng/ml。在一个实施方案中,在给予第二剂量时,突释超过受试者的血浆浓度小于7ng/ml。在一个实施方案中,在给予第二剂量时,突释超过受试者的血浆浓度小于6ng/ml。在一个实施方案中,在给予第二剂量时,突释超过受试者的血浆浓度约3.5ng/ml与约10ng/ml之间。在一个实施方案中,在给予第二剂量时,突释超过受试者的血浆浓度约4ng/ml至约10ng/ml之间。在一个实施方案中,给药为使用在约23号至约27号之间的针头的皮下注射。在一个实施方案中,给药为使用27号针头的皮下注射。在一个实施方案中,给药为使用26号针头的皮下注射。在一个实施方案中,给药为使用25号针头的皮下注射。在一个实施方案中,给药为使用24号针头的皮下注射。在一个实施方案中,给药为使用23号针头的皮下注射。在一个实施方案中,丁丙诺啡的血浆浓度在给药后第一小时内小于10ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度在给药后第一个12小时内不超过约9ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度在给药后第一个12小时内不超过约8ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度在给药后第一个12小时内不超过约7.5ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度在给药后第一个12小时内不超过约7ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度在给药后第一个12小时内不超过约6.5ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度在给药后第一个12小时内不超过约6ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度在给药后第一个12小时内不超过约5.5ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度在给药后第一个12小时内不超过约5ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度在给药后1至12小时期间从最低浓度至所达到的最高浓度变化不超过10ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度从给药后30分钟至约12小时从最低浓度至所达到的最高浓度变化不超过10ng/ml。在一个实施方案中,丁丙诺啡的血浆浓度在给药后第2天至第30天之间保持接近或基本上接近治疗水平。在一个实施方案中,丁丙诺啡的血浆浓度在给药后约第2天至第30天之间保持在基本治疗水平。在一个实施方案中,丁丙诺啡的血浆浓度在给药后约12小时至约第35天之间保持在基本治疗水平。在一个实施方案中,丁丙诺啡的血浆浓度在给药后约第5天至约第40天之间保持在基本治疗水平。在一个实施方案中,丁丙诺啡的血浆浓度在给药后约第2天至约第30天、或约第40天、或约第60天、或约第120天、或约第180天之间保持在基本治疗水平。在一个实施方案中,丁丙诺啡的血浆浓度在给药后约12小时至约第30天、或约第40天、或约第60天、或约第120天、或约第180天之间保持在基本治疗水平。在一个实施方案中,治疗水平包括约1ng/ml至约8ng/ml。在一个实施方案中,对于阿片样物质依赖的治疗,治疗水平包括约1ng/ml至约8ng/ml。在一个实施方案中,对于疼痛的治疗,治疗水平包括约1ng/ml至约5ng/ml。在一个实施方案中,对于在阿片样物质依赖的受试者中的疼痛的治疗,治疗水平包括约1ng/ml至约8ng/ml。在一个实施方案中,cmax不超过10ng/ml、9ng/ml、8ng/ml、7ng/ml、6.25ng/ml、6ng/ml、5.75ng/ml、5.5ng/ml、5.25ng/ml、5ng/ml、4.75ng/ml、4ng/ml、3ng/ml、或2ng/ml。在一个实施方案中,srbm制剂包含直径在约12μm至约100μm之间的颗粒。在一个实施方案中,srbm制剂包含直径在约15μm至约80μm之间的颗粒。在一个实施方案中,srbm制剂包含颗粒,其中大多数所述颗粒的直径在约20μm与约40μm之间。在以下公开其它实施方案。附图说明图1示出丁丙诺啡血浆浓度(ng/ml)×时间(hr)(第1组-1068-57)。图2示出丁丙诺啡血浆浓度(ng/ml)×时间(hr)(第2组-1068-60)。图3示出丁丙诺啡血浆浓度(ng/ml)×时间(hr)(第3组-1068-78)。图4示出丁丙诺啡血浆浓度(ng/ml)×时间(hr):第1组、第2组和第3组的组合性别(线性标度)。图5示出丁丙诺啡血浆浓度(ng/ml)×时间(hr):第1组、第2组和第3组的组合性别(对数标度)。图6示出给药后丁丙诺啡储库注射显示稳定的释放动力学和接近治疗目标水平的稳定的血浆水平约35天。图7示出在哥廷根小型猪(gottingenminipig)中单剂量srbm制剂给药之后血浆丁丙诺啡浓度对时间的曲线。图8示出在给予第一剂量时srbm制剂的24h突释效应。图9示出srbm制剂的粒径分布。图10示出在27号针头中的srbm制剂。具体实施方式本文中描述的是使用如由以下研究所证实具有缓释特征的制剂治疗受试者的阿片样物质依赖和/或疼痛的方法,所述研究为在雄性和雌性哥廷根小型猪中单次给予缓释丁丙诺啡储库微球(srbm)的两剂3mg/kg皮下注射之后评价血浆丁丙诺啡及其主要代谢物去甲丁丙诺啡的药物代谢动力学(pk)长达60天的研究。缩写列表:auc0-inf(hr*ng/ml)在外推终末相(terminalphase)的情况下从零时刻至∞的浓度-时间曲线下面积auc0-last(hr*ng/ml)从0时刻至最后一个可定量的血浆浓度水平的时刻的血浆浓度-时间曲线下面积外推的auc%从最后一个分析上可定量的浓度的时刻外推至∞的浓度-时间曲线下面积占总auc的%blq低于定量下限。是指低于定量下限的分析物浓度,即,低于标准曲线上的最低校准标准。bup丁丙诺啡cmax/d通过剂量水平归一化的cmaxclast(ng/ml)超过loq的最后一个分析上可定量的血浆或血清浓度cl_fobs(ml/hr/kg)给药后药物的表观总血浆或血清清除率lloq定量下限。标准曲线上的最低校准标准mv缺失值n数量nobs观察数量norbup去甲丁丙诺啡srbm缓释丁丙诺啡微球uloq定量上限。标准曲线上的最高校准标准本文中所述的剂型和制剂可以通过例如以下记载于如下文献中的方法中的一种或多种来制得:us6,495,155;us8,916,196;us8,703,843;us2010-0069602a1;us2010-0189800a1;us2013-0059008a1;us2012-0178629a1;us2011-0204533a1;us2015-0072928a1和us2012-0082731a1,其均以其整体通过参考引入本文。可以通过如以其整体通过参考引入本文的美国专利no.5,407,609中记载的方法来制备微粒。在一个实施方案中,对于人类受试者,对于20天至约40天剂量,给药剂量将为约60mg至240mg。作为参考,约240mg剂量的srbm将对应于每日服用16-24mg的口腔膜或口腔舌下片制剂的受试者。在另一实施方案中,约180mg剂量的srbm将对应于服用12-16mg的口腔膜或口腔舌下片的受试者。在另一实施方案中,180mg剂量的srbm将对应于服用8-12mg剂量的口腔膜或口腔舌下片制剂的受试者。在另一实施方案中,60mg剂量的srbm将对应于服用4-8mg日剂量的口腔膜或口腔舌下片的受试者。赋形剂、释放调节剂、增塑剂、成孔剂(poreformingagent)、凝胶化液体、非活性填充剂(extender)和其它成分也可以包括在丁丙诺啡缓释递送系统中。在给予可流动的组合物时,这些附加成分中的一些,如凝胶化液体和释放调节剂,应当保留在植入物中,而其它附加成分如成孔剂应当分开与有机液体一起分散和/或扩散。示例性制剂包括例如丁丙诺啡游离碱、盐酸丁丙诺啡、或其代谢物或衍生物;由例如resomerrg503h、resomerrg502h、mw为24,000-38,000或mw为7,000-17,000的聚(d,l-丙交酯-共-乙交酯)或聚(d,l-丙交酯)中的一种或多种、聚乙烯醇、乙酸乙酯或另一药学上可接受的溶剂、以及水制成的微球。用于制造微球的聚(d,l-丙交酯-共-乙交酯)可以是酸封端的。聚(d,l-丙交酯-共-乙交酯)中的丙交酯:乙交酯可以为50:50。聚(d,l-丙交酯-共-乙交酯)的mw可以为24,000-38,000或mw可以为7,000-17,000。可以使用聚(d,l-丙交酯-共-乙交酯)的混合物。比例可以为例如mw24,000-38,000:mw7,000-17,000为1:99或99:1。在一个实施方案中,具有mw24,000-38,000的聚(d,l-丙交酯-共-乙交酯):具有mw7,000-17,000的聚(d,l-丙交酯-共-乙交酯)的比例可以为1:1、0:1、1:0、或其间的任何比例。在合适的溶媒中配制微粒,示例性溶媒制剂可以在随后的实施例中找到。对于单剂量,丁丙诺啡游离碱、盐酸丁丙诺啡、或其代谢物或衍生物可以为约10mg至1g。制剂可以进一步包含纳曲酮,其范围可以为约150mg至300mg。如在实施例中例示的,溶媒可以为无菌水、磷酸盐缓冲盐水或其它溶媒,用于给予微粒。可以存在添加剂从而改善微粒的悬浮性、减缓微粒沉降、并且减少来自注射的不适。甘露醇可以以溶媒的约2重量%至10重量%存在。其它生理上可接受的添加剂可以包括:非离子洗涤剂例如吐温,其可以以溶媒的约0重量%至约0.05-0.2重量%存在;在溶媒的约0.1重量%至1重量%的范围内的增粘剂例如羧甲基纤维素;和其它添加剂,视情况而定。溶媒的量一般将在约1ml至5ml、通常1ml至3.5ml的范围内。在临用前将微粒分散在溶媒中。可以将无菌微粒保存在具有隔膜的无菌小瓶中,其中可以将微粒与溶媒混合然后抽吸至注射器中。可以通过作为基于乳剂的方法的方法来制备微粒,所述方法包括制备包含水性连续相(水和表面活性剂和/或增稠剂)和疏水相(聚合物溶剂、聚合物和药物)的乳剂。在形成乳剂之后,将聚合物溶剂萃取至水性萃取相中。在萃取了足够量的聚合物溶剂以使微粒硬化之后,将微粒收集在筛网上并洗涤,从而除去残留在微粒的表面上的任何表面活性剂。然后将微粒用氮气流干燥较长时间,例如约12小时,然后在室温下在真空烘箱中干燥直至至少基本上干燥,通常为约3天。使用用于不同的液流(stream)的存储容器、管、三通阀和均化器,组装微粒制造系统。将有机溶液导入连接至三通阀的第一管中,所述三通阀连接至水性连续相并且连接至均化器。通过控制两种液流进入连接均化器的线路中的流速,可以控制两种液流的比例以及在均化器中的停留时间。来自均化器的流出物通过连接至三通阀的线路流出,通过所述三通阀引入水流。流速比控制进入均化器流出物液流的水的量。通过管的长度和合并液流的流速控制水萃取步骤的停留时间。然后通过经过两个以上的将在期望范围之外的微粒排除的筛网按尺寸将微粒分离。为了制备微粒,分散相可以包含例如分散或溶解(下文中,当将在溶剂中的聚合物称为分散时,这两者都包括在内)在例如如乙酸乙酯等溶剂中的约1重量%至10重量%的药物和约20重量%的聚合物。连续相为约1重量%至10重量%的聚(乙烯醇)的水溶液并且以1重量%至7.5重量%包含乙酸乙酯。萃取相可以为水或另一溶剂。药物的量可以超过微粒中的最终的药物约10重量%至50重量%。温度可以为环境温度,例如,约15℃至30℃。在收集并干燥微粒之后,可以将它们保存在环境温度下,特别是在约0℃至20℃的范围内、在没有氧和水的环境中,或者将它们分成等分试样放入合适的容器中并灭菌。可以采用各种灭菌方法,γ辐射是方便的。可以通过肌内注射或皮下注射给予srbm制剂。将药学有效量的制剂直接注射至药学上可接受的部位例如臀肌中。此后,可以监测受试者的药物血浆浓度从而确保所述量在治疗范围内。当药物血浆浓度降低到低于治疗范围时,可以进行后续注射并且在治疗期间重复该过程。治疗期可以为1-5天、15天、30天、45天、60天、90天、120天、180天、1-30天、1-60天、1-90天、1-120天、或1-180天。本文中公开的srbm的制剂是可用注射器注射的,例如,粒径和颗粒分布在图9中示出。这使得srbm制剂能够以在23号与27号之间的针头给药。在一个实施方案中,制剂以27号针头给药。在另一实施方案中,制剂以26号针头给药。在另一实施方案中,制剂以25号针头给药。在另一实施方案中,制剂以24号针头给药。在另一实施方案中,制剂以23号针头给药。在一个实施方案中,制剂用于约30天的阿片样物质依赖的治疗。例如,制剂将具有在约5ng/ml至约10ng/ml之间的cmax和约大于1ng/ml的ctrough。在一个实施方案中,制剂用于约30天的阿片样物质依赖的受试者中疼痛的治疗。例如,制剂将具有约2ng/ml至约3ng/ml的cmax和约大于0.25ng/ml的ctrough。在一个实施方案中,制剂用于约30天的受试者中慢性疼痛的治疗。例如,制剂将具有约2ng/ml至约3ng/ml的cmax和约大于0.25ng/ml的ctrough。例如用于治疗阿片样物质依赖、阿片样物质依赖的受试者中的疼痛和/或用于慢性疼痛的这些制剂中的每一种具有受到良好控制的24h释放并且在给药之后也具有极小的突释。在一个实施方案中,阿片样物质依赖的治疗用于阿片样物质依赖的维持治疗。在另一实施方案中,阿片样物质依赖的治疗用于开始阿片样物质依赖的治疗。可以将制剂包装在例如预充式注射器中或小瓶中。可以将小瓶干燥从而重构或者其可以为液体制剂。例如,可以在医师的办公室由医疗专业人员或者由受试者或另一个人来给予制剂。例如,为了在注射部位减少反应或刺激,制剂具有小的注射体积。体积为约0.25ml至约2.5ml。例如,注射的体积可以为约小于或等于1.5ml。制剂将保存在例如室温或冷藏下或者在其间的某一温度下。在一个实施方案中,第二次给药将具有与受试者的来自先前给药的血浆浓度相加的突释。在一个实施方案中,在给予第二剂量时,突释超过受试者的血浆浓度小于10mg/ml。在一个实施方案中,在给予第二剂量时,突释超过受试者的血浆浓度约4ng/ml至约10mg/ml之间。如本文中所使用的,突释包括来自缓释产品的活性药物成分的初始吸收,所述初始吸收高于将在稳态下释放的剂量。突释还包括药物的初始快速释放,其随后平稳至治疗水平或接近治疗水平。本文中所述的制剂使突释效应最小化。本文中所述的制剂避免了在给药时释放的毒性水平。制剂还避免了突释效应的副作用如恶心和/或呕吐。第一次给药的突释(假设在第一剂量前未服用丁丙诺啡或者所有先前给予的丁丙诺啡均不再存在或不再可检测到)可以例如通过测量血液水平来确定。在第二次和后续的剂量或剂量暴露时,在之前的剂量间隔结束时将存在现有浓度。突释将例如为血浆浓度从该点增加的量。本文中所述的srbm制剂包含直径在约15μm至约80μm之间的颗粒。在一个实施方案中,颗粒的直径在约12μm至约100μm之间。在一个实施方案中,大多数颗粒的直径在约20μm与约40μm之间。实施例这部分毒理学研究的目的在于在雄性和雌性哥廷根小型猪中在第1天单次给予缓释丁丙诺啡储库微球(srbm)的两剂3mg/kg皮下注射之后评价血浆丁丙诺啡及其主要代谢物去甲丁丙诺啡的药物代谢动力学(pk)长达60天。评价和比较了srbm的三种(3)不同制剂的pk。在0时刻(给药前)和在给药后0.5、1、1.5、2、3、4、6、8、12和24小时采集血液样品。还在给药后48、72、120和168小时以及此后约每周一次采集血液样品,用于研究的其余部分。评价了丁丙诺啡的血浆浓度×时间数据。对于cmax值,与第2组制剂1068-60(25.0-32.5ng/ml)和第3组制剂1068-78(8.8-32.5ng/ml)相比,第1组制剂1068-57(5.3-7.1ng/ml)明显更低。对于tmax值,与第2组制剂1067-60和第3组制剂1067-78(120-168hr)相比,第1组制剂1067-58(168-696hr)更大。考虑到各组中的变异量,当将第1组、第2组和第3组进行比较时,丁丙诺啡的总暴露量(auc0-inf)是相似的。虽然在将3个组进行比较时丁丙诺啡的总暴露量是相似的,但是在将第1组与第2组和第3组进行比较时,血浆浓度×时间曲线的形状差异很大。与第2组和第3组相比,第1组的cmax值低得多并且tmax值更长。对于丁丙诺啡的终末消除半衰期,与第2组制剂1068-60(59-270hr)和第3组制剂1068-78(78-186hr)相比,第1组制剂1068-57(57-79hr)最低并且变异最小。所有3个组的可定量的血浆去甲丁丙诺啡浓度的暴露量均低(从低于定量下限(lloq)至比0.05ng/ml的lloq高约7倍),然而,当与第2组制剂1068-60和第3组制剂1068-78进行比较时,第1组制剂1068-57的血浆浓度最小。研究由三个处理组组成,其中2只动物/性别/组。动物在第1天接受两剂3mg/kg皮下注射(总共6mg/kg),接着是至少60天的观察和定期的血液采集,从而评价丁丙诺啡及其主要代谢物去甲丁丙诺啡的pk。研究设计总结在以下的表中:表1.研究设计溶媒:溶媒为液体并且以所提供的形式使用。溶媒包含na-cmc(5mg)、d-甘露醇(50mg)、吐温80(1mg)和wfi(注射用水;1g)。试验材料:试验材料为缓释微球(srbm)并且以三种制剂来提供。将试验材料重新悬浮在溶媒中(在给药当天)从而达到各试验材料的浓度30mg/ml。动物接受以下srbm制剂中的一种的两剂(2)皮下3mg/kg注射:30mg/ml1068-57、30mg/ml1068-60和30mg/ml1068-78,当以0.1ml/kg/注射部位(2个注射部位)的剂量体积给药时,相当于6mg/kgsrbm的总剂量。表2:srbm制剂表3:用于重构的溶媒的组分和组成组分量组成(%)羧甲基纤维素钠nf5mg0.5d-甘露醇nf50mg5吐温801mg0.1注射用水1g冰醋酸根据需要na药物代谢动力学(pk)在各样品时间点采集全血。制备血液样品用于分析。phoenix版本6.3(pharsightcorporation,mountainview,ca)用于评价血浆丁丙诺啡pk参数。没有足够水平的血浆去甲丁丙诺啡来进行该代谢物的pk评价。采用名义(norminal)剂量水平和血液采集时间用于丁丙诺啡的pk评价。将低于定量下限(0.05ng/ml)的血浆丁丙诺啡浓度指定为0值。进行在6mg/kg的制剂1068-57(第1组)、1068-60(第2组)和1068-78(第3组)的单次皮下注射之后丁丙诺啡pk参数的比较(表4-6和图1-5)。对于cmax值,与第2组制剂1068-60(25.0-32.5ng/ml)和第3组制剂1068-78(8.8-32.5ng/ml)相比,第1组制剂1068-57(5.3-7.1ng/ml)明显更低。在第1组和第2组中,在cmax值方面不存在明显的与性别相关的差异。对于tmax值,与第2组制剂1067-60和第3组制剂1067-78(120-168hr)相比,第1组制剂1067-58(168-696hr)更大。对于第2组和第3组,在tmax值方面不存在明显的与性别相关的差异。tlast值对于第2组制剂1068-60(528-1440hr)是可变的。第3组制剂1068-78的tlast值也是可变的,范围为696-1440hr。第1组制剂1068-57的tlast值变化最小,范围为1200-1368hr。考虑到各组中的变异量,当将第1组、第2组和第3组进行比较时,丁丙诺啡的总暴露量(auc0-inf)是相似的。对于第1组制剂1068-57,该值的范围为2613-4300hr*ng/ml,对于第2组制剂1068-60,该值的范围为3457-4789hr*ng/ml,并且对于第3组制剂1068-78,该值的范围为3281-5104hr*ng/ml。虽然在将3个组进行比较时丁丙诺啡的总暴露量似乎是相似的,但是在将第1组与第2组和第3组进行比较时,血浆浓度×时间曲线的形状是不同的。与第2组和第3组相比,第1组的cmax值低得多并且tmax值更长。考虑到各组中的变异性,对于第1-3组,清除率值(cl_fobs)似乎是相似的。在一级消除动力学的情况下,清除率保持恒定。每单位时间消除的药物的量随着血浆中的药物的浓度变化。对于丁丙诺啡的终末消除半衰期,与第2组制剂1068-60(59-270hr)和第3组制剂1068-78(78-186hr)相比,第1组制剂1068-57(57-79hr)最短并且变化最小。与第2组中的其它动物(59-72hr)相比,第2组中的变异性主要是由9号雌性动物(t1/2=270hr)导致的。进行在6mg/kgsrbm制剂1068-57(第1组)、1068-60(第2组)和1068-78(第3组)的单次皮下注射之后去甲丁丙诺啡血浆浓度的比较(表7-9)。对于第1组制剂1068-57,观察到去甲丁丙诺啡的低血浆浓度(0.05-0.07ng/ml),并且所述低血浆浓度与最大血浆丁丙诺啡浓度(对于1号和2号雄性动物为第7天;对于2号雄性动物以及7号和8号雌性动物为第29天)同时出现。在第1组动物的整个研究中,在任何其它时间点未观察到超过lloq(0.05ng/ml)的其它可测量的去甲丁丙诺啡的血浆浓度。对于第2组制剂1068-60,早在给药后0.5hr开始并且持续长达第7天(3号和4号雄性动物以及10号雌性动物)或第15天(9号雌性动物)观察可定量的血浆去甲丁丙诺啡浓度。雄性血浆去甲丁丙诺啡浓度的范围为0-0.32ng/ml,而雌性的该值的范围为0-0.36ng/ml。与第1组相比,第2组的暴露时间(天数)和暴露水平(ng/ml血浆去甲丁丙诺啡)大得多。对于第3组制剂1068-78,对于5号雌性动物(0.10ng/ml)和12号雄性动物(0.16ng/ml),早在给药后0.5hr观察到低浓度的血浆去甲丁丙诺啡。所有四只动物均在第5天和第7天具有可定量的血浆去甲丁丙诺啡浓度(对于雄性为0.10-0.17ng/ml并且对于雌性为0.07-0.20ng/ml)。11号雌性动物直至作为研究的最终样品时间点的第60天持续具有可定量的血浆去甲丁丙诺啡水平(0.07-0.26ng/ml)。与第1组相比,第3组的暴露时间(天数)和暴露水平(ng/ml血浆去甲丁丙诺啡)更大,但是低于第2组。结论对于cmax值,与第2组制剂1068-60(25.0-32.5ng/ml)和第3组制剂1068-78(8.8-32.5ng/ml)相比,第1组制剂1068-57(5.3-7.1ng/ml)明显更低。对于tmax值,与第2组制剂1067-60和第3组制剂1067-78(120-168hr)相比,第1组制剂1067-57(168-696hr)更大。考虑到各组中的变异量,当将第1组、第2组和第3组进行比较时,丁丙诺啡的总暴露量(auc0-inf)是相似的。虽然在将3个组进行比较时丁丙诺啡的总暴露量是相似的,但是在将第1组与第2组和第3组进行比较时,血浆浓度×时间曲线的形状差异很大。与第2组和第3组相比,第1组的cmax值低得多并且tmax值更长。对于丁丙诺啡的终末消除半衰期,与第2组制剂1068-60(59-270hr)和第3组制剂1068-78(78-186hr)相比,第1组制剂1068-57(57-79hr)最低并且变化最小。所有3个组的可定量的血浆去甲丁丙诺啡浓度的暴露量均低(从低于0.05ng/ml的lloq至比lloq高约7倍),然而,与第2组制剂1068-60和第3组制剂1068-78相比,第1组制剂1068-57的所述暴露量最小。表4.血浆丁丙诺啡浓度(ng/ml)×时间(hr):第1组(6mg/kg1068-57)表5.血浆丁丙诺啡浓度(ng/ml)×时间(hr):第2组(6mg/kg1068-60)表6.血浆丁丙诺啡浓度(ng/ml)×时间(hr):第3组(6mg/kg1068-78)表7.血浆去甲丁丙诺啡浓度(ng/ml)×时间(hr):第1组(6mg/kg1068-57)表8.血浆去甲丁丙诺啡浓度(ng/ml)×时间(hr):第2组(6mg/kg1068-60)表9.血浆去甲丁丙诺啡浓度(ng/ml)×时间(hr):第3组(6mg/kg1068-78)表10.组平均血浆丁丙诺啡(ng/ml)×时间(hr):组合性别表11.制剂1068-57、1068-60和1068-78的药物代谢动力学参数当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1