生产巨核细胞组合物和用于治疗血小板减少的疗法的制作方法
本申请要求2016年12月2日提交的美国临时专利申请序列号62/429,501(在此通过引用完整并入)并且要求于2016年8月4日提交的美国临时专利申请序列号62/371,024(在此通过引用完整并入)的优先权。
ii.关于联邦资助的声明
本发明是在国立卫生研究院(nih)授予的拨款号r41hl130754的政府支持下完成的。美国政府对本发明享有一定的权利。
iii.发明领域
本发明的领域是生产巨核细胞(mk)组合物和用所述mk组合物治疗血小板减少(thrombocytopenia)的疗法。
iv.发明背景
血小板减少是一种以血液中血小板(凝血细胞)缺乏(低血小板计数)为特征的罕见但通常严重的状况。正常血小板计数在每微升(μl)循环血液150,000至450,000个血小板(ptl)之间。当血小板计数因任何原因下降得低于正常值时发生血小板减少。在罕见的情况下,血小板减少可以是危及生命的,例如当血小板计数下降得低于10,000ptl/μl时,其可以引起内部出血,包括对脑的出血。血小板减少的最常见的症状包括容易或过度擦伤、浅表或延长的出血和/或瘀斑,并且在更严重的情况下是尿液和/或粪便中的血液、疲劳、黄疸或脾扩大。在美国,估计的血小板减少的患病率是每100,000人中的约9.5,影响儿童和成人两者。血小板减少通常由于分开的病症,例如肝病(最常见的原因)、免疫性血小板减少性紫癜(itp)、骨髓病症、肾衰竭、妊娠、药物诱导的血小板减少,例如来自化疗、身体创伤、酒精中毒和/或重度饮酒、癌症和恶性,包括白血病,以及感染,如hiv或丙肝而发生。目前,大多数血小板减少的治疗聚焦于治疗根本原因,希望得到的低血小板计数得到纠正。在严重的情况下,治疗可能包括血液或血小板输注。然而,这些治疗没有提供允许患者用健康有效的血小板再生血液的解决方案,因为血液和血小板输血仅提供循环血小板的临时增加并依赖于志愿捐献者,而仍然聚焦于治疗根本原因。使用造血干细胞(hsc)扩充已经出现了一些实验性治疗,但是它们就离体产生的产物的临床价值而言已经以有限的成功得到满足。对血小板输血的不应性和针对人白细胞抗原(hla)i类抗体的同种免疫(alloimmunization)是另一个严重的临床问题。因此,需要用于治疗血小板减少的供体非依赖性的基于细胞的疗法,其允许患者用血小板细胞再生血液。此外,离体大规模血小板生产的成本和血小板不能耐受长期贮存(例如冷冻保存)对培养物衍生的血小板的临床转化造成额外的困难。因此,进一步需要用于治疗血小板减少的供体非依赖性的基于细胞的疗法,其允许治疗性组合物的长期贮存。
v.发明概述
在一些实施方案中,本发明涉及生产巨核细胞产物的方法。在一些实施方案中,方法包括在第一培养基中培养包含造血干细胞(hsc)的细胞群体的第一步。在一些实施方案中,第一培养基包含至少一种细胞因子。在一些实施方案中,第一培养基包含干细胞因子(scf)、白细胞介素-3(il-3)、fms样酪氨酸激酶3(flt-3)、血小板生成素(thrombopoeitin)(tpo)及其组合中的至少一种。在一些实施方案中,第一培养基包含干细胞因子(scf)。在一些实施方案中,第一培养基包含白细胞介素-3(il-3)。在一些实施方案中,第一培养基包含血小板生成素(tpo)。在一些实施方案中,第一培养基不包含干细胞因子(scf)。在一些实施方案中,第一培养基不包含白细胞介素-3(il-3)。在一些实施方案中,第一培养基不包含血小板生成素(tpo)。在一些实施方案中,第一培养基是无血清(sf)培养基。
在一些实施方案中,方法包括将染色质修饰剂(chromatin-modifyingagent)添加到培养基中。在一些实施方案中,染色质修饰剂包含丙戊酸(vpa)。在一些实施方案中,在第一步之后约12小时至约36小时添加染色质修饰剂。在一些实施方案中,步骤还包括添加另外的细胞因子。在一些实施方案中,添加细胞因子包括白细胞介素-6(il-6)。在一些实施方案中,另外的细胞因子与染色质修饰剂同时添加。在一些实施方案中,在染色质修饰剂之后添加另外的细胞因子剂。在一些实施方案中,在染色质修饰剂之前加入另外的细胞因子试剂。
在一些实施方案中,方法包括将细胞群体扩充第一时间。在一些实施方案中,第一扩充步骤发生约24小时至约120小时。在一些实施方案中,第一扩充步骤发生约24小时至约120小时。在一些实施方案中,第一扩充步骤发生约24小时至约36小时。在一些实施方案中,第一扩充步骤发生约24小时至约48小时。在一些实施方案中,第一扩充步骤发生约36小时至约48小时。在一些实施方案中,第一扩充步骤发生约24小时至约72小时。在一些实施方案中,第一扩充步骤发生约36小时至约72小时。在一些实施方案中,第一扩充步骤发生约48小时至约72小时。在一些实施方案中,第一扩充步骤发生约72小时至约96小时。在一些实施方案中,第一扩充步骤发生约72小时至约120小时。在一些实施方案中,第一扩充步骤发生约96小时至约120小时。在一些实施方案中,第一扩充步骤发生约48小时至约120小时。在一些实施方案中,第一扩充步骤发生约24小时至约120小时。在一些实施方案中,第一扩充步骤发生约36小时至约96小时。在一些实施方案中,第一扩充步骤发生约48小时至约96小时。
在一些实施方案中,方法包括在第二培养基上培养细胞群体的步骤。在一些实施方案中,第二培养基包含至少一种细胞因子。在一些实施方案中,第二培养基包含干细胞因子(scf)、白细胞介素-3(il-3)、fms样酪氨酸激酶3(flt-3)、血小板生成素(tpo)及其组合中的至少一种。在一些实施方案中,第二培养基包含干细胞因子(scf)和血小板生成素(tpo)中的至少一种中的至少一种。在一些实施方案中,第二培养基包含干细胞因子(scf)。在一些实施方案中,第二培养基包含白细胞介素-3(il-3)。在一些实施方案中,第二培养基包含血小板生成素(tpo)。在一些实施方案中,第二培养基不包含干细胞因子(scf)。在一些实施方案中,第二培养基不包含白细胞介素-3(il-3)。在一些实施方案中,第二培养基不包含血小板生成素(tpo)。在一些实施方案中,第二培养基是无血清(sf)培养基。
在一些实施方案中,方法包括将细胞群体扩充第二时间。在一些实施方案中,第二扩充步骤发生约24小时至约120小时。在一些实施方案中,第二扩充步骤发生约24小时至约120小时。在一些实施方案中,第二扩充步骤发生约24小时至约36小时。在一些实施方案中,第二扩充步骤发生约24小时至约48小时。在一些实施方案中,第二扩充步骤发生约36小时至约48小时。在一些实施方案中,第二扩充步骤发生约24小时至约72小时。在一些实施方案中,第二扩充步骤发生约36小时至约72小时。在一些实施方案中,第二扩充步骤发生约48小时至约72小时。在一些实施方案中,第二扩充步骤发生约72小时至约96小时。在一些实施方案中,第二扩充步骤发生约72小时至约120小时。在一些实施方案中,第二扩充步骤发生约96小时至约120小时。在一些实施方案中,第二扩充步骤发生约48小时至约120小时。在一些实施方案中,第二扩充步骤发生约24小时至约120小时。在一些实施方案中,第二扩充步骤发生约36小时至约96小时。在一些实施方案中,第二扩充步骤发生约48小时至约96小时。
在一些实施方案中,方法包括在第三培养基上培养细胞群体的步骤。在一些实施方案中,第三培养基包含至少一种细胞因子。在一些实施方案中,第三培养基包含干细胞因子(scf)、白细胞介素-3(il-3)、fms样酪氨酸激酶3(flt-3)、血小板生成素(tpo)及其组合中的至少一种。在一些实施方案中,第三培养基包含干细胞因子(scf)和血小板生成素(tpo)中的至少一种中的至少一种。在一些实施方案中,第三培养基包含干细胞因子(scf)。在一些实施方案中,第三培养基包含白细胞介素-3(il-3)。在一些实施方案中,第三培养基包含血小板生成素(tpo)。在一些实施方案中,第三培养基不包含干细胞因子(scf)。在一些实施方案中,第三培养基不包含白细胞介素-3(il-3)。在一些实施方案中,第三培养基不包含血小板生成素(tpo)。在一些实施方案中,第三培养基是无血清(sf)培养基。在一些实施方案中,培养步骤包括诱导巨核细胞产物形成偏倚。在一些实施方案中,巨核细胞产物形成偏倚朝向巨核细胞祖细胞。在一些实施方案中,巨核细胞产物形成偏倚朝向未成熟的巨核细胞。在一些实施方案中,巨核细胞产物形成偏倚朝向成熟的巨核细胞。
在一些实施方案中,方法包括将细胞群体扩充第三时间。在一些实施方案中,第三扩充步骤发生约24小时至约120小时。在一些实施方案中,第三扩充步骤发生约24小时至约120小时。在一些实施方案中,第三扩充步骤发生约24小时至约36小时。在一些实施方案中,第三扩充步骤发生约24小时至约48小时。在一些实施方案中,第三扩充步骤发生约36小时至约48小时。在一些实施方案中,第三扩充步骤发生约24小时至约72小时。在一些实施方案中,第三扩充步骤发生约36小时至约72小时。在一些实施方案中,第三扩充步骤发生约48小时至约72小时。在一些实施方案中,第三扩充步骤发生约72小时至约96小时。在一些实施方案中,第三扩充步骤发生约72小时至约120小时。在一些实施方案中,第三扩充步骤发生约96小时至约120小时。在一些实施方案中,第三扩充步骤发生约48小时至约120小时。在一些实施方案中,第三扩充步骤发生约24小时至约120小时。在一些实施方案中,第三扩充步骤发生约36小时至约96小时。在一些实施方案中,第三扩充步骤发生约48小时至约96小时。
在一些实施方案中,方法包括诱导巨核细胞产物形成偏倚。在一些实施方案中,巨核细胞产物形成偏倚朝向巨核细胞祖细胞。在一些实施方案中,巨核细胞产物形成偏倚朝向未成熟的巨核细胞。在一些实施方案中,巨核细胞产物形成偏倚朝向成熟的巨核细胞。
在一些实施方案中,方法包括收集所得巨核细胞产物的步骤。在一些实施方案中,巨核细胞产物包含巨核细胞祖细胞、未成熟巨核细胞、成熟巨核细胞及其组合中的至少一种。在一些实施方案中,方法包括冷冻保存所得巨核细胞产物的步骤。
在一些实施方案中,本发明涉及巨核细胞产物。在一些实施方案中,巨核细胞产物用于治疗血小板减少。在一些实施方案中,巨核细胞产物包含巨核细胞祖细胞。在一些实施方案中,巨核细胞产物包含未成熟的巨核细胞。在一些实施方案中,巨核细胞产物包含成熟巨核细胞。在一些实施方案中,巨核细胞产物包含巨核细胞祖细胞、未成熟巨核细胞、成熟巨核细胞及其组合中的至少一种。在一些实施方案中,产物能够进行冷冻保存。在一些实施方案中,产物是冷冻保存的。
在一些实施方案中,巨核细胞产物是cd41+巨核细胞产物。在一些实施方案中,组合物包含至少5%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少10%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少15%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少20%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少25%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少30%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少35%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少40%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少45%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少50%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少55%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少60%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少65%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少70%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少75%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少80%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少85%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少90%cd41+巨核细胞产物。在一些实施方案中,组合物包含至少95%cd41+巨核细胞产物。
在一些实施方案中,巨核细胞祖细胞的量小于1%。在一些实施方案中,巨核细胞祖细胞的量小于2%。在一些实施方案中,巨核细胞祖细胞的量小于3%。在一些实施方案中,巨核细胞祖细胞的量小于4%。在一些实施方案中,巨核细胞祖细胞的量小于5%。在一些实施方案中,巨核细胞祖细胞的量小于6%。在一些实施方案中,巨核细胞祖细胞的量小于7%。在一些实施方案中,巨核细胞祖细胞的量小于8%。在一些实施方案中,巨核细胞祖细胞的量小于9%。在一些实施方案中,巨核细胞祖细胞的量小于10%。在一些实施方案中,巨核细胞祖细胞的量小于12%。在一些实施方案中,巨核细胞祖细胞的量小于15%。在一些实施方案中,巨核细胞祖细胞的量小于20%。在一些实施方案中,巨核细胞祖细胞的量为约1%至约5%。在一些实施方案中,巨核细胞祖细胞的量为约1%至约10%。在一些实施方案中,巨核细胞祖细胞的量为约5%至约10%。在一些实施方案中,巨核细胞祖细胞的量为约1%至约15%。在一些实施方案中,巨核细胞祖细胞的量为约5%至约15%。在一些实施方案中,巨核细胞祖细胞的量为约1%至约20%。在一些实施方案中,巨核细胞祖细胞的量为约5%至约20%。在一些实施方案中,巨核细胞祖细胞的量为约10%至约20%。
在一些实施方案中,未成熟巨核细胞的量小于20%。在一些实施方案中,未成熟巨核细胞的量小于25%。在一些实施方案中,未成熟巨核细胞的量小于30%。在一些实施方案中,未成熟巨核细胞的量小于35%。在一些实施方案中,未成熟巨核细胞的量小于40%。在一些实施方案中,未成熟巨核细胞的量小于45%。在一些实施方案中,未成熟巨核细胞的量小于50%.在一些实施方案中,未成熟巨核细胞的量为约20%至约25%。在一些实施方案中,未成熟巨核细胞的量为约20%至约30%。在一些实施方案中,未成熟巨核细胞的量为约25%至约30%。在一些实施方案中,未成熟巨核细胞的量为约25%至约35%。在一些实施方案中,未成熟巨核细胞的量为约25%至约40%。在一些实施方案中,未成熟巨核细胞的量为约25%至约50%。在一些实施方案中,未成熟巨核细胞的量为约30%至约50%。在一些实施方案中,未成熟巨核细胞的量为约35%至约50%。在一些实施方案中,未成熟巨核细胞的量为约40%至约50%。在一些实施方案中,未成熟巨核细胞的量为约45%至约50%。
在一些实施方案中,成熟巨核细胞的量为至少25%。在一些实施方案中,成熟巨核细胞的量为至少30%。在一些实施方案中,成熟巨核细胞的量为至少35%。在一些实施方案中,成熟巨核细胞的量为至少40%。在一些实施方案中,成熟巨核细胞的量为至少45%。在一些实施方案中,成熟巨核细胞的量为至少50%。在一些实施方案中,成熟巨核细胞的量为至少55%。在一些实施方案中,成熟巨核细胞的量为至少60%。在一些实施方案中,成熟巨核细胞的量为至少65%。在一些实施方案中,成熟巨核细胞的量为至少70%。在一些实施方案中,成熟巨核细胞的量为至少75%。在一些实施方案中,成熟巨核细胞的量为大于75%。
在一些实施方案中,成熟巨核细胞的量为约25%至约75%。在一些实施方案中,成熟巨核细胞的量为约30%至约75%。在一些实施方案中,成熟巨核细胞的量为约25%至约75%。在一些实施方案中,成熟巨核细胞的量为约30%至约75%。在一些实施方案中,成熟巨核细胞的量为约35%至约75%。在一些实施方案中,成熟巨核细胞的量为约40%至约75%。在一些实施方案中,成熟巨核细胞的量为约45%至约75%。在一些实施方案中,成熟巨核细胞的量为约50%至约75%。在一些实施方案中,成熟巨核细胞的量为约55%至约75%。在一些实施方案中,成熟巨核细胞的量为约60%至约75%。在一些实施方案中,成熟巨核细胞的量为约65%至约75%。在一些实施方案中,成熟巨核细胞的量为约70%至约75%。
在一些实施方案中,本发明涉及治疗有此需要的患者中的血小板减少的方法。在一些实施方案中,治疗血小板减少的方法利用本发明的巨核细胞产物。在一些实施方案中,本发明涉及增加有此需要的受试者中的血小板计数的方法。在一些实施方案中,血小板计数增加到每微升循环血液至少10,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少12,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少15,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少25,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少50,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少75,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少100,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少125,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少150,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少200,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少250,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少300,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少350,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少400,000个血小板。在一些实施方案中,血小板计数增加到每微升循环血液至少450,000个血小板。在一些实施方案中,本发明涉及本发明的巨核细胞产物在制备用于治疗血小板减少的药物中的用途。
vi.附图简述
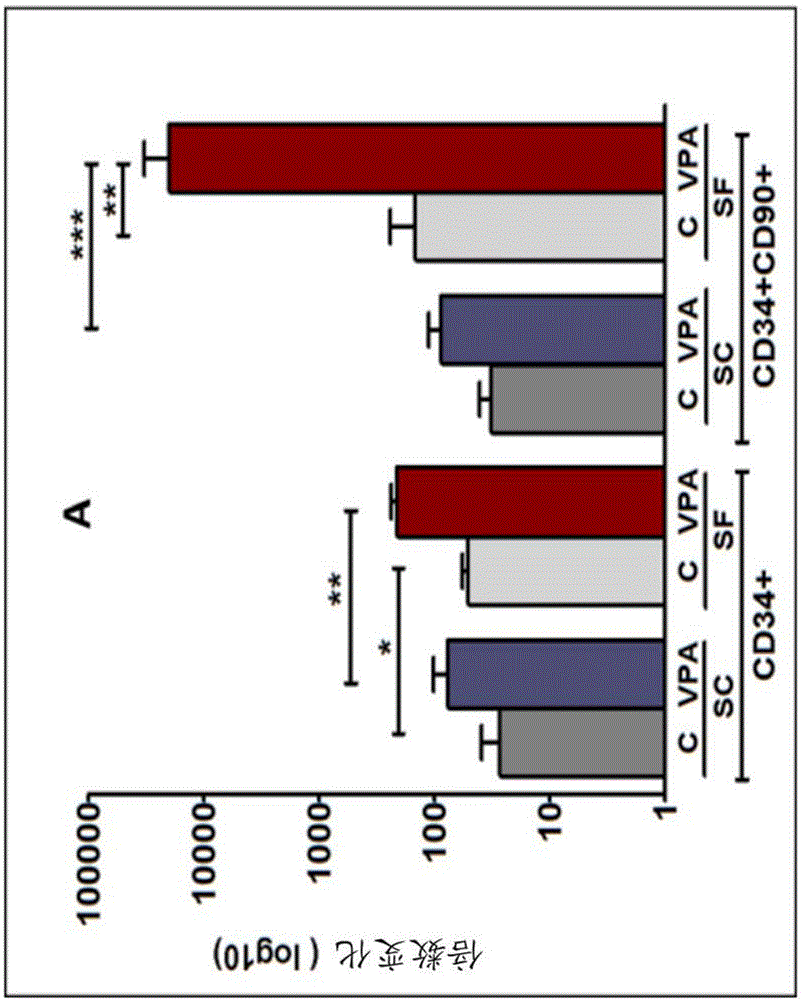
图1a和1b表示丙戊酸(vpa)(染色质修饰剂)对cbcd34+细胞的离体扩充的影响。图1a:在缺乏(c)或存在vpa的情况下,在补充有scf、flt-3、il-3和tpo的含血清(sc)或无血清(sf)培养基中培养cbcd34+细胞。在sf培养物中比在sc培养物中产生更多的cd34+细胞和cd34+/cd90+细胞。图1b:在缺乏(对照)或存在vpa的情况下,在补充有scf、flt-3、il-3和tpo的sf培养基中扩充7天的未操作的原代cbcd34+细胞(pc)和cd34+细胞的表型分析。
图2a、2b和2c表示由cbcd34+细胞的离体巨核细胞(mk)和血小板(ptl)生成。图2a:mk培养物的时间过程分析指示cd34(菱形)表达逐渐下降,其伴随着mk特异性表面标志物cd41(正方形)/cd42(三角形)表达的增加。图2b:第7天和第10天mk培养物的流式细胞术点图分析。图2c:通过前向(fsc)和侧向(ssc)散射特性(上图)和通过双重cd41/噻唑橙染色鉴定的培养物衍生的ptl的流式细胞术分析。新鲜分离的pbptl用作对照。
图3a和3b表示丙戊酸(vpa)扩充对cbcd34+细胞产生巨核细胞(mk)的能力的影响。图3a:mk培养物的cd41表达的表型分析,所述mk培养物从用1mmvpa扩充7天,然后再进行tpo介导的mk分化7天的cbcd34+细胞产生。图3b:通过从未处理或用0.5或1mmvpa扩充的cd34+细胞产生的mk培养物的nf-e2、pf4和gata-1表达的q-pcr分析。
图4表示从丙戊酸(vpa)扩充的脐带血(cb)cd34+细胞中离体产生巨核细胞(mk)。
图5a和5b指示根据实施例4中所述的方案形成大量的cfu-mk。图5a和图5b各自的第一列对应于处理1,第二列对应于处理2,并且第三列对应于处理3,并且第四列对应于处理4。
图6a和6b表示从丙戊酸(vpa)扩充的培养物中分离的巨核细胞(mk)易于冷冻保存。图6a表示冷冻保存前的cd61+mk表型;图6b表示冷冻保存后的cd61+mk表型
图7a和7b表示将从在存在单独的细胞因子或细胞因子加vpa的情况下扩充的hsc产生的冷冻保存的mk解冻并评估它们离体释放血小板和形成cfu-mk的能力。图7a表示流式细胞术,而图7b表示噻唑染色,箭头指出形成血小板的mk。
图8a、8b、8c、8d、8e和8f表示在输注离体产生的mk后在nsg小鼠体内hptl和hmk植入的评估。图8a表示mpb中的hptl的门控策略和评估;在经亚致死照射的nsg小鼠中注射富含hptl的血浆,并在1小时、48小时和120小时后评估mpb中hptl的存在。hptl基于大小和光散射特性进行门控,并且表示为在点图直方图上表达人cd41的圆圈点的簇。图8b表示将离体产生的mk培养物收集,定量并且免疫表型表征(左侧点图直方图)。将包含50万个cd41+mk的100万个tnc输注到经亚致死照射的nsg小鼠中,并在60天的时间段内评估体内产生的hptl的存在。点图直方图显示在输注后3、10、28和48天在mpb中检测到的表达hcd41(左上象限)和hcd42b(右上象限)的hptl。用小鼠抗cd41抗体标记的mptl在右下象限中表示。图8c表示输注图8b中描述的离体产生的mk培养物后mpb中hptl的动力学和定量。每条线代表一只动物(n=7)。图8d表示用0.25x106个未操作的cd34+hsc和用细胞因子加vpa扩充4天的等同数目的hsc(cc#16)的后代输注的nsg小鼠中的hptl产生;在输注后15周评估mbp中的hptl(右图)和mbm中的hmk(左图)的存在。图8e表示10天后产生的异质mk培养物(用vpa扩充4天,随后6天mk分化,(cc#16))以每只小鼠约5x106的量移植到nsg中;在移植后6周评估小鼠脾(sp)和bm中的人mk植入物。将来自受体小鼠的全部mbm细胞在允许人集落形成(cfu)的条件下在半固体培养基中铺板。使用抗人cd41抗体,通过流式细胞术和显微镜分析检测形成的cfu内的人mk。图8f表示将在存在vpa的情况下扩充的培养物中产生的20万个冷冻保存的纯化mk输注到经亚致死照射的nsh小鼠中,并且在28天时间段期间评估mpb中hptl的存在。每条线代表一只动物中随时间的hptl数目(n=4)。
图9a和9b表示在存在单独的细胞因子(图9a)或细胞因子加vpa(图9b)的情况下扩充的mk培养物的流式细胞术分析。在vpa介导的hsc扩充后产生的mk显示mkp群体的早期富集,其导致优异的imk和mmk产率。
图10a和10b表示从cd34+hsc产生的mk培养物,所述cd34+hsc在存在单独的细胞因子或细胞因子加vpa的情况下扩充7天:扩充4天,然后是3天mk分化,然后在基于胶原的培养基中铺板并允许形成cfu-mk。在14天后评估形成的cfu-mk的数目和大小(图10a)以及形态外观(图10b)。
vii.发明详述
血小板产生或血小板生成是骨髓(bm)造血干细胞(hsc)产生巨核细胞(mk)祖细胞的独特过程的最终结果,所述巨核细胞(mk)祖细胞最初增殖并获得谱系特异性标志物,然后成为多倍体巨核细胞(即,超出二倍体2n的染色体互补物的重复)。细胞经历进一步的细胞质成熟和促血小板延伸,其最终使血小板脱落入循环中。体内血小板的此种释放是依赖于骨髓微环境内的内在(例如,细胞骨架变化)和外在因素(例如,细胞-细胞接触,可溶性因子和剪切应力)两者的高度有效事件。此种高度复杂的过程非常难以离体复制,这是离体(例如在组织培养瓶中)制备临床上有活力的血小板的主要障碍。不希望受理论束缚,准确复制此分化过程的困难是为何使用离体造血干细胞扩充的先前治疗已经以有限的成功得到满足。仅仅极小分数的巨核细胞能够在体外脱落血小板,由培养的巨核细胞产生的血小板数目与体内速率绝不匹配。此外,离体血小板的产生通常是成本过高的措施,并且血小板在长期贮存条件,例如冷冻保存下未良好贮存。
如本文所用,术语“巨核细胞”或“mk”指负责产生凝血细胞(血小板)的骨髓细胞。如本文所用,术语巨核细胞可以指巨核细胞祖细胞、未成熟巨核细胞和/或成熟巨核细胞中的任一种。造血干细胞(hsc)成为成熟巨核细胞的过程称为巨核细胞生成,并且通常遵循以下进展。hsc是cd34+,并且在骨髓(bm)、外周血(pb)和脐带血(cb)中找到。如贯穿实施例显示,脐带血是hsc的优选来源。hsc分化为巨核细胞祖细胞。如本文所用,术语“巨核细胞祖细胞”或“mk祖细胞”可以指表征为cd34+/cd41+/cd42-的多倍体(通常是4n)巨核细胞。然后,巨核细胞祖细胞分化成未成熟的巨核细胞。如本文所用,术语“未成熟巨核细胞”或“未成熟mk”可以指表征为cd34-/cd41+/cd42-的多倍体(通常为8n)巨核细胞。然后,未成熟的巨核细胞分化成成熟的巨核细胞。如本文所用,术语“成熟巨核细胞”或“成熟mk”可以指表征为cd34-/cd41+/cd42-的多倍体巨核细胞,通常为16n。成熟的巨核细胞能够在体外、离体或体内产生血小板。
如本文所用,术语“巨核细胞产物”或“mk产物”可以指包含不同量的mk祖细胞、未成熟mk和/或成熟mk中的一种或多种的组合物。可以将本发明的巨核细胞产物施用于有此需要的患者以治疗血小板减少。如下文讨论,可以根据期望的治疗用途调节巨核细胞产物组合物中mk祖细胞、未成熟mk和/或成熟mk的比例。此外,本发明的巨核细胞产物可以进行冷冻保存以长期贮存和解冻。
术语疾病的“治疗”或“处理”指执行方案,所述方案可以包括对患者(人或其他)施用一种或多种药物,以努力缓解疾病的体征或症状。缓解可以在出现疾病的体征或症状前以及其出现后发生。因此,“治疗”或“处理”包括“预防”疾病。术语“预防”指防范和/或预防措施,其中目的是预防或减缓靶定的病理状况或病症。例如,在血小板减少的情况下,可以在进行治疗过程以防止血小板计数下降得低于指定阈值(例如但不一定低于每微升血液150,000个血小板或低于每微升血液10,000个血小板)的情况下出现“预防”。另外,“治疗”或“处理”不需要完全缓解体征或症状,不需要治愈,并且具体包括对患者仅具有边际效应的方案。
如本文所用,术语“载体”可以包括药学上可接受的载体、赋形剂或稳定剂,其在采用的剂量和浓度对暴露于其的细胞或哺乳动物无毒。药学上可接受的载体通常是含水ph缓冲溶液。生理学上可接受的载体的实例包括但不限于缓冲剂,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括但不限于抗坏血酸;低分子量(小于约10个残基)多肽;蛋白质,例如但不限于血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如但不限于聚乙烯吡咯烷酮;氨基酸,例如但不限于甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括但不限于葡萄糖、甘露糖或糊精;螯合剂,例如但不限于edta;糖醇,例如但不限于甘露醇或山梨糖醇;成盐抗衡离子,例如但不限于钠;和/或非离子表面活性剂,例如但不限于tween;聚乙二醇(peg)和pluronics。此类组分的任何组合(包括抑菌剂的可能纳入)可以用于填充本发明的组合物。
如本文所用,术语“患者”可以指可以接受治疗施用的生物系统。生物系统可以包括例如个别细胞、一组细胞(例如细胞培养物)、器官、组织或多细胞生物。“患者”可以指人类患者或非人类患者。
如本文所用,术语“有效量”或“治疗有效量”可以指能够在治疗的受试者中产生医学上期望的结果的化合物或试剂的量。治疗方法可以在体内或离体进行,单独进行或与其他药物或疗法联合进行。治疗有效量可以在一次或多次施用、应用或剂量中施用,并不意图限于特定的配制剂或施用途径。
如本文所用,术语“共施用”和“与......组合”可以指对受试者施用至少两种试剂或疗法。在一些实施方案中,两种或更多种试剂/疗法的共施用是同时的。在其他实施方案中,在第二试剂/疗法之前施用第一试剂/疗法。本领域技术人员理解,所使用的各种试剂/疗法的配制剂和/或施用途径可以变化。
本发明使用大量实验条件来产生本发明的巨核细胞产物,例如,如实施例1至7,9-10和其中描述的培养条件1至20(即cc#1至cc#20)所示。前体产物通常是cd34+细胞,例如脐带血(cb)cd34+细胞或外周血(pb)cd34+细胞。脐带血细胞是cd34+细胞的优选来源,但本发明本身不受限制。此类方法优选使用限定的mk群体的两步培养系统:cd34+/cd41+/cd42b-mk前体(mkp),未成熟cd34-/cd41+/cd42b-mk(imk)和成熟cd34-/cd41+/cd42b+mk(mmk)。在这些培养物中获得的产率是稳健的,但是由于例如脐带血中cd34+细胞的数目,它可以受到限制。在用染色质修饰剂(例如实施例中使用的丙戊酸(vpa))处理后,通过表观遗传重编程可以大大扩充cd34+细胞的数目。本文公开了具有mk分化的造血干细胞(hsc)的整合和优化,其导致产生临床相关的mk细胞产物。实施例公开了20种不同的培养条件,标记为cc#1至cc#20,其中cd34+细胞在缺乏或存在vpa的情况下在具有各种细胞因子的无血清培养基中培养第一时间段(例如5至8天)以允许hsc扩充。将得到的hsc合并物在mk分化/成熟培养基中再培养第二时间段(例如4至7天)。总体观察到的产率范围为每个在存在单独细胞因子的情况下扩充的输入cd34+细胞的8至33mk(参见例如表4,下文实施例9)和每个在存在细胞因子加vpa的情况下扩充的输入cd34+细胞的9至34mk。不希望受理论束缚,鉴于可以从单一cbu中分离出多达2x106个cd34+细胞,每一个cd34+细胞产生28或更多mk的培养物能够产生超过56x106mk或7x105cd41+mk/kg/体重的等同物以输注到约80kg的正常成人,高得令人惊讶且临床相关的产率。
更详细地,方法通常包括以下内容。首先,获得cd34+细胞。一旦获得cd34+细胞,就将它们在培养基中进行细胞因子引发。培养基优选是无血清(sf)培养基。细胞因子引发可以但不一定包括干细胞因子(scf)、白细胞介素-3(il-3)、血小板生成素(tpo)和/或fms样酪氨酸激酶3(flt-3)。scf的量可以为约1ng/ml至约250ng/ml,包括任何居间范围,例如,约150ng/ml。il-3的量可以为约1ng/ml至约100ng/ml,包括任何居间范围,例如,约50ng/ml。tpo的量可以为约1ng/ml至约200ng/ml,包括任何居间范围,例如,约100ng/ml。flt-3的量可以为约1ng/ml至约200ng/ml,包括任何居间范围,例如,约100ng/ml。虽然细胞因子引发通常包括这些列出的试剂中的每一种,但并非所有试剂都需要存在。
发生了细胞因子引发后,细胞可以暴露于染色质修饰剂或可以不暴露于染色质修饰剂。染色质修饰剂的综述可参见seideletal.,chromatin-modifyingagentsinanti-cancertherapy,biochimie94(11):2264-79。示例性的染色质修饰剂是丙戊酸(vpa)。染色质修饰剂通常在细胞因子引发后约1天,即约24小时添加,尽管它可以在引发直至约3天的情况下,即细胞因子引发后约72小时(包括任何居间范围)添加。染色质修饰剂通常以约0.1mm至约5mm的量,包括任何居间范围,例如,约1mm添加。可以与染色质修饰剂一起或以后,例如在添加染色质修饰剂后24-48小时内添加另外的细胞因子,包括但不限于白细胞介素-6(il-6)。或者,可以将il-6添加到原始细胞因子引发中。il-6可以以约5ng/ml至约100ng/ml的量,包括任何居间范围,例如,约50ng/ml添加。
在添加任选的染色质修饰剂和任何另外的细胞因子后,使细胞培养物扩充约1天至约5天,即约24小时至约120小时,包括任何居间范围。在此第一次扩充之后,任选将细胞再铺板到第二培养基中。第二培养基优选是无血清(sf)培养基。另外的细胞因子可以存在于第二培养基中,包括但不限于scf和tpo,例如以约1ng/ml至约250ng/ml的量,包括任何居间范围,例如,约100或150ng/ml。理想地,第二培养基不含染色质修饰剂,例如vpa。使细胞培养物进行第二次扩充约1天至约5天,即约24小时至约96小时,包括任何居间范围。在此第二次扩充之后,任选将细胞再铺板到第三培养基上。第三培养基优选是无血清(sf)培养基。第三培养基可以具有约1ng/ml至约200ng/ml的tpo,包括任何居间范围,例如,约100ng/ml。理想地,第三培养基不含scf和任何染色质修饰剂,如vpa。可以使细胞培养物进行第三次扩充约1天至约5天,即约24小时至约120小时,包括任何居间范围,但更优选约72小时至约120小时。在第三次扩充后,收集细胞。
如下文实施例6中所示,本发明的巨核细胞产物令人惊讶地能够进行冷冻保存,用于长期贮存,其中高百分比的巨核细胞产物在解冻后存活。解冻后冷冻保存的mk培养物的存活力平均为71%,mk表型没有变化。凝血细胞(血小板)不能幸免于冷冻保存,因此本发明的巨核细胞产物幸免于冷冻保存的事实是重大的,因为它解决了血小板输血和贮存的基本问题。适合于冷冻保存的本发明的巨核细胞产物可以包含mk祖细胞、未成熟mk和/或成熟mk的混合物。适合于冷冻保存的巨核细胞产物的示例性实施方案是小于约1%至约5%的mk祖细胞、约25%至约35%的未成熟mk、和约55%至约75%的成熟mk。然而,巨核细胞产物中各种类型的巨核细胞的确切范围可以是变化的。例如,mk祖细胞的量可以小于1%,约1%,约2%,约3%,约4%,约5%,约6%,约7%,约8%,约9%。约10%,约12%,约15%,约20%,约25%,约30%,约35%,约40%,约45%,约50%,约55%,约60%,约65%,约70%,约75%,约80%,约85%,约90%,约95%,约98%,约99%,大于99%,以及其中的任何居间范围,未成熟的量mk可以小于1%,约1%,约2%,约3%,约4%,约5%,约6%,约7%,约8%,约9%,约10%,约12%,约15%,约20%,约25%,约30%,约35%,约40%,约45%,约50%,约55%,约60%,约65%,约70%,约75%,约80%,约85%,约90%,约95%,约98%,约99%,大于99%,以及其中的任何居间范围,并且成熟mk的量可以小于1%,约1%,约2%,约3%,约4%,约5%,约6%,约7%,约8%,约9%,约10%,约12%,约15%,约20%,约25%,约30%,约35%,约40%,约45%,约50%,约55%,约60%,约65%,约70%,约75%,约80%,约85%,约90%,约95%,约98%,约99%,大于99%,以及其中的任何居间范围。巨核细胞产物可以含有药学上可接受的载体、防腐剂或不会对其中所含的巨核细胞产生不利影响的其它组合物。
在一些实施方案中,本发明包括对有此需要的患者施用治疗有效量的巨核细胞产物以治疗血小板减少的方法。巨核细胞产物可以包含巨核细胞前体、未成熟巨核细胞、成熟巨核细胞及其组合。这些特定巨核细胞组中的每个将在不同时间点在患者中产生血小板,因此可以拥有不同的治疗效用。例如,成熟的巨核细胞将在对患者施用的数天内产生血小板,而未成熟的巨核细胞将在数周内产生血小板,并且巨核细胞前体将在数月内产生血小板。因此,根据患者的需要,可以优化治疗以在巨核细胞产物中包括一种或多种类型的巨核细胞。
单独或组合的本发明的巨核细胞产物可以在体内使用。因此,本发明提供了施用药物组合物,其包含药学上可接受的载体和药理学有效量的一种或多种主题肽或其合适的盐的。药物组合物可以配制成粉末、颗粒、溶液、悬浮液、气溶胶、固体、丸剂、片剂、胶囊、凝胶、局部乳膏、栓剂、透皮贴剂等。
巨核细胞产物可以静脉内施用。静脉内递送巨核细胞产物可以包括适合于经由任何静脉内方法(包括推注)对患者施用的任何配制剂。巨核细胞产物可以经由注射方法对患者施用。除静脉内注射外,合适的注射方法可以包括动脉内输注、肌内注射、透皮注射、胃肠外和皮下注射。巨核细胞配制剂可以包含含水载体。作为实例而非限制,含水载体包括氯化钠、氯化钙、林格氏溶液、等张右旋糖溶液、无菌水、右旋糖和乳酸林格氏溶液。非水性胃肠外载体包括例如但不限于植物来源的不挥发性油、棉籽油、玉米油、芝麻油和花生油。必须将抑菌或抑制真菌浓度的抗微生物剂添加到包装在多剂量容器中的胃肠外配制剂中,所述容器包括酚类或甲酚类、汞、苄醇、氯丁醇、对羟基苯甲酸甲酯和丙酯、硫柳汞、苯扎氯铵和苄索氯铵。作为实例而非限制,等张剂包括氯化钠和右旋糖。缓冲剂可以包括磷酸盐和柠檬酸盐。抗氧化剂可以包括硫酸氢钠。
剂量和给药方案取决于内科医生容易确定的多种因素,例如病症的性质,例如其治疗指数、患者和患者的病史。通常,将治疗有效量的组合物施用于患者。在一些实施方案中,施用的组合物的量在约0.01mg/kg至约1000mg/kg患者体重的范围内,以及其间的任何范围。根据状况的严重程度,约0.1mg/kg至约50mg/kg体重(例如,约0.1-15mg/kg/剂,更通常约1-25mg/kg体重)的组合物是用于对患者施用的初始候选剂量,例如不论通过一次或多次分开施用还是通过连续输注。组合物可以以相对低的体积速率递送,例如但不一定是约0.001ml/天至10ml/天,以使组合物释放的部位附近的组织干扰或创伤最小化。取决于具体的生物制剂,配制剂可以以低剂量,例如以约0.01μg/hr或0.1μg/hr、0.25μg/hr、1μg/hr,通常高达约200μg/hr的速率释放,或配制剂以低体积速率递送,例如,体积速率为约0.001ml/天至约1ml/天,例如,0.01微克/天直至约20毫克/天。剂量取决于许多因素,例如活性成分的效力、生物利用度和毒性以及受试者的要求。通过常规方法和测定法并且基于内科医生或本领域其他技术人员已知的标准,容易地监测此种疗法的进展。用于评估成功治疗和疾病改善的上述参数可通过内科医生熟悉的常规程序容易地测量。
递送系统还包括持续释放或长期递送方法,其是本领域技术人员公知的。如本文所用,“持续释放”或“长期释放”指递送系统施用药学治疗量的主题化合物超过一天,优选超过一周,最优选至少约30天至60天或更长。长期释放系统可以包含含有主题肽的可植入固体或凝胶,例如上述可生物降解的聚合物;泵,包括蠕动泵和氟碳化合物推进剂泵;渗透泵和微渗透泵;等等。随泵的每次启动,蠕动泵递送设定量的药物,并且可以再填充贮存器,优选通过端口经皮再填充。控制器设定剂量并且还可以提供关于递送的剂量、剩余剂量和递送频率的读数。碳氟化合物推进剂泵利用碳氟化合物液体来操作泵。碳氟化合物液体施加高于大气压的蒸气压,并且压缩含有药物的室以释放药物。渗透泵(和微渗透泵)利用渗透压以恒定速率释放药物。药物包含在不透的隔膜中,所述隔膜被渗透剂包围。半透膜含有渗透剂,并且整个泵容纳在外壳中。水通过半透膜扩散挤压保持药物的隔膜,迫使药物进入血液、器官或组织。这些和其他此类植入物特别可用于治疗炎性疾病状况,特别是那些表现出复发事件或本质上进行性的炎性疾病状况,通过经由系统性(例如静脉内或皮下)或局部剂量以持续长期方式递送本发明的寡肽进行。
在提供范围数值的情况下,应当理解的是,本发明内涵盖在该范围的上限和下限与叙述范围中的任何其他叙述数值或居间数值之间的每个居间值(至下限单位的十分之一,除非上下文另有明确规定)。可以独立地包括在较小范围内的这些较小范围的上限和下限也包括在本发明内,服从叙述范围中任何明确排除。在所述叙述范围包括限度之一或两者的情况下,排除那些包括限度的任一两者的范围也包括在本发明中。
除非另外定义,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管与本文描述的那些方法和材料类似或等同的任何方法和材料也可用于本发明的实践或测试,但现在描述优选的方法和材料。本文提及的所有出版物均通过引用整体并入本文。
如本文和所附权利要求书中所用,单数形式“一个/种”、“和”和“所述”包括复数指代物,除非上下文另有明确说明。
术语“约”指本领域普通技术人员认为不与基线值实质性不同的数值范围。例如,术语“约”可以指在叙述数值的20%,15%,10%,9%,8%,7%,6%,5%,4%,3%,2%,1%,0.5%,0.1%,0.05%或0.01%内的值以及介于此类叙述数值的数值。
本文公开的出版物仅仅是为了它们在本发明的提交日之前的公开内容而提供的。本文中的任何内容均不应解释为承认凭借在先发明,本发明没有资格先于此类出版物。此外,提供的出版日期可以与可能需要独立确认的实际出版日期不同。
本文本中引用的每篇申请和专利以及每篇申请和专利中引用的每篇文件或参考文献、专利或非专利文献(包括在每篇公告专利的起诉期间;“申请引用文件”)以及与这些申请和专利中的任一篇对应和/或要求这些申请和专利中的任一篇的优先权的每篇pct和外国申请或专利,以及在每篇申请引用文献中引用或提到的每篇文献在此通过引用明确完整并入本文。更一般地,在本文本中,在权利要求书前的参考文献列表中;或在文本本身中引用文献或参考文献;并且,这些文献或参考文献中的每篇“(本文引用的参考文献”),以及在每篇本文引用的参考文献(包括任何制造商的说明书,用法说明等)中引用的每篇文献或参考文献在此通过引用明确并入本文。
以下非限制性实施例用来进一步示例本发明。
viii.实施例
以下实施例涉及脐带血(cb)cd34+细胞体外扩充和分化为巨核细胞(mk),所得mk产物的冷冻保存,以及经由扩充/分化产生的mk产物的体内输血。在列出细胞培养条件的情况下,提供附带的标识符,例如cc#1,其对应于下文的表5。从贯穿实施例列出的不同细胞培养条件获得的cd41+mk的总体产率的范围为每个在存在单独的细胞因子的情况下扩充的输入cd34+细胞的8-33mk和每个在存在细胞因子加vpa的情况下扩充的输入cd34+细胞的9-34mk。鉴于可以从一个cbu中分离出多达2x106个cd34+细胞,虽然不希望受理论束缚,产生28个或更多mk/输入cd34+细胞的培养物预计产生超过56x106mk或7x105mk/kg的等同物用于输注到80kg接受者中。
1.通过丙戊酸(vpa)处理在无血清(sf)培养物中扩充cd34+细胞
获得脐带血(cb)cd34+细胞并分成测试组和对照组。对各组进行以下细胞培养方案:
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)、和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)(仅测试组)。无vpa添加到对照组。
第2-8天:使细胞在sf培养物中扩充并在第7天收集。总cd34+细胞扩充200倍左右。
结果指示经vpa处理的培养物(测试组)中cd34+细胞的数目比在缺乏vpa的情况下扩充的细胞数目大>200倍,参见图1。扩充的hsc主要由原始cd34+/cd90+细胞(74.2±9.8%),接着是血型糖蛋白(gpa)+红系细胞(17±5.4%)和cd41+mk细胞(8.9±2%)组成。体外和体内评估vpa扩充的cd34+细胞的功能表明在nsg小鼠中移植后重建多谱系造血的能力增加,包括改善的mk谱系植入。
2.从原代cd34+细胞离体有效地产生不同发育阶段的巨核细胞(mk)
获得脐带血(cb)cd34+细胞。对各组进行以下细胞培养方案。
第0天:将cd34+细胞在具有血小板生成素(tpo)的干细胞因子(scf)培养基上铺板。
第1-7天:细胞在培养物中生长。
第7天:用具有血小板生成素(tpo)的无血清(sf)培养物再铺板细胞
第8-14天:使细胞分化成巨核细胞产生。
第14天:将细胞收集,定量并且表征。总cd41+巨核细胞扩充3至15倍左右。
结果指示用pb或bmcd34+细胞启动的培养物产生了不同发育阶段的mk:cd34+/cd41+/cd42b-mk祖细胞/前体(mkpp)、未成熟cd34-/cd41+/cd42b-mk(imk)和成熟cd34-/cd41+/cd42b+mk(mmk)。值得注意的是,cb衍生的cd34+细胞可以逐渐产生包含这些表型限定的mk群体的稳健mk培养物(图2a和图2b)。mkpp和imk早在第4天就出现,而在第7天已经观察到mmk。到第12天,77%的细胞是cd41+细胞,其中23%是mkpp,并且74%是mmk。这对应于来自1个最初铺板的cd34+细胞的3个mk的绝对产率。此外,在培养物中,这些mk脱落ptl,其在表型上与新鲜分离的pbptl相当(图2c)。这些结果指示cbcd34+细胞是产生血小板的巨核细胞的可靠来源。
3.丙戊酸(vpa)增强cd34+细胞定型和分化为巨核细胞(mk)的能力。
为了确保对丙戊酸(vpa)的暴露不影响脐带血(cb)cd34+细胞定型和分化为巨核细胞(mk)的能力,测试了vpa对血小板生成素(tpo)介导的mk分化和成熟的影响。为此,将50,000个冷冻保存的cbcd34+细胞在补充有干细胞因子(scf)、白细胞介素-3(il-3)、fms样酪氨酸激酶3(flt-3)和tpo的无血清(sf)培养基中铺板,并允许在有或没有vpa(测试对对照)的情况下扩充,如上文实施例1中所述。7天后,替换收集,洗涤细胞以除去vpa和细胞因子,并在仅补充有tpo的sf培养基中铺板。在vpa扩充培养物中比在仅用细胞因子扩充的培养物中检测到多约50%的cd41+mk(图3a)。与由在缺乏vpa的情况下铺板的1个cd34+细胞产生的约5个cd41+mk相比,这对应于从在存在vpa的情况下铺板的1个cd34+细胞产生的约40mk的最终产率。q-pcr分析证实在mk分化前暴露于vpa的培养物中mk特异性基因(gata1、pf4和nfe2)的上调(图3b)。这些结果表明mk分化前的vpa暴露改善了mk的最终产率。
4.从丙戊酸(vpa)扩充的脐带血(cb)cd34+细胞离体生成巨核细胞(mk)
获得脐带血(cb)cd34+细胞并进行以下处理(cc#15):
第0天:用细胞因子混合物引发cbcd34+细胞并在无血清(sf)培养物(stemline培养基)中铺板。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)。
第1天至第5天:使细胞在sf培养物中扩充。
第5天至第12天:将细胞在含有150ng/mlscf和100ng/mltpo的stemline培养基中再铺板,并在第12天收集。
图4中所示的结果指示在第0天,存在着朝着cd34+细胞的强烈偏倚。到第5天,已经开始进行一些分化,但仍有显著量的cd34+细胞。在分化培养基中再过5天后,在第10天,86.4%的巨核细胞(mk)分化成cd41+/cd61+mks。
5.从丙戊酸(vpa)扩充的脐带血(cb)cd34+细胞产生的巨核细胞(mk)培养物能够形成集落形成单位(cfu)。
获得脐带血(cb)cd34+细胞并进行以下处理。
处理1:(cc#11)
第0天至第5天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)、和100ng/ml量的血小板生成素(tpo)。使细胞在培养物中扩充。
第5天至第8天:将细胞在含有150ng/mlscf和100ng/mltpo的stemline培养基中再铺板。使细胞在培养物中扩充。
第8天至第12天:将细胞在仅含有100ng/mltpo的stemline培养基中再铺板。
处理2:(cc#14)
第0天至第5天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。使细胞在培养物中扩充。
第5天至第8天:将细胞在含有10ng/mlscf和100ng/mltpo的stemline培养基中再铺板。使细胞在培养物中扩充。
第8天至第12天:将细胞在含有100ng/mltpo的stemline培养基中再铺板。
处理3:(cc#17)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)、和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)。
第1天至第5天:使细胞在sf培养物中扩充。
第5天至第8天:将细胞再铺板于含有150ng/mlscf和100ng/mltpo的stemline培养基中。
第8天至第12天:将细胞再铺板于仅含100ng/mltpo的stemline培养基中。
处理4:(cc#19)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)。
第1天至第5天:使细胞在sf培养物中扩充。
第5天至第8天:将细胞再铺板于含有10ng/mlscf和100ng/mltpo的stemline培养基中。
第8天至第12天:将细胞再铺板于含有10ng/mlscf和100ng/mltpo的1/2体积的stemline培养基中。
图5中所示的结果指示与其他cfu(图5b)相比,大小范围为更大、中等和更小的cfu-mk的稳健数目(图5a),所述其他cfu数目相当少并且主要是混合簇。图5a和图5b中每个的第一列对应于处理1(cc#11),第二列对应于处理2(cc#14),第三列对应于处理3(cc#17),并且第四列对应于处理4(cc#19)。
6.从丙戊酸(vpa)扩充培养物中分离的cd61+巨核细胞(mk)易于冷冻保存
a.获得脐带血(cb)cd34+细胞并进行各种培养方案(如本文所述的cc#5、cc#15、cc#16和cc#17)。从得到的分化的巨核细胞产物中免疫磁性纯化cd61+巨核细胞(mk)。与未纯化的异质巨核细胞(mk)产物一起将cd61+mk冷冻保存三(3)个月。然后解冻纯化的cd61+mk和异质mk产物并评估表型。纯化的cd61+mk的结果显示在下表1中,而异质mk产物的结果显示在下表2中。
表1.在cd61+纯化的mk细胞产物的冷冻保存之前和之后存活力和mk表型恢复。
表2.在异质mk细胞产物的冷冻保存之前和之后存活力和mk表型恢复。
b.获得脐带血(cb)cd34+细胞,并如上文实施例4的处理3中所述进行培养方案cc#17。从得到的分化的巨核细胞产物中免疫磁性纯化cd61+巨核细胞(mk)。将cd61+mk冷冻保存三(3)个月。结果指示在冷冻保存之前,70.9%的mk是有存活力的,并且在解冻后,68.4%是存有活力的,解冻后mk的保存水平高得令人惊讶。解冻后mk的群体分布如下:cd34+/cd41+占总mk群体的0.9%,cd41+/cd42-占总mk群体的27.4%,并且cd41+/cd42+占总mk群体的65.5%。如图6a所示,在冷冻保存之前,从vpa扩充的培养物中分离的86.4%的巨核细胞(mk)是cd61+细胞,而如图6b所示,解冻后从vpa扩充的培养物中分离的89.4%的巨核细胞(mk)是cd61+细胞。
c.将从在存在单独的细胞因子或细胞因子加vpa(进行培养方案cc#17)的情况下扩充的hsc产生的冷冻保存的mk解冻并评估它们离体释放血小板和形成cfu-mk的能力。在图7a和7b(噻唑橙染色)中显示结果。
7.整合培养方案
获得脐带血(cb)cd34+细胞并进行以下处理。
第0天:用细胞因子混合物引发cbcd34+细胞,并在无血清(sf)培养物中铺板,所述无血清(sf)培养物具有150ng/ml量的干细胞因子(scf)、50ng/ml量的il-3、100ng/ml量的fms样酪氨酸激酶3(flt-3)、和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)和50ng/mlil-6。
第1天至第7天:使细胞在sf培养物中扩充。
第7天:将细胞再铺板在sf培养基中,所述sf培养基具有范围为10ng/ml至150ng/ml的量的scf和100ng/ml量的tpo。
第7天至第10天:使细胞扩充和分化。
第10天:将细胞再铺板在具有100ng/ml量的tpo的sf培养基中。
第10天至第14天:使细胞分化。
第14天:将细胞收集,定量并且表征。
8.免疫受损的nsg小鼠中的人mk和血小板植入
检测在免疫受损的nsg小鼠中输注后离体产生的mk在体内产生血小板的能力。首先,在受体动物中输注新鲜的富含人血小板的血浆,并且在输注后约1小时至5天之间在小鼠外周血(mpb)中评估人ptl的存在(图8a)。将与人cd41标记结合的人ptl大小和光散射特性用作在用mk培养物输注后mpb中的人ptl检测的检测阳性对照。离体产生mk培养物并收获,定量和表型评估并输注入四个不同的实验组:第一组,其接受在基础mk培养系统中产生的mk群体(第0-7天sfqbsf培养基中100ng/mlscf和50ng/mltpo,然后第8-10天在仅含50ng/mltpo的sfqbsf培养基中)(iancu-rubinetal.blood2011,exphematol2012和2014,leukemia2017);第二组,其接受仅在存在细胞因子的情况下产生的mk(cc#10);第三组,其接受在存在细胞因子加vpa的情况下产生的mk(cc#16);和第四组,其接受新鲜纯化的cd61+mk。在这三组中输注的mk培养物(cc#16)包含异质mk群体,并且输注的细胞总数在约60万至约500万之间变化(参见下表3)。如图8所示,输注离体产生的mk产物导致可检测的hptl进入nsg受体小鼠的mpb中和cd41+细胞进入小鼠骨髓(mbm)中。
结果令人惊讶地指示,与存在vpa的情况下在培养物中产生的mk相比,当在基础培养条件(在仅含scf和tpo的无血清培养基中两步培养)下产生mk时,输注相当大数目的mk后体内hptl产生的程度更大。不希望受理论束缚,在输注纯化的mk后缺乏体内ptl产生归因于注射的mk数目有限。结论是源自cbhsc的离体产生的mk细胞产物不仅包含能够立即释放ptl的mmk和imk,而且还包含能够持续产生mk和ptl的mkp和hpc。
如实施例6中所示,扩充的mk适合于冷冻保存。然而,重要的是,它们还能够在体内产生血小板。更具体地,当在免疫受损的nsg小鼠中输注异质或纯化的冷冻保存的mk时,它们能够在体内产生血小板。用异质mk或纯化的mk培养物输注的每组中五分之二的动物在体内释放hptl。令人惊讶的是,在输注少至10万个纯化的mk后,早在第3天、第7天和第10天就在mpb中观察到hptl。然而,它们的数目在稍后的时间点时下降到检测不到的水平(图8f)。相反,在用异质mk群体输注的nsg小鼠中,hptl产生持续长达三个月,比给予纯化的mk培养物的那些小鼠显著更长的时间段。虽然不希望受理论束缚,但是这些发现指示纯化的成熟mk群体可以导致快速、早期的ptl产生,包含mk前体和成熟mk的异质mk群体可以允许体内既快速又持续的ptl产生。
表3.在输注离体产生的mk后,在nsg小鼠体内产生的hptl的评估。tnc=总的有核细胞。
9.来自培养优化的平均巨核细胞产率和某些细胞培养条件的另外的离体表征
将源自脐带血(cb)的cd34+hsc在缺乏或存在丙戊酸(vpa)的情况下扩充4或7天,然后在使用各种细胞因子混合物的条件下诱导向巨核细胞(mk)分化和成熟。没有vpa的细胞培养条件(“单独的细胞因子”)包括如本文所述的cc#1-4,9-14,并且具有vpa的那些细胞培养条件(“细胞因子+vpa”)包括如本文所述的cc#5-8,15-20。这两组细胞培养物的mk产率的平均值±标准偏差(sd)在下表4中表示。代表性的流式细胞术分析在图9a(用于仅细胞因子的cc#11)和9b(用于细胞因子+vpa的cc#17)中表示。对于“单独的细胞因子”以及“细胞因子+vpa”在共同时间点(第8天)采集的cfu的代表性数目在图10中呈现。
表4.来自培养优化的mk产率
这些培养条件代表优化以进一步最大化产生的mk产率的分数,其可以在培养物的15%至57%之间变化。无论vpa处理如何,这些条件中所得的mk的主要亚群由mmk组成。然而,与单独的细胞因子相比,在存在vpa的情况下产生的培养物含有更大数目的cd34+/cd41+mk前体和可测定的cfu-mk(参见图9)。
10.其他细胞培养方案
对脐带血(cb)cd34+细胞进行以下另外的细胞培养方案。
处理1:(cc#1)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。
第1天至第8天:使细胞在sf培养物中扩充。
第8天至第12天:将细胞再铺板于含有150ng/mlscf和100ngmltpo的stemline培养基中。
第12天:收集细胞。
处理2:(cc#2)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)、和100ng/ml量的血小板生成素(tpo)。
第1天至第8天:使细胞在sf培养物中扩充。
第8天至第12天:将细胞再铺板在仅含有100ngmltpo的stemline培养基中。
第12天:收集细胞。
处理3:(cc#3)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)、和100ng/ml量的血小板生成素(tpo)。
第1天至第8天:使细胞在sf培养物中扩充。
第8天至第12天:将细胞再铺板于仅含有150ng/mlscf和100ngmltpo的qbsf培养基中。
第12天:收集细胞。
处理4:(cc#4)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。
第1天至第8天:使细胞在sf培养物中扩充。
第8天至第12天:将细胞再铺板于仅含有100ngmltpo的qbsf培养基中。
第12天:收集细胞。
处理5:(cc#5)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)。
第1天至第8天:使细胞在sf培养物中扩充。
第8天至第12天:将细胞再铺板于含有150ng/mlscf和100ng/mltpo的stemline培养基中。
第12天:收集细胞。
处理6:(cc#6)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)。
第1天至第8天:使细胞在sf培养物中扩充。
第8天至第12天:将细胞再铺板在含有100ng/mltpo的stemline培养基中。
第12天:收集细胞。
处理7:(cc#7)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)。
第1天至第8天:使细胞在sf培养物中扩充。
第8天至第12天:将细胞再铺板于含有150ng/mlscf和100ng/mltpo的qbsf培养基中。
第12天:收集细胞。
处理8:(cc#8)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)、和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)。
第1天至第8天:使细胞在sf培养物中扩充。
第8天至第12天:将细胞再铺板于仅含有100ng/mltpo的qbsf培养基中。
第12天:收集细胞。
处理9:(cc#9)
第0天至第5天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。使细胞在sf培养物中扩充。
第5-12天:将细胞再铺板于含有150ng/mlscf和100ng/mltpo的stemline培养基中。
第12天:收集细胞。
处理10:(cc#10)
第0天至第5天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。使细胞在sf培养物中扩充。
第5-8天:将细胞再铺板于含有150ng/mlscf和100ng/mltpo的stemline培养基中。使细胞扩充。
第8-12天:将细胞再铺板于含有150ng/mlscf和100ng/mltpo的1/2体积的stemline培养基中。
第12天:收集细胞。
处理11:(cc#12)
第0天至第5天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。使细胞在sf培养物中扩充。
第5-12天:将细胞再铺板于含有10ng/mlscf和100ng/mltpo的stemline培养基中。
第12天:收集细胞。
处理12:(cc#13)
第0天至第5天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。使细胞在sf培养物中扩充。
第5天至第8天:将细胞再铺板于含有10ng/mlscf和100ng/mltpo的stemline培养基中。使细胞扩充。
第8天至第12天:将细胞再铺板于含有150ng/mlscf和100ng/mltpo的1/2体积的stemline培养基中。
第12天:收集细胞。
处理13:(cc#16)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)。
第1天至第5天:使细胞在sf培养物中扩充。
第5天:将细胞再铺板于含有150ng/mlscf和100ng/mltpo的stemline培养基中。
第5天至第8天:使细胞在sf培养物中扩充。
第8天:将细胞再铺板在含有150ng/mlscf和100ng/mltpo的1/2体积的stemline培养基中。
第8天至第12天:使细胞在sf培养物中扩充。
第12天:收集细胞。
处理14:(cc#18)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)。
第1天至第5天:使细胞在sf培养物中扩充。
第5天:将细胞再铺板于含有10ng/mlscf和100ng/mltpo的stemline培养基中。
第5天至第12天:使细胞在sf培养物中扩充。
第12天:收集细胞。
处理15:(cc#20)
第0天:用细胞因子混合物引发cbcd34+细胞并铺板于无血清(sf)培养物(stemline培养基)中。细胞因子混合物包括150ng/ml量的干细胞因子(scf)、50ng/ml量的白细胞介素-3(il-3)、100ng/ml量的fms样酪氨酸激酶3(flt-3)和100ng/ml量的血小板生成素(tpo)。
第1天:对sf培养物添加1mm丙戊酸(vpa)。
第1天至第5天:使细胞在sf培养物中扩充。
第5天:将细胞再铺板于含有10ng/mlscf和100ng/mltpo的stemline培养基中。
第5天至第8天:使细胞在sf培养物中扩充。
第8天:将细胞再铺板于仅含有100ng/mltpo的stemline培养基中。
第8天至第12天:使细胞在sf培养物中扩充。
第12天:收集细胞。
表5:通过实施例中标记的培养条件组织的cd41+巨核细胞产率,实际对理论。
前述实施例和优选实施方案的描述应视为示例,而非限制如由权利要求限定的本发明。如将容易理解的,在不脱离如权利要求书中所阐述的本发明的情况下,可以利用上文阐述的特征的许多变化和组合。此类变化不视为脱离本发明的范围,并且所有此类变化旨在包括在所附权利要求书的范围内。本文中引用的所有参考文献都通过引用整体并入。
- 还没有人留言评论。精彩留言会获得点赞!