在基因组重新编码生物体中生产硒代生物制剂的制作方法
在文件中包含的命名为“utfb_p1174wo.txt”的为3305kb(如在microsoftwindows中所测量)且创建于2017年8月30日的序列表,通过电子投递随本文一起提交并且通过引用并入本文。
发明领域
本发明在政府支持下由海军研究办公室(officeofnavalresearch)授予的fa9550-10-1-0169号赠款和太平洋空间和海战系统中心(thespaceandnavalwarfaresystemscenter,pacific)授予的n66001-14-2-4051号赠款进行。政府对本发明拥有某些权利。
本发明涉及蛋白质生物制剂领域。特别是,它涉及制备具有有益特性的蛋白质生物制剂的方法。
发明背景
蛋白质生物制剂,包括单克隆抗体、蛋白质治疗剂和疫苗,是癌症、感染、以及免疫和其它疾病的有效疗法,构成几十亿美元的市场。但是大多数生物制剂必须在昂贵的哺乳动物细胞系统中制备,这在很大程度上是因为它们通过化学键(称为二硫键)来稳定,这种化学键不能在微生物细胞中形成。此外,由于二硫键易于化学还原,它们可能在如血清和细胞内等环境中断裂,因此许多生物制剂的半衰期很差。
绝大多数生物制剂-包括98%的治疗性单克隆抗体-是在哺乳动物系统中产生的,如中国仓鼠卵巢(cho)细胞。cho细胞具有产生人样糖基化的优点,并且具有必需的折叠伴侣和氧化还原机制以高产率产生含二硫键的蛋白质。然而,cho细胞需要比微生物设施显著更高的资本支出、更长的生产时间(数周至数月相对于数天)、高出许多倍的消耗品成本(例如,培养基)和另外的纯化步骤以除去内源性逆转录病毒样颗粒。
现有两种在细菌中产生含二硫键的生物制剂的方法。首先是改变细胞内的化学环境,使其氧化并允许二硫键形成,但这种变化会显著影响中心代谢,并可能损害发酵性能和蛋白质产生。第二种方法是将新生物质(nascentbiologic)分泌到称为周质的较小氧化区。由于输出期间的能量损失,该方法产生低产率,并且还非常容易通过聚集产生产物损失。由于这些缺点,这两种方法都没有得到广泛采用用于大规模生产含二硫键生物制剂,因此更昂贵的哺乳动物生物过程占主导地位。重要的是,这两种方法都没有解决二硫键对如细胞质或血液等环境中的还原剂敏感的本质问题。
本领域一直需要以有成本效益的方式生产蛋白质生物制剂的方法。本领域一直需要用于生产在血液和细胞质中稳定的蛋白质生物制剂的方法。
技术实现要素:
根据本发明的一个方面,提供了一种蛋白质,其包含至少两个硒代半胱氨酸残基,在至少两个硒代半胱氨酸残基之间具有至少一个二硒键。蛋白质包含选自由下列组成的组的序列:seqidno:1-1631和与所述序列具有至少80%同一性的序列。蛋白质可包含选自由下列组成的组的序列:seqidno:1-1630和与所述序列具有至少80%同一性的序列。蛋白质可包含seqidno:1631的序列和与所述序列具有至少80%同一性的序列。
根据本发明的另一方面,提供了一种抗体分子,其包含(i)选自由seqidno:472-801组成的组的重链序列和与所述序列具有至少80%同一性的序列;(ii)选自由seqidno:812-1131组成的组的轻链序列和与所述序列具有至少80%同一性的序列。抗体分子中的0-15对硒代半胱氨酸残基被0-15对半胱氨酸残基替换。抗体可以在重链和轻链之间含有至少一个二硒键。抗体可在重链内和/或轻链内含有至少一个链内二硒键。
根据本发明的又一方面,提供了经修饰的胰岛素蛋白。它包含(i)具有选自seqidno:1142、1144、1146、1148、1150、1152和1154的序列和与所述序列具有至少80%同一性的序列的a链;和(ii)具有选自seqidno:1143、1145、1147、1149、1151、1153和1155的序列和与所述序列具有至少80%同一性的序列的b链。蛋白质在a链和b链之间包含至少一个二硒键。
根据本发明的一个方面,提供了一种细菌宿主,其已被基因组重新编码,使得未指定的密码子被具有相应反密码子的硒代半胱氨酸trna识别。细菌宿主含有构建的dna序列,其编码蛋白质的变体形式,在所述蛋白质的变体形式中一对半胱氨酸密码子已被未指定的密码子替换。变体形式包含选自由seqidno:1-1631和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含选自由seqidno:1-1630和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含seqidno:1631的序列和与所述序列具有至少80%同一性的序列。
根据本发明的另一方面,提供了一种细菌宿主。细菌宿主已被基因组重新编码,使得未指定的密码子被具有相应反密码子的硒代半胱氨酸trna识别。细菌宿主含有构建的dna序列,其编码单克隆抗体的变体形式,在所述单克隆抗体的变体形式中一对半胱氨酸密码子已被未指定的密码子替换。单克隆抗体包含vl链,并且vl链的第23位和第88位被硒代半胱氨酸残基取代。单克隆抗体包含vh链,并且vh链的第22位和第92位被硒代半胱氨酸残基取代。
根据本发明的另一方面,提供了产生蛋白质的变体形式的方法。蛋白质在半胱氨酸残基之间具有二硫键,并且变体形式在硒代半胱氨酸残基之间具有二硒键。培养已经被基因组重新编码使得未指定的密码子被具有相应反密码子的硒代半胱氨酸trna识别的细菌宿主。细菌宿主含有编码蛋白质的变体形式的构建的dna序列,在所述蛋白质的变体形式中一对半胱氨酸密码子已被未指定的密码子替换。培养在其中表达蛋白质的变体形式的条件下进行。变体形式包含选自由seqidno:1-1631和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含选自由seqidno:1-1630和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含seqidno:1631的序列和与所述序列具有至少80%同一性的序列。
根据本发明的一个方面,提供了产生单克隆抗体的变体形式的方法。单克隆抗体在半胱氨酸残基之间具有二硫键,并且变体形式在硒代半胱氨酸残基之间具有二硒键。培养已经被基因组重新编码使得未指定的密码子被具有相应反密码子的硒代半胱氨酸trna识别的细菌宿主。细菌宿主含有编码单克隆抗体的变体形式的构建的dna序列,在所述单克隆抗体的变体形式中一对半胱氨酸密码子已被未指定的密码子替换。在其中表达单克隆抗体的变体形式的条件下进行培养。单克隆抗体包含vl链,并且vl链的第23位和第88位被硒代半胱氨酸残基取代。单克隆抗体包含vh链,并且vh链的第22位和第92位被硒代半胱氨酸残基取代。
根据本发明的另一方面,提供了用蛋白质的变体形式治疗哺乳动物的方法。将蛋白质的变体形式施用于哺乳动物。蛋白质在半胱氨酸残基之间具有二硫键。变体形式在硒代半胱氨酸残基之间具有二硒键代替半胱氨酸残基之间的二硫键。变体形式包含选自由seqidno:1-1631和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含选自由seqidno:1-1630和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含seqidno:1631的序列和与所述序列具有至少80%同一性的序列。
根据本发明的另一方面,提供了用单克隆抗体的变体形式治疗哺乳动物的方法。将单克隆抗体的变体形式施用于哺乳动物。单克隆抗体在半胱氨酸残基之间具有二硫键,其中变体形式在硒代半胱氨酸残基之间具有二硒键代替半胱氨酸残基之间的二硫键。单克隆抗体包含vl链,并且vl链的第23位和第88位被硒代半胱氨酸残基取代。单克隆抗体包含vh链,并且vh链的第22位和第92位被硒代半胱氨酸残基取代。
根据本发明的一个方面,提供了包含构建的核酸分子和trna分子的体外翻译系统。构建的核酸分子编码蛋白质的变体形式,在所述变体形式中一对半胱氨酸残基已被一对硒代半胱氨酸残基替换。变体形式包含选自由seqidno:1-1631和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含选自由seqidno:1-1630和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含seqidno:1631的序列和与所述序列具有至少80%同一性的序列。核酸分子包含未指定的密码子或利用对同源密码子的抑制以将硒代半胱氨酸掺入生长的多肽中。trna分子是具有对应于未指定密码子的反密码子的硒代半胱氨酸trna。
根据本发明的另一方面,提供了包含构建的核酸分子和trna分子的体外翻译系统。构建的核酸分子编码包含vl链的单克隆抗体的变体形式。vl链的第23位和第88位被硒代半胱氨酸残基取代。单克隆抗体包含vh链,并且vh链的第22位和第92位被硒代半胱氨酸残基取代。构建的核酸分子包含至少一对半胱氨酸密码子,其已被核酸中未指定的密码子替换。trna分子是具有与未指定密码子互补的反密码子的硒代半胱氨酸trna。
根据本发明的另一方面,提供了一种用于产生蛋白质的变体形式的方法。蛋白质在半胱氨酸残基之间具有二硫键,其中变体形式在硒代半胱氨酸残基之间具有二硒键。编码蛋白质的变体形式的构建的核酸序列被翻译。构建的核酸序列包含一对半胱氨酸密码子,其已被未指定的密码子替换。变体形式包含选自由seqidno:1-1631和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含选自由seqidno:1-1630和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含seqidno:1631的序列和与所述序列具有至少80%同一性的序列。翻译步骤使用具有未指定的密码子相应反密码子的硒代半胱氨酸trna。
根据本发明的一个方面,提供了一种测试样品的方法。使样品与蛋白质的变体形式接触以形成反应混合物。蛋白质在半胱氨酸残基之间具有二硫键。变体形式在硒代半胱氨酸残基之间具有二硒键代替半胱氨酸残基之间的二硫键。变体形式包含选自由seqidno:1-1631和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含选自由seqidno:1-1630和与所述序列具有至少80%同一性的序列组成的组的序列。变体形式可包含seqidno:1631的序列和与所述序列具有至少80%同一性的序列。测试反应混合物以检测与蛋白质的变体形式结合的特异性结合配偶体。
根据本发明的另一方面,提供了一种用于测试样品的方法。使样品与单克隆抗体的变体形式接触以形成反应混合物。单克隆抗体在半胱氨酸残基之间具有二硫键。变体形式在硒代半胱氨酸残基之间具有二硒键代替半胱氨酸残基之间的二硫键。单克隆抗体包含vl链,并且vl链的第23位和第88位被硒代半胱氨酸残基取代。单克隆抗体包含vh链,并且vh链的第22位和第92位被硒代半胱氨酸残基取代。测试反应混合物以检测与蛋白质的变体形式结合的特异性结合配偶体。
根据本发明的另一方面,提供了修饰的抗体。它包含至少一个二硒键。
根据本发明的一个方面,提供了经修饰的胰岛素蛋白。它包含具有seqidno:1630的残基90-110的a链,其具有至少一个半胱氨酸至硒代半胱氨酸取代;具有seqidno:1630的残基25-54的b链,其具有至少一个半胱氨酸至硒代半胱氨酸取代;以及a链和b链之间的至少一个二硒桥。
本发明的另一方面是经修饰的人胰岛素蛋白,其包含至少两个硒代半胱氨酸残基替换天然人胰岛素蛋白中的两个半胱氨酸残基。它在至少两个硒代半胱氨酸残基之间具有至少一个二硒键。
在阅读说明书后,本领域技术人员显而易见的这些和其它方面为本领域提供了用于治疗人和动物疾病以及制备和使用治疗剂、诊断剂、分析剂和预防剂的方法和产品。
附图说明
图1显示了二硒键和二硫键的性质比较。
图2显示了二硒化物生物制剂显示出相对于二硫化物的血清半衰期的显著改善。
图3a-图3b显示10μm抗ms2scfv的放大的解卷积质谱(图3a)和片段化序列图(图3b)。使用xtract对片段光谱进行解卷积,s/n阈值为3,并使用prosightlite进行分析。通过标记的硒代半胱氨酸(u)残基之间缺少碎片段离子来指示二硒键的形成。没有检测到对应于丝氨酸掺入的质量峰。
图4显示了6种不同的硒代生物制剂的蛋白质表达。凝胶上的序列1-6对应于序列表中的seqidno:1620-1625。二硒键位于:seqidno:1620secys23-secys97和secys138-secys192;seqidno:1621secys23-secys97、secys138-secys192、secys267-secys327和secys373-secys431;seqidno:1622secys24-secys98;seqidno:1623secys24-secys98、secys164-secys224和secys270-secys328;seqidno:1624secys32-secys92和secys138-secys196;以及seqidno:1625secys4-secys28和secys86-secys92。
图5显示了2种不同的硒代生物制剂的蛋白质表达。凝胶上的序列7-8对应于序列表中的seqidno:1626-1627。二硒键位于seqidno:1626secys183-secys190、secys210-secys234和secys298;以及seqidno:1627secys183-secys190、secys238-secys298和secys344-secys402
图6显示了2种不同的硒代生物制剂的蛋白质表达。凝胶上的序列9-10对应于序列表中的seqidno:1628-1629。二硒键位于seqidno:1628secys54-secys166和secys183-secys190;以及seqidno:1629secys24-secys89和secys149-secys244。
图7a-图7b显示了在不同氧化还原条件下野生型(二硫化物)和硒代(二硒化物)抗rcascfv的elisa数据。将野生型(a)和硒代(seqidno:1631,b)抗-rcascfv在含0、1、10或50mmdtt的tbs(ph7.5)中稀释至1μm,并在37℃下孵育16小时。将蓖麻毒素a链(sigmal9514)在pbs中稀释至10μg.ml,并在4℃下与96孔板结合过夜。对照板用含有5%w/v脱脂乳的pbs结合。将板用pbs洗涤并用含5%w/v脱脂乳的pbs封闭2小时。在用dtt孵育后,将scfv在含5%w/v脱脂乳和0.05%吐温20的pbs中稀释至0、0.25、0.5、1、1.5、2、4、6、8、10、15和20nm并在25℃下一式四份结合,持续2小时。将二抗(抗多组氨酸-hr,sigmaa7058)在含5%w/v脱脂乳和0.05%吐温20的pbs中以1/10,000稀释,并在25℃下结合2小时。将板与tmb一起在25℃孵育10分钟,同时搅拌并通过加入2mh2so4终止显色。立即在450nm处测量吸光度。所有结合、封闭和酶促步骤在轨道振荡器上以450rpm进行,并且所有洗涤均用pbs或含0.05%吐温20的pbs进行。只有野生型抗rcascfv在1和10mmdtt处显示出显著的结合丧失,并且与wtscfv相比,针对硒代抗rca在所有浓度下基本上消除了结合丧失。
图8a-图8b显示了2种不同生物制剂的野生型(二硫化物)和硒代(二硒化物)变体的热变换数据。纯化的野生型和硒代(seqidno:1132)hgh(a)以及野生型和硒代(seqidno:1629)赫赛汀scfv(b)在不同还原条件下的热变性在quantstudio3实时pcr系统上使用appliedbiosystemsproteinthermalshift染料监测。将还原剂dtt以0m和10mm的浓度加入到一式三份的5μghgh-cys/secys和2μg赫赛汀scfv-cys/secys中,然后在室温下孵育10分钟。蛋白质以0.03℃/s的线性斜坡从25℃至98℃变性。熔化温度(tm)通过使用proteinthermalshiftsoftware(thermofisher)找到df/dt的最小值来确定。hgh样本(a)在两种dtt浓度下都显示出一个最小值。在10mmdtt存在下,hgh-cys的tm从没有dtt的77℃降至60℃。与cys变体相比,secys变体在还原条件下显示出显著的稳定性,没有dtt时tm为75℃而在10mmdtt时tm为66℃。对于赫赛汀(b),cys变体在两种条件下都显示出df/dt的两个最小值。加入10mmdtt后,tm最小值从在较高温度(70℃)下的最小值显著移动到较低温度(58℃)。相比之下,赫赛汀-secys在两种dtt浓度中仅有一个最小值。同样,secys变体在还原条件下显示出稳定性,从没有dtt时的tm68c降低至10mmdtt中的64c。
具体实施方式
序列表构成本申请公开内容的一部分,并且作为本公开的一部分并入。
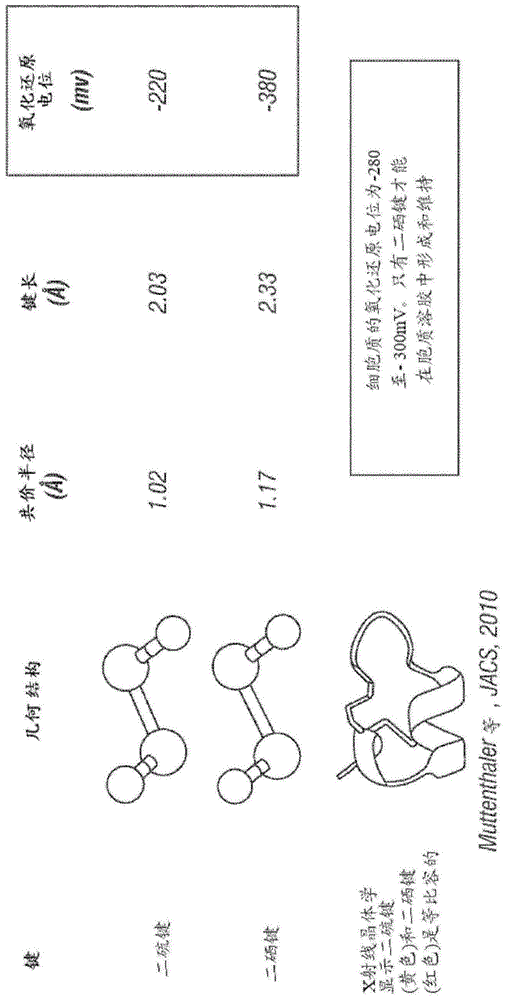
本发明人已经开发了多肽和方法以在基因组重新编码生物体(gro)中产生多肽,所述多肽折叠成通过硒代半胱氨酸氨基酸之间的二硒键稳定的生物制剂。尽管半胱氨酸氨基酸之间的二硫键具有约-220mv的氧化还原电位,但二硒键具有约-380mv的氧化还原电位。由于细菌胞质溶胶通常具有约-280至-300mv的氧化还原电位,因此二硒键而非二硫键避免还原,从而它们在细胞溶胶中形成并持续存在。由于二硒键具有与二硫键相同的几何键角和扭转,以及非常相似的键长,因此它们可以被取代到多肽中而不破坏多肽的三维结构(图1)。此外,因为预期的体内像血液这样的环境含有还原剂如谷胱甘肽、白蛋白和硫氧还蛋白,因此多肽中的二硫键可被还原,导致多肽展开,并且在多个二硫键的情况下,“扰乱的”二硫键,使得不正确的半胱氨酸彼此键合。这两者都导致多肽的预期生物活性的消除。当二硒化物暴露于血清或纯化的血清还原成分时,它们较低的氧化还原电位使其对还原具有抗性(图2),从而使其具有比含二硫键的对应物更长的血清半衰期(muttenhaler等)。
虽然体外通过固相肽合成可以产生带有形成二硒键的硒代半胱氨酸的肽(armishaw等,safavi-hemami等),但该方法不易于按照治疗应用(特别是蛋白质)所需的产量进行缩放。然而,体内重组硒代蛋白的产生受限于硒代半胱氨酸可能出现在蛋白质中的严格序列要求。特别是,硒代半胱氨酸插入序列(secis)元件必须在硒代半胱氨酸掺入位点处出现在编码dna序列中,以募集内源性硒代半胱氨酸翻译机制,所述翻译机制由专门的酶(sela,seld)、trna(selc)和延伸因子(selb)组成。相反,我们使用重新编码的菌株大肠杆菌,其具有未指定的密码子,例如琥珀终止密码子;以及具有抗琥珀反密码子的工程改造的硒代半胱氨酸trna,其允许通过将琥珀终止密码子引入相应的dna编码序列中而将硒代半胱氨酸靶向放入多肽中。通常,重新编码需要从基因组中移除未指定密码子的所有天然存在的实例,以及移除与未指定的密码子相关的翻译机制或以其它方式使其失活(例如,对于琥珀密码子,移除释放因子1或使其失活)。修饰的trna与内源延伸因子ef-tu相互作用。如本领域已知的,其它密码子(通常是稀有密码子)可以被重新编码。参见,ostrov等,science,353:819-822,2016。mrna上的密码子和trna上的反密码子通常是互补碱基序列的三联体。
重新编码蛋白质可以在细菌中合成,例如大肠杆菌细胞,或体外,在翻译或链接的转录翻译系统中。编码这种重新编码蛋白质的基因或mrna是非天然存在的,并且是天然存在的编码序列的变体。
虽然我们在相关序列表中显示的许多蛋白质具有参与被硒代半胱氨酸残基替换的二硫键的所有半胱氨酸残基,但是不需要替换所有半胱氨酸残基以获得取代的益处。甚至一个二硒键也可以改善蛋白质的稳定性。任何数量的二硒键(硒代半胱氨酸对)可以取代蛋白质中的二硫键。如果蛋白质具有n个二硫键,则蛋白质可具有n、n减1、n减2、n减3、n减4、......减至1个这样的键。具有二硒键和二硫键的不同组合的蛋白质显示在seqidno:1220至1631中。还可以在半胱氨酸和硒代半胱氨酸残基之间形成键,称为硒基硫键。该键具有比二硫键(-220mv)更低的氧化还原电位(~270mv),但不低于细菌细胞质(-280mv)。硒基硫键可用于增加某些氧化还原环境中对还原的抗性。硒基硫键可以使用本文描述的方法代替二硒键,方式是用硒代半胱氨酸代替单个二硫键键合的半胱氨酸,或者用半胱氨酸代替单个二硒键键合的硒代半胱氨酸。
使用我们的方法,在标准实验室摇瓶中以mg/l规模,并在微生物发酵罐中按比例扩大成g/l生产,可以在大肠杆菌的胞质溶胶中产生具有取代的硒代半胱氨酸的二硫键稳定的生物制剂的序列。这些序列包括治疗性蛋白质、疫苗和单克隆抗体、抗体片段、抗体缀合物和其它免疫球蛋白样分子。fv结构域可以与任何人fc结构域组合。此外,在我们的系统中可以通过使用可变轻链中的kabat编号用硒代半胱氨酸取代位置23和88处的半胱氨酸和/或通过使用可变重链中的kabat编号用硒代半胱氨酸取代位置22和92处的半胱氨酸来产生任何fv结构域。免疫球蛋白类别igg、iga、igm、igd和ige(包括iga1、iga2、igg1、igg2、igg3和igg4亚类)可以通过这些方法以典型类别产生,其中任何恒定变体与本领域技术人员已知的igκ或λ恒定轻链变体组合。公开的序列中的任何硒代半胱氨酸可以维持为半胱氨酸,只要半胱氨酸的存在不干扰多肽的表达、折叠或预期功能即可。我们公开了以下方法用于产生参与抗体单链可变片段(scfv,图3、图6)、人生长激素(hgh,图6)、pd-l1(图4)、人fc的变体(图4)以及pd-l1和hgh与人fc变体的融合物(图4和图5)的预期二硒键的硒代半胱氨酸并验证其存在,但这些方法也适用于完整单克隆抗体、其它抗体片段、抗体缀合物、其它治疗性蛋白质和疫苗。
根据本发明,可以制备和使用治疗性、诊断性、生物传感性和预防性生物制剂,其中两个硒代半胱氨酸残基之间具有二硒键。此技术和修饰可用于任何蛋白质生物制剂,包括但不限于激素(例如人生长激素,图8)、抗体和抗体片段(图7和图8)、细胞因子、生长因子、结构蛋白等。胰岛素产品,例如lantustm、novorapidtm、humalogtm、humulintm、levemirtm、apidratm和tresibatm可以用于这种修饰,如seqidno:1142-1155所示。这些胰岛素产品的a链可以如seqidno:1142、1144、1146、1148、1150、1152和1154所示进行修饰。这些胰岛素产物的b链可以如seqidno:1143、1145、1147、1149、1151、1153和1155所示进行修饰。二硒键可以是分子内或分子间的。适用于此类修饰的其它蛋白质包括程序性死亡-配体1(pd-l1)、与一个或多个抗体结构域的pd-l1融合蛋白、pd-l1的部分(例如结合结构域,无论是与一个或多个抗体结构域融合还是未融合)、一个或多个抗体结构域、人生长激素(无论是与一个或多个抗体结构域融合还是未融合)和赫赛汀(图4-图8)。这并不预期是可以如此修饰的蛋白质的详尽列表。
尽管在序列表(其形成本公开的一部分)中显示具有特定序列的特定示例性蛋白质,但这些序列不需要以完全保真度使用和再现。如本领域已知的,对蛋白质的轻微修饰(包括等位基因变异和多态性)可以在对其使用和功能无害的蛋白质部分中发生。因此,根据本发明的有用蛋白质可以具有序列表中所示的精确序列,或者它们可以略有不同。例如,有用的蛋白质可以是至少99%、至少98%、至少97%、至少96%、至少95%、至少94%、至少93%、至少92%、至少91%、至少90%、至少89%、至少88%、至少87%、至少86%、至少85%、至少84%、至少83%、至少82%、81%、或至少80%同一。
可根据本发明制备的蛋白质的目的不受限制。它们可以是治疗性蛋白质、预防性蛋白质(如疫苗)、酶蛋白质、内分泌蛋白质、信号传导蛋白质、支架蛋白质、诊断性蛋白质、分析蛋白质等。二硒键通常会使蛋白质在还原剂存在时更稳定。
蛋白质可以在宿主细胞中、或体外在无细胞合成系统中制备。宿主细胞可以是任何可以被稳健地重新编码的细胞。这些可以是具有良好发育的遗传系统的细菌细胞,其中大肠杆菌是示例性的。也可以使用其它细菌种类。用于产生蛋白质的无细胞系统可以是偶联的转录/翻译系统或仅是翻译系统。本发明方法的一个值得注意的方面是使用生物合成而不是化学合成方法。
培养具有构建的核酸序列的重新编码的细胞可以通过本领域已知的任何方法进行。培养可以是分批的或连续的,在摇瓶中或在发酵罐中或固定在固体表面上,例如包含在较大容器中的小颗粒。通常,培养基将补充有硒源,例如na2seo3。如本领域所知,所需蛋白质变体的产生可以在诱导物或阻遏物的控制下进行。可以选择本领域已知的任何此类系统以便于构建和蛋白质生产。
向需要这种治疗的受试者施用治疗性、诊断性或预防性蛋白质可以通过本领域已知的任何方法进行并且适合于蛋白质。这些包括但不限于静脉内、肌肉内、皮下、鞘内、口腔、冠状动脉内和颅内递送。由于稳定性和靶标,某些蛋白质适合于某些类型的递送。施用治疗性蛋白质可包括一种或多种药学上可接受的载体,诸如例如液体或固体填充剂、稀释剂、赋形剂、缓冲剂、稳定剂或包封材料。
以上公开内容总体上描述了本发明。本文公开的所有参考文献明确地通过引用并入。通过参考以下具体实施例可以获得更完整的理解,这些实施例仅出于说明的目的而提供,并不意图限制本发明的范围。
实施例1
scfv表达和纯化
将用携带编码抗-αms2scfv抗体的基因(其中uag密码子指导硒代半胱氨酸掺入,取代替代所有半胱氨酸密码子)的质粒pacyc-pcau-ams2转化的rtδa2x310k细胞以1/250稀释在1l补充有1000μg.ml羧苄青霉素、12.5μg.ml四环素和25μmna2seo3的优质肉汤中,在中期对数期期间用(1mm)3,4--二-羟基苯甲酸诱导,然后在37℃下生长o/n。通过在8000xg下离心10分钟收获细胞,并重悬于25ml具有蛋白酶抑制剂混合物(complete,无miniedta,roche)和溶菌酶(0.5mg.ml-1)的洗涤缓冲液(ph8.0的50mmk2hpo4、300mmnacl、20mm咪唑和10%甘油)中。在4℃温和搅拌下孵育20分钟后,通过超声处理(model500,fisherscientific)裂解细胞,并通过在35000xg下离心30分钟澄清三次。将裂解物通过0.2μm膜过滤,并使用ni-nta树脂和重力流动柱通过imac回收蛋白质。将洗脱液浓缩至3ml并对tbs(ph7.5)透析,然后通过尺寸排阻fplc纯化至表观均一性。在透析期间沉淀相当大比例的样品,另外一部分样品以较不稳定/可溶的二聚体形式存在。可溶性ams2硒代-scfv单体的最终产量为3mg/l。
将用携带编码抗tnf(肿瘤坏死因子)scfv抗体的基因(其中uag密码子指导硒代半胱氨酸掺入,取代替代所有半胱氨酸密码子)的质粒pacyc-teto-atnf转化的rtδa2x310k-t7细胞以1/250稀释在1l补充有1000μg.ml羧苄青霉素、33μg.ml氯霉素和25μmna2seo3的优质肉汤中,在中期对数期期间用200ng.ml无水四环素诱导,然后在30℃下生长o/n。如前所述,通过imac收获细胞并纯化。为了减少沉淀,将样品以更大的体积(>6ml)透析。通过尺寸排阻fplc或阴离子交换色谱(hitrapqhp柱)将蛋白质样品纯化至均一。通过相同的方法纯化抗rca、抗gm-csf和抗干扰素γ硒代-scfv。可溶性硒代-scfv单体的最终产率范围为0.5-1mg/l。
实施例2
质谱
使用先前描述的方法分析完整蛋白质样品。使用10kda分子量截留过滤器将硒代蛋白质样品缓冲液交换至lc-ms级水中。一旦缓冲液交换完成,将样品在甲醇/水/甲酸(50/49/1)溶液中稀释至20μm。稀释后,将蛋白质溶液以3μl.min-1的速率通过电喷雾电离注入orbitrapelite质谱仪(thermofisherscientificinstruments,bremen,germany)。为了确认硒代半胱氨酸的掺入,以240k分辨率并平均进行20次扫描进行完整质量分析。蛋白质序列的表征通过紫外光解离(uvpd)使用193nm准分子激光器(coherent,inc.)进行,该激光器如前所述与orbitrap质谱仪连接。对于每个uvpd光谱,使用2.5mj的两个激光脉冲并平均进行250次扫描。使用xtract解卷积算法(thermofisherscientific)对ms1光谱进行解卷积。还使用xtract对uvpd质谱进行解卷积,然后使用prosightpc3.0进行分析。通过在四个掺入位点上向丝氨酸残基添加61.9146da的修饰(包括由于二硒键的形成而减少一个氢原子),搜索含有硒代半胱氨酸的蛋白质。通过修饰的蛋白质峰的面积除以未修饰的蛋白质峰和修饰的蛋白质峰的总面积来计算掺入效率。用于每种蛋白质的峰面积是来自每个同位素簇的五个最丰富峰的积分面积的总和。
实施例3
适用于表达具有非标准氨基酸的多肽的uag基因组重新编码生物体
完全去除uag密码子翻译功能的基因组重新编码生物体(gro)用于在uag处明确地掺入非标准氨基酸(nsaa)。参见lajoie,m.j.等.genomicallyrecodedorganismsexpandbiologicalfunctions.science342,357-360,doi:10.1126/science.1241459(2013),其全部内容通过引用并入本文。基因组重新编码生物体可包括一个或多个重新分配的三联体密码子,以促进非标准氨基酸(nsaaa)的掺入,例如硒代半胱氨酸。可以使用本领域技术人员已知的方法将三联体密码子重新分配以掺入非标准氨基酸,例如硒代半胱氨酸。参见lajoie,m.j.等.probingthelimitsofgeneticrecodinginessentialgenes.science342,361-363,doi:10.1126/science.1241460(2013),通过引用整体并入。还参见thyer,r.等.evolvingtrnasecforefficientcanonicalincorporationofselenocysteine.jacs137(1),46-49,(2015),通过引用整体并入。还参见ostrov,等.design,synthesis,andtestingtowarda57-codongenome,science353,819-822,2016。或者,使用本领域技术人员已知的方法,可以使用四联体密码子掺入非标准氨基酸。参见anderson,j.c.等.anexpandedgeneticcodewithafunctionalquadrupletcodon.proc.natl.acad.sci.u.s.a.101,7566-7571,doi:10.1073/pnas.0401517101(2004),neumann,h.,wang,k.,davis,l.,garcia-alai,m.&chin,j.w.encodingmultipleunnaturalaminoacidsviaevolutionofaquadruplet-decodingribosome.nature464,441-444,(2010)和chatterjee,a.,lajoie,m.j.,xiao,h.,church,g.m.&schultz,p.g.abacterialstrainwithauniquequadrupletcodonspecifyingnon-nativeaminoacids.chembiochem,n/a-n/a,doi:10.1002/cbic.201402104(2014)每个都通过引用整体并入。开发了正交氨酰-trna合成酶(aars)/trna对,它基于非功能性uag三联体特异性且有效地解码四联体uaga密码子,从而在uaga密码子处明确掺入非标准氨基酸,如硒代半胱氨酸,产生高蛋白质产量。这种四联体密码子可用于本方法中。
已经合成了超过100种具有不同化学性质的nsaa,并使用进化的正交氨酰-trna合成酶(aars)/trna对共翻译并入蛋白质中。参见liu,c.c.&schultz,p.g.addingnewchemistriestothegeneticcode.an.rev.biochem.79,413-444,doi:10.1146/annurev.biochem.052308.105824(2010),通过引用整体并入。非标准氨基酸是基于酪氨酸或吡咯赖氨酸设计的。可以在质粒上或基因组重新编码生物体的基因组中提供aars/trna。正交aars/trna对用于生物正交地将nsaa掺入蛋白质中。基于载体的过表达系统可用于通过其再分配功能来胜过自然密码子功能。参见wang,l.,brock,a.,herberich,b.&schultz,p.g.expandingthegeneticcodeofescherichiacoli.science292,498-500(2001),young,t.s.,ahmad,i.,yin,j.a.&schultz,p.g.anenhancedsystemforunnaturalaminoacidmutagenesisine.coli.journalofmolecularbiology395,361-374(2009),和chatterjee,a.,sun,s.b.,furman,j.l.,xiao,h.&schultz,p.g.aversatileplatformforsingle-andmultiple-unnaturalaminoacidmutagenesisinescherichiacoli.biochemistry52,1828-1837,doi.10.1021/bi4000244(2013)其各自通过引用整体并入。如果完全消除天然uag翻译功能,则低得多的aars/trna功能可能足以实现有效的nsaa掺入。基于gro的nsaa掺入可以使用基于载体和/或基因组的aars/trna对。基于基因组的aars/trna对已被用于在缺乏可用的nsaa的情况下减少经典氨基酸的错误掺入(mandell和lajoie等,nature.2015年2月5日;518(7537):55-60.doi:10.1038/nature14121,其通过引用并入)。
由于uag密码子功能已在基因组重新编码生物体中完全重分配,因此可将nsaa(例如硒代半胱氨酸)掺入基因组重新编码生物体中而没有任何表型后果。在基因组重新编码生物体中掺入nsaa可以包括用非标准氨基酸(例如硒代半胱氨酸)和aars的诱导物补充生长培养基。或者,aars可以组成型表达。或者,如在本公开中,内源性丝氨酰-trna合成酶可用于硒化硒代半胱氨酸trna,其中trna被包含sela和seld的酶作用以产生trnasec(硒代半胱氨酸带电荷的trna)。培养基可以补充硒源如亚硒酸钠以改善trnasec的产生。使用任何所需的蛋白质过表达系统可以过表达所需的蛋白质(例如,基于iptg/异乳糖、无水四环素、阿拉伯糖、鼠李糖或其它可诱导系统的t7-rnap、组成型掺入或诱导型表达)。蛋白质交联(二硒键)可以在蛋白质折叠期间基于临近和取向自发形成,并且蛋白质可以作为任何其它过表达产物处理。
实施例4
方法
将编码目的基因的序列克隆到具有由tet阻遏物控制的t7启动子的氯霉素抗性载体中。将载体转化到2x310k细胞中,其中整合的t7rna聚合酶由tet操纵子控制。使细胞生长至od~0.6,并在室温下用100ng/ml的atc诱导过夜。使诱导的细胞沉淀并重悬于20mmtris(ph7.4)、100mmnacl、20mm咪唑和0.01%tritonx-100中,然后通过超声裂解。将裂解物离心以分离并沉淀。将上清液在与裂解相同的缓冲液中的ni-亲和珠上运行。目的蛋白质在pbs(ph7.4)中洗脱,加入300mm咪唑。将纯化的级分在sdspage凝胶上电泳。10种不同的硒代生物制剂的结果显示在图4-图6中。
参考文献
所引用的每篇参考文献的公开内容明确地并入本文。
1.anderson,j.c.etal.anexpandedgeneticcodewithafunctionalquadrupletcodon.proc.natlacadsci.u.s.a.101,7566-7571,doi:10.1073/pnas.0401517101(2004),
2.armishaw,c.j.,daly,n.l.,nevin,s.t.,adams,d.j.,craik,d.j.&alewood,p.f.alpha-selenoconotoxins,anewclassofpotentalpha7neuronalnicotinicreceptorantagonists.jbiolchem281,14136-43(2006).
3.chatterjee,a.,lajoie,m.j.,xiao,h.,church,g.m&schultz,p.g.abacterialstrainwithauniquequadrupletcodonspecifyingnon-nativeaminoacids.chembiochem,n/a-n/a,doi:10.1002/cbic.201402104(2014)
4.chatterjee,a.,sun,s.b.,furman,j.l.,xiao.h.&schultz,p.g.aversatileplatformfotsingle-andmultiple-unnaturalaminoacidmutagenesisinescherichiacoli.biochemistry52,1828-1837,doi:10.1021/bi4000244(2013)
5.lajoie,m.j.etal.genomicallyrecodedorganismsexpandbiologicalfunctions.science342.357-360,doi:10.1126/science.1241459(2013)
6.lajoie,m.j.etal.probingthelimitsofgeneticrecodinginessentialgenes.science342,361-363,doi:10.1126/science.1241460(2013)
7.liu,c.c.&schultz,p.g.addingnewchemistriestothegeneticcode.anrev.biochem.79,413-444,doi:10.1146/annurev.biochen.052308.105824(2010)
8.mandellandlajoieetal.,nature.2015feb5:518(7537):55-60,doi:10.1038/nature14121,
9.muttenthaler,m.,andersson,a.,dearaujo,ad.,dekan,z.,lewis,r.j.&alewood,p.f.modulatingoxytocinactivityandplasmastabilitybydisulfidebondengineering.jmedchem53,8585-96(2010).
10.neumann,h.,wang,k.,davis,l.,garcia-alai,m.&chin,j.w.encodingmultipleunnaturalaminoacidsviaevolutionofaquadruplet-decodingribosome.nature464,441-444,(2010)
11.ostrov,ctal.design,synthesis,andtestingtowarda57-codongenome,science353,819-822,2016
12.safavi-hemami,h.,gajewiak,j.,karanth,s.,robinson,s.d.,ueberheide,b.,douglass,a.d.,schlegel,a.,imperial,j.s.,watkins.m.,bandyopadhyay,p.k.,yandell,m.,li,q.,purcell,a.w.,norton,r.s.,ellgaard,l.&olivera,b.m.specializedinsulinisusedforchemicalwarfarebyfish-huntingconesnails.procnatlnatlacadsciusa112,1743-8(2015).
13.thyer,r.etal.evolvingtrnasecforefficientcanonicalincorporationofselenocysteine.jacs137(1),46-49,(2015)
14.wang,l.,brock,a.,herberich,b.&schultz,p.g.expandingthegeneticcodeofescherichiacoli.science292,498-500(2001)
15.young,t.s.,ahmad,l,yin,j.a.&schultz,p.g.anenhancedsystemforunnaturalaminoacidmutagenesisine.colijournalofmolecularbiology395,361-374(2009).
- 还没有人留言评论。精彩留言会获得点赞!