核酸的聚烷氧基化方法,其能够回收和再利用过量的聚烷氧基化试剂与流程
药物(诸如核酸、肽、蛋白质和纳米颗粒)与其他部分(诸如聚烷氧基化合物)的缀合被广泛用于提高治疗应用的生物利用度、稳定性、安全性和功效。在寡核苷酸治疗领域内,适体和镜像适体(spiegelmers)(也称为镜像成像适体)通常是多烷氧基化的。聚乙二醇(缩写peg)是一种常用的聚烷氧基化合物,已被食品和药物管理局批准作为静脉内、口服和皮肤施用的药物的一部分。
通常,通过首先在固相上组装含有反应基团的核酸的方法制备聚烷氧基化核酸(hoffmann等人,currentprotocolsinnucleicacidchemistry2011,4:4.46.1–4.46.30)。从固相切割和脱保护后,合成的核酸通过诸如反相高效液相色谱(缩写rp-hplc)或离子交换色谱高效液相色谱法(缩写iex-hplc)或超滤(缩写uf)等方法纯化。然后核酸的反应基团可以与具有合适的匹配反应基团的聚烷氧基化合物反应,形成聚烷氧基化合物和核酸的缀合物。缀合后,由聚烷氧基化核酸分子和非聚烷氧基化核酸分子组成的粗产物通过可以是hplc,特别是rp-或iex-hplc和超滤的组合的方法纯化。
聚烷氧基化反应的产量取决于待聚烷氧基化的核酸的性质和纯度,聚烷氧基化反应的类型和反应条件本身。用于核酸聚烷氧基化的最常用反应类型是:
a)在碱存在下通过氨基修饰的寡核苷酸对聚烷氧基羧酸活性酯的氨解;
b)将硫醇修饰的寡核苷酸添加到带有马来酰亚胺基团的聚烷氧基化合物中;和
c)叠氮化物修饰的寡核苷酸与带有炔基的聚烷氧基化合物或炔烃修饰的寡核苷酸与带有叠氮基的聚烷氧基化合物的的1,3-偶极环加成反应。
最广泛使用的聚烷氧基化反应是在碱存在下通过氨基修饰的寡核苷酸对聚烷氧基羧酸活性酯的氨解。反应快速且易于扩展。马来酰亚胺-硫醇的添加不需要任何碱,是快速的和选择性反应,但是硫醇需要用还原剂如dtt在单独反应步骤中从二硫化物前体中释放。过量的dtt必须在缀合反应之前完全除去,因为它也会添加到马来酰亚胺中,因此会降低产量。由于释放的硫醇将经历氧化,因此必须快速去除dtt。这使得针对大规模生产的使用变得复杂。1,3-偶极环加成,也称为“链接反应”,需要存在铜作为催化剂或存在空间受限的炔烃物质。对于无金属的“链接反应”,需要将叠氮化物或空间受限的炔烃在合成后引入寡核苷酸,因为两者都对亲核碱基敏感,诸如用于寡核苷酸的切割和去保护的甲胺/氨。
考虑到马来酰亚胺-硫醇加成和“链接反应”的限制,大规模地形成聚烷氧基化寡核苷酸最好藉由通过氨基修饰的寡核苷酸对聚烷氧基羧酸活性酯的氨解进行。通常,聚烷氧基羧酸作为n-羟基琥珀酰亚胺酯活化,其在单独的反应中制备、纯化并储存直至使用。由于它们的反应性质,上述酯易于水解成相应的游离聚烷氧基羧酸和n-羟基琥珀酰亚胺。这不可避免地要求在处理、储存或运输这样的物质时采取预防措施。
本发明所要解决的问题是提供制备经修饰的核酸分子的方法,更具体地,提供聚烷氧基化的核酸分子,诸如聚乙二醇化的核酸分子的方法。
这个和其他问题通过所附的独立权利要求的主题解决。优选实施例可以从所附的从属权利要求中获得。
在第一方面(其也是第一方面的第一个实施方案),本发明所要解决的问题藉由通过使第一反应物和第二反应物反应来制备包含核酸部分和非核酸部分的经修饰的核酸分子的方法更具体地解决,其中所述第一反应物包含非核酸部分和羧基,且其中所述第二反应物是氨基修饰的核酸分子,所述氨基修饰的核酸分子包含所述核酸部分和包含与所述核酸部分附接的氨基的氨基修饰,其中所述方法包括以下步骤:
a)通过在水混溶性有机溶剂中的缩合试剂活化所述第一反应物,优选所述第一反应物的羧基,以及
b)使步骤a)的活化的第一反应物,优选所述第一反应物的活化的羧基,与所述第二反应物,优选已溶解在水或水混溶性有机溶剂和水的混合物中的所述氨基修饰的核酸分子的氨基修饰的氨基相反应,
由此形成所述经修饰的核酸分子。
在第一方面的第二个实施方案(其也是第一方面的第一实施方案的实施方案)中,所述氨基修饰的核酸分子在季铵盐存在下溶解在水和水混溶性有机溶剂的混合物中。
在第一方面的第三个实施方案(其也是第一方面的第一个和第二个实施方案的实施方案)中,将步骤a)的活化的第一反应物添加至溶解在水中或水混溶性有机溶剂和水的混合物中的所述氨基修饰的核酸分子。
在第一方面的第四个实施方案(其也是第一方面的第一个、第二个和第三个实施方案的实施方案)中,所述第一反应物和/或所述非核酸部分选自包含以下各项的组:聚烷氧基化合物、肽、蛋白质、糖蛋白、核酸、碳水化合物部分以及不同于肽、蛋白质、糖蛋白、核酸和/或基于碳水化合物的部分的化学部分,优选地所述第一反应物和/或所述非核酸部分是聚烷氧基化合物。
在第一方面的第五个实施方案(其也是第一方面的第一个、第二个、第三个和第四个实施方案的实施方案)中,所述氨基修饰的核酸分子适用于分析方法、诊断和/或治疗。
在第一方面的第六实施方案中,其也是第一方面的第一、第二、第三、第四和第五实施方案的实施方案,所述氨基修饰的核酸分子选自包含以下各项的组:氨基修饰的适体、氨基修饰的镜像适体(spiegelmer)、氨基修饰的免疫刺激核酸、氨基修饰的sirna、氨基修饰的mirna分子和氨基修饰的核酸反义分子,优选地适体是由l-和/或d-核苷酸组成的适体
和/或其中所述核酸部分选自包括以下的组:适体、镜像适体、免疫刺激性核酸、sirna、mirna分子和核酸反义分子,优选地适体是由l-和/或d-核苷酸组成的适体。
在第一方面的第七个实施方案(其也是第一方面的第一个、第二个、第三个、第四个、第五个和第六个实施方案的实施方案)中,在步骤b)中使用超过所述氨基修饰的核酸分子的过量的所述活化的第一反应物的分子。
在第一方面的第八个实施方案(其也是第一方面的第七个实施方案的实施方案)中,所述过量表示为所述活化的第一反应物和所述氨基修饰的核酸分子的分子的摩尔比,其中所述摩尔比为约1.1至约10,优选约1.5至约3.5。
在第一方面的第九个实施方案(其也是第一方面的第一个、第二个、第三个、第四个、第五个、第六个、第七个和第八个实施方案的实施方案)中,为了活化根据步骤a)的所述第一反应物,将所述第一反应物溶解在水混溶性有机溶剂中,并添加缩合剂和碱,优选地首先添加缩合剂随后添加碱,其中优选地将所述缩合剂溶解在水混溶性有机溶剂中。
在第一方面的第十个实施方案(其也是第一方面的第九个实施方案的实施方案)中,所述碱是非亲核碱。
在第一方面的第十一个实施方案(其也是第一方面的第九个和第十个实施方案的实施方案)中,在添加所述碱后,在0.25min至60min之间,优选在0.5min至20min之间,更优选在1.0min至5.0min之间,将由此获得的溶液添加至含有所述氨基修饰的核酸分子的溶液中,优选在添加所述碱后1.0min至5.0min之间,将包含所述缩合剂和所述碱的溶液添加至含有所述氨基修饰的核酸分子的溶液中。
在第一方面的第十二个实施方案(其也是第一方面的第九个、第十个和第十一个实施方案的实施方案)中,所述缩合剂选自包含以下各项的组:
a)鏻盐,如bop、pybop、pybrop、aop、pyaop、brop和pyclop
b)脲盐,如hctu,tctu,tbtu,hbtu,hatu,totu和comu,以及
c)碳二亚胺,
其中优选地所述缩合溶剂是pybop、tbtu、comu、hbtu,更优选是hbtu。
在第一方面的第十三个实施方案(其也是第一方面的第十二实施方案的实施方案)中,所述碳二亚胺选自包含以下各项的组:dcc(n,n'-二环己基碳二亚胺)、edc(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺)和dic(n,n'-二异丙基碳二亚胺)。
在第一方面的第十四个实施方案(其也是第一方面的第一个、第二个、第三个、第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个和第十三个实施方案的实施方案)中,所述水混溶性有机溶剂选自包含以下各项的组:甲醇、乙醇、正丙醇、异丙醇、正丁醇、仲丁醇、叔丁醇、二甲基亚砜、二乙基亚砜、甲基乙基亚砜、甲酰胺、甲基甲酰胺、二甲基甲酰胺、乙基甲酰胺、乙基甲基甲酰胺、二乙基甲酰胺、2-吡咯烷酮、n-甲基吡咯烷酮、n-乙基吡咯烷酮、乙腈、丙酮、乙基甲基酮、甲基丙基酮、二乙基酮、甲基异丙基酮、甲酸甲酯、甲酸乙酯、甲酸丙酯、甲酸异丙酯、乙酸甲酯、乙酸乙酯、丙酸甲酯、四氢呋喃和二恶烷,优选二甲基甲酰胺、乙腈和二甲基亚砜。
在第一方面的第十五个实施方案(其也是第一方面的第一个、第二个、第三个、第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个和第十四个实施方案的实施方案)中,所述碱选自包含以下各项的组:二异丙基乙胺(dipea)、三甲胺和dbu,优选二异丙基乙胺(dipea)。
在第一方面的第十六实施方案中(其也是第一方面的第九个、第十个、第十一个、第十二个、第十三个、第十四个和第十五个实施方案的实施方案)中,所述碱与所述第一反应物的摩尔比等于或大于1。
在第一方面的第十七个实施方案(其也是第一方面的第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个和第十六个实施方案的实施方案)中,所述氨基修饰的核酸分子的溶液含有碱,优选非亲核碱,由此优选地所述非亲核碱与所述氨基修饰的核酸分子中的磷酸二酯的数量的摩尔比大于3。
在第一方面的第十八个实施方案(其也是第一方面的第一个、第二个、第三个、第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个、第十六个和第十七个实施方案的实施方案)中,步骤a)在5℃至60℃的温度下进行,优选在10℃至40℃的温度下进行,更优选在15℃至30℃的温度下进行,最优选在环境温度下。
在第一方面的第十九个实施方案(其也是第一方面的第一个、第二个、第三个、第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个、第十六个、第十七个和第十八个实施方案的实施方案)中,步骤b)在5℃至60℃的温度下进行,优选在10℃至40℃的温度下进行,更优选在15℃至30℃的温度下进行,最优选在环境温度下。
在第一方面的第二十个实施方案(其也是第一方面的第一个、第二个、第三个、第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个、第十六个、第十七个、第十八个和第十九个实施方案的实施方案)中,所述第一反应物的活化的羧基与所述氨基修饰的核酸分子的氨基的反应在5分钟至6小时后,优选在15分钟至45分钟后,更优选15至30分钟后完成。
在第一方面的第二十一个实施方案(其也是第一方面的第一个、第二个、第三个、第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个、第十六个、第十七个、第十八个、第十九个和第二十个实施方案的实施方案)中,步骤b)在7.5至10的ph范围内,优选在7.5至9的ph范围内,更优选在7.5至8.5的ph范围内进行。
在第一方面的第二十二个实施方案(其也是第一方面的第一个、第二个、第三个、第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个、第十六个、第十七个、第十八个、第十九个、第二十个和第二十一个实施方案的实施方案)中,在步骤b)中,将所述活化的第一反应物添加到所述氨基修饰的核酸分子的溶液中,直到80%至100%的所述氨基修饰的分子与所述第一反应物反应,优选地直至90%至100%的所述氨基修饰的核酸分子与所述第一反应物反应。
在第一方面的第二十三个实施方案(其也是第一方面的第一个、第二个、第三个、第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个、第十六个、第十七个、第十八个、第十九个、第二十个、第二十一个和第二十二个实施方案的实施方案)中,在步骤b)完成之后,通过超滤和/或色谱,优选通过离子交换色谱法从反应中分离任何未反应的第一反应物。
在第一方面的第二十四个实施方案(其也是第一方面的第二十三个实施方案的实施方案)中,将分离的第一反应物再循环并用于步骤a)。
在第一方面的第二十五个实施方案(其也是第一方面的第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个、第十六个、第十七个、第十八个、第十九个、第二十个、第二十一个、第二十二、第二十三个和第二十四个实施方案的实施方案)中,所述聚烷氧基化合物是直链或支链聚烷氧基化合物。
在第一方面的第二十六个实施方案(其也是第一方面的第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个、第十六个、第十七个、第十八个、第十九个、第二十个、第二十一个、第二十二、第二十三个、第二十四个和第二十五个实施方案的实施方案)中,所述聚烷氧基化合物选自包含以下各项的组:聚乙二醇、聚丙二醇、聚丁二醇、聚甘油。
在第一方面的第二十七个实施方案(其也是第一方面的第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个、第十六个、第十七个、第十八个、第十九个、第二十个、第二十一个、第二十二、第二十三个、第二十四个、第二十五个和第二十六个实施方案的实施方案)中,所述聚烷氧基化合物是聚乙二醇。
在第一方面的第二十八个实施方案(其也是第一方面的第四个、第五个、第六个、第七个、第八个、第九个、第十个、第十一个、第十二个、第十三个、第十四个、第十五个、第十六个、第十七个、第十八个、第十九个、第二十个、第二十一个、第二十二、第二十三个、第二十四个、第二十五个、第二十六个和第二十七个实施方案的实施方案)中,所述聚烷氧基化合物的分子量为5,000da至100,000da,优选地20,000da至80,000da,更优选地40,000da。
在第二方面,本发明的问题是通过以下解决:根据第一方面的方法获得的经修饰的核酸分子(包括其任何实施方案)。
在第三方面,本发明的问题是通过以下解决:根据第一方面的方法获得的经修饰的核酸分子(包括其任何实施方案)用于治疗。
在第四方面,本发明的问题是通过以下解决:根据第一方面的方法获得的修饰的核酸分子(包括其任何实施方案)用于诊断。
在第五方面,本发明的问题是通过以下解决:由根据第一方面的方法获得的修饰的核酸分子(包括其任何实施方案)在用于分析样品的体外方法中的用途。
本发明基于对氨基修饰的寡核苷酸的多烷氧基化的改进方案的惊人鉴定,其允许更有效地生产聚烷氧基化核酸,如现有技术中已知的(hoffmann等人,currentprotocolsinnucleicacidchemistry2011,4:4.46.1–4.46.30)。本发明特别提供了制备聚烷氧基化核酸的方法,该方法包括在缀合反应之前使氨基修饰的核酸与用缩合试剂活化的聚烷氧基羧酸反应。另外,出乎意料地发现,在诸如通过uf和/或hplc纯化粗聚烷氧基化产物的下游加工过程中,过量使用以促使反应完成的聚烷氧基羧酸可以被回收。干燥后,再循环的聚烷氧基羧酸可重复用于另一个聚烷氧基化反应。
与现有技术的方法相比,本发明的方法具有各种优点。更具体地,本发明的方法更省力,并且是一种更环保的制造方法,能够回收过量使用的带有羧基的第一反应物。而且,带有羧基的第一反应物的制备需要较少的制造步骤,因此比现有技术中描述的活化羧基反应物的制备和分离更省力。而且,带有羧基的第一反应物比现有技术中描述的活化羧基部分更稳定,并且不需要特殊的冷藏条件,这增加了本发明方法的优点。
鉴于上文和根据本发明,聚烷氧基羧酸本身可用作与氨基修饰的核酸分子(诸如氨基修饰的寡核苷酸)反应的起始材料,以便分别形成经修饰的核酸分子和经修饰的寡核苷酸,由此所述修饰优选为聚烷氧基部分,更优选为peg部分。
在本发明方法的一个实施方案中,在本发明方法的步骤a)中制备的活化的第一反应物与氨基修饰的核酸分子反应,由此反应在溶液中发生;这种溶液的元素包括所述活化的第一反应物和所述氨基修饰的核酸分子和溶剂,由此所述溶剂选自包含水以及水混溶性有机溶剂和水的混合物的组。优选地,将活化的第一反应物和/或氨基修饰的核酸分子溶解或分散在该溶剂或这种溶剂的一部分中。如本文优选使用的,溶剂的一部分是该溶剂的一相或由溶剂形成的一相。
在本发明方法的一个实施方案中,将活化的第一反应物添加至氨基修饰的核酸中,由此,优选地,氨基修饰的核酸存在于溶液中。在一个备选的实施方案中,将优选地存在于溶液中的氨基修饰的核酸添加至第一活化反应物,优选地至步骤a)的第一活化反应物。
在本发明方法的一个实施方案中,所述核酸部分包含核酸分子。
在本发明方法的一个实施方案中,所述非核酸部分带有羧基。
在本发明方法的一个实施方案中,所述氨基修饰的核酸分子包含核酸部分和附接至核酸部分的氨基修饰。
在本发明方法的一个实施方案中,在氨基修饰的核酸分子与第一反应物反应之前,将氨基修饰的核酸分子溶解在水或水混溶性有机溶剂和水的混合物中。因此,在与第一反应物反应之前和之后氨基修饰的核酸分子所存在的溶液是不同的,对于溶液和形成这种溶液的溶剂也是如此。
在一个实施方案中并且如本文优选使用的,所述碳水化合物部分是包含碳水化合物或碳水化合物聚合物的部分。所述碳水化合物部分包括但不限于碳水化合物、碳水化合物的聚合物、糖蛋白、核苷酸和核酸。
在本发明方法的一个实施方案中,所述氨基修饰的免疫刺激核酸是氨基修饰的免疫刺激核酸。
在本发明方法的一个实施方案中,所述免疫刺激核酸是免疫刺激核酸。
在本发明方法的一个实施方案中,适体是靶结合核酸,其优选通过不同于watson-crick碱基配对或hoogsteen碱基配对的结合与靶标结合。优选地,所述适体由d-核苷酸组成。在备选实施方案中,所述适体是混合适体,其包含d-核苷酸和至少一个l-核苷酸,由此优选地所述适体中l-核苷酸的数目低于d-核苷酸的数目。
在本发明方法的一个实施方案中,镜像适体是l-核苷酸的靶结合核酸,其优选地通过不同于watson-crick碱基配对或hoogsteen碱基配对的结合与靶标结合。优选地,镜像适体由l-核苷酸组成。在备选实施方案中,镜像适体是混合的镜像异构体,其包含l-核苷酸和至少一个d-核苷酸,由此优选地适体中d-核苷酸的数目低于l-核苷酸的数目。
适体和镜像适体二者都可以被修饰。这种修饰可以与这种适体和镜像适体的核苷酸序列的单个核苷酸有关,并且是本领域熟知的。此类修饰的实例尤其由venkatesan等人(venkatesan,n.,kim,s.j.,等人,curr.med.chem.10,1973(2003))和kusser(kusser,w.,j.biotechnol.74,27(2000))描述。这种修饰可以是位于组成适体的单个核苷酸的2'位的h原子、f原子或och3基团或nh2-基团。而且,根据本发明的适体可包含至少一个锁核苷酸(lna)或解锁核苷酸(una)。
在一个实施方案中并且如本文优选使用的,所述环境温度意指20℃至22℃。
在本发明方法的一个实施方案中,所述氨基修饰的核酸分子包含氨基;优选地,所述氨基可以与羧基,优选地与活化的羧基反应。
在本发明方法的一个实施方案中,活化的第一反应物是已经通过缩合试剂的手段活化的第一反应物;优选地,活化的第一反应物是包含活化的羧基的第一反应物,由此活化的羧基由通过缩合试剂的手段进行活化的第一反应物的羧基而产生。
在本发明方法的一个实施方案中使用的季铵盐用于增强氨基修饰的核酸分子在水和水混溶性有机溶剂的混合物中的溶解度。其选自包含以下各项的组:四烷基氯化铵、四烷基溴化铵、四烷基铵四氟硼酸盐、四烷基六氟磷酸盐、四烷基硫酸氢盐、四烷基磷酸氢盐,其中烷基是由1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17或18个c原子组成的烷基链,其中优选地所述季铵化合物是四丁基溴化铵。
在本发明方法的一个实施方案中,脂肪酸包括饱和脂肪酸和具有一个或几个双键的不饱和脂肪酸。饱和和不饱和脂肪酸均可具有8至30个碳原子的链长,即长度为8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个碳原子。
在本发明方法的一个实施方案中,类固醇包括皮质类固醇诸如胆固醇,胆汁酸诸如胆酸和石胆酸,类固醇激素诸如皮质醇或黄体酮,类固醇糖苷诸如地高辛,以及上述类固醇的代谢物。
在本发明方法的一个实施方案中。碱和优选地非亲核碱选自包含以下各项的组:三烷基胺如二异丙基乙胺(dipea)、三甲胺、三异丙胺,全烷基化空间位阻多氨基磷腈碱如t-bu-p4、1,8-二氮杂双环十一碳-7-烯(dbu)、2,6-二叔丁基吡啶、1,8-双(二甲基氨基)萘、四甲基哌啶锂、叔丁醇钾、1,1,3,3-四甲基胍、2,2,6,6-四甲基哌啶。在优选的实施方案中,所述碱是二异丙基乙胺(dipea)。
本发明的聚烷氧基化方法可以应用于含有天然糖部分的核酸,例如2'-脱氧核糖核酸(下文称为“dna”)和核糖核酸(下文称“rna”)以及含有经修饰的糖部分、经修饰的磷酸部分或经修饰的核碱基的核酸。根据本发明的方法不限于rna和dna的天然立体异构体。此外,包含镜像dna(l-dna)或rna(l-rna)以及糖、磷酸或核苷酸修饰的l-dna或l-rna以及d/l-杂合寡核苷酸及其修饰的聚烷氧基化核酸可以通过根据本发明的方法制备。对糖部分的修饰包括环大小的变化(例如,呋喃糖、己糖),单环原子(例如,碳糖、氮杂糖)的取代、引入或除去,侧链基团或原子(例如,2'-f、2'ome)的取代、引入或除去,通过非环状或多环衍生物(例如,解锁核酸、氨基酸核酸、锁核酸、三环核酸)的环的取代,核碱基的取向或位置(α-异构取向,己糖醇核酸)。所述寡核苷酸还可以由一种或更多种天然或非天然无碱基部分(例如,四氢呋喃、乙二醇)组成。经修饰的磷酸酯部分包括硫代磷酸酯、二硫代磷酸酯、烷基膦酸酯、烷基磷酸酯、氨基磷酸酯和氨基硫代磷酸酯。核碱基的修饰可以是天然存在的,例如肌苷、黄嘌呤、5,6-二氢尿嘧啶或5-甲基胞嘧啶,或人工修饰,诸如c5-炔基嘧啶、n-烷基化嘌呤和嘧啶,嘧啶和嘌呤的c6-和/或c5-衍生物和其他。核酸还可以包含一种或更多种上述修饰或由其组成。
用于组装核酸的方法是本领域熟知的。在实施方案中,核酸将通过亚磷酰胺方法组装,采用在固体支持物上将受保护的结构单元逐步偶联至新生核酸(beaucage等人,tetrahedron1992,48(12),2223-2311)。在一个优选的实施方案中,合成方向是3'至5'方向,但是从5'至3'方向的反向合成也是可用的(srivastava等人nucleicacidssymposiumseries2008,52,103-104)。一旦组装了所需的核酸序列并引入了用于下游加工的所有必要修饰,就将核酸从固体支持物上切下并脱保护。该核酸然后可以通过本领域已知的任何方法纯化。
通常,裂解和脱保护步骤涉及使用氨和/或烷基胺或氨盐。例如,rna用nh3/menh2切割,然后用net3·hf或bu4nf切割。在随后的聚烷氧基化的情况下,必须除去这些胺和铵盐,因为它们会导致不想要的副反应,从而降低聚烷氧基化过程中的偶联效力。通过盐交换实现胺物质的去除,其可以通过添加大量钠盐然后沉淀或超滤来实现,或者在iex-hplc期间通过使用钠盐梯度进行洗脱来实现。在iex-hplc纯化后,在聚烷氧基化之前除去过量的盐也是必要的。如果必要,可以应用多种不同的技术。在优选的实施方案中,在聚烷氧基化之前使用盐交换然后超滤。第二反应物中且优选地氨基修饰的核酸分子(诸如例如寡核苷酸)中氨基修饰的位置,可以在第二反应物且优选地氨基修饰的核酸分子(诸如例如寡核苷酸)的3'末端和/或5'末端和/或在3'末端核苷酸和5'末端核苷酸之间的任何位置。用于实施例以说明本发明的氨基修饰的核酸根据实施例1-3合成和纯化。
可用于本发明的聚烷氧基化合物包括聚(环氧乙烷)、聚(环氧丙烷)和混合的聚(环氧乙烷)/聚(环氧丙烷)化合物。聚烷氧基化合物优选是下式:pro-(ch2ch2o-)x-(ch2chro-)y-(ch2ch2o-)zq,,其中x,y和z各自独立地为零或正整数,条件是至少一个x、y和z不为零;r是h或烷基,例如c1、c2、c3或c4烷基,优选甲基,pr是封端基团或标记基团,q是允许与寡核苷酸偶联的基团。当x、y或z不为零时,它们通常多至1000。在一些实施方案中,x为3至1000,例如100至500,并且y和z均为0。在其他实施方案中,x和y各自独立地为3至1000,例如100至500,并且z为0。在其他实施方案中,x和z各自独立地为3至500,例如100至300,并且y为3至1000,例如100至500。优选地,聚烷氧基化合物被封端,例如被c1、c2、c3或c4烷基,优选甲基封端。可由pr表示的标记基团包括荧光素和生物素或还有任何其他反应性基团,诸如硫醇、马来酰亚胺、叠氮化物或炔烃。所用的聚烷氧基化合物通常通过它们的近似平均分子量和缩写的化学名称(例如,peg=聚(乙二醇);ppg=聚(丙二醇))来鉴定。聚烷氧基化合物可以是直链或支链的,并且通常具有约0.2kd至约60kd,优选约2kd至约40kd的平均分子量。当聚烷氧基化合物是支化的时,允许与寡核苷酸偶联的基团q可带有两个或更多个聚烷氧基部分。例如,q可以代表带有两个聚烷氧基部分和反应性基团的赖氨酸或等同部分。在本发明方法的一个优选实施方案中,允许与寡核苷酸偶联的基团q包含羧酸部分。优选地,聚烷氧基化合物是peg。
在包含羧基的第一反应物和第二反应物(即包含氨基的氨基修饰的核酸分子)之间的,作为在本发明的方法中优选实现的羧酸和胺之间酰胺键的形成,是缩合反应,可在160-180℃下实现(jursic,b.s.;zdravkovski,z.synth.commun.1993,23,2761–2770)。然而,高温与寡核苷酸不相容。因此,羧酸例如作为酯被活化。吸电子醇酯诸如对硝基苯酚(pnp)、五氟苯酚、n-羟基琥珀酰亚胺(nhs)、羟基苯并三唑(hobt)及其他在羰基中心表现出增强的亲电性,因此使得他们易于与各种亲核物质反应。据此,这种醇在本发明方法的实施方案中是优选的。它们在温和条件下与胺反应以产生所需的酰胺。对于多烷氧基羧酸与生物分子如dna、rna或蛋白质的缀合,最常使用n-羟基琥珀酰亚胺酯(nhs-酯)。
优选地,氨基修饰的寡核苷酸与peg-nhs-酯的反应在含水有机溶剂或包含水和水混溶性有机溶剂的溶液中进行。优选的有机溶剂是非质子的、极性的并且包括例如dmf、dmso、nmp或乙腈。包含可水混溶性有机溶剂的溶液中的有机溶剂的浓度可在约10%至约75%之间变化。核酸,例如寡核苷酸,通常使用或存在于微碱性水溶液中,该微碱性水溶液通常同样适用于第二反应物。为了获得微碱性ph缓冲剂,可以使用例如碳酸氢钠或硼酸钠,还可以使用非亲核叔胺碱,例如net3或dipea。优选地,将寡核苷酸溶液的ph调节至8.5至9.5。当使用非亲核胺进行缓冲时,这可以通过添加比存在的寡核苷酸提供的磷酸二酯桥的总数多2至5倍的碱来实现。peg-nhs-酯用作水混溶性有机溶剂中的溶液,并且当加入至寡核苷酸的水溶液中时保持在溶液中。peg-nhs-酯的摩尔比和寡核苷酸的摩尔比,可以取决于规模和反应性,在1:1至5:1(每个由寡核苷酸提供的反应性氨基)之间变化。优选地加入peg-nhs-酯直至反应完成。该反应之后可以是技术人员可用的所有分析技术。在本发明的实施方案中,聚乙二醇化反应之后可以应用rp-hplc。为实现最佳转换,温度可会从环境温度变化到45℃。
上述聚烷氧基羧酸-nhs酯,或更具体地peg-nhs酯优选在单独的反应中预形成,并随后将其纯化和储存直至它们在本发明的方法中使用。nhs-酯例如通过羧酸与nhs在缩合剂如碳二亚胺例如dcc、edc或dic存在下的反应来制备。在肽化学中,过多的缩合剂可用于羧酸和胺之间的酰胺键形成。缩合剂的组包含鏻盐,诸如bop、pybop、pybrop、aop、pyaop、brop和pyclop,脲盐,诸如hctu、tctu、tbtu、hbtu、hatu、totu和comu以及许多其他的(c.a.g.n.montalbetti,v.falquetetrahedron,2005,61,10827–10852,aymanel-faham和fernandoalbericio,chem.rev.,2011,111,(11),6557–6602)所有这些都可用于本发明的实施方案中。缩合剂是与羧酸反应以形成酯的试剂,该试剂对胺或其它亲核试剂具有高反应性,从而能够在温和条件下进行所需的缩合反应。溶液和固相肽合成中的酰胺键形成在含水量低的有机溶剂(诸如dmf、nmp、dmso、acn或ch2cl2.)中进行,然而,寡核苷酸不溶于不含水的有机溶剂。
本发明人另外令人惊讶地发现,如果用缩合试剂活化peg-cooh在0.5分钟至60分钟,优选1至20分钟的时间内,在水混溶性有机溶剂中进行,然后将活化的peg加入到水中的氨基修饰的寡核苷酸中,则在制备聚乙二醇化寡核苷酸的情况下,如上所述的常用缩合试剂可非常有效地用于活化peg羧酸(peg-cooh)(参见,实施例4-10)。图3显示了当通过a)iex-hplc和c)通过rp-hplc分析时的聚乙二醇化之前的粗5'-氨基修饰的l-rna镜像适体nox-e36(5'-nh2-nox-e36,表1,条目1)的典型色谱图。用40kdapeg-cooh和缩合试剂hbtu聚乙二醇化后的粗5'-nh2-nox-e36的典型色谱图分别显示在图3b和3d中(实施例9)。在所示的实施例中,rp-hplc分析表明,如果较晚的洗脱产物峰的uv面积百分比等于或略高于iex-hplc找到的5'-氨基修饰的寡核苷酸的全长产物含量的百分比,则表明完全转化。例如,实施例4-10中使用的粗5'-nh2-nox-e36显示使用iex-hplc的纯度为47%的全长产物。粗产物含有高达15%的氨基修饰种类,其不具有所需的核苷酸序列,例如失败和添加序列,它们也是可聚乙二醇化的。因此,在这种情况下,使用rp-hplc的高达60%的产物峰的uv面积可归因于完全转化(实施例5)。
当使用pybop、tbtu或comu时,实现了可比较的结果(实施例4-7)。此外,小分子的羧酸被证明与氨基修饰的寡核苷酸有效偶联。如实施例11中所示,生物素被活化并以非常高的效力与5'-nh2-nox-a12(表1,条目2)偶联。在使用hbtu进行预活化生物素化之前的粗5'-nh2-nox-a12的iex-hplc分析显示在图4a中。所得粗5'-生物素-nox-a12的lc-ms和iex-hplc分析显示在图4b和4c中,并验证了生物素化产物预期的正确分子量和保留时间的变化。
此外,本发明人惊奇地发现,用于驱动聚乙二醇化反应完成的过量peg-cooh如40kdapeg-cooh可通过超滤粗聚乙二醇化寡核苷酸(实施例12)或在iex纯化(实施例15)粗聚乙二醇化寡核苷酸期间从粗反应混合物中回收。在通过uf除去反应中包含的小分子(诸如缩合试剂、有机溶剂或盐)并随后干燥(实施例16)后,回收的peg-cooh可以重新用于氨基修饰的寡核苷酸的聚乙二醇化(实施例18、19和22)。聚乙二醇化前的粗5'-nh2-nox-a12的iex-hplc分析显示在图5a中。用“新鲜的”peg-cooh聚乙二醇化后的粗nox-a12的典型iex-色谱图显示在图5b中。所得纯化的聚乙二醇化nox-a12产物的典型iex-色谱图显示在图5c中。与新鲜peg-cooh相比,再循环的40kdapeg-cooh显示出类似的高缀合效力(分别为实施例18、19和17)。对于“新鲜的”和再循环的40kdapeg,聚乙二醇化产物的产量和质量同样高。图5c和5e分别显示了用“新鲜的”和“再循环的”40kdapeg-cooh聚乙二醇化后纯化的聚乙二醇化nox-a12的典型iex-hplc分析。
本发明证明是较好的,因为它使用聚烷氧基羧酸代替聚烷氧基羧酸nhs-酯用于氨基修饰的核酸分子如寡核苷酸的聚烷氧基化。该方法是较好的,因为它不需要任何中间产品以及从聚烷氧基羧酸中分离任何活化的nhs-酯,从而减少总反应步骤的数量。而且,与水分敏感的聚烷氧基羧酸nhs酯相比,聚烷氧基羧酸更稳定且更容易储存。此外,本发明的方法能够经济地重复使用通常过量使用以促使反应完成的试剂。
根据本发明方法的一个实施方案,且其在其中,在其各种实施方案中的步骤b)完成之后,任何未反应的第一反应物从反应中分离,优选通过超滤和/或色谱法,优选离子交换色谱法。取决于第一反应物的过量的性质,不反应物质,即不反应的第一反应物可以通过超滤(uf)或色谱法,从核酸分子,且更具体地从经修饰的核酸分子,优选从所需的经修饰的核酸分子中分离。当第一反应物与未修饰和经修饰的核酸分子之间存在与分子量相关的足够大的流体动力学体积差异时,uf是选择的方法。备选地,在第一反应物与未修饰和经修饰的核酸分子之间的电荷或亲脂性差异的情况下,可以使用离子交换(iexhplc)或反相(rphplc)色谱。在不带电(中性)第一反应物如聚烷氧基化合物、类固醇、碳水化合物和脂肪酸的情况下,iex-hplc是选择的方法,因为树脂对第一反应物的亲和力弱于对核酸的亲和力。在两亲性肽、蛋白质或糖蛋白的情况下,可以使用iex-hplc或rp-hplc。
在本发明范围内,核酸是核酸分子。就本文使用的术语而言,如果没有相反的指示,核酸和核酸分子以同义方式使用。此外,此类核酸优选在本文中也称为根据本发明的核酸分子、根据本发明的核酸、本发明的核酸或本发明的核酸分子。另外,在本发明范围内,核酸是寡核苷酸。鉴于此,应当认识到,本申请的公开内容在其涉及寡核苷酸的程度上同样适用于任何核酸,反之亦然,只要没有明确说明不同。此外,本文提出的与寡核苷酸在本发明方法中的用途有关的任何公开同样适用于第一反应物及其在本发明方法中的用途。
在另一方面,本发明涉及通过本发明的方法获得的经修饰的核酸分子。
在又一方面,本发明涉及通过本发明的方法获得的经修饰的核酸分子,其用于治疗。这种在治疗中的用途包含将经修饰的核酸分子施用至有需要的受试者。这样的受试者优选患有疾病或具有患有疾病风险的人。在这种用途中,经修饰的核酸分子能够治疗这种疾病或预防这种疾病。
还有一个方面,本发明涉及通过本发明的方法获得的经修饰的核酸分子,其用于诊断。这种诊断可以是体内诊断或体外诊断。在体内诊断的情况下,将经修饰的核酸分子施用至待诊断的受试者。这样的受试者优选是患有疾病,具有患有疾病风险或怀疑患有或患得这种疾病的人。在这种用途中,经修饰的核酸分子能够结合至与疾病相关的生物标志物。
最后,本发明在另一方面涉及通过本发明方法获得的经修饰的核酸分子在用于分析样品的体外方法中的用途。对样品的这种分析旨在检测分析物的存在或不存在。对于这样使用,核酸分子能够结合分析物。
本领域技术人员将认识到这一点。通过本发明的方法获得的经修饰的核酸分子的分析和诊断应用可以涵盖核酸的体外或体内杂交的方法,或者在适体的情况下核酸与靶分子的体外或体内结合,以及通过放射性、光吸收率或发射率检测杂交的或结合的核酸。
合成应用包括在不对称催化、核酸编码文库和亲和层析中使用核酸。
本领域技术人员将认识到,根据本发明的核酸优选由优选通过磷酸二酯键或键合(linkage)彼此共价连接的核苷酸组成。存在于本发明的核酸分子中的其他键或键合分别是硫代磷酸酯键和键合,以及磷酰胺键和键合。
应该承认,术语缩合剂(condensatingagent)和缩合剂(condensingagent)在本文中同义使用。
应该承认,术语“发明的”和“本发明的”在本文中同义使用。
应该承认,本文表明的任何百分比是体积/体积(v/v)。
通过表、附图和实施例进一步说明本发明,其中可以采用进一步的特征、实施方案和优点,其中
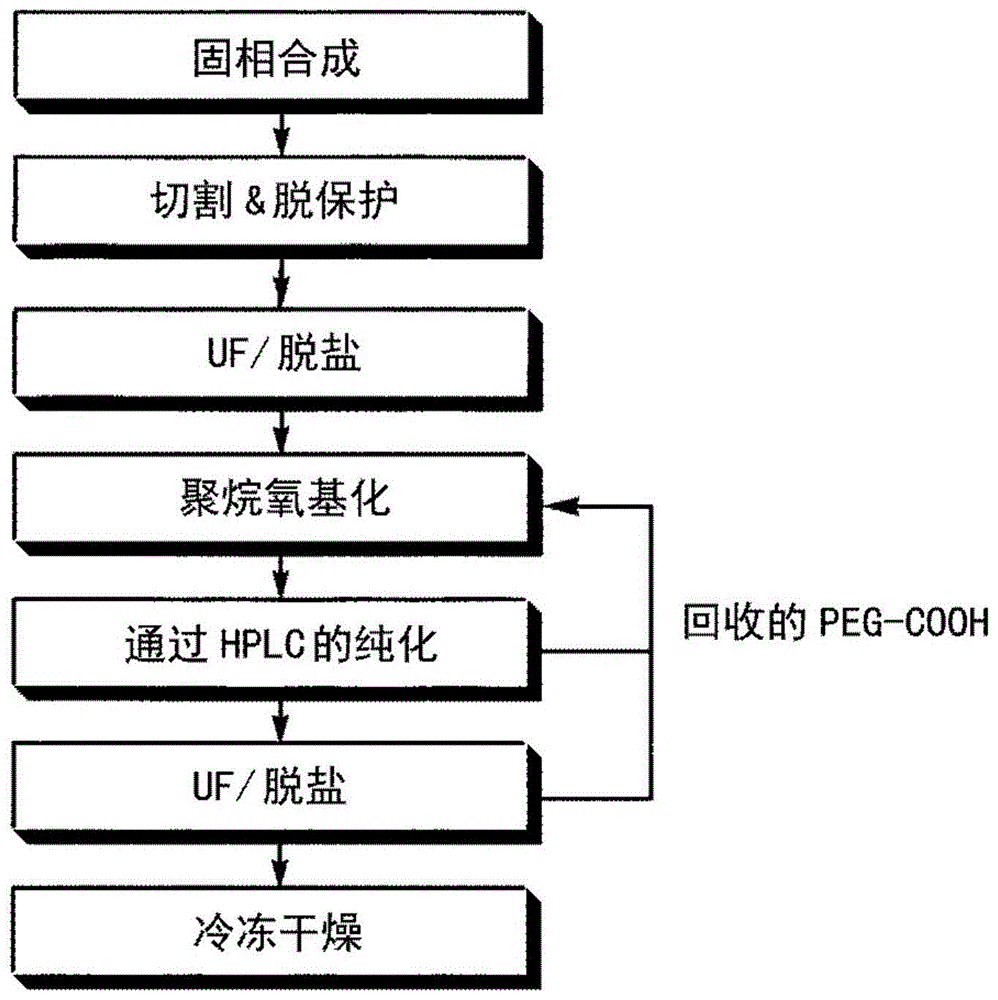
图1显示根据本发明的方法的示意图;
图2显示能够将反应性氨基引入核酸中的试剂。
图3a显示聚乙二醇化之前5'nh2-nox-e36的典型粗合成产物的iex-hplc分析;
图3b显示聚乙二醇化后5'nh2-nox-e36的典型粗合成产物的iex-hplc分析;
图3c显示聚乙二醇化前5'nh2-nox-e36的典型粗合成产物的rp-hplc分析;
图3d显示聚乙二醇化后5'nh2-nox-e36的典型粗合成产物的rp-hplc分析;
图4a显示缀合前5'nh2-nox-a12的典型粗合成产物的iex-hplc分析;
图4b显示生物素缀合后5'nh2-nox-a12的典型粗合成产物的lcms分析;
图4c显示生物素缀合后5'nh2-nox-a12的典型粗合成产物的iex-hplc分析;
图5a显示聚乙二醇化前5'nh2-nox-a12的典型粗合成产物的iex-hplc分析;
图5b显示用“新鲜”peg聚乙二醇化后5'nh2-nox-a12的典型粗产物的iex-hplc分析;
图5c显示用“新鲜”peg聚乙二醇化后5'nh2-nox-a12的典型纯化产物的iex分析;
图5d显示用“再循环的”peg聚乙二醇化后5'nh2-nox-a12的典型粗产物的iex-hplc分析;和
图5e显示用“再循环”peg聚乙二醇化后5'nh2-nox-a12的典型纯化产物的iex分析。
实施例1:rna合成
rna镜像适体使用
实施例2:5'nh2-nox-e36(每个peg1个)的合成
应用实施例1中描述的方法,每一核苷酸偶联循环,10.2g的l-rgcpg(
实施例3:(每个peg2个)5'nh2-nox-a12的合成
应用实施例1中描述的方法,每一核苷酸偶联循环,1.7g的l-rgcpg(
实施例4:使用pybop用于活化且使用dmf作为共溶剂的5'nh2-nox-e36的聚乙二醇化
向在1ml水中的1000od(40mg,1.54μmol)的(每个peg1个)5'nh2-nox-e36溶液中添加在750mldmf中的193mg(600μmol)bu4nbr的溶液,然后添加69μl(52mg,405μmol)的dipea。在另一个反应容器中,将92mg(2.31μmol)的40kdapeg-cooh(jenkemtechnology,allen,tx,usa)溶解在2.5ml的dmf中。向该peg溶液中添加在60μldmf中的1.8mg(3.5μmol)pybop,然后添加6.0μl(4.6mg,35μmol)的dipea。然后将该peg溶液彻底涡旋并在2分钟后将其添加寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示52%的转化率。
实施例5:使用pybop用于活化且使用dmso作为共溶剂的5'nh2-nox-e36的聚乙二醇化
向在1ml的水中的1000od(40mg,1.54μmol)的(每个peg1个)5'nh2-nox-e36的溶液中添加在2mldmso中的193mg(600μmol)bu4nbr的溶液,然后添加69μl(52mg,405μmol)的dipea。在另一个反应容器中,将92mg(2.31μmol)的40kdapeg-cooh(jenkemtechnology,allen,tx,usa)溶解在0.5ml的acn中。向该peg溶液中添加在60μlacn中的1.8mg(3.5μmol)pybop,然后添加6.0μl(4.6mg,35μmol)dipea。然后将该peg溶液彻底涡旋并在2分钟后将其添加寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示60%的转化率。
实施例6:使用tbtu用于活化的5'nh2-nox-e36的聚乙二醇化
向在1ml的水中的1000od(40mg,1.54)的(每个peg1个)5'nh2-nox-e36的溶液中添加在2mldmso中的193mg(600μmol)bu4nbr的溶液,然后添加69μl(52mg,405μmol)的dipea。在另一个反应容器中,将92mg(2.31μmol)的40kdapeg-cooh(jenkemtechnology,allen,tx,usa)溶解在0.5ml的acn中。向该peg溶液中添加在60μlacn中的1.1mg(3.5μmol)tbtu,然后添加6.0μl(4.6mg,35μmol)的dipea。然后将该peg溶液彻底涡旋并在2分钟后将其添加寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示59%的转化率。
实施例7:使用comu用于活化的5'nh2-nox-e36的聚乙二醇化
向在1ml的水中的1000od(40mg,1.54μmol)的(每个peg1个)5'nh2-nox-e36的溶液中添加在2mldmso中的193mg(600μmol)bu4nbr的溶液,然后添加69μl(52mg,405μmol)dipea。在另一个反应容器中,将92mg(2.31μmol)的40kdapeg-cooh(jenkemtechnology,allen,tx,usa)溶解在0.5ml的acn中。向该peg溶液中添加在60μlacn中的1.5mg(3.5μmol)comu,然后添加6.0μl(4.6mg,35μmol)dipea。然后将peg溶液彻底涡旋2分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示45%的转化率。
实施例8:在bu4nbr存在下使用hbtu用于活化的5'nh2-nox-e36的聚乙二醇化
向在1ml的水中的1000od(40mg,1.54μmol)的(每个peg1个)5'nh2-nox-e36的溶液中添加在2mldmso中的193mg(600μmol)bu4nbr的溶液,然后添加69μl(52mg,405μmol)dipea。在另一个反应容器中,将92mg(2.31μmol)的40kdapeg-cooh(jenkemtechnology,allen,tx,usa)溶解在0.5mlacn中。向该peg溶液中添加在7.5μlacn中的1.3mg(3.5μmol)hbtu,然后添加6.0μl(4.6mg,35μmol)dipea。然后将peg溶液彻底涡旋5分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示42%的转化率。
实施例9:在没有bu4nbr的情况下使用hbtu用于活化的5'nh2-nox-e36的聚乙二醇化
向在6ml水中的6000od(240mg,9.23μmol)的(每个peg1个)5'nh2-nox-e36的溶液中添加12mldmso,然后添加414μl(307mg,2.38mmol)dipea。在另一个反应容器中,将554mg(13.8μmol)的40kdapeg-cooh(jenkemtechnology,allen,tx,usa)溶解在2.5mlacn中。向该peg溶液中添加在100μlacn中的7.85mg(20.7μmol)hbtu,然后添加36.0μl(26.8mg,207μmol)的dipea。然后将peg溶液彻底涡旋5分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示45.5%的转化率。
实施例10:在没有bu4nbr的情况下使用hbtu用于活化的5'nh2-nox-a12的聚乙二醇化
向在16ml水中的15966od(638mg,19.6μmol,50%flp)的(每个peg2个)5'nh2-nox-a12的溶液中添加32mldmso,然后添加1.12mldipea。在另一个反应容器中,将1.97g(49.3μmol)的40kdapeg-cooh(jenkemtechnology,allen,tx,usa)溶解在8mlacn中。向该peg溶液中添加在200μlacn中的19.9mg(52.5μmol)hbtu,然后添加83μl的dipea。然后将peg溶液彻底涡旋5分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示58%的转化率。
实施例11:使用hbtu用于活化的5'nh2-nox-a12的生物素化
向在200μl水中的200od(8mg,0.237μmol,50%flp)的5'nh2-nox-a12(每个peg2个)的溶液中加入400μldmso,然后加入12.5ml的dipea。在另一个反应容器中,将0.167mg(0.683μmol)的生物素溶解在90μl的dmso中。向该生物素溶液中添加在10μlcan中的0.259mg(0.683μmol)hbtu,然后添加1.8μl的dipea。然后将生物素溶液彻底涡旋1分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示55%的转化率。通过添加20μl的3m乙酸钠溶液和10mletoh使粗产物沉淀,并在-20℃下储存2小时。沉淀物通过离心(4000g)和倾析收集。将颗粒沉淀物溶解在水中并通过尺寸排阻色谱法脱盐以产生159od(6.4mg,0.192μmol)生物素化的nox-a12,纯度为45%(通过iex-hplc),ms:14883da(计算值),14883da(实测值)。
实施例12:在5'nh2-nox-a12的聚乙二醇化后,将过量的40kdapeg-cooh进行uf-再循环
使用30kda分子量截留(mwco)再生纤维素膜(sartorius,
实施例13:粗制nox-a12聚乙二醇化混合物的超滤
使用2kdamwco再生纤维素膜(sartorius,
实施例14:iex-hplc纯化和随后的聚乙二醇化的nox-a12的uf
实施例12中得到的0.87g(7264od)的粗制nox-a12产物通过iex-hplc色谱法进一步纯化。将6000od样品的水溶液装料至12mltosohsuperq5pwiex-hplc柱(500od/ml树脂,50℃),并通过应用以下缓冲系统的梯度在50℃洗脱(缓冲液a:25mmna2hpo4,ph7.5,10%acn;缓冲液b:25mmna2hpo4,1mnabr,ph7.5,10%acn;梯度:25cv中5%b至35%b)。将所有含有产物的级分(通过iex-hplc测定>75%flp)合并(842od),使用5kdamwco再生纤维素膜(millipore,bedford,ma)通过uf脱盐,最后冷冻干燥。产量:801od,76%flp。
实施例15:在5'nh2-nox-a12的聚乙二醇化后,将过量的40kdapeg-cooh进行iex-hplc-再循环
实施例13中得到的粗制nox-a12产物(1.38g,7829od)通过iex-hplc色谱法进一步纯化。将6000od样品的水溶液装料至12mltosohsuperq5pwiex-hplc柱(500od/ml树脂,50℃)上,并通过应用以下缓冲系统的梯度在50℃洗脱(缓冲液a:25mmna2hpo4,ph7.5,10%acn;缓冲液b:25mmna2hpo4,1mnabr,ph7.5,10%acn;梯度:25cv中5%b至35%b)。在上样期间和上样后2cv洗涤期间,收集流过物,通过2kdamwco再生纤维素膜(sartorius,
实施例16:干燥经再循环的40kdapeg-cooh,用于随后的在5'nh2-nox-a12的聚乙二醇化中使用
通过iex-hplc色谱或如实施例12和15中举例说明的切向流过滤回收的40kdapeg-cooh溶解在乙腈(20ml/g)中并在分子筛干燥垫上储存过夜以除去任何残留的水。除去分子筛,减压浓缩peg溶液。
实施例17:使用“新鲜的”40kdapeg-cooh和hbtu用于活化的5'nh2-nox-a12的聚乙二醇化
向在100μl水中的100od(4mg,0.14μmol,50%flp)的(每个peg2个)5'nh2-nox-a12的溶液中添加200μldmso,然后添加7.5mldipea。在另一个反应容器中,将13.7mg(0.34μmol)的“新鲜的”40kdapeg-cooh(jenkemtechnology,allen,tx,usa)溶解在60μl的acn中。向该peg-cooh溶液中添加在10μlacn中的0.13mg(0.34μmol)hbtu,然后添加0.6μl的dipea。将peg溶液彻底涡旋5分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示43%的转化率。
实施例18:使用“uf-回收的”40kdapeg-cooh和hbtu用于活化的5'nh2-nox-a12的聚乙二醇化
向在100μl水中的100od(4mg,0.14μmol,50%flp)的(每个peg2个)5'nh2-nox-a12的溶液中添加200μldmso,然后添加7.5mldipea。在另一个反应容器中,将13.7mg(0.34μmol)“uf-回收的”并干燥的(如实施例12和16中获得的)40kdapeg-cooh溶解在60μl的acn中。向该peg溶液中添加在10μlacn中的0.13mg(0.340μmol)hbtu,然后添加0.6μl的dipea。将peg-cooh溶液彻底涡旋5分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示48%的转化率。
实施例19:使用“iex-hplc-回收的”40kdapeg-cooh和hbtu用于活化的5'nh2-nox-a12的聚乙二醇化
向在100μl水中的100od(4mg,0.14μmol,50%flp)的(每个peg2个)5'nh2-nox-a12的溶液中添加200μldmso,然后添加7.5mldipea。在另一个反应容器中,将13.7mg(0.34μmol)“iex-hplc-回收的”并干燥的(如实施例15和16中获得的)40kdapeg-cooh溶解在60μl的acn中。向该peg溶液中添加在10μlacn中的0.13mg(0.34μmol)hbtu,然后添加0.6μl的dipea。将peg-cooh溶液彻底涡旋5分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示47%的转化率。
实施例20:5'nh2-nox-a12的固相合成
应用实施例1中描述的方法,每一核苷酸偶联循环,1.70g的l-rgcpg(
实施例21:使用“新鲜的”40kdapeg-cooh的5'nh2-nox-a12的聚乙二醇化以及随后的下游加工以生产nox-a12
向在6ml水中的6000od(240mg,7.86μmol,48%flp)的(根据实施例20合成的,每个peg2个)5'nh2-nox-a12的溶液中添加12mldmso,然后添加0.42mldipea。在另一个反应容器中,将628mg(15.7μmol)的40kdapeg-cooh(jenkemtechnology,allen,tx,usa)溶解在2.55mlacn中。向该peg溶液中添加在50μlacn中的5.96mg(15.7μmol)hbtu,然后添加40μl的dipea。将peg溶液彻底涡旋5分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示39%的转化率。额外等份的0.5eq的peg-cooh通过将157mg(1.97μmol)40kdapeg-cooh(jenkemtechnology,allen,tx,usa)溶解在0.7ml的acn中制备。向该peg溶液中添加在12.5μlacn中的1.49mg(1.97μmol)hbtu,然后添加10μl的dipea。将peg溶液彻底涡旋5分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc重新监测反应显示52%的转化率。额外添加0.5eq的活化peg-cooh在额外的30分钟后导致58%的转化率。通过稀释到500ml水中终止反应,并使用30kdamwco再生纤维素膜(sartorius,
实施例22:使用“iex-hplc-回收的”40kdapeg-cooh的5'nh2-nox-a12的聚乙二醇化以及随后的下游加工以生产nox-a12
向在6ml水中的6000od(240mg,7.86μmol,48%flp)的(根据实施例20合成的,每个peg2个)5'nh2-nox-a12的溶液中添加12mldmso,然后添加0.42mldipea。在另一个反应容器中,将628mg(15.7μmol)的“iex-hplc回收的”和干燥的40kdapeg-cooh(如实施例15和16中获得的)溶解在2.55ml的acn中。向该peg溶液中添加在50μlacn中的5.96mg(15.7μmol)hbtu,然后添加40μl的dipea。将peg溶液彻底涡旋5分钟,然后将其添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc监测反应显示29%的转化率。额外0.5eq.的peg-cooh的等分试样通过将157mg(1.97μmol)的“iex回收的”和干燥的40kdapeg-cooh溶解在0.7mlacn中来制备。向该peg溶液中添加在12.5μlacn中的1.49mg(1.97μmol)hbtu,然后添加10μl的dipea。将peg溶液彻底涡旋5分钟并添加至寡核苷酸溶液中。将反应混合物轻轻搅拌30分钟。通过rp-hplc重新监测反应显示37%的转化率。活化的“iex-回收的”和干燥的peg-cooh的第二个和第三个0.5eq.的添加在额外的30分钟后导致45%和52%的转化率。通过稀释到500ml水中终止反应,并使用30kdamwco再生纤维素膜(sartorius,
在说明书、权利要求和/或附图中公开的本发明的特征可以单独地和以其任何组合的形式用于以各种形式实现本发明。
- 还没有人留言评论。精彩留言会获得点赞!