与A20结合的核因子κB抑制蛋白1在制备治疗脂肪肝及相关疾病药物中的应用的制作方法
本发明属于基因的功能与应用领域,特别涉及一种泛素链结合蛋白,即与a20结合的核因子κb抑制蛋白1(a20bindinginhibitorofnf-κbactivation,abin1)在脂肪肝及相关疾病中的功能和应用,以及abin1作为靶基因在制备预防、缓解和/或治疗脂肪肝及相关疾病的药物中的应用。
背景技术:
非酒精性脂肪肝(non-alcoholicfattyliverdisease,nafld)是常见的肝脏疾病,是指除酒精性和其它明确肝损伤因素以外,肝脏细胞以脂肪变性和脂质集聚为主要病理特征的慢性肝脏疾病。与高血压、糖尿病一样,脂肪肝也成为当代人常见的慢性病之一,成为仅次于病毒性肝炎的第二大肝病,发病率呈逐年上升且日趋低龄化。据一项来自于英国的研究显示,nafld已成为体检人群中肝酶异常的主要原因。nafld可逐步发展为肝纤维化、肝硬化、甚至肝癌,其发展为肝硬化和肝癌的比例分别为5%~10%和1%~2%,严重威胁着人们的身体健康。因此,nafld是当代世界肝脏病学领域面临的新挑战。目前市场上还没有十分有效的针对于非酒精脂肪肝病的药物,因此开发这一方面的治疗药物显得十分急需。因此,发现参与nafld的特异性分子及信号传导通路,对进一步系统阐明nafld的发生发展机制,从细胞分子水平对nafld进行调控,探索新的防治nafld的治疗靶点,具有非常重要的理论和实践意义。
研究发现abin1蛋白在调节nf-κb信号通路,维持免疫反应稳态中发挥着重要作用,其能参与由a20介导的对nf-κb的抑制作用中,同时通过结合泛素链和a20发挥重要生理功能。abin1通过ahd1区域(abin和a20均有表达)与a20相结合,通过介导去泛素化效应阻断ikk上游激活分子myd88与泛素链相结合,抑制ikks的活化,阻碍nf-κb的激活[1]。更多的研究显示,除了能够抑制nf-κb信号通路以外,在jnk、erk、p38、mapk等多种促炎信号通路中,abin1也表现出抑制效应[2-4]。此外,abin1和nemo(ikkγ)都含有能与nf-κb调节蛋白相结合的区域(uban),能特异性的介导abin1与相应泛素化的调节蛋白相结合,抑制nf-κb不同亚基的活化。此外,abin1蛋白也能竞争nemo羧基末端的结合区域(nbd),发挥其在nf-κb上的抑制作用[5,6]。但是关于本发明abin1在脂肪肝及相关疾病中的功能及其应用目前尚未见报道。
参考文献
1.callahan,j.a.,etal.,cuttingedge:abin-1protectsagainstpsoriasisbyrestrictingmyd88signalsindendriticcells.jimmunol,2013.191(2):p.535-9.
2.zhang,s.,etal.,anewerk2bindingprotein,naf1,attenuatestheegf/erk2nuclearsignaling.biochembiophysrescommun,2002.297(1):p.17-23.
3.huang,l.,etal.,abinsinhibitegfreceptor-mediatednf-kappabactivationandgrowthofegfreceptor-overexpressingtumourcells.oncogene,2008.27(47):p.6131-40.
4.charlaftis,n.,etal.,themekk1phdubiquitinatestab1toactivatemapksinresponsetocytokines.emboj,2014.33(21):p.2581-96.
5.mauro,c.,etal.,abin-1bindstonemo/ikkgammaandco-operateswitha20ininhibitingnf-kappab.jbiolchem,2006.281(27):p.18482-8.
6.nanda,s.k.,etal.,polyubiquitinbindingtoabin1isrequiredtopreventautoimmunity.jexpmed,2011.208(6):p.1215-28.
技术实现要素:
为解决上述现有技术的缺陷和不足,本发明的目的在于提供一种abin1基因的表达与脂肪肝及相关疾病之间的相互关系,提供一个用于治疗脂肪肝及相关疾病的靶基因abin1的新用途,进而把abin1应用于脂肪肝病的治疗。
本发明的目的通过以下技术方案实现:
本发明第一方面,提供与a20结合的核因子κb抑制蛋白1在制备保护肝脏的药物中的应用。
优选地,所述药物具有抑制肝脏脂质蓄积的功能。
本发明第二方面,提供与a20结合的核因子κb抑制蛋白1在制备预防、缓解和/或治疗脂肪肝及相关疾病药物中的应用。
本发明涉及的与a20结合的核因子κb抑制蛋白1在制备预防、缓解和/或治疗脂肪肝及相关疾病药物中的应用,所述的药物的活性成分是与a20结合的核因子κb抑制蛋白1。
本发明涉及的与a20结合的核因子κb抑制蛋白1在制备预防、缓解和/或治疗脂肪肝及相关疾病药物中的应用,具体的是与a20结合的核因子κb抑制蛋白1作为药物靶点筛选预防、缓解和/或治疗脂肪肝及相关疾病的药物,所述药物是提高与a20结合的核因子κb抑制蛋白1表达量的试剂。
优选地,提高与a20结合的核因子κb抑制蛋白1表达量的试剂,给药方式为直接裸dna注射法、脂质体包裹dna直接注射法、金包被dna基因枪轰击法、繁殖缺陷细菌携带质粒dna法、复制缺陷腺病毒携带目的dna法、peg修饰蛋白药物注射法、脂质体包裹蛋白静脉注射法,或蛋白微球制剂皮下注射法。
所述的与a20结合的核因子κb抑制蛋白1或abin1,包括基因或蛋白。所述的abin1基因在对象体内经转录翻译为与a20结合的核因子κb抑制蛋白1蛋白产物。
所述脂肪肝及相关疾病包括但不限于:胰岛素抵抗、代谢综合征、肥胖、糖尿病、高血糖、高血脂症、单纯性肝脏脂肪变性、非酒精性脂肪性肝炎,肝纤维化、肝硬化、肝癌等。
本发明通过试验确定了与a20结合的核因子κb抑制蛋白1的表达与脂肪肝及相关疾病之间的关系:
本发明以正常人肝细胞l02细胞系、abin1过表达l02细胞系、小鼠原代肝细胞、abin1过表达小鼠原代肝细胞为实验对象,通过棕榈酸(pa)、油酸(oa)联合诱导脂肪肝细胞模型,利用油红o染色来研究abin1基因过表达对pa、oa联合刺激诱导的细胞中脂质聚集的影响。油红o染色结果显示,在相同浓度的棕榈酸、油酸联合刺激下,与正常l02细胞相比,abin1过表达l02细胞中红色脂肪滴的面积显著减小。同样的油红o染色结果趋势也在abin1过表达的小鼠原代肝细胞中观察到,表明abin1过表达对棕榈酸、油酸联合诱导的脂肪肝细胞中脂质的堆积具有明显的抑制作用。本发明人的研究证明了abin1具有抑制肝脏脂质蓄积,保护肝脏的功能。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明发现abin1基因的新功能,即abin1基因具有能够抑制脂肪肝及相关疾病的作用。
(2)基于abin1在抑制脂肪肝及相关疾病中的作用,其可以用于制备预防、缓解和/或治疗脂肪肝及相关疾病的药物。由于abin1是机体内源性蛋白质,因此作为药物的安全性很高。
附图说明
图1是稳定表达abin1的l02稳定细胞系的wb鉴定结果;
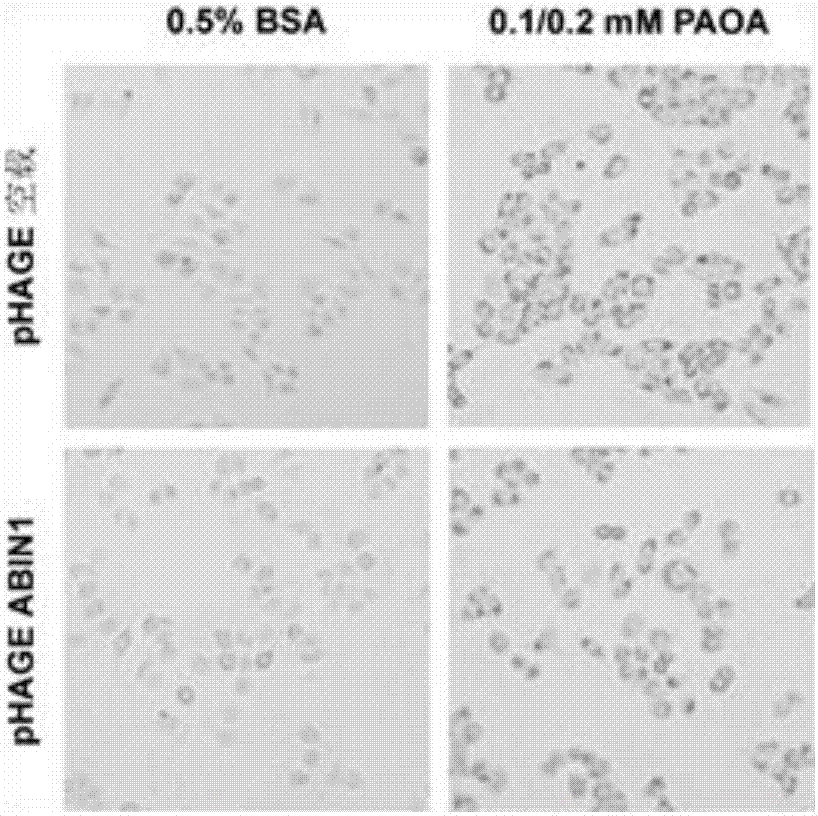
图2是稳定表达abin1的l02稳定细胞系在pa及oa联合刺激后的油红o染色结果图;
图3是用过表达abin1的慢病毒感染小鼠的原代肝细胞后,abin1蛋白表达的wb鉴定结果;
图4是过表达abin1的小鼠的原代肝细胞经pa及oa刺激之后的油红o染色结果图。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
本发明中的实验所涉及的试剂在国内外市场购买,或按照说明书中的配方自行配制;未做特殊说明的实验方法都是采用本领域已知的常规方法。
实验用细胞及培养:
人正常肝细胞系l02购自中国科学院细胞库(目录号gnhu6),人胚肾上皮细胞系hek293t购自美国菌种保藏中心(americantypeculturecollection,atcc)。上述细胞均采用dmem高糖培养基(含10%fbs,1%青霉素-链霉素)置于5%co2的37℃恒温细胞专用培养箱培养,实验用细胞培养时间不超过三个月,每三个月进行一次支原体检测。细胞冻存采用含10%dmso的fbs冻存。
原代肝细胞分离及培养:
采用ⅳ型胶原酶消化法分离小鼠原代肝细胞。小鼠乙醚吸入麻醉,留直针穿刺门静脉,肝脏原位灌流(sc-1和sc-2轮流灌注)至肝脏消化完全,取下肝脏,反复吹打并过滤,收集肝细胞悬液。离心收集肝细胞于鼠尾胶包被的培养皿中,加完全培养基培养,6h后换液去除死细胞,继续培养。
1)培养皿包被(以六孔板为例)
①配适量的1×鼠尾胶(现用现配):
用灭菌的超纯水将无水乙醇稀释为30%乙醇后,0.22μm滤器过滤,然后将100×的鼠尾胶稀释为1×。
②将200μl1×鼠尾胶加入到培养皿,晃动,铺匀(要保证孔底每个地方都能接触到鼠尾胶)。
③开盖,在超净台吹风过夜。
2)细胞铺板
①鼠尾胶包被的培养皿开盖,紫外照射30min。
②台盼蓝染色进行细胞计数,根据实验目的,调整细胞密度,进行细胞铺板。
③铺板后2h换液。
④细胞大约6-8h贴壁,贴壁后即可进行后续操作。
油红o染色:
1)样品组和对照组用1×pbs洗涤2次,加入300μl3%多聚甲醛固定20min;
2)加入1×pbs洗涤2次后,加入60%异丙醇漂洗10s;
3)加入1×pbs洗涤2次,通风橱吹干;
4)每孔500μl加入油红o染色1h;
5)加入1×pbs洗涤2次,60%异丙醇进行分选,再加入1×pbs洗2次;镜检,拍照。
westernblot(wb)检测:
1)制胶
根据目的蛋白大小选择需要的分离胶浓度,一般8%-10%的分离胶可满足大部分实验需求。
2)蛋白提取
细胞用适量ripa(50mmtris-hclph7.4,150mmnacl,1%tritonx-100ornp-40,1%sodiumdeoxycholate,0.1%sds,1mmedta,使用前加蛋白酶或磷酸酶抑制剂)冰上裂解10-30min;4℃,12000rpm离心10min,上清即为总蛋白;采用bcaproteinassaykit进行蛋白定量,取30-50μg总蛋白进行westernblot分析。
3)上样及电泳
保证上样量及上样体积一致,恒压电泳,上层胶采用80-90v,下层胶采用100v。
4)转膜
配制转膜液,提前预冷;pvdf膜使用前用甲醇浸泡1-2min;转膜,胶在负极侧,膜在正极侧,海绵、滤纸提前浸泡。转膜电压设为250v,电流设为0.2a,转移1.5h。
5)封闭
5%脱脂奶粉(intbst)于震荡摇床室温封闭1h。
6)一抗孵育
封闭结束后用tbst洗涤蛋白膜3次,每次5min,加一抗(anti-abin1:15104-1-ap,proteintech;anti-gapdh:2118,cst),4℃孵育过夜。
7)二抗孵育
一抗孵育后膜用tbst洗3遍,每次5min,加一定比例二抗(北京博奥龙免疫技术有限公司,bf03008/bf03008x)(intbst)室温孵育1h。
8)显影。
孵育后用tbst洗涤3次,每次5min。利用bio-radchemidocxrs+凝胶成像系统检测目的条带。
abin1慢病毒过表达质粒构建:
1)pcr扩增abin1基因,引物为:
正向:5’-tcgggtttaaacggatccatggaagggagaggaccgtacc-3’
反向:5’-gggccctctagactcgagtcactgaggcccctcacggt-3’;
2)pcr产物进行琼脂糖凝胶电泳,随后使用dna凝胶回收试剂盒(天根)进行dna片段的回收;
3)将所得dna产物和限制性内切核酸酶fastdigestrestrictionenzymes(thermo)、
4)使用
5)制作大肠杆菌感受态细胞,将上述连接产物进行转化实验,涂板,置于37℃培养箱,过夜培养;
6)从37℃培养箱中取出过夜培养的平板,挑克隆摇菌,并检测菌落pcr阳性克隆;
7)将pcr鉴定为阳性的菌液吸取5-10μl接种至5mllb(含抗性)培养基中,在220rpm/min,37℃摇床中过夜培养;
8)取出过夜培养的菌液,对已经混浊的菌液进行质粒提取(天根质粒dna小提试剂盒);
9)提取后的质粒可直接用于abin1瞬时转染或构建慢病毒稳定转染细胞系。
慢病毒载体构建和包装:
1)用胰酶消化并记数293t细胞,按1×106个293t/孔传至6孔板中;
2)第二天细胞汇合度至80%时开始转染;
3)取1.5ml灭菌ep管,加入2个包装质粒pspax(addgene,12260)和pmd2g(addgene,12259)和过表达质粒1μg溶于100μl的无血清培养基。轻柔混匀,室温孵育5min。
4)取1.5ml灭菌ep管,取3μlpei(1.6μg/μl)溶于100μl无血清培养基中。轻柔混匀,室温孵育5min。
5)将dna溶液和pei溶液轻柔混匀,室温孵育15min;
6)将上述dna-pei混合液,逐滴加入6孔板中;
7)转染6h后,换新鲜培养基;
8)转染后48-72h收获含病毒的上清,3000rpm/min离心10min,去除沉淀,并用0.45μm的滤膜过滤,过滤后的病毒可立即用于感染。
细胞感染
(1)细胞铺板:每种病毒感染两个孔,并留出一孔作为空白对照,以便后期筛选细胞用。
(2)第一次感染:将病毒液与待感染的细胞(和普通转染密度一致)培养基混合,混合比率取决于病毒滴度和细胞承受能力(本次每孔使用500ul病毒液+2ml完全培养基),并随后加入2.5μl聚凝胺(8mg/ml),使其终浓度为8ug/ml。
(3)感染后最快2h即可换液终止感染,若细胞承受力强,最长可持续感染24h。
(4)第二次感染:感染24h后,再感染一次。
加药筛选细胞
第一次感染48h后,在六孔板中(包括空白孔)加入含有嘌呤霉素的完全培养基(终浓度为1ug/ml),待空白孔细胞完全死亡,将六孔板中细胞传代至t25培养瓶,一般空白细胞在24~48h后全部死亡。待细胞长满后,收取一部分细胞做western验证过表达,并冻存部分细胞。
【实施例1】abin1过表达对l02细胞脂肪堆积的影响
构建过表达abin1的慢病毒表达载体,转染hek-293t细胞,包装慢病毒,感染l02细胞构建过表达abin1的稳定细胞株,同时过表达空载体作为对照(con),通过westernblot检测稳定细胞株是否表达abin1。
检测完成后,细胞分为4组,即:l02空载对照组、abin1过表达的l02稳定细胞系对照组、l02-空载实验组、abin1过表达的l02稳定细胞系实验组。待细胞贴壁,细胞培养到50%愈合度之后,向两个实验组中加入棕榈酸酯(pa)及油酸(oa)(pa0.2mm+oa0.4mm)进行刺激,对照组中加入同等量的bsa,12h后收集各组细胞样品,进行油红o染色。
westernblot检测结果如图1所示,感染过表达abin1慢病毒的l02细胞株abin1的蛋白表达量显著高于空载对照组。油红o染色结果如图2所示,对照组细胞无明显红色,而当加入pa+oa刺激后,被油红o染红的细胞相比于对照组显著增多。相同的pa+oa联合刺激下,abin1过表达的l02稳定细胞系实验组中红色脂肪滴的面积明显低于l02-空载实验组,说明abin1的过表达可有效抑制pa+oa刺激诱导的l02细胞脂质沉积。
【实施例2】abin1过表达对小鼠原代肝细胞脂肪堆积的影响
构建过表达abin1的慢病毒表达载体,转染hek-293t细胞,包装慢病毒,感染小鼠原代肝细胞细胞构建过表达abin1的细胞模型,同时过表达空载体作为对照(con),通过westernblot检测abin1感染组细胞是否过表达abin1。
检测完成后,细胞分为4组,即:空载对照组、abin1过表达的细胞对照组、l02-空载实验组、abin1过表达的细胞实验组。待细胞贴壁,细胞铺孔至50%愈合度之后,向两个实验组中加入棕榈酸酯(pa)及油酸(oa)(pa0.2mm+oa0.4mm)刺激,对照组中加入同等量的bsa,12h后收据各组细胞样品,进行油红o染色实验。
westernblot检测结果如图3所示,感染过表达abin1慢病毒的原代肝细胞中abin1的蛋白表达量显著高于空载对照组。油红o染色结果如图4所示,对照组细胞无明显红色,而当加入pa+oa刺激后,被油红o染红的细胞相比于对照组显著增多。相同的pa+oa联合刺激下,abin1过表达的小鼠原代肝细胞实验组中红色脂肪滴的面积明显低于小鼠原代肝细胞空载实验组,说明abin1的过表达可有效抑制pa+oa刺激诱导的小鼠原代肝细胞脂质沉积。
上述结果显示abin1基因过表达可显著抑制肝细胞脂质堆积,抑制脂肪肝及相关疾病的发生发展,abin1基因对脂肪肝及相关疾病具有显著的抑制作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
序列表
<110>武汉大学
<120>与a20结合的核因子κb抑制蛋白1在制备治疗脂肪肝及相关疾病药物中的应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>1
tcgggtttaaacggatccatggaagggagaggaccgtacc40
<210>2
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>2
gggccctctagactcgagtcactgaggcccctcacggt38
- 还没有人留言评论。精彩留言会获得点赞!