一种心脑双靶向脂质体及其制备方法和应用与流程
本发明涉及一种作为药物载体使用的脂质体及其制备方法和应用,特别涉及一种具有脑以及心脏的双靶向的作用,能够实现心脑同治的脂质体及其制备方法。本发明属于医药技术领域。
背景技术:
心脑血管疾病(阿斯综合征、心脑供血不足等)严重威胁人类健康,具有较高的死亡率和发病率。心脑血管疾病伴随着心脑血液供应不足的情况。由于心肌缺血,心脏处于缺乏能量的状态,可引起心律失常和心绞痛。当发生这种情况时,也会导致急性心肌梗死,常引起的心源性休克。与此同时,大脑供血因为心输出量下降也是由心功能异常降低,有时会恶化为心源性脑卒中。心源性脑卒中的治疗主要依靠心功能的正常和血供的恢复。
近年来,研究人员研究了许多以纳米技术为基础的策略,有效地将药物转运到病灶,以恢复梗塞心脏的功能。在这些策略中,通常选择配体与受体,抗体或抗原结合以及通过转运蛋白转运的分子来修饰纳米载体的表面,以提高纳米颗粒对缺血心脏的特异性。尽管取得了一些改善,大多数颗粒仍然积累到网状内皮系统,并提前到达目标组织。为了克服上述这些问题,一些课题组设计了一些基于两种不同生物现象和机制的双靶纳米载体,如转运蛋白,抗体和受体。
本发明发明人前期已证实脂质体表面修饰的抗ctni抗体(anti-ctni,一种特异性单克隆抗体)修饰在脂质体表面可以提高心肌部位的药物浓度。然而,心肌细胞摄取anti-ctni抗体修饰脂质体的速度并不比普通脂质体快。葡萄糖转运蛋白(glut)可以通过血脑屏障(bbb)转运葡萄糖,果糖,半乳糖,甘露糖和其他具有相似结构的物质。甘露糖修饰的脂质体表现出优异的脑靶向性,甘露糖修饰的脂质体可以快速进入目标细胞。这些发现告诉我们,如果我们同时在脂质体表面同时修饰抗体和甘露糖,将会加速囊泡进入受影响的细胞的内化速度,拯救那些注定要死亡的细胞。
具有2000da链的聚乙二醇(peg)作为许多研究者的首选,由于市场的可用性,通过点击化学很容易用于将靶向分子共轭到囊泡表面。修饰脂质体的聚乙二醇的不同密度和链长会导致分子间互作以及细胞摄取和靶向积累不同的可能性。然而,脂质膜表面各种分子的空间位阻可能会限制配体及其受体的结合,从而影响纳米载体靶向效率的实现。与普通药物相比,靶向给药具有剂量低,疗效高的显着特点,对中枢神经系统疾病的治疗具有重要意义。虽然心肌靶向治疗已经探索多年,但仍存在一些副作用和低效率的挑战。另外,人们总是把注意力集中在单个靶向器官和/或组织中的药物浓度上,而忽略了一些人体内的连锁反应。心源性脑卒中可能需要脑部和缺血性心脏的治疗,系统地保证心脏和脑部的功能不受缺血状态的影响,减少随后的灾难。因此,如何基于上述peg链的空间位阻来实现受影响的心脏和大脑的要求来实现合理的药物递送是一个有吸引力的研究热点。
技术实现要素:
本发明的目的在于提供一种具有脑以及心脏双靶向作用,能够实现心脑同治的脂质体及其制备方法。
为了达到上述目的,本发明采用了以下技术手段:
本发明的一种心脑双靶向脂质体(anti-ctniab-peg/ac4man-peg-lip),是通过在式i所示的乙酰化糖酯-聚乙二醇-磷脂酰乙醇胺共轭物修饰的脂质体(ac4man-peg-lip)的表面偶联anti-ctni蛋白抗体或其片段后得到的;
其中,n=10~120,优选13~45,更优选的,所述的聚乙二醇为聚乙二醇600、聚乙二醇1000或聚乙二醇2000。
其中,优选的,式i所示的乙酰化糖酯-聚乙二醇-磷脂酰乙醇胺共轭物通过以下步骤制备得到:在二氯甲烷中将p-对羧基苯基-α-d-乙酰甘露糖胺(ac4man)和聚乙二醇(peg)通过缩合反应形成peg-ac4man,然后将二硬脂酰基磷脂酰乙醇胺(dspe)与peg-ac4man进行偶联,得到dspe-peg-ac4man,即为式i所示的化合物。
其中,优选的,式i所示的乙酰化糖酯-聚乙二醇-磷脂酰乙醇胺共轭物通过以下步骤制备得到:将叠氮-聚乙二醇-羧基溶于四氢呋喃中,之后加入pd/c和乙酸,于室温下通入氢气,反应一夜;将粗品过滤后,旋转蒸发至干燥,然后溶于二氯甲烷中,加入三乙胺和p-对羧基苯基-α-d-乙酰甘露糖胺(ac4man),在室温下反应一夜,分离纯化,得到peg-ac4man;将peg-ac4man溶于二氯甲烷中,依次加入n-羟基琥珀酰亚胺(nhs)和1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(edci),室温反应过夜,分离纯化,得到丁二酰亚胺聚乙二醇乙酰甘露糖苷;将丁二酰亚胺聚乙二醇乙酰甘露糖苷溶于二氯甲烷中,加入tea和溶于氯仿中的二硬脂酰基磷脂酰乙醇胺(dspe),在室温下反应一夜,用饱和nacl萃取2次,分离纯化,得到dspe-peg-ac4man,即为式i所示的化合物。
进一步的,本发明还提出了一种制备所述的心脑双靶向脂质体的方法,包括以下步骤:
(1)乙酰化糖酯-聚乙二醇-磷脂酰乙醇胺共轭物修饰的脂质体(ac4man-peg-lip)的制备
将蛋黄磷脂酰胆碱(epc)、胆固醇(cho)和式i所示的乙酰化糖酯-聚乙二醇-磷脂酰乙醇胺共轭物用无水乙醇溶解在旋转瓶中,通过在减压条件下蒸发该混合物形成薄的脂质膜;用生理盐水溶液水化该脂质膜;通过超声处理使脂质体溶液分散,并通过聚碳酸酯膜挤出,得到乙酰化糖酯-聚乙二醇-磷脂酰乙醇胺共轭物修饰的脂质体,命名为ac4man-peg-lip,将脂质体样品保存在4℃,备用;
(2)anti-ctni抗体修饰的脂质体制备(anti-ctniab-peg/ac4man-peg-lip)
合成anti-ctniab-dspe-peg溶液:将anti-ctni抗体和dspe-peg-马来酰亚胺分别溶于hepes溶液中,然后混合在4℃下过夜,得到anti-ctniab-dspe-peg溶液;将anti-ctniab-dspe-peg溶液与步骤(1)制备的ac4man-peg-lip脂质体溶液在37℃温育2小时,制备得到anti-ctni抗体修饰的ac4man-peg-lip,命名为anti-ctni-peg/ac4man-peg-lip,即为心脑双靶向脂质体。
其中,优选的,步骤(1)中epc,cho和式i所示的乙酰化糖酯-聚乙二醇-磷脂酰乙醇胺共轭物的摩尔比为(40-49):(50-55):(1-5),更优选为49:50:1。
其中,步骤(2)中anti-ctniab-dspe-peg与ac4man-peg-lip脂质体的摩尔比为(1-100):(50-1000),更优选为1:500。
其中,优选的,步骤(2)中所述的dspe-peg-马来酰亚胺为dspe-peg600-马来酰亚胺,dspe-peg1000-马来酰亚胺或dspe-peg2000-马来酰亚胺。
更进一步的,本发明还提出了所述的心脑双靶向脂质体在制备药物载体中的应用。
其中,所述的心脑双靶向脂质体具有脑以及心脏的双靶向的作用,从而实现心脑同治的目的。
其中,优选的,所述的药物用于治疗心肌疾病以及心源性脑病,更优选的,所述的心源性脑病包括心源性脑缺血综合征、心源性脑供血不足以及心源性脑卒中。
相较于现有技术,本发明的有益效果是:
1、本发明通过在脂质体表面修饰甘露糖分子衍生物以及anti-ctni蛋白抗体,使得该脂质体具有了脑靶向以及心脏靶向的双靶向作用,能够实现心脑同治。经体外细胞试验、亲和力实验、体内分布实验均证明该脂质体既可以治疗心肌疾病,与此同时也可跨越血脑屏障,治疗由心源性疾病所致的脑病。
2、通过改变脂质体表面peg(linker)长度可以改变糖分子衍生物、抗体的空间位置,从而改变药物在心脏和脑组织的分布,调控药物在心、脑分布变化,实现个体化治疗。
附图说明
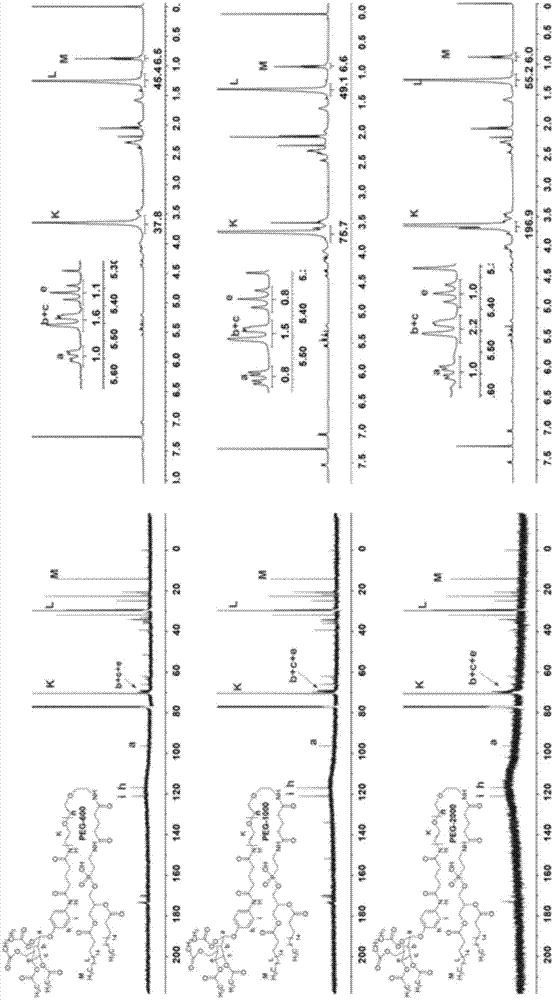
图1为dspe-peg600-ac4man、dspe-peg1000-ac4man及dspe-peg2000-ac4man的核磁共振氢谱和碳谱图;
图2a为ac4m胶束修饰ato脂质体(以peg1000为例)的示意图;
图2b为在ni(oac)2溶液中加入ato溶液时可明显观察到绿色沉积,表明了ato和ni(oac)2在ac4man修饰的脂质体中的存在状态;
图3为在ph为7.4的pbs中,测定了脂质体在37℃下ato和ni(oac)2的体外累积释放率曲线;
(a)ato在ato-lip和ac4m-ato-lip(以peg1000为例)中的释放曲线;(b)ni(oac)2在ni-lip和ac4m-ni-lip中的释放曲线;数据以平均值±标准差(n=3)来表示;
图4为不同脂质体对胶质瘤细胞生长抑制作用的研究;
分别用mtt法和细胞成像法检测不同浓度的ato、ato-lip和ac4m-ato-lip(以peg1000为例)加药48h(a,a)、72h(b,b)和96h(c,c)后u87细胞的存活率;ato浓度分别为40.6、81.5、162.5、325、650和1300μm,数据为平均值±标准差(n=3);(标尺,300nm);
图5为采用流式细胞术检测药物在体外的摄取情况;
其中,图5a为摄取试验:直方图峰向右侧移动,表明u87对ac4m-ato-lip(以peg1000为例)的摄取率增加;
图5b为统计分析:各制剂的荧光强度用柱形图表示;数据需经归一化处理,并用平均值±标准差(n=3,***p<0.001,与rho-lip的细胞摄取进行比较)表示;
图6a为u87胶质瘤细胞与rho标记的ac4man-peg1000-lip孵育0~20min的过程中拍摄的活细胞图;(红色部分为被rho标记的脂质体;绿色为被dio染色的细胞膜;蓝色为被hoechst33258染色的细胞核)(标尺,30μm);
图6b为u87胶质瘤细胞与rho标记的ac4man-peg1000-lip孵育0~20min的过程中延时活细胞成像实验的统计学分析;各制剂的荧光强度用归一化数值做成曲线图;数据显示为平均值±标准差(n=3);
图7a为u87胶质瘤细胞与rho标记的ac4man-peg600-lip孵育0~20min的过程中拍摄的活细胞图;(红色部分为被rho标记的脂质体;绿色为被dio染色的细胞膜;蓝色为被hoechst33258染色的细胞核)(标尺,30μm);
图7b为u87胶质瘤细胞与rho标记的ac4man-peg600-lip孵育0~20min的过程中延时活细胞成像实验的统计学分析;各制剂的荧光强度用归一化数值做成曲线图;数据显示为平均值±标准差(n=3);
图8a为u87胶质瘤细胞与rho标记的ac4man-peg2000-lip孵育0~20min的过程中拍摄的活细胞图;(红色部分为被rho标记的脂质体;绿色为被dio染色的细胞膜;蓝色为被hoechst33258染色的细胞核)(标尺,30μm);
图8b为u87胶质瘤细胞与rho标记的ac4man-peg2000-lip孵育0~20min的过程中延时活细胞成像实验的统计学分析;各制剂的荧光强度用归一化数值做成曲线图;数据显示为平均值±标准差(n=3);
图9为ac4man-peg-lip对胶质瘤荷瘤小鼠的抗肿瘤作用;
其中,图9a为注射ac4man-peg1000-lip的脑胶质瘤冰冻切片的h.e染色;(标尺,50μm);
图9b为注射ac4man-peg-lip的小鼠的kaplanmeier生存曲线;
其中,1)注射ac4man-peg1000-lip的小鼠的kaplanmeier生存曲线(n=7);2)注射ac4man-peg600-lip的小鼠的kaplanmeier生存曲线(n=7);3)注射ac4man-peg2000-lip的小鼠的kaplanmeier生存曲线(n=7);
图10为心脑双靶向脂质体的结构表征;
其中:(a)制备anti-ctniab-peg2000/ac4man-peg2000-lip的示意图;(b)使用zetasizernanozs90的anti-ctniab-peg2000/ac4man-peg2000-lip的zeta电位分布;(c)使用tem(比例尺,100)的anti-ctniab-peg2000/ac4man-peg2000。(d)使用zetasizernanozs90的anti-ctniab-peg2000/ac4man-peg2000-lip的粒径分布;
图11为各种dir标记的心脑双靶向脂质体在mi大鼠中的靶向分布;
其中:(a)静脉注射各种制剂后大鼠全身荧光信号的时间依赖性分布:mi大鼠分别给予等体积的dir标记的anti-ctniab-peg2000-lip,dir标记的ac4man-peg2000-lip、dir标记的anti-ctniab-peg2000/ac4man-peg600-lip、dir标记的anti-ctniab-peg2000/ac4man1000-lip和dir标记的anti-ctniab-peg2000/ac4man-peg2000-lip;(b)在给药后1、2、3、4、5和6小时,来自所有实验大鼠的离体的心脏组织中的荧光强度;(c)给药后1、3和6小时,所有实验大鼠的心脏组织切片中的荧光强度。
图12a为直方图统计分析小鼠心脏组织中1、2、3、4、5和6小时心脏组织中心脑双靶向脂质体的分布,表示为dir在心脏中的荧光强度。数据表示平均值±s.d。(n=3)。与在第1、2、3、4、5和6小时的anti-ctniab-peg2000-lip相比,*p<0.05,**p<0.01和***p<0.001;
图12b为直方图统计分析分离的心脏组织中1、3和6小时的心脏组织中心脑双靶向脂质体的分布,表示为dir的荧光强度。与anti-ctniab-peg2000-lip在1、3和6小时相比,*p<0.05,**p<0.01和***p<0.001。
图13为microscalethermophoresis检测各种dir标记的心脑双靶向脂质体与glut1的亲和力,并显示出趋势;x轴表示脂质体浓缩物,而y轴表示分数结合值;anti-ctniabpeg2000/ac4man-peg600-lip的结合常数为2746.9±13182nm;anti-ctniabpeg2000/ac4man-peg1000-lip的结合常数为41.8±36.37nm;而anti-ctniabpeg2000/ac4man-peg2000-lip的结合常数1.17±5.69nm;
图14为使用流式细胞术测定具有不同peg链的连接的ac4man修饰的脂质体通过心肌细胞与c6细胞的摄取量(a和b)。心肌细胞的摄取量如图14a所示。图14b显示c6细胞的平均荧光强度。数据表示为平均值±s.d.(n=3)。*p<0.05,***p<0.001,与lip相比。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将更为清楚。但实施例仅用于说明本发明,并不对本发明的保护范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径获得。
实施例所用的材料如下:
健康成年雄性wistar大鼠
二油酰磷脂酰甘油(dopg)从日本精细化工有限公司购买(日本,大阪)。
二棕榈酰磷脂酰胆碱(dppc),二硬脂酰基磷脂酰乙醇胺(dspe),二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg2000)和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-马来酰亚胺(dspe-peg2000-mal)从先进载体技术制药有限公司购买(中国,上海)。
peg600/1000/2000、戊二酸n-羟基琥珀酰亚胺(nhs)和1-乙基-3-(3-二甲基-异丙基)碳二亚胺盐酸盐(edci)。来自阿拉丁工业公司(中国,上海)。
p-对羧基苯基-α-d-乙酰甘露糖胺(ac4man)从中国北京innochem获得。
蛋黄磷脂酰胆碱(epc)和胆固醇(cho)购自biolifescience&technologyco.,ltd(中国上海)。
三氧化二砷(ato)是哈尔滨医科大学药业有限公司(中国,哈尔滨)赠与。
罗丹明b(rho)和1,1'-二(十八烷基)-3,3,3',3'-四甲基-碘化二碘花青(dir)得自hede生物技术有限公司(北京,中国)。
抗ctni抗体(anti-ctniab)购自immunoway(北京,中国)。
d-甘露糖购自innochem(北京,中国)。
mst毛细管和吐温20从quantumdesign(北京,中国)购买。
实施例1脑靶向分子二异戊基磷乙醇胺-聚乙二醇-1000-p-对羧基苯基-α-d-乙酰甘露糖胺(dspe-peg-1000-ac4man)的合成
式i(其中聚乙二醇部分为peg-1000)
叠氮-聚乙二醇-羧基1000(1.3g)溶于四氢呋喃(20ml)中,之后加入pd/c(0.066g)和乙酸(1ml),于室温下通入氢气,反应一夜。将粗品过滤后,旋转蒸发至干燥,然后溶于二氯甲烷(20ml),加入三乙胺(tea,0.65ml)和ac4man(1.5g),在室温下反应一夜。过柱子,得到peg1000-ac4man(1.18g),产率为62%。将peg1000-ac4man(1.18g)溶于二氯甲烷中,依次加入nhs(0.2g)和edci(0.45g),室温反应过夜,过柱,得到丁二酰亚胺聚乙二醇乙酰甘露糖苷(1.0g),产率为78%。将丁二酰亚胺聚乙二醇乙酰甘露糖苷(0.95g)溶于二氯甲烷(20ml)中,加入tea(0.2ml)和溶于氯仿中的dspe(0.4g),在室温下反应一夜,用饱和nacl萃取2次,过柱,得到dspe-peg1000-ac4man(0.86g),产率为86%。
图1是1hnmr和13cnmr图,用于证实dspe-peg-1000-ac4man的成功合成。如图1所示,在3.8ppm处的峰是peg,在1.3ppm和0.8ppm处,分别有两个峰代表-ch3-和-ch2-,这是dspe的特征峰,而对应5.5ppm的峰为糖的特征峰。
实施例2脑靶向分子二异戊基磷乙醇胺-聚乙二醇-600-p-对羧基苯基-α-d-乙酰甘露糖胺(dspe-peg-600-ac4man)的合成
式i(其中聚乙二醇部分为peg-600)
叠氮-聚乙二醇-羧基600(1.3g)溶于四氢呋喃(20ml)中,之后加入pd/c(0.078g)和乙酸(1ml),于室温下通入氢气,反应一夜。将粗品过滤后,旋转蒸发至干燥,然后溶于二氯甲烷(20ml),加入三乙胺(tea,0.79ml)和ac4man(1.7g),在室温下反应一夜。过柱子,得到peg600-ac4man(1.08g),产率为62%。将peg600-ac4man(0.95g)溶于二氯甲烷(20ml)中,依次加入nhs(0.3g)和edci(0.51g),室温反应过夜,过柱,得到丁二酰亚胺聚乙二醇乙酰甘露糖苷(0.82g),产率为80%。将丁二酰亚胺聚乙二醇乙酰甘露糖苷(0.82g)加入tea(0.3ml)和溶于氯仿中的dspe(0.49g),在室温下反应一夜,用饱和nacl萃取2次,过柱,得到dspe-peg1000-ac4man(0.76g),产率为76%。
图1是1hnmr和13cnmr图,用于证实dspe-peg-600-ac4man的成功合成。如图1所示,在3.8ppm处的峰是peg,在1.3ppm和0.8ppm处,分别有两个峰代表-ch3-和-ch2-,这是dspe的特征峰,而对应5.5ppm的峰为糖的特征峰。
实施例3脑靶向分子二异戊基磷乙醇胺-聚乙二醇-2000-p-对羧基苯基-α-d-乙酰甘露糖胺(dspe-peg-2000-ac4man)的合成
式i(其中聚乙二醇部分为peg-2000)
叠氮-聚乙二醇-羧基2000(1.3g)溶于四氢呋喃(20ml)中,之后加入pd/c(0.052g)和乙酸(1ml),于室温下通入氢气,反应一夜。将粗品过滤后,旋转蒸发至干燥,然后溶于二氯甲烷(20ml),加入三乙胺(tea,0.54ml)和ac4man(1.34g),在室温下反应一夜。过柱子,得到peg2000-ac4man(1.15g),产率为63%。将peg2000-ac4man(0.95g)溶于二氯甲烷(20ml)中,依次加入nhs(0.09g)和edci(0.19g),室温反应过夜,过柱,得到丁二酰亚胺聚乙二醇乙酰甘露糖苷(0.87g),产率为82%。将丁二酰亚胺聚乙二醇乙酰甘露糖苷(0.87g),加入tea(0.15ml)和溶于氯仿中的dspe(0.3g),在室温下反应一夜,用饱和nacl萃取2次,过柱,得到dspe-peg2000-ac4man(0.75g),产率为84%。
图1是1hnmr和13cnmr图,用于证实dspe-peg-2000-ac4man的成功合成。如图1所示,在3.8ppm处的峰是peg,在1.3ppm和0.8ppm处,分别有两个峰代表-ch3-和-ch2-,这是dspe的特征峰,而对应5.5ppm的峰为糖的特征峰。
实施例4载药(ato)脑靶向脂质体的制备
(1)ato-lip的制备
采用薄膜水化法制备空白脂质体:将二棕榈酰磷脂酰胆碱,二油酰磷脂酰甘油,胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000按摩尔比49.4:3.2:43.3:4.1称取,溶于乙醇中,通过旋转蒸发蒸干,可在圆底烧瓶中获得脂质膜。干燥的脂质膜用醋酸镍(ni(oac)2)溶液(600mm,ph=6.8)经超声水化,之后用探针超声(200w)超声5min进一步分散,再通过220nm的聚碳酸酯膜(220nm)挤出3次。挤压过的脂质体过sephadexg-50柱,除去脂质体双分子层外的ni(oac)2溶液,将缓冲液1(300mmnacl+200mmhepes,ph6.8)加入到脂质体胶体溶液中,在脂质体内、外水相之间形成一个梯度,即形成ni(oac)2脂质体(ni-lip)。然后,在2mlni-lip(8.73mg脂质/ml)中加入1mlato溶液(33.4mm),调ph为7.2,在震荡摇床(50℃,110rpm)中孵育10~15h,之后,脂质体悬液过sephadexg-50柱,用缓冲液2(300mmnacl+200mmhepes,ph4)除去过量的h3aso3。最后将脂质体ph值调回7.2,从而得到了ato-lip。
图2a是脂质体制备的示意图。将ni(oac)2包封于脂质体内部,然后将ato主动载入脂质体中,再与ni(oac)2进行络合。最后将ac4m胶束插入到脂质体表面。图2b表明,在室温下,ni(oac)2溶液与ato溶液可形成绿色沉淀,显示出ato和ni(oac)2在脂质体中的存在状态。当它们结合在一起时,ato从囊泡中的快速释放得到了改善。
(2)dspe-peg1000-ac4man修饰ato-lip
用实施例1合成的dspe-peg1000-ac4man对ato-lip进行修饰。首先制备dspe-peg1000-ac4man胶束,其中含有dspe-peg1000-ac4man和dspe-peg2000,摩尔比为8.32:3.75。1mlato-lip(5.82mg脂/ml)与0.5mldspe-peg1000-ac4man胶束(8mg脂质/ml)在室温下孵育2h,可获得ac4m-ato-lip(peg1000)。ac4m-ato-lip(peg600)和ac4m-ato-lip(peg2000)按照相同摩尔比加入,制备方法相同。
(3)包封率与药物的体外释放
采用原子吸收分光光度法(aas)分析ato-lip和ac4m-ato-lip(peg1000)的药物含量。采用透析法测定ato或ni(oac)2的体外释放率。透析袋两端用线系紧,将1mlato-lip或ac4m-ato-lip(peg1000)置于透析袋(cutoff8000~14400da)中。然后将透析袋放入含300mlpbs的500ml离心管中,使离心管在37℃,100rpm的摇床中不断振摇。在特定的时间点(0.5h、1h、2h、4h、8h、12h、24h、48h、72h和96h)采集样品,每次收集后加入相同体积的pbs。
用以下公式计算包封率(%):包封率(%)=(过g-50柱后的药物浓度/过g-50柱前的药物浓度)×100%。计算释放率(%)的公式为:释放率(%)=(mn/m)×100%。mn是ato或ni(oac)2在某个时间点的累积释放量。m是脂质体中载入的ato或ni(oac)2的总量。
结果:ato在ato-lip和ac4m-ato-lip(peg1000)中的包封率分别为22.48%±3.95和25.85%±2.64。由于经过修饰和未经过修饰的脂质体之间的包封率无明显差异,可知修饰配体dspe-peg1000-ac4man胶束不影响脂质体的包封性能。图3a和3b显示的是ato-lip和ac4m-ato-lip(peg1000)中ato和ni(oac)2的体外释放率。运用透析法后,ato和ni(oac)2的释放率用元素分析仪进行检测。实验结果显示,在开始的2小时,ato和ni(oac)2在透析液中的释放率分别小于28.18%±6.23和27.76%±2.56。48个小时后,ato和ni(oac)2的释放率分别约为84.82%±2.78和47.44%±3.51。ato和ni(oac)2在ato-lip和ac4m-ato-lip(peg1000)中的体外释放率是相似的。
实施例5脑靶向脂质体的体外疗效研究实验
(1)细胞培养
人胶质瘤细胞u87来源于中国科学院细胞库(上海)。在含1%青霉素-链霉素和20%胎牛血清的dmem中培养u87胶质瘤细胞。该细胞在37℃、5%co2的细胞培养箱中培养。
(2)细胞毒性对脑胶质瘤细胞的影响
采用细胞成像实验和mtt法检测脂质体的细胞毒性作用。在96孔培养板中,以2.0×104个/孔的密度接种u87细胞,培养过夜,然后分别用不同浓度的空白脂质体、游离ato、ato-lip和ac4m-ato-lip(peg1000)孵育细胞,分别孵育48h、72h和96h。ato浓度分别为40.6、81.5、162.5、325、325、650和1300μm。之后,将含药物的原培养基换为100μl新培养基和10μlmtt(5mg/ml),在37℃下继续孵育4h后,除去mtt,每孔加入100μl二甲基亚砜(dmso)。我们用酶联免疫测定仪(tecan,奥地利)测量了490nm处的光密度(od)值。
将u87细胞接种,培养过夜,然后用各种不同脂质体孵育,孵育48h、72h或96h后将原培养液换为新培养液,然后用hoechst33258(0.2mg/ml)进行染色,用磷酸盐缓冲液(pbs)冲洗3次,立即开始细胞成像实验。我们使用cytation5进行图像拍摄并对数据进行分析。
图4显示的是脂质体对u87胶质瘤细胞的细胞毒作用。为探讨ato对u87胶质瘤细胞的生长是否具有有效的抑制作用,我们对u87胶质瘤细胞给予不同浓度的游离ato、ato-lip或ac4m-ato-lip(peg1000),并用mtt法和细胞成像法进行观察。我们观察到不同脂质体对u87胶质瘤细胞的生长均有明显的抑制作用,并以剂量依赖性的方式诱导细胞死亡。随着时间的延长,细胞毒性增强。各制剂对u87细胞的抑制强度顺序为:游离ato>ac4m-ato-lip(peg1000)>ato-lip。与脂质体相比,游离ato对细胞的生长抑制作用最强,其原因是小分子与细胞直接接触,细胞摄取速度快,并且这是一种具有杀伤性的自然物质。ac4m-ato-lip(peg1000)对u87细胞的抑制作用强于ato-lip,说明存在于脂质体表面的ac4m胶束,增强了ato-lip对u87细胞生长的抑制作用。
(3)u87胶质瘤细胞摄取
1)rho-lip和ac4m-rho-lip的制备
称量epc,cho,dspe-mpeg2000,加入dspe-peg1000-ac4man(dspe-peg600-ac4man或dspe-peg2000-ac4man)溶于无水乙醇,采用薄膜分散发成膜一次,无水乙醇为溶剂;将第一次成膜的脂质体加入无水乙醇复溶;向溶于乙醇的脂质体中加入rho(6.57mm甲醇);用旋蒸使其再次成膜;在避光条件下加入生理盐水超声水化;将水化后的脂质体转移到包有锡箔纸的ep管中,进行探头超声破碎功率150w左右。参数工作10秒暂停30秒运行30次;将脂质体过0.22μm的水相滤膜3次;测量脂质体粒径和电位,透析除去未包入的rho,获得ac4m-rho-lip(分别为peg1000、peg600和peg2000做linker)。
rho-lip的制备与上述方法相同,区别在于不加入dspe-peg-ac4man。
2)流式细胞术
用流式细胞术检测不同脂质体的细胞摄取情况。我们将u87胶质瘤细胞接种到六孔板中,并使细胞培养过夜,然后用dmem/低糖替代dmem/高糖,继续培养12小时,之后分别加游离rho、rho-lip和ac4m-rho-lip(peg1000)在37℃、5%co2下孵育细胞(脂质体用rho标记)。空白对照组为dmem/低糖培养基。孵育4小时后,对细胞进行胰酶消化,离心,再用pbs重悬,收集细胞,进行检测。流式细胞仪检测细胞内rho的荧光强度。rho的发射波长为560nm,用fl2-a滤光片检测荧光强度,并利用flowjo7.6软件对数据进行分析。
图5a和5b显示脂质体在u87胶质瘤细胞中的定量分析,揭示了肿瘤细胞对囊泡的摄取速度。应用流式细胞术检测u87细胞中的荧光信号,监测细胞对游离rho、rho-lip和ac4m-rho-lip(peg1000)的摄取情况。实验结果表明,游离rho的平均荧光强度为6162,rho-lip的平均荧光强度为7125,ac4m-rho-lip(peg1000)的平均荧光强度为10827。实验数据显示,在体外,u87细胞对ac4m-rho-lip的摄取比对rho-lip更显著(p<0.05)。根据细胞摄取结果,由于dspe-peg-1000-ac4man的存在,dspe-peg-1000-ac4man胶束修饰的脂质体具有脑靶向性和胶质瘤靶向性。
3)活细胞成像
使用deltavision显微镜系统观察脂质体随时间推移的细胞摄取能力和摄取率。我们将u87胶质瘤细胞接种于玻璃底小皿中,细胞在37℃,5%co2条件下培养过夜。细胞的细胞核和膜分别用hoechst33258(0.2mg/ml)和dio(0.2mg/ml)染色,然后用pbs洗三次,加1ml新培养液,将rho-lip或ac4m-rho-lip(分别为peg1000、peg600和peg2000做linker)加入到小皿中,然后开始拍摄,并每隔5分钟采集一次图像直到20分钟。最后使用deltavisionsoftwx软件分析结果。
图6-8为延时活细胞成像图,显示不同制剂被u87胶质瘤细胞内化的过程。图片显示的是rho-lip和ac4m-rho-lip(分别为peg1000、peg600和peg2000做linker)在0~20min被细胞摄取的过程。在与rho-lip或ac4m-rho-lip作用的20min中,u87细胞中出现了红色荧光信号。图像显示,两种制剂均能被u87细胞摄取。而与rho-lip孵育的u87细胞中,发现的荧光信号较弱,与此同时,ac4m-rho-lip在各时间点的荧光信号比rho-lip强。图像和数据分析表明,rho-lip进入胶质瘤细胞的速度比ac4m-rho-lip慢。ac4m-rho-lip的荧光信号在细胞质和细胞核中都有显示,说明囊泡在各个细胞器中的分布无明显差异。
实施例6脑靶向脂质体的体内抗肿瘤作用
(1)胶质瘤荷瘤小鼠模型的构建
5~6周龄雄性balb/c裸鼠(18~20g)来源于北京生命河实验动物技术有限公司(中国,北京)。用5%水合氯醛(15ml/20g)麻醉,固定在立体定向仪上,先在头皮上切一个开口,在头盖骨上找到前囟,在前囟的前方0.5mm,侧方2mm处钻一个孔,以0.75μl/min的速度,将u87细胞(2×106细胞/15μlpbs)缓慢注入脑内,深度为2.5mm。切口用组织胶封闭,手术完成,之后每天给模型鼠称重。
(2)脑胶质瘤荷瘤小鼠的治疗
手术完3周后,将小鼠分为四组,每2天通过尾静脉给药一次,分别给予生理盐水、游离ato、ato-lip和ac4m-ato-lip(实施例4制备),给药剂量为每克体重给予2μgato。每天观察和记录小鼠的身体状况和体重。
(3)存活时间
每组有7只小鼠用于监测存活时间,在给药后第1天开始计算到小鼠死亡当天,并绘制各组的kaplanemeier生存曲线。
kaplanemeier生存曲线(图9b)显示,给予生理盐水、游离ato、ato-lip和ac4m-ato-lip(peg1000)的胶质瘤模型鼠的平均存活时间为23、25、30和32天。ac4m-ato-lip(peg1000)组小鼠的存活时间明显长于生理盐水组、游离ato组和ato-lip组。这证明了dspe-peg-1000-ac4man修饰的ato-lip对治疗胶质瘤具有巨大的潜力。而ac4man-ato-lip(peg600)和ac4man-ato-lip(peg2000)生存时间分别为33天和35天。
(4)h.e.染色
监测不同制剂对荷瘤小鼠的疗效,在小鼠死亡前,用4%多聚甲醛溶液进行心脏灌注10分钟,之后,取出脑用来制备冷冻切片(每片切片5μm)。切片用苏木精和伊红进行染色,然后在荧光显微镜下观察。
以荷瘤裸鼠为模型,研究了不同ato制剂的抗肿瘤作用。从h.e.染色结果(图9a)中可直接观察到肿瘤组织切片与正常脑组织切片有所不同,在给予模型鼠ato-lip和ac4m-ato-lip治疗后,荷瘤鼠脑中的肿瘤细胞减少。ato-lip杀死的胶质瘤细胞高于游离ato,而ac4m-ato-lip(peg1000)与ato-lip相比可使更多的胶质瘤细胞死亡。这些结果表明,脂质体在胶质瘤部位的累积多于小分子,是由于高通透性和滞留效应(epr)所致。此外,ac4m胶束还能促进更多的脂质体在胶质瘤部位积累。
实施例7心脑双靶向脂质体的制备与表征
(1)制备ac4man-peg2000-lip
称取摩尔比为49:50:1的蛋黄磷脂酰胆碱(epc),胆固醇(cho)和dspe-peg-2000-ac4man,按照先前报道的方法通过薄膜分散制备脂质体。简而言之,将脂材用无水乙醇溶解在旋转瓶中。通过在减压条件下蒸发该混合物形成薄的脂质膜。用生理盐水溶液水化脂膜。通过超声处理3分钟(运行10秒,暂停6秒,10次)使脂质体溶液分散,并通过聚碳酸酯膜(220nm和150nm,依次3次)挤出。将脂质体样品保存在4℃以供进一步研究。
(2)anti-ctni抗体修饰脂质体制备(anti-ctni-peg2000/ac4man-peg-lip)
用先前报道的方法合成anti-ctniab-dspe-peg溶液[theuseofantibodymodifiedliposomesloadedwithamo-1todeliveroligonucleotidestoischemicmyocardiumforarrhythmiatherapy,meifangliu,et.al.biomaterials,volume35,issue11,april2014,pages3697-3707]。将anti-ctni抗体(ab)(分子量23kd)和dspe-peg-2000-马来酰亚胺(dspe-peg2000-mal,分子量2900da)(摩尔比为1:500)分别溶于hepes溶液(10mm,ph7.4)中,然后混合在4℃下过夜,得到anti-ctniab-dspe-peg2000溶液。将anti-ctniab-dspe-peg2000溶液与步骤(1)制备的脂质体溶液在37℃温育2小时,制备得到anti-ctni抗体修饰的ac4man-peg2000-lip,命名为anti-ctni-peg2000/ac4man-peg2000-lip。
按照以上相同的方法分别制备得到anti-ctni-peg2000/ac4man-peg1000-lip和anti-ctni-peg2000/ac4man-peg600-lip。
(3)脂质体表征
通过动态光散射法(nanozs90,malvern)和透射电子显微镜(tecnaig2f20,stem;fei,hillsboro)。测量前用脂质体稀释一定程度的脂质体,每个样品一式三份。
图10a是脂质体表面的anti-ctni抗体和ac4man的示意图。图10b和d显示了脂质体数据的各种peg包衣的zeta电位和粒径的结果。图10c通过tem表示lip的形态。表1显示平均粒径在100-130nm范围内。ac4man-peg2000-lip带负电(-1.74mv),而anti-ctniab-peg2000/ac4man-peg600-lip为-32.0mv。在用10%fbs孵育24小时期间,lip主要小于150nm。随着peg链长的增加,囊泡的zeta电位逐渐降低。peg链越长,囊泡的表面电荷越低,可能是由于peg的屏蔽作用。
表1脂质体的粒度分布和zeta电位
注:数据表示为平均值±标准差(s.d.)(n=3)
实施例8心脑双靶向脂质体的体内荧光示踪
1、大鼠急性心肌梗死模型建立
每100g体重腹腔注射0.3ml水合氯醛麻醉大鼠,并连接心电图电极。大鼠进行左侧开胸手术,并在左耳廓和肺锥之间的连接点下方约2-3mm处立即结扎左前降支冠状动脉。然后立即将心脏放回胸部并保持心电图记录半小时。碘伏被用来擦伤伤口皮肤并避免感染。成功的标志包括心脏的白色表面,心率降低和st段的抬高。
2、dir标记的脂质体的制备
称量epc,cho,dspe-mpeg2000,dspe-peg600-ac4man(dspe-peg1000-ac4man,dspe-peg2000-ac4man)溶于无水乙醇,采用薄膜分散发成膜一次,无水乙醇为溶剂;将第一次成膜的脂质体加入无水乙醇复溶;向溶于乙醇的脂质体中加入dir(6.57mm甲醇);用旋蒸使其再次成膜;在避光条件下加入生理盐水超声水化;将水化后的脂质体转移到包有锡箔纸的ep管中,进行探头超声破碎功率150w左右。参数工作10秒暂停30秒运行30次;将脂质体过0.22μm的水相滤膜3次;测量脂质体粒径和电位。加入anti-ctniab孵育2h,或补加nacl至同体积,透析除去未包入的dir。分别获得dir标记的ac4man-peg2000-lip,anti-ctniab-peg2000-lip(制备时不加入dspe-peg-ac4man),anti-ctniab-peg2000/ac4man-peg600-lip,anti-ctniab-peg2000/ac4man-peg1000-lip,anti-ctniab-peg2000/ac4man-peg2000-lip。
3、体内荧光示踪
对于光学成采用carestreaminvivofx专业成像系统配备了720nm的激发通滤光片和790nm的发射通滤光片。拍摄方案:x射线照射时间为每个图像2分钟,荧光的暴露时间为30秒。mi大鼠分别注射dir标记的anti-ctni-peg2000-lip,ac4man-peg2000-lip,anti-ctni-peg2000/ac4man-peg600-lip,anti-ctni-peg2000/ac4man-peg1000-lip和ctni-peg2000/ac4man-peg600-lip。将大鼠放入装有720nm带通滤光片和790nm长通滤光片的成像系统中。荧光的曝光时间是30秒,x射线曝光是每个图像2分钟。由与成像台集成的ccd照相机拍摄图像。使用carestream成像系统对数据进行评估
为了研究不同摩尔比例的ac4man和anti-ctni抗体的囊泡表面对体内分布的影响,我们在这里指定了anti-ctni抗体和ac4man(摩尔比为5:12)在所连接的脂质体的表面上的比例通过连接不同的peg分子诸如anti-ctni-peg2000/ac4man-peg600-lip,anti-ctni-peg2000/ac4man-peg1000-lip和ctni-peg2000/ac4man-peg600-lip。使用体内成像系统观察大鼠在不同时间点的缺血性心脏和脑中的制剂分布,其中图像中的伪彩色代表包括心脏和脑的给定组织中不同强度的荧光信号(图11a)。我们之前的研究已经证实注射dir标记的anti-ctni抗体peg2000-lip后缺血心脏的荧光强度达到峰值。anti-ctniab-peg2000-lip和ac4man-peg2000-lip组作为对照,图中信息显示心脑双靶向的脂质体的荧光信号最强。
心脏灌注后,取出心脏组织观察脂质体在心脏组织中的分布,证明荧光信号确实来自组织而不是血管。在灌注大鼠前,通过尾静脉给大鼠注射脂质体,并在注射后第六小时取出心脏。离体心脏中的荧光信号强度说明选择ac4man的较短的peg链,观察到心脏中脂质体积聚的更多(图11b)。心脏组织纵切面的荧光成像与心脏分布的变化一致(图11c)。直方图表示心脏和离体心脏组织(1、2、3、4、5和6)的荧光强度,进一步证实,随着与ac4man连接的peg链长的增加,脂质体向心脏的靶向分布变得更弱(图12a和12b)。随着peg连接ac4man长度链的增加,由于anti-ctni抗体竞争性结合缺血心肌中基质内的游离ctni,脂质体在心脏中的靶分布变得更弱。
实施例9分子相互作用研究
通过microscalethermophoresis(mst)(quantumdesignchina)来确定各种脂质体与glut1的相互作用,该技术可以定量测定生物分子的互作。将ep管编号,加生理盐水,然后将glut1与吐温20混合,然后将dir标记的脂质体加入每个管中。孵育10分钟后,毛细管吸取管中的混合物并依次放置托盘。通过mst检测dir标记的脂质体与glut1的结合力,数据处理用manual_mo.affinityanalysis_v04软件。
使用microscalethermophoresis(mst)测量peg,ac4man接头和glut1的不同链长度的亲和力,研究了脂质体对脑的靶向效率。基于这些数据,我们可以得出结论,脂质体与glut1之间存在结合。结合强度的解离常数(kd)呈现出趋势性,其中anti-ctniab-peg2000/ac4man-peg2000-lip修饰脂质体的kd值为1.17±5.69nm;anti-ctniab-peg2000/ac4man-peg1000-lip为41.8±36.37nm;anti-ctniab-peg2000/ac4man-peg600-lip的2746.9±13182nm。glut1在各种组织,特别是血脑屏障中的血糖转运中起着重要的作用。使用脂质体表面的甘露糖修饰来增强囊泡的脑靶向能力。在本研究中,修饰脂质体可与glut1结合,表面peg2000甘露糖结合剂的结合力高于peg1000,而peg600的结合力最低(图13)。ac4man与不同链长的peg结合glut1蛋白的能力有显着差异。
实施例10心脑双靶向脂质体的细胞摄取研究
1、原代心机细胞的培养
将3日龄的wistar大鼠幼仔在75%乙醇溶液中浸泡1-2min后处死,迅速取出心脏,清洗,切碎并研磨成小块。用37℃的10ml离心管中胰蛋白酶-edta溶液的组织体积的两倍量将组织片段消化1-3分钟。当溶液变混浊时,加入含有血清的培养基以终止消化。重复过程,直到组织消失。使用200目筛网去除组织碎片并以2500rpm离心3分钟以收集细胞。然后将细胞转移到一次性培养瓶中。在37℃,5%co2条件下培养2小时后,根据细胞附着能力去除成纤维细胞。细胞在37℃,5%co2条件下孵育48h,更换新的培养基中进行后续试验。
2、rho标记的脂质体的制备
方法同实施例8中dir标记的脂质体的制备,区别在于将dir替换为rho。
3、细胞摄取研究
通过流式细胞术(bectondickinsonfacsariai,mountainview,ca)进行原代心肌细胞和c6细胞的rho标记脂质体的摄取。将原代细胞和c6细胞以每孔2×105个细胞接种在六孔板中并培养48小时。然后将rho标记的lip包括anti-ctniab-peg2000-lip,ac4man-peg2000-lip,anti-ctniab-peg2000/ac4man-peg600-lip,anti-ctniab-peg2000/ac4man-peg1000-lip和anti--ctniab-peg2000/ac4man-peg2000-lip与心肌细胞或者c6细胞共孵育,dmem培养基作为空白组。4小时后,将细胞用0.25%胰蛋白酶消化分离,收集并重悬于pbs中用于流式细胞术测定。测量rho标记的脂质体吸收,并使用flowjo7.6软件分析数据。
使用流式细胞术检测rho标记的与ac4man连接的不同链长的peg修饰的脂质体的细胞摄取。未修饰的lip作为对照,并通过归一化处理所有荧光值。心肌细胞对lip的平均摄取量为1.5476,anti-ctniab-peg2000-lip为1.8680,ac4man-peg2000-lip为2.0820,anti-ctniab-peg2000/ac4man-peg600为2.3954,对于anti-ctniab-peg2000/ac4man-peg1000-lip为2.435,anti-ctniab-peg2000/ac4man-peg2000-lip为2.7132。与对照组相比,不同链长的peg修饰的脂质体的心肌细胞的摄取明显增加(*p<0.05和***p<0.001)。随着与ac4man连接的peg链长增加,心肌细胞对脂质体的摄取变得更强(图14a)。c6细胞的平均荧光强度为lip为3.9440,anti-ctniab-peg2000-lip为4.6351,ac4man-peg2000-lip为6.5682,对于anti-ctniab-peg2000/ac4man-peg600-lip荧光值为6.1121,anti-ctniab-peg2000/ac4man-peg1000-lip为6.8042,对于anti-ctniab-peg2000/ac4man-peg2000-lip为8.2738。与对照组相比,c6细胞对各种脂质体的摄取显着增加(*p<0.05,***p<0.001)。随着与ac4man连接的peg链长增加,脑的摄取增加(图14b)。
- 还没有人留言评论。精彩留言会获得点赞!