一种新型药物涂层球囊及其制备方法和应用与流程
本发明属于生物医学领域,具体涉及一种新型药物涂层球囊及其制备方法和应用。
背景技术
自1977年gruntzing成功开展经皮冠状动脉球囊扩张技术以来,目前全球每年约超过200万冠心病病人需要进行经皮冠状动脉介入治疗(pci),pci已成为冠心病最主要的血运重建策略。然而,支架内再狭窄一直以来是影响远期疗效的主要因素之一。单纯经皮冠状动脉腔内成形术再狭窄发生率高达30-60%,在裸金属支架(bms)时代,再狭窄发生率达30%以上,随着药物洗脱支架(des)的问世,再狭窄的发生率降低至5-10%左右,但仍未从根本上解决支架内再狭窄问题。如何处理支架内再狭窄,已成为当今冠心病介入治疗面临的新问题。
药物洗脱球囊(dcb),是近年来出现的一项用于治疗支架内再狭窄的新兴手段。突破传统球囊的设计理念,以球囊导管输送抗组织增生药物达到降低再狭窄率的目的,局部发挥作用在体内无存留,具有独特优势。与药物洗脱支架相比,药物洗脱球囊主要具有如下优势:(1)在小血管病变、分叉病变中药物洗脱球囊通过率高,操作更灵活,避免了金属支架外源性植入,最大程度保存了血管原有解剖结构,可进而减少对冠状动脉血流模式的影响;(2)药物洗脱球囊能将药物在特定区域均匀、高浓度、短时间涂布于血管壁,可降低支架金属网的不均匀分布引起的内皮化延迟的发生率,亦不易引起长期炎症反应和全身不良反应;(3)药物洗脱球囊扩张后持续释放药物,药物浓度在术后内膜受损修复最活跃时最高,降低内膜增生从而减少再狭窄;(4)缩短口服双联抗血小板药物疗程,减少出血等并发症,避免药物间相互作用。
现有的研究主要集中在单纯药物(如紫杉醇)涂覆至球囊表面或使用纳米材料包裹抗组织增生药物(如紫杉醇),前者无法保证药物在血栓部位的驻留时间,药物到达血栓部位的20-30min即被血流冲刷流失,后者则很难实现涂覆到高分子基材的球囊表面,还未形成能用于生产的适宜的涂覆技术,且载药种类单一,无法同时实现抗凝血、抗组织增生和促进内皮生长。因此,亟需制备新型药物涂层球囊以解决当前球囊面临的诸多问题。
技术实现要素:
针对现有技术中存在的不足,本发明提供一种新型药物涂层球囊及其制备方法和应用。该方法制得的新型药物涂层球囊避免了传统球囊上药物涂层药物种类单一、极易被血液冲刷的缺点。利用微纳米马达自驱动的特点,将生长因子、抗组织增生药物和抗凝药物负载至介孔-大孔微纳米马达中,可以在实现其在血栓部位长时间停留,提高了药物利用效率,具有广阔的医学领域应用前景。
为了实现上述发明目的,本发明采用了以下技术方案:
一种新型药物涂层球囊,包括球囊本体和覆盖在所述球囊本体表面的药物涂层,所述药物涂层含有活性药物和载体,所述活性药物为生长因子、抗组织增生药物和抗凝药物,所述载体为介孔-大孔微纳米马达。
优选地,所述药物涂层的厚度为1-10μm,所述生长因子、抗组织增生药物和抗凝药物的质量比为1:10:50-1:50:100。
一种新型药物涂层球囊的制备方法,包括以下步骤:
1)制备介孔-大孔微纳米马达;
2)利用介孔-大孔微纳米马达不同尺寸的孔径,使用湿浸渍法分别装载生长因子、抗组织增生药物和抗凝药物,所述介孔装载生长因子,所述大孔装载抗组织增生药物和抗凝药物;
3)将装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米马达通过交联剂均匀涂覆于裸球囊表面,得到新型药物涂层球囊。
优选地,所述的步骤1)中介孔-大孔微纳米马达为介孔-大孔微纳米球形马达、介孔-大孔微纳米管状马达或介孔-大孔微纳米棒状马达。
优选地,所述的步骤2)中抗组织增生药物为依维莫司、雷帕霉素或紫杉醇;所述抗凝药物为肝素、阿司匹林、华法林、双香豆素、潘生丁、硫氮
优选地,所述步骤3)中交联剂为多巴胺或戊二醇。
优选地,所述介孔-大孔微纳米马达的介孔孔径为2-50nm,大孔孔径为50-500nm。
优选地,所述介孔-大孔微纳米球形马达的粒径为10nm-10μm,所述介孔-大孔微纳米管状马达和介孔-大孔微纳米棒状马达直径为50nm-5μm,长度为10μm-20μm。
一种新型药物涂层球囊应用于医学领域。
与现有技术相比,本发明具有以下的有益效果:
本发明针对药物涂层球囊开发中的难点,开发具有自驱动性、分级装载释放药物的多功能介孔-大孔微纳米马达,延长其在血栓部位的停留时间,改善了传统球囊药物极易被血液冲刷、利用率低的现状,极大地改善了治疗效果,具有广阔的医学领域应用前景。
附图说明
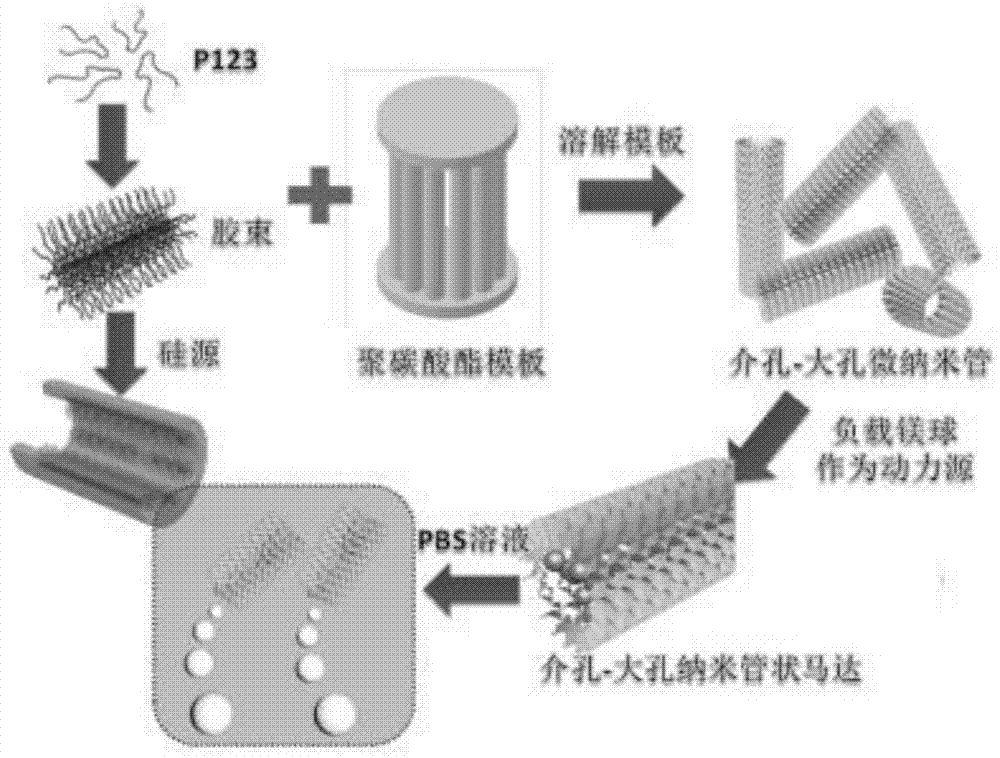
图1为实施例1的介孔-大孔微纳米管状马达的制备方法;
图2为实施例1的介孔-大孔微纳米管状马达的透射电镜图;
图3为实施例1的介孔-大孔微纳米管状马达装载药物涂覆至球囊表面示意图;
图4为实施例1的介孔-大孔微纳米管状马达运动视频截图:(a)为介孔-大孔微纳米管状马达不同时间的运动状态和(b)为介孔-大孔微纳米管状马达1s内的运动路线图;
图5为实施例2的介孔-大孔微纳米球形马达的透射电镜图;
图6为实施例2的介孔-大孔微纳米球形马达运动视频截图:(a)为介孔-大孔微纳米球形马达不同时间的运动状态和(b)为介孔-大孔微纳米球形马达1s内的运动路线图;
图7为实施例3的新型药物涂层球囊的光学图:(a)裸球囊和(b)介孔-大孔微纳米球形马达药物涂层球囊图;
图8为实施例4的介孔-大孔微纳米球形马达药物涂层球囊肝素和雷帕霉素的药物缓释图。
具体实施方式
下面通过具体实施方式对本发明作进一步详细说明。但本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件按照说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
一种新型药物涂层球囊的制备方法,包括以下步骤:
1)介孔-大孔微纳米管状马达的制备
如图1所示:取10g正硅酸四乙酯与74.8μl浓h2so4溶于5.5gh2o和9g乙醇中得到第一溶液;将2.83gp123溶于27g乙醇和5.55gh2o得到第二溶液;将第一溶液和第二溶液混合均匀并抽滤到聚碳酸酯模板中;随后将抽滤后的聚碳酸酯模板浸泡至上述溶液中,保持8天;将粒径为50nm-10μm的镁粉溶液抽滤到聚碳酸酯模板,溶解聚碳酸酯模板,释放得到介孔-大孔微纳米管状马达;所述介孔-大孔微纳米管状马达透射电镜图如图2所示,所合成的介孔-大孔微纳米管状马达直径为5μm,长度为10μm-20μm。
2)生长因子、抗组织增生药物和抗凝药物的装载
使用湿浸渍法将5ml10mg·ml-1血管内皮生长因子和5ml10mg·ml-1的肝素溶液(抗凝药物)与5mg介孔-大孔微纳米管状马达相混合,搅拌并离心处理后将所得物质浸泡至2mg·ml-1的雷帕霉素溶液中(抗组织增生药物),静态混合1h后离心分离、干燥,得到装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米管状马达;
3)使用多巴胺作为交联剂,将裸球囊浸泡至2mg·ml-1的多巴胺缓冲溶液中12h,随后将具有聚多巴胺层的球囊与装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米管状马达分散液混合5h,取出球囊分别用水、乙醇清洗三次,得到介孔-大孔微纳米管状马达药物涂层球囊(如图3所示)。图4a为介孔-大孔微纳米管状马达在pbs溶液中不同时间的运动状态的运动视频与路线截图,图4b为介孔-大孔微纳米管状马达在pbs溶液中在1s内的运动状态的运动视频与路线截图,图4说明该介孔-大孔微纳米管状马达在pbs溶液具有一定的运动能力。
实施例2
一种新型药物涂层球囊的制备方法,包括以下步骤:
1)介孔-大孔微纳米球形马达的制备
取1×1cm-2大小的高分子膜,将镁粉均匀地分散于高分子膜表面并置于10ml50mg·ml-1的多巴胺tris-hcl缓冲溶液中,避光下静置24小时,反应结束后,洗涤干燥得到聚多巴胺-镁粉-高分子膜;将0.15ml水合肼和9.6μl正硅酸四乙酯分散于30ml水中并搅拌10分钟得到分散液,将聚多巴胺-镁粉-高分子膜置于分散液中并在37℃下静置5小时;将2.4ml质量分数为25%十六烷基三甲基溴化铵、0.18g三乙胺、1.6ml环己烷和0.4ml正硅酸四乙酯混合并搅拌10分钟,37℃静置5小时;使用有机溶剂去除高分子膜,释放出介孔-大孔微纳米球形马达。图5为介孔-大孔微纳米球状马达的透射电镜图,由图5可知所合成的介孔-大孔微纳米球形马达直径约为8μm,且外层成功包裹了一层介孔材料。
2)生长因子、抗组织增生药物和抗凝药物的装载
使用湿浸渍法将5ml10mg·ml-1血管内皮生长因子和5ml10mgml-1的肝素溶液(抗凝药物)与5mg介孔-大孔微纳米球形马达相混合,搅拌半小时后,离心,将所得物质浸泡至2mg·ml-1的雷帕霉素溶液(抗组织增生药物),静态混合1h后离心分离、干燥,得到装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米球形马达;
3)使用多巴胺作为交联剂,将裸球囊浸泡至2mgml-1的多巴胺缓冲溶液中12h,随后将具有聚多巴胺层的球囊与装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米球形马达分散液混合5h,取出球囊分别用水、乙醇清洗三次,得到介孔-大孔微纳米球形马达药物涂层球囊。图6a为介孔-大孔微纳米球状马达在pbs溶液中不同时间的运动状态的运动视频与路线截图,图6b为介孔-大孔微纳米球状马达在pbs溶液中在1s内的运动状态的运动视频与路线截图,图6说明该介孔-大孔微纳米管状马达在pbs溶液具有一定的运动能力。
实施例3
步骤1)和步骤2)同实施例2中的步骤1)和步骤2)制备得到装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米球形马达,将装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米球形马达均匀地旋涂在裸球囊,随后晾干,取出球囊分别用水、乙醇清洗三次,得到介孔-大孔微纳米球形马达药物涂层球囊,如图7所示:a为裸球囊,b为介孔-大孔微纳米球形马达药物涂层球囊,介孔-大孔微纳米球形马达药物涂层球囊表面均匀涂覆了一层装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米球形马达,
所述药物涂层的厚度为1-10μm。
实施例4
步骤1)和步骤2)同实施例2中的步骤1)和步骤2)制备得到装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米球形马达,将装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米球形马达均匀地旋涂在裸球囊,将单独负载了肝素钠的样品置于5mlpbs/乙醇混合溶液(vpbs:v乙醇=9:1,ph=7.4)溶液中,37℃下进行释放,每隔一段时间(2h、4h、6h、12h、24h、2d、3d、4d)从中离心取出3ml上清液,再补充3mlpbs溶液。分别采用甲苯胺蓝法和分光光度法对样品缓释出的肝素和雷帕霉素含量进行测试,如图8所示,本发明的新型药物涂层球囊可以持久缓慢地释放出药物。
实施例5
一种新型药物涂层球囊的制备方法,包括以下步骤:
1)介孔-大孔微纳米球形马达的制备
取1×1cm-2大小的高分子膜,将镁粉均匀地分散于高分子膜表面并置于10ml50mg·ml-1的多巴胺tris-hcl缓冲溶液中,避光下静置24小时,反应结束后,洗涤干燥得到聚多巴胺-镁粉-高分子膜;将0.15ml水合肼和9.6μl正硅酸四乙酯分散于30ml水中并搅拌10分钟得到分散液,将聚多巴胺-镁粉-高分子膜置于分散液中并在37℃下静置5小时;将2.4ml质量分数为25%十六烷基三甲基溴化铵、0.18g三乙胺、1.6ml环己烷和0.4ml正硅酸四乙酯混合并搅拌10分钟,37℃静置5小时;使用有机溶剂去除高分子膜,释放出介孔-大孔微纳米球形马达。
2)生长因子、抗组织增生药物和抗凝药物的装载
使用湿浸渍法将5ml10mg·ml-1血管内皮生长因子和5ml10mg·ml-1的肝素溶液(抗凝药物)与5mg介孔-大孔微纳米球状马达相混合,搅拌半小时后,离心,将所得物质浸泡至2mg·ml-1的依维莫司溶液(抗组织增生药物),静态混合1h后离心分离、干燥,得到装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米球形马达;
3)使用戊二醛作为交联剂,将裸球囊浸泡至2mgml-1的戊二醛缓冲溶液中12h,随后将具有聚多巴胺层的球囊与装载有生长因子、抗组织增生药物和抗凝药物的介孔-大孔微纳米球形马达分散液混合5h,取出球囊分别用水、乙醇清洗三次,得到介孔-大孔微纳米球形马达药物涂层球囊。
以上所述,仅是本发明较佳的实施例而已,并非对本发明的技术范围作任何限制,故凡是依据本发明的技术实质对以上实施例所做的任何细微修改、等同变化和修饰,均属于本发明技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!