一种凝血酶原突变体蛋白及其编码核酸的应用的制作方法
本发明属于出血病治疗领域,特别涉及一种凝血酶原突变体蛋白及其编码核酸的应用。
背景技术:
凝血因子缺陷或其它人体凝血功能障碍时会导致出血性疾病的发生,其中由于凝血因子viii/ix(fviii/fix)缺陷所导致的出血性疾病称之为血友病(甲型/乙型),重型病人的凝血因子viii/ix活性往往低于正常的1%,经常发生自发的出血导致肌肉血肿或者关节畸形。输注因子viii/ix制剂(目前通常是体外重组表达的凝血因子viii/ix蛋白)补充患者体内的凝血因子viii/ix水平是目前唯一有效的治疗方法,但是需要频繁的给药。基因治疗是目前正在临床试验的治疗方法,将正常的凝血因子viii/ix基因导入患者体内表达,从而达到提高凝血因子viii/ix水平,预防出血的目的。虽然应用重组或血浆来源的fviii/fix可以有效地治疗血友病a和b,但是约有30%的病人在治疗后产生抗体,使治疗失效。旁路凝血活性药物是治疗有抑制物产生血友病患者的最佳选择。但是目前临床上应用的凝血因子viia(fviia),由于半寿期短(~2小时),所需剂量大(90~100μg/kg体重),治疗成本高昂,因此如何获得具有更好治疗效果和药物代谢特点的新型旁路凝血途径药物是目前血友病治疗的一个亟待解决的问题。
凝血酶原是凝血反应的核心成分,当其被凝血因子x活化成为具有酶活性的凝血酶后,催化裂解纤维蛋白原称为纤维蛋白,使血液凝固从而达到止血的目的。凝血酶在凝血反应的调节中也发挥重要的作用。在血栓调节蛋白(tm)的协助下,凝血酶将蛋白c裂解活化称为活化的蛋白c(apc),后者催化灭活活化的凝血因子v和viii,从而抑制凝血反应的扩增。因此,生理环境下,凝血酶/凝血酶原在凝血反应中发挥着双重功能,既促进血液凝固,又调节凝血反应,抑制过强的凝血反应发生,导致血栓形成。凝血酶在循环中迅速被其抑制物,如抗凝血酶(atiii)灭活,从而使凝血反应终止。
凝血酶原复合物(包括凝血酶原,凝血因子ix,凝血因子x,凝血因子vii)也被应用于血友病,特别是有抑制物存在的血友病的治疗,但是效果并不理想。在血友病患者中应用凝血酶原后,除被活化促进凝血反应外,也可以活化蛋白c,抑制凝血反应,削弱了凝血酶原的止血治疗效果。同时,由于凝血酶会迅速被抗凝血酶灭活,也限制了凝血酶原的在血友病患者中的止血效果。因此,如何对凝血酶原进行改造,使其具有促凝功能的选择性,也即是在保有促进纤维蛋白原转化为纤维蛋白的活性的同时,削弱活化蛋白c抗凝的活性;同时,延长凝血酶的半寿期,对抗凝血酶的抑制能力产生抵抗,也可以提升凝血酶原在出血病中的治疗效果。
技术实现要素:
本发明所要解决的技术问题是提供一种凝血酶原突变体蛋白及其编码核酸的应用,该突变体凝血活性高,具有很好的基因治疗与重组蛋白替代治疗前景。
本发明提供了一种凝血酶原突变体蛋白及其编码核酸的应用,应用凝血酶原突变体的核苷酸序列于制备基因治疗药物,包括将其与启动子和/或终止序列连接并构建表达质粒。
本发明还提供了一种凝血酶原突变体蛋白及其编码核酸的应用,应用突变体蛋白(凝血酶原r541w蛋白)及其编码核酸于基因编辑的病毒、非病毒载体或模板。
本发明还提供了一种凝血酶原突变体蛋白及其编码核酸的应用,应用突变体蛋白(凝血酶原r541w蛋白)于制备血友病或其他出血性疾病的重组蛋白治疗药物。
本发明还提供了一种凝血酶原突变体蛋白及其编码核酸的应用,应用突变体蛋白(凝血酶原r541w蛋白)于制备凝血酶原r541w突变体融合蛋白,并将其施用于血友病或其他出血性疾病的重组蛋白治疗药物。
所述融合蛋白为人白蛋白、免疫球蛋白fc、转铁蛋白或alpha1抗胰蛋白酶。
凝血酶原突变体的核苷酸序列如seqidno:1所示,位于1621位的核苷酸为t而非c;凝血酶原突变体蛋白的氨基酸序列如seqidno:2所示,位于541的氨基酸为trp而非人野生型凝血酶原hfii的arg;或是任意其他氨基酸在该位点的改变。
本发明还提供了一种凝血酶原突变体的核酸,或与所述编码核酸长度相同且与所述编码核酸完全互补的核酸。
本发明还提供了一种凝血酶原突变体蛋白的制备方法,包括如下步骤:
(1)将人野生型或凝血酶原r541w突变的人凝血酶原基因连入载体中,得到重组载体;
(2)将上述重组载体转化宿主细胞,得到表达重组凝血酶原r541w突变细胞克隆;
(3)于无血清培养基中连续灌流培养上述重组细胞克隆,诱导重组凝血酶原r541w的突变体蛋白的表达;
(4)分离纯化、过滤,最后灌装、冻干,得到所表达的凝血酶原r541w突变体蛋白。
所述步骤(3)中的无血清培养基为“safcbiosciencesex-celltm302”(商品化的试剂)。
所述步骤(4)中的纯化包括初纯和精纯。
本发明还提供了一种表达突变蛋白(凝血酶原r541w)的质粒载体进行基因转导,其制备和检验包括如下步骤:
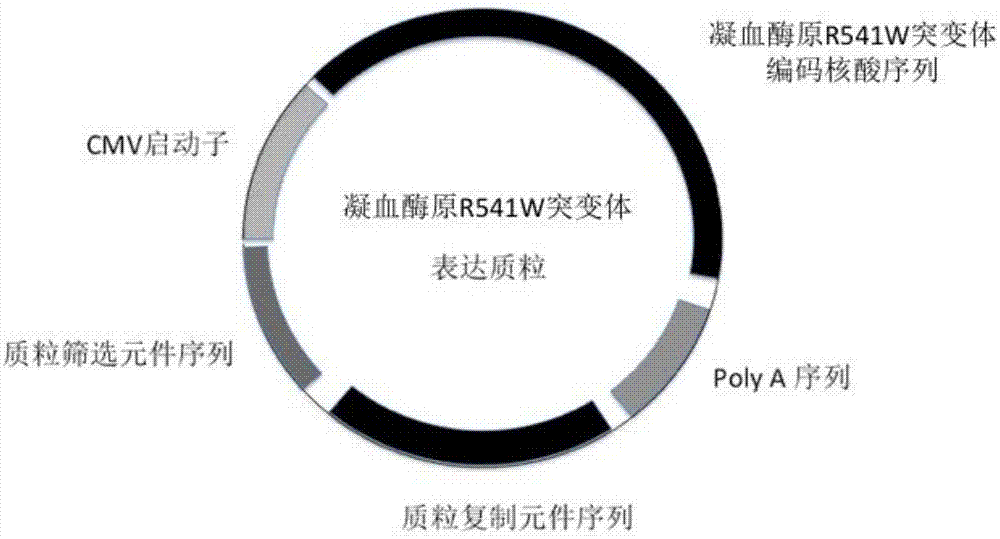
(1)将编码凝血酶原r541w的cdna连接入含cmv启动子的pcdna3.1质粒。
(2)将纯化的表达凝血酶原r541w的质粒载体150μg溶于2ml生理盐水经鼠尾静脉高压注射入4-8周的a型血友病小鼠体内。注射同体积pbs为阴性对照。
(3)注射48小时后,眼眶采血应用凝固法检测凝凝血酶原活性,elisa法检测凝血酶原抗原。
(4)注射后72小时,直径2mm处断尾,置于温生理盐水中观察10分钟内出血情况。通过检测血红蛋白量估测出血量,以缓冲液注射组出血量为100%,比较不同质粒转导后的血友病小鼠断尾后出血量。
(5)心脏取血进行血栓弹力图检测。
本发明的核酸或氨基酸序列的药物组合物或基因治疗载体,用于诊断,预防和/或治疗疾病,其中所述疾病主要包括出血性疾病或各种原因导致的出血;其中,最可能的出血性疾病是血友病a和b,即由于遗传性凝血因子viii或ix缺乏导致的出血性疾病,并包括其中有抑制性抗体产生的血友病a和b,或者后天因抑制物产生所导致的获得性凝血因子viii或ix缺乏;及其它使用旁路制剂的出血性疾病,例如新生儿凝血障碍;严重的肝脏疾病;高风险手术;创伤性失血;骨髓移植;血小板减少症和血小板功能障碍;口服抗凝的紧急逆转;先天性凝血因子v,vii,x和xi的缺陷;血管性血友病,及血管性血友病因子抑制物导致的获得性血管性血友病,与大量损伤有关的失血,大脑出血,血小板功能障碍。
有益效果
本发明的凝血选择性高活性凝血酶原突变体,具有选择性促凝活性,在被转化称为凝血酶后,仍有很强的凝血活性,但是对抗凝系统的作用显著减弱,对抗凝血酶的灭活产生抵制,从而对凝血反应产生更高的促进作用,提升机体整体凝血功能。该凝血酶原突变体可以用于包括血友病(凝血因子ix/凝血因子viii缺陷)(存在或不存在抑制物)等出血性疾病的治疗,具有很好的基因治疗与重组蛋白替代治疗前景。
附图说明
图1为本发明载体结构的示意图;
图2a和b为重组凝血酶原r541w促凝及活化蛋白c的示意图;
图3a和b为重组凝血酶原r541w体外纠正凝血因子viii/ix缺陷血浆凝血酶生成示意图;
图4为重组凝血酶原r541w处理后,血友病a小鼠断尾后生存率示意图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
本实施例提供了一种凝血选择型性高活性凝血酶原突变体蛋白的氨基酸序列如seqidno:2所示。
制备方法包括如下步骤:
(1)将人野生型或凝血酶原突变体r541w的人凝血酶原编码基因连入载体中,得到重组载体;(见图1)
(2)将上述重组载体转化宿主细胞,得到重组表达细胞克隆;
(3)于无血清培养基中培养上述细胞克隆,表达高活性凝血因子xi的突变体蛋白的表达;
无血清培养基为“safcbiosciencesex-celltm302”(商品化的试剂)。为保证产品安全,防止血液来源制剂传播感染性疾病,故应用无血清培养基用于哺乳动物细胞培养、蛋白表达,细胞经对数期生长达到稳态后,将细胞密度维持在目标区间内,维持凝血因子xi高表达。
(4)分离纯化与冻干,从而得到所表达的凝血酶原突变蛋白及相关融合蛋白。
在培养基收集后,经深层滤器澄清过滤并进一步分离纯化。纯化步骤分为初纯和精纯两个阶段,初纯:将过滤澄清的培养液在10倍超滤浓缩后通过有机溶剂/洗涤剂法灭活脂包膜病毒即hiv1/2、hcv以及hbv等;精纯:以离子交换(阴离子和阳离子)和分子筛等色谱层析方法进一步去除产品中残留以宿主细胞分泌的其他蛋白为主的杂质。纯化蛋白经过超滤换液、调节配方后再进行即20nm纳米膜除病毒过滤并冻干。冻干过程为速冻、淬火、冷冻、真空、主干燥、后干燥。冻干配方以甘氨酸、甘露醇、氯化钠、氯化钙等惰性糖类以及无机盐为主(组成为甘氨酸、甘露醇、氯化钠、氯化钙等;冻干时间为30小时)。
(5)凝血酶原突变体促凝,抗凝活性和抗原检测方法。凝血酶原的特异性凝血活性由凝血活性与抗原比较推算而得,蛋白活化由发色底物法测定由图4可知凝血酶原r541w凝血选择性高活性凝血酶原突变体。
凝血酶原活性和抗原检测方法:
①凝固法检测凝血酶原活性:
正常混合血浆用ovbuffer分别进行1:10,1:20,1:40,1:80,1:160,1:320稀释,血浆待测样本进行1:10和1:20稀释,细胞上清液不处理。取50微升稀释的正常混合血浆、待测血浆样本或转染凝血酶原表达载体的细胞上清液,加入50微升凝血酶原基质血浆,加入pt试剂,st4半自动血凝仪(stago公司,法国)上记录凝固时间。以正常混合血浆1:10稀释的凝血酶原活性为100%,以不同稀释度对应的凝固时间的log值和对应的活性得log值建立标准曲线,若相关系数r2大于0.95,则将待测样本的值带入计算,得到待测样本的凝血酶原活性。
②双抗夹心法检测凝血酶原的抗原:
用包被液(1.59g/l碳酸钠和2.94g/l碳酸氢钠,ph9.6)将包被抗体(f9elisa试剂盒,affinitybiologicals,eia9-0035r1)1:100稀释,加入稀释抗体100ul/孔,室温孵育2小时。重复洗涤3次。将正常混合血浆用样品稀释液(23.8ghepes(freeacid)/l,5.84g/lnacl,3.72g/lna2edta,10g/lbsa,0.1%吐温-20,ph7.2)分别1:100对倍稀释至1:3200。待测血浆样本以1:200,1:400和1:800稀释,细胞上清液分别为原液、1:10和1:100稀释。每孔加入100ul稀释好的正混血浆或待测样品,室温放置90min。重复洗涤3次。将检测抗体用样品稀释液1:100稀释,每孔加入100ul的稀释完的检测抗体,室温放置90min。重复洗涤3次。每孔加入100ul的opd底物,待出现稳定的黄色之后(约5-10min),每孔加入100ul的终止液。用酶标仪在450nm的波长下读取吸光度。建立标准曲线,并计算待测样本的抗原值。
凝血酶原和凝血酶活性检测结果如图2a所示,重组表达的野生型和r541w突变体凝血酶原的抗原水平累似,均为60%左右,且两种蛋白对小分子底物(发色底物)的裂解活性也相近,均为65~66%,但是凝血活性r541w突变体略降低(野生型65.1%,r541w为38.6%)。
(6)凝血酶催化裂解活化蛋白c
凝血酶原经太攀蛇毒活化称为具有酶活性的凝血酶,将凝血酶与不同浓度的蛋白c在37c孵育后,将反应产物与发色底物s2765共同孵育,通过检测其对发色底物的裂解能力,估算蛋白c被凝血酶活化的能力。结果如图2b所示,野生型凝血酶可以高效的催化蛋白c转变为活化的蛋白c(apc),但是凝血酶原突变体r541w裂解蛋白c的活性显著低于野生凝血酶,km高于野生凝血酶,而kcat低于野生凝血酶。
(7)凝血酶原突变体纠正血友病a患者血浆凝血酶生成缺陷
凝血酶生成试验(thrombingenerationtest,tgt):是用于监测血浆中凝血酶生成能力的综合性实验。将激活剂(含组织因子及磷脂)加入血浆中启动凝血反应,再加入凝血酶特异性的荧光底物,生成的凝血酶催化底物释放出荧光基团,使用fluoroskan荧光读数仪动态监测生成的荧光信号,使用配套的凝血酶生成实验软件将信号转换成一条凝血酶生成曲线。主要通过曲线的几个参数评价凝血酶生成能力:(1)延迟时间(lagtime),即从反应开始到凝血酶开始生成所需时间;(2)峰值(peak),即生成的凝血酶最大量;(3)达峰时间(timetopeak,ttpeak),即从反应开始到凝血酶达峰值所需时间;(4)凝血酶生成潜力(endogenousthrombinpotential,etp),即凝血酶生成曲线下面积,反应凝血酶生成总量。
在血友病a患者的血浆中(乏凝血因子viii)中加入凝血酶原突变体(浓度为正常生理浓度1.5或3倍150ug~300/ml),在tm存在及蛋白c被活化的情况下进行凝血酶生成检测,见图3。在加入5pm组织因子启动凝血反应后,外源凝血途径启动,促进凝血酶生成(f8-def);但是在加入血栓调节素(tm)模拟体内促凝抗凝的综合效应时,外源途径激活的凝血酶生成被显著抑制(f8-defwithtm);在乏凝血因子viii的血浆中加以1.5倍(图3a)和3倍(图3b)于生理活性的野生型凝血酶原或者r541w突变体后,即使有tm存在,凝血酶生成仍有提高,但是r541w的凝血酶生成较野生型酶原更为显著。
实施例2
凝血酶原突变体r541w治疗血友病a小鼠
(1)将纯化的野生型凝血酶原或突变体r541w以1.5倍生理量(150ug/ml)注射a型血友病小鼠。选用4-8周的血友病小鼠,通过尾静脉将蛋白溶于2ml生理盐水分别注射3只小鼠。pbs注射3只小鼠为负对照。
(2)将小鼠麻醉后,在直径为2mm处断尾,放置于笼中观察其存活率。由图4可知,凝血活性选择性凝血酶原突变体r541w可在体内纠正凝血因子viii缺陷所导致的凝血缺陷,减少出血,提高生存率。
sequencelisting
<110>上海交通大学医学院附属瑞金医院王学锋武文漫丁秋兰
<120>一种凝血酶原突变体蛋白及其编码核酸的应用
<130>1
<160>2
<170>patentinversion3.3
<210>1
<211>1869
<212>dna
<213>人工序列
<400>1
atggcgcacgtccgaggcttgcagctgcctggctgcctggccctggctgccctgtgtagc60
cttgtgcacagccagcatgtgttcctggctcctcagcaagcacggtcgctgctccagcgg120
gtccggcgagccaacaccttcttggaggaggtgcgcaagggcaacctggagcgagagtgc180
gtggaggagacgtgcagctacgaggaggccttcgaggctctggagtcctccacggctacg240
gatgtgttctgggccaagtacacagcttgtgagacagcgaggacgcctcgagataagctt300
gctgcatgtctggaaggtaactgtgctgagggtctgggtacgaactaccgagggcatgtg360
aacatcacccggtcaggcattgagtgccagctatggaggagtcgctacccacataagcct420
gaaatcaactccactacccatcctggggccgacctacaggagaatttctgccgcaacccc480
gacagcagcaccacgggaccctggtgctacactacagaccccaccgtgaggaggcaggaa540
tgcagcatccctgtctgtggccaggatcaagtcactgtagcgatgactccacgctccgaa600
ggctccagtgtgaatctgtcacctccattggagcagtgtgtccctgatcgggggcagcag660
taccaggggcgcctggcggtgaccacacatgggctcccctgcctggcctgggccagcgca720
caggccaaggccctgagcaagcaccaggacttcaactcagctgtgcagctggtggagaac780
ttctgccgcaacccagacggggatgaggagggcgtgtggtgctatgtggccgggaagcct840
ggcgactttgggtactgcgacctcaactattgtgaggaggccgtggaggaggagacagga900
gatgggctggatgaggactcagacagggccatcgaagggcgtaccgccaccagtgagtac960
cagactttcttcaatccgaggacctttggctcgggagaggcagactgtgggctgcgacct1020
ctgttcgagaagaagtcgctggaggacaaaaccgaaagagagctcctggaatcctacatc1080
gacgggcgcattgtggagggctcggatgcagagatcggcatgtcaccttggcaggtgatg1140
cttttccggaagagtccccaggagctgctgtgtggggccagcctcatcagtgaccgctgg1200
gtcctcaccgccgcccactgcctcctgtacccgccctgggacaagaacttcaccgagaat1260
gaccttctggtgcgcattggcaagcactcccgcaccaggtacgagcgaaacattgaaaag1320
atatccatgttggaaaagatctacatccaccccaggtacaactggcgggagaacctggac1380
cgggacattgccctgatgaagctgaagaagcctgttgccttcagtgactacattcaccct1440
gtgtgtctgcccgacagggagacggcagccagcttgctccaggctggatacaaggggcgg1500
gtgacaggctggggcaacctgaaggagacgtggacagccaacgttggtaaggggcagccc1560
agtgtcctgcaggtggtgaacctgcccattgtggagcggccggtctgcaaggactccacc1620
tggatccgcatcactgacaacatgttctgtgctggttacaagcctgatgaagggaaacga1680
ggggatgcctgtgaaggtgacagtgggggaccctttgtcatgaagagcccctttaacaac1740
cgctggtatcaaatgggcatcgtctcatggggtgaaggctgtgaccgggatgggaaatat1800
ggcttctacacacatgtgttccgcctgaagaagtggatacagaaggtcattgatcagttt1860
ggagagtag1869
<210>2
<211>622
<212>prt
<213>人工序列
<400>2
metalahisvalargglyleuglnleuproglycysleualaleuala
151015
alaleucysserleuvalhisserglnhisvalpheleualaprogln
202530
glnalaargserleuleuglnargvalargargalaasnthrpheleu
354045
glugluvalarglysglyasnleugluargglucysvalglugluthr
505560
cyssertyrgluglualapheglualaleugluserserthralathr
65707580
aspvalphetrpalalystyrthralacysgluthralaargthrpro
859095
argasplysleualaalacysleugluglyasncysalagluglyleu
100105110
glythrasntyrargglyhisvalasnilethrargserglyileglu
115120125
cysglnleutrpargserargtyrprohislysprogluileasnser
130135140
thrthrhisproglyalaaspleuglngluasnphecysargasnpro
145150155160
aspserserthrthrglyprotrpcystyrthrthraspprothrval
165170175
argargglnglucysserileprovalcysglyglnaspglnvalthr
180185190
valalametthrproargsergluglyserservalasnleuserpro
195200205
proleugluglncysvalproaspargglyglnglntyrglnglyarg
210215220
leualavalthrthrhisglyleuprocysleualatrpalaserala
225230235240
glnalalysalaleuserlyshisglnasppheasnseralavalgln
245250255
leuvalgluasnphecysargasnproaspglyaspglugluglyval
260265270
trpcystyrvalalaglylysproglyasppheglytyrcysaspleu
275280285
asntyrcysgluglualavalgluglugluthrglyaspglyleuasp
290295300
gluaspseraspargalailegluglyargthralathrserglutyr
305310315320
glnthrphepheasnproargthrpheglyserglyglualaaspcys
325330335
glyleuargproleupheglulyslysserleugluasplysthrglu
340345350
arggluleuleuglusertyrileaspglyargilevalgluglyser
355360365
aspalagluileglymetserprotrpglnvalmetleuphearglys
370375380
serproglngluleuleucysglyalaserleuileseraspargtrp
385390395400
valleuthralaalahiscysleuleutyrproprotrpasplysasn
405410415
phethrgluasnaspleuleuvalargileglylyshisserargthr
420425430
argtyrgluargasnileglulysilesermetleuglulysiletyr
435440445
ilehisproargtyrasntrparggluasnleuaspargaspileala
450455460
leumetlysleulyslysprovalalapheserasptyrilehispro
465470475480
valcysleuproasparggluthralaalaserleuleuglnalagly
485490495
tyrlysglyargvalthrglytrpglyasnleulysgluthrtrpthr
500505510
alaasnvalglylysglyglnproservalleuglnvalvalasnleu
515520525
proilevalgluargprovalcyslysaspserthrtrpileargile
530535540
thraspasnmetphecysalaglytyrlysproaspgluglylysarg
545550555560
glyaspalacysgluglyaspserglyglyprophevalmetlysser
565570575
propheasnasnargtrptyrglnmetglyilevalsertrpglyglu
580585590
glycysaspargaspglylystyrglyphetyrthrhisvalphearg
595600605
leulyslystrpileglnlysvalileaspglnpheglyglu
610615620
- 还没有人留言评论。精彩留言会获得点赞!