追风伞在制备防治内质网应激诱导疾病的药物中的应用的制作方法
本发明属于生物医药技术领域,尤其涉及追风伞在制备防治内质网应激诱导疾病的药物中的应用。
背景技术:
追风伞,为报春花科植物狭叶排草的全草。又名,"追风伞"又叫是"马比木"。马比木是一种中草药,具有祛风除湿,理气散寒的功能。
《贵州民间方药集》、《贵阳民间药草》以及《贵州草药》均有记载,也异名为惊风伞、一把伞或公接骨丹。狭叶排草多年生草本,高约30厘米。植物形态须根淡黄色。茎丛生,不分枝,近基部红色,有柔毛。上部绿色,节稍膨大,有短柔毛。茎下部叶退化,很小,如鳞片状,对生;茎顶叶轮生,多为4-7片,大小不等,圆形至倒卵形,长4-14厘米,宽2-10厘米,先端急尖,全缘,稍成皱波状,基部阔楔形至狭楔形,上面光绿,下面淡绿;叶柄无,或极短,枣红色。生于低山区阴湿林下及沟边。分布四川、贵州等地。
据《贵州草药》记载,追风伞性温,味苦辛。具有祛风,活血功效,用于治疗风湿痹痛,半身不遂,跌打损伤,小儿惊风等症状。
目前,多是在药方中将惊风伞与其他组分配伍使用用于治疗上述病症,对于追风伞提取产物分离鉴定以及从分子水平进行机理等方面研究较少,尚未发现追风伞其他的用途的报道,严重影响了追风伞进一步推广应用。
技术实现要素:
鉴于现有技术所存在的问题,本发明提供追风伞及其提取物新的用途。
本发明解决上述技术问题的技术方案如下:
追风伞在制备防治内质网应激诱导疾病的药物中的应用。具体的,追风伞可以单独使用或者与其他组分联合使用用于制备防治内质网应激诱导疾病的药物。
追风伞提取物在制备防治内质网应激诱导疾病的药物中的应用。具体的,追风伞提取物可以单独使用或者与其他组分联合使用用于制备防治内质网应激诱导疾病的药物。
追风伞或追风伞提取物在制备防治神经退行性疾病的药物中的应用。具体的,追风伞或追风伞提取物可以单独使用或者与其他组分联合使用用于制备防治神经退行性疾病的药物。
追风伞或追风伞提取物在制备防治阿尔兹海默病或帕金森氏病的药物中的应用。具体的,追风伞或追风伞提取物可以单独使用或者与其他组分联合使用用于制备防治阿尔兹海默病或帕金森氏病的药物。
追风伞或追风伞提取物在制备抗内质网应激作用的药物中的应用。具体的,追风伞或追风伞提取物可以单独使用或者与其他组分联合使用用于制备抗内质网应激作用的药物。
追风伞或追风伞提取物在下调氨肽酶的表达水平中的应用。具体的,追风伞或追风伞提取物可以作为或制备用于下调氨肽酶的表达水平的药物。
本发明中,追风伞为报春花科植物狭叶落地梅lysimachiaparidiformisfranch.var.stenophyllafranch.的干燥全草。
追风伞提取物以追风伞为原料提取,追风伞为报春花科植物狭叶落地梅lysimachiaparidiformisfranch.var.stenophyllafranch.的干燥全草。
追风伞提取物可以通过以下方法提取:将追风伞药材粉碎,运用回流提取法采用蒸馏水对药材进行回流提取,收集提取液,浓缩、冷冻干燥,得到追风伞提取物。
具体的,追风伞提取物可以通过以下方法提取:追风伞粉碎,每次使用3-20倍质量的蒸馏水,运用回流提取法对追风伞进行回流提取0.5-4小时,总共提取1-5次,合并提取液,将提取液浓缩成浓缩液,浓缩液的体积为合并后的提取液的体积的1%-10%,将浓缩液进行冷冻干燥,得到追风伞提取物。
附图说明
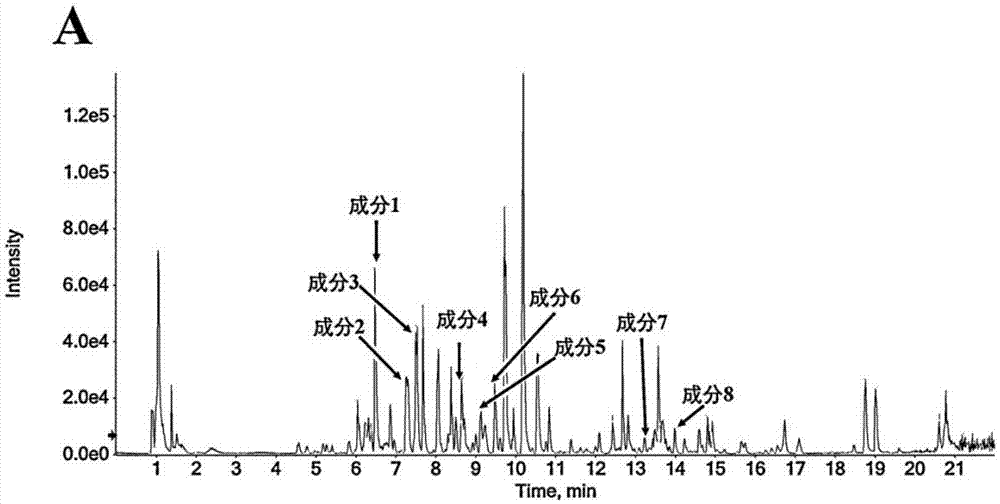
图1为采用正离子扫描模式扫描追风伞提取物的色谱图;
图2为采用负离子模式扫描追风伞提取物的色谱图。
具体实施方式
以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
追风伞为报春花科植物狭叶落地梅lysimachiaparidiformisfranch.var.stenophyllafranch.的干燥全草。
1、追风伞提取物的制备
追风伞药材2000克,进行粉碎,每次使用10倍质量的蒸馏水(即每次使用的蒸馏水的质量为20千克),运用回流提取法对药材进行回流提取2个小时,总共提取3次,合并提取液,将提取液浓缩至2升,浓缩液进行冷冻干燥,得到253克的追风伞提取物。
2、追风伞提取物色谱轮廓的测定
(1)液相条件:岛津超高效液相色谱仪30a(日本岛津公司),配备acquityuplctmhsst3色谱柱(100mm×2.1mmi.d.,1.8μm)(美国waters集团公司)。流动相a为蒸馏水(含0.1%甲酸,w/w),流动相b为乙腈(含0.1%甲酸,w/w)。柱温为40℃,流速为0.4ml/min,进样量为5μl。梯度洗脱方法见表1。色谱仪流出液不经分流直接注入质谱仪进行正负离子扫描分析。
表1uplc流动相梯度洗脱方法
a为0.1%甲酸-水;b为0.1%甲酸-乙腈
(2)质谱条件:使用absciextripletof4600质谱仪(美国absciex集团公司)。
正离子扫描模式:
离子喷雾电压:5.5kv,离子源温度:600℃,解簇电压(dp):100v,碰撞能量(ce):35ev。氮气为雾化气和辅助气:雾化气为55psi,辅助气为55psi,气帘气为35psi。在m/z:100-1000amu质量范围esi正离子模式下进行全扫描,积累时间为160ms。ida采用标准:每个分析物,超过100cps的八个最强的碎片离子在100~1000amu质量范围内进行子离子扫描,累积时间为100ms。碰撞电压差为15ev,动态背景扣除dbs开启。自动校准系统(cds)对ms和ms/ms自动进行调谐和校正。数据获取和处理分析采用
负离子扫描模式:
离子喷雾电压:4.0kv,离子源温度:600℃,解簇电压(dp):100v,碰撞能量(ce):35ev。氮气为雾化气和辅助气,雾化气为65psi,辅助气为65psi,气帘气为35psi。在m/z:100-1000amu质量范围esi正离子模式下进行全扫描,积累时间160ms。ida采用标准:每个分析物,超过100cps的八个最强的碎片离子在100~1000amu质量范围内进行子离子扫描,累积时间为100ms。碰撞电压差为15ev,动态背景扣除dbs开启。自动校准系统(cds)对ms和ms/ms自动进行调谐和校正。数据获取和处理分析采用采用
(3)化学成分鉴定
将成分列表导入masterview软件,给予其相应加合形式(pos:+h、+nh4、+na、+k、2m+h等;neg:-h、+cl、+fa-h等),建立了目标性成分筛选列表。结合ida模式采集的二级数据进行结构匹配,以文献报道、网络质谱数据库的信息与对比分析得分为标准。
实验结果:
追风伞提取物的色谱图轮廓如图1和图2所示。
图1为追风伞提取物的正离子模式的色谱图轮廓,
图2为追风伞提取物的负离子模式的色谱图轮廓;
成分1:格链孢醇,离子峰强度为1500-3000,
成分2:芹菜素,离子峰强度为9000-13000,
成分3:7-羟基香豆精,离子峰强度为9000-13000,
成分4:莰酮,离子峰强度为500-2000,
成分5:木犀草素,离子峰强度为20000-35000,
成分6:异鼠李素-3-o-β-d-葡萄糖苷,离子峰强度为40000-60000,
成分7:5-甲基山奈酚,离子峰强度为4000-8000,
成分8:刺槐素,离子峰强度为500-2000,
成分9:2,5-二羟基苯甲酸甲酯,离子峰强度为1500-3000,
成分10:原儿茶酸,离子峰强度为30000-60000,
成分11:华中冬青素,离子峰强度为3000-6000。
3、动物分组与给药方法
雄性sd大鼠(200g),随机分为空白对照组、追风伞低剂量组、追风伞中剂量组、追风伞高剂量组。追风伞提取物的给药剂量是0.01g/kg-0.60g/kg,每天口服给药一次,连续3-90天。空白对照组给予等量生理盐水3-90天,每天一次。
实施例1
雄性sd大鼠购自斯贝福(北京)生物技术有限公司,空白对照组的雄性sd大鼠的数量为10只,追风伞低剂量组的雄性sd大鼠的数量为10只、追风伞中剂量组的雄性sd大鼠的数量为10只、追风伞高剂量组的雄性sd大鼠的数量为10只。追风伞低剂量组的追风伞提取物的给药剂量为每次0.01-0.02g/kg、追风伞中剂量组的追风伞提取物的给药剂量为每次0.03-0.04g/kg、追风伞高剂量组的追风伞提取物的给药剂量为每次0.05-0.06g/kg,每天口服给药一次,连续3天。空白对照组给予等量生理盐水3天,每天口服一次。
实施例2
雄性sd大鼠购自斯贝福(北京)生物技术有限公司,空白对照组的雄性sd大鼠的数量为10只,追风伞低剂量组的雄性sd大鼠的数量为10只、追风伞中剂量组的雄性sd大鼠的数量为10只、追风伞高剂量组的雄性sd大鼠的数量为10只。追风伞低剂量组的追风伞提取物的给药剂量为每次0.01-0.02g/kg、追风伞中剂量组的追风伞提取物的给药剂量为每次0.03-0.04g/kg、追风伞高剂量组的追风伞提取物的给药剂量为每次0.05-0.06g/kg,每天口服给药一次,连续30天。空白对照组给予等量生理盐水30天,每天口服一次。
实施例3
雄性sd大鼠购自斯贝福(北京)生物技术有限公司,空白对照组的雄性sd大鼠的数量为10只,追风伞低剂量组的雄性sd大鼠的数量为10只、追风伞中剂量组的雄性sd大鼠的数量为10只、追风伞高剂量组的雄性sd大鼠的数量为10只。追风伞低剂量组的追风伞提取物的给药剂量为每次0.01-0.02g/kg、追风伞中剂量组的追风伞提取物的给药剂量为每次0.03-0.04g/kg、追风伞高剂量组的追风伞提取物的给药剂量为每次0.05-0.06g/kg,每天口服给药一次,连续90天。空白对照组给予等量生理盐水90天,每天口服一次。
4、样本收集与处理
在末次给药的24h后,从各组大鼠的腹主动脉收集血液样本,待血液凝固后,2000rpm,4℃离心10分钟,小心取出上清液。收集上清液,分装后冻存于-80℃中。
5、蛋白质组学分析
(1)液相条件:1000system高效液相色谱仪(美国thermoscientic公司),配备easy-spraycolumn色谱柱(12cmx75μm,c18,3μm)(美国thermoscientic公司)。流动相a为超纯水(含0.1%甲酸,w/w),流动相b为乙腈(含0.1%甲酸,w/w)。上样体积为10μl,装载泵流速350nl/min,15分钟,分离流速350nl/min,分离梯度如表2所示。
表2高效液相流动相梯度洗脱方法
(2)质谱条件:使用q-exactive质谱系统(美国thermoscientic公司)。
离子源参数:sprayvoltage:2.1kv;capillarytemperature:250℃;ionsource:easy-spraysource;dp:100。
fullms:resolution:70000fwhm;fullscanagctarget:1e6;fullscanmax.it:60ms;scanrange:350-1800m/z;
dd-ms2:resolution:17500fwhm;agctarget:5e6;maximumit:70ms;intensitythreshold:5.00e+03;fragmentationmethods:hcd;nce:29%;topn:20。
(3)检索鉴定参数:使用maxquant软件进行蛋白质的检索鉴定。
检索参数设置如下:
6、统计学分析:差异蛋白的筛选标准:p-value<0.05,foldchange>2.0或<0.5,得到差异蛋白的分析结果。
实验结果:
通过蛋白质组学研究,发现了血液中3390个蛋白质的表达情况,运用统计学方法在这些大量数据中进行分析筛选,其中,氨肽酶的蛋白质组学结果如表3所示。发明人在研究中意外的发现,经追风伞干预后,氨肽酶的表达水平显著下调。氨肽酶表达不足可以减轻内质网应激。
表3追风伞干预大鼠血清的差异蛋白
目前,追风伞主要用于关节疾病的治疗。本研究意外的发现,追风伞可以通过对相关蛋白的调节来产生抗内质网应激作用。这可以进一步扩展追风伞的运用范围,可以用于多种内质网应激诱导疾病的防治,例如神经退行性疾病,(例如:阿尔兹海默病、帕金森氏病等等)。
发明人又进行了多次的实验,例如,分别采用以下方式提取追风伞提取物:
方式一,将追风伞粉碎,每次使用3倍质量的蒸馏水,运用回流提取法对追风伞进行回流提取0.5小时,总共提取1次,合并提取液,将提取液浓缩成浓缩液,浓缩液的体积为合并后的提取液的体积的1%,将浓缩液进行冷冻干燥,得到追风伞提取物。
方式二,将追风伞粉碎,每次使用20倍质量的蒸馏水,运用回流提取法对追风伞进行回流提取4小时,总共提取5次,合并提取液,将提取液浓缩成浓缩液,浓缩液的体积为合并后的提取液的体积的10%,将浓缩液进行冷冻干燥,得到追风伞提取物。
分别将上述方式提取的追风伞提取物用于上述各实施例的实验验证,结果表明,采用上述方式获得的追风伞提取物均可以通过对相关蛋白的调节来产生抗内质网应激作用。这可以进一步扩展追风伞的运用范围,可以用于多种内质网应激诱导疾病的防治。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!