转甲状腺素蛋白在抑制血管新生中的应用的制作方法
本发明涉及转甲状腺素蛋白在抑制血管新生中的应用,属于生物化学、分子生物学和医学领域。
背景技术:
血管生成(angiogenesis)是指从已有的毛细血管或毛细血管后静脉发展而形成新的血管,主要包括:激活期血管基底膜降解;血管内皮细胞的激活、增殖、迁移;重建形成新的血管和血管网,是一个涉及多种细胞的多种分子的复杂过程。血管形成是促血管形成因子和抑制因子协调作用的复杂过程,正常情况下二者处于平衡状态,一旦此平衡打破就会激活血管系统,使血管生成过度或抑制血管系统使血管退化。血管生成机制复杂,参与并促进血管生成的因子也众多,emt腹腔液中巨噬细胞数量明显增加,其分泌的tnf-α和il-8可以促进血管内皮细胞的增殖,转化生长因子-β(tgf-β),血小板衍生内皮细胞生长因子(pd-ecgf),乙酰肝素酶,血管生成素(angs),骨生成素(opn),环氧化酶(cox-2),缺氧诱导因子-1,层粘连蛋白(ln),胎盘生长因子(plgf),survivin,促红细胞生成素(epo)均参与了emt血管形成过程(depalmam.nat.rev.cancer201708;17(8)457-474)。
病理性新生血管的相关疾病包括肿瘤新生血管(lix.science2018mar23;359(6382)1335-1336),脑缺血新生血管(changj.nat.med.2017;23(4)450-460),肾脏新生血管(aminem.cancercell2011;20(6)768-780),糖尿病新生血管(huj.nature20171214;552(7684))等。新生血管的产生是复杂的生物学过程,牵涉多种生长因子及其讯息传递受体,且靶向在讯息传递路径(signalingcascade)中的单一分子可能无法对疾病(例如癌症)中不受控的血管新生提供有效的临床治疗。因此,发展可协同结合数种关键的血管新生因子,以有效抑制血管新生及疾病进程的创新疗法的需求将不断的增加。如今治疗血管新生主要利用靶向药物抗vegf疗法,然而针对靶向药物的个体不敏感性及耐药性临床尚未有有效攻克方法。
技术实现要素:
本发明的第一个目的是提供转甲状腺素蛋白在制备抑制血管新生的药物中的应用。
在本发明的一种实施方式中,所述转甲状腺素蛋白的genbank登录号为cag33189.1。
在本发明的一种实施方式中,所述转甲状腺素蛋白的有效剂量为≥4mmol/l。
在本发明的一种实施方式中,所述应用包括抑制肿瘤新生血管,糖尿病新生血管,眼部新生血管或脑部新生血管。
在本发明的一种实施方式中,所述抑制血管新生药物可抑制肿瘤血管新生。
在本发明的一种实施方式中,所述肿瘤血管新生包括肝癌,肺癌,膀胱癌,乳腺癌,直肠癌,骨肉瘤,胃癌,胰腺癌,白血病、淋巴瘤、骨髓瘤血液癌症的血管新生,血管瘤,血管瘤并发组织血管新生,多发性血管瘤,血管母细胞瘤,良性血管增生疾病。
在本发明的一种实施方式中,所述抑制血管新生药物可抑制眼部血管新生。
在本发明的一种实施方式中,所述抑制血管新生药物可改善高糖环境下眼部血管内皮细胞增殖迁移及成管能力。
在本发明的一种实施方式中,所述眼部血管新生相关的疾病包括脉络膜新生血管、糖尿病视网膜病变、糖尿病黄斑水肿、老年性黄斑退化(amd)、视网膜静脉阻塞、多发息肉性脉络膜血管病变。
本发明的第二个目的是提供一种药物组合物,含有所述转甲状腺素蛋白和药学上可接受的载体。
在本发明的一种实施方式中,所述药物组合物的剂型为注射制剂。
在本发明的一种实施方式中,所述药物组合物的剂型为口服制剂。
本发明的优点和效果:本发明发现给予哺乳动物ttr,在stz诱导的糖尿病大鼠和小鼠模型中其眼部新生血管明显减少。并通过肿瘤新生血管、糖尿病新生血管、眼部新生血管及脑部新生血管体外实验模型验证了ttr抑制血管新生的作用,结果显示,ttr作用于脑部缺氧环境的体外细胞模型,可持续并有效抑制新生血管的产生。ttr作用于脐静脉内皮细胞可明显抑制90%的血管形成;作用于脑微血管内皮细胞可有效抑制95%的血管形成;作用于眼部微血管内皮细胞可有效抑制90%血管形成;作用于大鼠和小鼠模型中,有效抑制新生血管产生高达90%。
附图说明
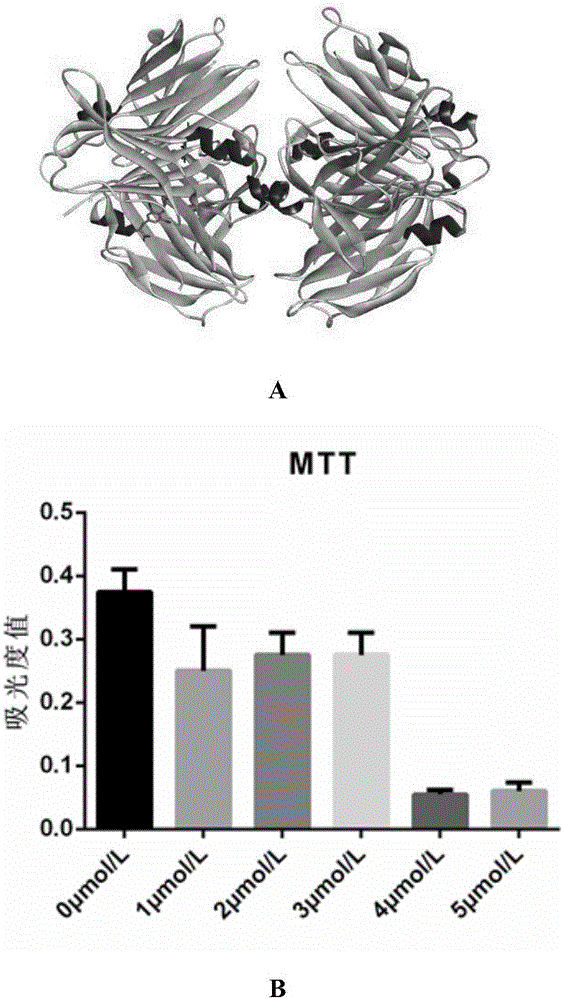
图1为ttr的化学结构图(a);及不同ttr浓度下的细胞活性(b);
图2为脐静脉内皮细胞迁移图;其中,a为高糖dmem培养正常脐静脉内皮细胞48小时,显微镜下观察照相,随机取5视野进行细胞计数算细胞的迁移率;b为外源性添加ttr后的显微镜下观察照相,随机取5视野进行细胞计数算细胞的迁移率;
图3为脑血管内皮细胞迁移图;其中,a为脑血管内皮细胞48小时后细胞的迁移率,b为外源性添加ttr后的细胞迁移率;
图4为眼视网膜内皮细胞迁移图,其中,a为眼视网膜内皮细胞48小时后细胞的迁移率,b为外源性添加ttr后的眼视网膜内皮细胞48小时后细胞的迁移率;
图5为眼视网膜内皮细胞成管图,其中,l为正常低糖(5mmol/l)培养眼视网膜内皮细胞血管形成,h为高糖(30mmol/l);t为外源性添加ttr后的血管新生;
图6为脐静脉内皮细胞成管实验,其中,l为正常脐静脉内皮细胞血管形成,h为外源性添加ttr后的血管新生;t为外源性添加ttr后的血管新生;
图7为不同处理条件下大鼠视网膜血管渗漏情况;其中,a为sd大鼠眼玻璃体腔注射ttr蛋白(4mmol/l,5ul每只眼)后视网膜血管渗漏情况;b为stz诱导的大鼠模型的视网膜血管渗漏情况,c为渗漏液的比例图;
图8为不同处理条件下小鼠视网膜血管渗漏情况;其中,a为c57小鼠眼玻璃体腔注射ttr蛋白(4mmol/l,2ul每只眼)后视网膜血管渗漏情况;b为stz诱导的小鼠模型的视网膜血管渗漏情况,c为渗漏液的比例图;
图9为c57小鼠的眼底光学相干断层扫描图像(a)和眼内的vegf水平(b);其中,l为低糖;h为高糖;t为高糖+ttr;
图10为不同处理条件下大鼠眼底图片;其中,a为正常大鼠的眼底图片,b为sd糖尿病大鼠眼底图片,c为ttr蛋白注射后眼底图片。
具体实施方式
实施例1
如图1所示,ttr结构为呈中心对称、轴对称;单体包括147氨基酸,编码ttr的geneid为7276。ttr对应genbank登录号为cag33189.1的氨基酸序列。
在高糖dmem培养条件下采用mtt法检测不同浓度的ttr作用于人微血管内皮细胞(3000/孔)后的细胞活力。结果显示,48h后各组细胞增殖比较,0μmol/l组a值为(0.40±0.03),4μmol/l组a值为(0.17±0.02)。4μmol/l组对增殖的抑制作用高于0μmol/l组,差异有统计学意义(t=15.47,p=0.0001)(图1)。4μmol/l组细胞增殖较0μmol/l组减少了57.4%。可见ttr对人微血管内皮细胞的增殖有抑制作用。
实施例2脐静脉内皮细胞迁移实验
在24孔板各孔内分别加入含有0μm和4μmttr的高糖dmem培养基600μl,同时置入孔径为8.0μm的transwell小室,小室内加入200μl含1×104个人脐静脉内皮细胞的无fbs培养基培养。48h后吸弃上下室培养基,用棉签擦净上室内细胞,24孔板内加入0.4g/l多聚甲醛600μl室温固定30min,吸弃多聚甲醛,pbs冲洗小室背面两遍,24孔板内加入结晶紫600μl,室温染色20min,吸出后pbs冲洗小室背面两遍,显微镜下观察照相,随机取5视野进行细胞计数。
48h细胞迁移实验结果显示,0μmol/l组人脐静脉内皮细胞向外迁移数为(227±14)个、4μmol/l组人脐静脉内皮向外迁移数为(140±7)个。两组间细胞向外迁移数比较,4μmol/l比0μmol/l组低150±3个,差异有统计学意义(t=6.75,p=0.0005)(图2)。可见ttr对人脐静脉内皮细胞的的迁移有阻碍作用。
实施例3脑血管内皮细胞迁移实验
在24孔板各孔内分别加入含有0μm和4μmttr的高糖dmem培养基600μl,同时置入孔径为8.0μm的transwell小室,小室内加入200μl含1×104个脑血管内皮细胞的无fbs培养基培养。48h后吸弃上下室培养基,用棉签擦净上室内细胞,24孔板内加入0.4g/l多聚甲醛600μl室温固定30min,吸弃多聚甲醛,pbs冲洗小室背面两遍,24孔板内加入结晶紫600μl,室温染色20min,吸出后pbs冲洗小室背面两遍,显微镜下观察照相,随机取5视野进行细胞计数。
结果如图3所示,48h细胞迁移实验结果显示,0μmol/l组脑血管内皮细胞向外迁移数为(300±25)个、4μmol/l组脑血管内皮向外迁移数为(150±2)个。两组间细胞向外迁移数比较,4μmol/l组低于于0μmol/l组,差异有统计学意义(t=7.85,p=0.0003)(图3)。可见ttr对脑血管内皮细胞的的迁移有阻碍作用。
实施例4眼视网膜内皮细胞迁移实验
在24孔板各孔内分别加入含有0μm和4μmttr的高糖dmem培养基600μl,同时置入孔径为8.0μm的transwell小室,小室内加入200μl含1×104个眼视网膜内皮细胞的无fbs培养基培养。48h后吸弃上下室培养基,用棉签擦净上室内细胞,24孔板内加入0.4g/l多聚甲醛600μl,室温固定30min,吸弃多聚甲醛,pbs冲洗小室背面两遍,24孔板内加入结晶紫600μl,室温染色20min,吸出后pbs冲洗小室背面两遍,显微镜下观察照相,随机取5视野进行细胞计数。
结果如图4所示,48h细胞迁移实验结果显示,0μmol/l组眼视网膜血管内皮细胞向外迁移数为(350±30)个、4μmol/l组眼视网膜内皮向外迁移数为(110±17)个。两组间细胞向外迁移数比较,4μmol/l组低于于0μmol/l组,差异有统计学意义(t=8.59,p=0.0002)。可见ttr对脑血管内皮细胞的的迁移有阻碍作用。
实施例5眼视网膜内皮细胞成管实验
将-20℃保存的matrigel基质胶置于4℃冰箱中过夜,当其完全融解成红色胶状液体时方可使用。用预冷的枪头向预冷的48孔板中加入matrigel胶,每孔150μl。在冰上轻轻晃动培养板,使matrigel胶平铺于板底。随后将48孔板置于37℃培养箱30min,使matrigel胶凝固。待细胞长至80%~90%融合时,更换无血清培养基饥饿24h。pbs清洗细胞3次,加入0.25%胰酶消化细胞,体积以覆盖瓶底为限,轻轻摇晃瓶身,使胰酶与细胞充分接触,37℃孵育数分钟。在倒置显微镜下观察细胞形态,当发现细胞质回缩,细胞间隙增大,但细胞尚未漂起时,立即加入完全培养基终止消化。用培养液反复吹打培养瓶底,使细胞完全脱落,收集全部液体至离心管中,细胞计数板计数。常温离心,1000rpm,5min。弃去上清,加入新的培养液,吹打成细胞悬液,等体积分装至四个离心管中,再次离心,1000rpm,5min。各管弃去上清,加入等体积的各组条件培养基制成细胞悬液。以3×104个/孔的密度接种于已铺好胶的培养板中,每组设2个复孔,37℃,5%co2培养箱中孵育8h。利用倒置显微镜观察细胞,并用照相系统采集图像。应用imagepro-plus软件分析图像,计算形成血管腔的数目。
结果如图5所示,l为正常糖浓度dmem培养基,h为高糖dmem培养基,t为高糖dmem培养基+ttr,正常眼视网膜内皮细胞血管呈现管腔状态,外源性添加ttr后的血管新生受到抑制,应用matrigel基质胶可在体外诱导培养的视网膜内皮细胞血管发生,形成管腔结构。内皮细胞在培养后4h开始形成管腔结构,图5示8h即可建立稳定的血管形成的体外模型。高糖+ttr组(50±2)比高糖组(500±12)管腔数显著减少(p=0.025,<0.05),差异均有统计学意义。
实施例6脐静脉内皮细胞成管实验
将-20℃保存的matrigel基质胶置于4℃冰箱中过夜,当其完全融解成红色胶状液体时方可使用。用预冷的枪头向预冷的48孔板中加入matrigel胶,每孔150μl。在冰上轻轻晃动培养板,使matrigel胶平铺于板底。随后将48孔板置于37℃培养箱30min,使matrigel胶凝固。待细胞长至80%~90%融合时,更换无血清培养基饥饿24h。pbs清洗细胞3次,加入0.25%胰酶消化细胞,体积以覆盖瓶底为限,轻轻摇晃瓶身,使胰酶与细胞充分接触,37℃孵育数分钟。在倒置显微镜下观察细胞形态,当发现细胞质回缩,细胞间隙增大,但细胞尚未漂起时,立即加入完全培养基终止消化。用培养液反复吹打培养瓶底,使细胞完全脱落,收集全部液体至离心管中,细胞计数板计数。常温离心,1000rpm,5min。弃去上清,加入新的培养液,吹打成细胞悬液,等体积分装至四个离心管中,再次离心,1000rpm,5min。各管弃去上清,加入等体积的各组条件培养基制成细胞悬液。以3×104个/孔的密度接种于已铺好胶的培养板中,每组设2个复孔,37℃,5%co2培养箱中孵育8h。利用倒置显微镜观察细胞,并用照相系统采集图像。应用imagepro-plus软件分析图像,计算形成血管腔的数目。
结果如图6所示,l为正常糖浓度dmem培养基,h为高糖dmem培养基,t为高糖dmem培养基+ttr,正常脐静脉内皮细胞血管呈现管腔状态,外源性添加ttr后的血管新生受到抑制,应用matrigel基质胶可在体外诱导培养的脐静脉内皮细胞血管发生,形成管腔结构。内皮细胞在培养后4h开始形成管腔结构,8h即可建立稳定的血管形成的体外模型。高糖+ttr组(50±1)比高糖组管腔数(500±20)显著减少(p=0.013,<0.05),差异均有统计学意义。
实施例7
实验按照如下步骤进行:stz(破坏胰岛脲佐菌素)试剂配制:
柠檬酸缓冲液:柠檬酸a液:称2.1g柠檬酸溶于100mlddh2o柠檬酸三钠b液:称2.9g柠檬酸三钠溶于100mlddh2oa液:b液=1.06:11.5%stz:1.5g加入100ml混合液中;大鼠:60mg/kg=6mg/100g;每只大鼠注射0.4ml/100g的1.5%stz;小鼠:150mg/kg=1.5mg/10g。每只小鼠注射0.1ml/10g的1.5%stz。stz配制完成后30min内用完,使用过程中冰上保存。1w后测量尾静脉血糖,如果血糖≥16.7,糖尿病造模成功,3个月后,糖网成模;血糖<16.7继续注射,下周继续测量血糖。注意观察小黑鼠状态,糖尿病小鼠怕冷,多饮多食多尿。首先按3.5ml/kg10%水合氯醛溶液麻醉大鼠,复方托吡卡胺滴眼液散瞳,诺倍喜眼球表面麻醉,抗生素凝胶滴于角膜表面,盖上直径约1cm盖玻片(可直视眼底),在手术显微镜下使用微量注射器抽吸腺病毒5μl,避开晶状体和视网膜血管,由角膜巩膜缘后1mm处刺入玻璃体腔注射,注射后于进针处滴抗生素凝胶再拔出针头。放至保温板上直至苏醒。观察是否出现术后眼底出血或者网脱,每日1次氯霉素滴眼液点眼防治感染。
结果如图7所示,向sd大鼠眼玻璃体腔注射ttr蛋白(4mmol/l,5ul)每只眼后视网膜血管渗漏情况为10%;采用stz诱导的大鼠模型的视网膜血管渗漏情况为90%,眼内注射ttr后渗漏范围由90%减少至10%,可见ttr的注入会明显抑制由于糖尿病引起的新生血管的生成。
实施例8
实验按照如下步骤进行:用氯胺酮(80mg/kg)和二甲基拉嗪(4mg/kg)麻醉糖尿病小鼠和对照组。将右颈静脉和右髂动脉插管,然后灌注肝素化生理盐水。伊万斯蓝(45mg/kg)经颈静脉注射10秒钟。两小时后,从麻醉小鼠获得约0.2毫升血液。动物经左心室灌注pbs,然后灌注1%多聚甲醛。摘除角膜、晶状体和玻璃体。其余视网膜和巩膜在室温下用4%多聚甲醛在磷酸盐缓冲盐水中固定30分钟。用二甲基甲酰胺(sigmaaldrich,st.louis,mo)在78℃下治疗视网膜一夜,然后在12000g下离心15分钟,上清液在620nm(蓝色)和740nm(背景)下进行分光光度检测。根据伊文思蓝在甲酰胺中的标准曲线,计算血浆中染料的浓度,以检测血管渗漏程度。
分别采用老鼠玻璃体注射处理c57小鼠,结果如图8所示,向c57小鼠眼玻璃体腔注射ttr蛋白(4mmol/l,2ul每只眼)后视网膜血管渗漏情况为90%;采用stz诱导的大鼠模型的视网膜血管渗漏情况为90%,血清渗漏范围由90%减少至10%,可见ttr的注入会明显抑制由于糖尿病引起的新生血管的生成。
对处理前后c57小鼠的眼底光学相干断层进行扫描,结果如图9(vegf为血管生长因子,gapdh为内参基因)所示,从左向右依次可以看出ttr添加后视网膜深层的渗出明显减少。b当添加的ttr后眼内的vegf水平下降(t=7.89,p<0.05)。
实施例10
按照实施例9的处理方式处理小鼠,用氯胺酮/二甲基拉嗪将糖尿病小鼠麻醉,复方托吡卡胺(alcon,fortworth,tx,美国)散瞳。在明场活眼底图像的引导下,使用microniv图像引导oct系统(phoenixresearchlaboratories,pleasanton,ca,usa)进行光谱域光学相干断层成像(oct)。结果如如图10所示,由于ttr的添加糖尿病所引起的血管迂曲现象明显好转。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!