包含RPL554的液体吸入制剂的制作方法
本发明涉及包含呼吸式药物的液体药物组合物。
背景技术:
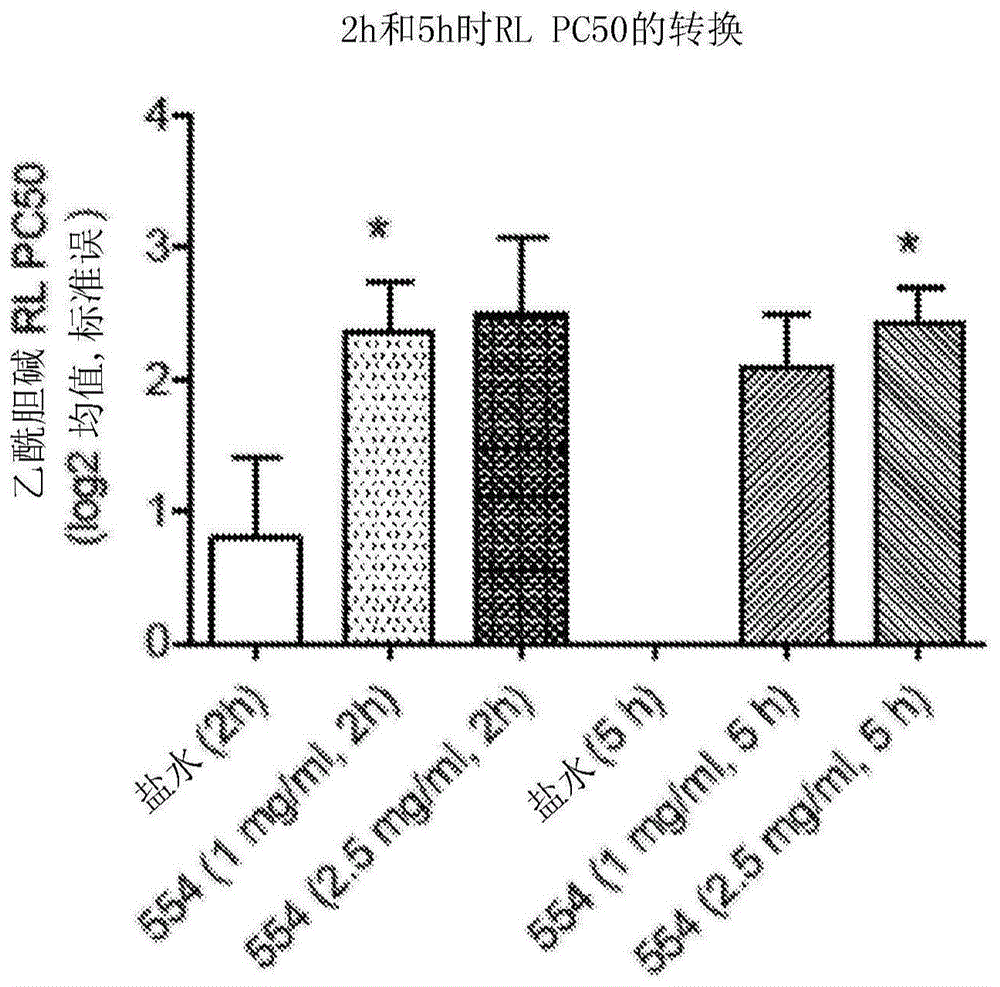
:液体药物组合物的毒代动力学特性是不可预测的。重要的是,正确地配制活性药物成分(api),使得当组合物递送至患者时提供安全、有效和受控的剂量。这对于吸入式组合物尤其如此。此外,液体药物组合物必须具有可靠的长期稳定性以确保在储存后会维持组合物的剂量特征。这避免了不正确的剂量的施用。药物组合物还必须配制为施药对于患者并不是不愉快的,例如对于味道和酸度。rpl554(9,10-二甲氧基-2-(2,4,6-三甲基苯基亚氨基)-3-(n-氨基甲酰基-2-氨基乙基)-3,4,6,7-四氢-2h-嘧啶并[6,1-a]异喹啉-4-酮)是双重pde3/pde4抑制剂,描述于wo00/58308中(有时也称为rpl554)。作为组合的pde3/pde4抑制剂,rpl554具有抗炎和支气管扩张活性,并且可用于治疗诸如哮喘和慢性阻塞性肺病(copd)等呼吸障碍。rpl554的结构如下所示。通常优选的是通过吸入施用rpl554,这归因于其在治疗呼吸障碍中的功效。有效的施用方法是雾化。franciosi等公开了rpl554在柠檬酸盐-磷酸盐缓冲剂中的溶液(efficacyandsafetyofrpl554,adualpde3andpde4inhibitor,inhealthyvolunteersandinpatientswithasthmaorchronicobstructivepulmonarydisease:findingsfromfourclinicaltrials,thelancet:respiratorymedicine11/2013;1(9):714-27.doi:10.1016/s2213-2600(13)70187-5)。技术实现要素:本发明令人惊讶的发现是,包含rpl554的用于吸入的最佳组合物是包含rpl554颗粒的悬浮液的液体药物组合物。已经发现rpl554的悬浮液对于临床环境具有非常理想的性质。已经发现许多益处与包含稀释剂和rpl554或其药学上可接受的盐的颗粒的悬浮液的液体药物组合物相关。与先前的制剂相比,例如与rpl554的溶液制剂相比时,本发明的液体药物组合物具有显著改善的性质。关于毒代动力学性质,已发现与溶液相比,悬浮液制剂具有缓释特性。这可以减少必须对患者施用的治疗次数。如由血浆cmax和auc值可见,还发现悬浮液允许施用更大剂量的rpl554。这也可以减少所需的施用频率。本发明的液体药物组合物还显示出优异的稳定性,组合物在环境条件(25℃)下12个月后或在加速条件(40℃)下6个月后都没有显示出降解。在相同的条件下,在相当的溶液组合物中观察到降解。组合物可以在环境条件(25℃/60%rh)下12个月后或在加速条件(40℃/75%rh)下6个月后都不显示降解。因此,本发明提供了一种液体药物组合物,其包含稀释剂和9,10-二甲氧基-2-(2,4,6-三甲基苯基亚氨基)-3-(n-氨基甲酰基-2-氨基乙基)-3,4,6,7-四氢-2h-嘧啶并[6,1-a]异喹啉-4-酮(rpl554)或其药学上可接受的盐的颗粒的悬浮液。本发明还提供用于治疗人体或动物体的本发明的液体药物组合物。本发明的液体药物组合物可用于治疗或预防选自以下的疾病或病况:哮喘、过敏性哮喘、花粉症、过敏性鼻炎、支气管炎、肺气肿、支气管扩张、慢性阻塞性肺病(copd)、成人呼吸窘迫综合征(ards)、类固醇抵抗性哮喘、重度哮喘、儿童哮喘、囊性纤维化、肺纤维化、肺间质纤维化、间质性肺病、皮肤病、特应性皮炎、牛皮癣、眼部炎症、脑缺血、炎性疾病和自身免疫疾病。通常,所述疾病或病况为哮喘或copd,更通常为copd。本发明还提供了在对象中治疗或预防如本文限定的疾病或病况的方法,所述方法包括对所述对象施用有效量的本发明的液体药物组合物。附图说明图1–在用盐水或rpl554溶液制剂处理的动物中累积产生总气道阻力的50%增加的乙酰胆碱的激发浓度(pc)(乙酰胆碱rlpc50):2h和5h时间点:将乙酰胆碱rlpc50对数转换用于统计分析。未转换数据的事后t检验显示组与盐水之间的差异。*非参数分析显示了2h(1mg/mlrpl554溶液,p=0.0190未调整)和5h(2.5mg/ml溶液,p=0.0095未调整)与盐水组之间的显著差异。从左至右n值=6,4,4,4,4(注:5h对照未绘制)。图2–用载体或rpl554悬浮液制剂处理的动物中的乙酰胆碱rlpc50:2h和5h时间点:将乙酰胆碱rlpc50对数转换用于统计分析(上图)。非参数分析显示了2h(10mg/mlrpl554悬浮液,p=0.0268未调整)与载体对照组之间的显著差异。通过组合载体数据(2+5h)重新分析数据揭示了总体显著的支气管保护(p=0.0016),这由利用2.5mg/mlrpl554悬浮液(2.52倍(1-5.72),p<0.05)和10mg/mlrpl554悬浮液(4.67倍(2-11),*p<0.05)相对于载体的显著的支气管保护程度所反映。在5h时间点,rpl55410mg/ml悬浮液引起显著程度的支气管保护(2.77倍(1.3-6.0),*p<0.05)。(从左至右n=8,4,4,3,6)(下图)。图3显示了在约1.5mg的标称剂量水平下通过雾化器施用(i)悬浮液制剂或(ii)溶液制剂后来自健康人类志愿者的血浆中的rpl554平均浓度。具体实施方式rpl554的颗粒可具有用于适合吸入的液体药物组合物的任何合适的尺寸。通常,rpl554的颗粒为微粉化颗粒。例如,rpl554的颗粒的dv50(按体积计的平均粒径)值可小于或等于10μm或者约0.1μm~约8μm。通常,所述颗粒具有dv50值为约0.2μm~约5μm的粒径分布。更通常地,rpl554颗粒具有dv50值为约0.7μm~约3.0μm的粒径分布。例如,rpl554颗粒可具有dv50值为0.9μm~1.7μm或者为1.7μm~2.7μm的粒径分布。通常,rpl554颗粒具有dv50值为约1.1μm~约2.6μm的粒径分布。dv50值是体积分布的平均粒径。因此,一半体积的颗粒归入直径小于dv50值的颗粒,一半体积的颗粒归入直径大于dv50值的颗粒。这是描述粒径分布的公知方式。所述颗粒通常具有dv10值为约0.4μm~约1.0μm的粒径分布。所述颗粒通常具有dv90值为约2.0μm~约4.0μm的粒径分布。dv10值反映其中10%体积的样品为粒径小于dv10值的颗粒时的粒径。dv90值反映其中90%体积的样品为粒径小于dv90值的颗粒时的粒径。用于测量dv50值的技术通常是激光衍射。例如,如通过激光衍射测得的,rpl554颗粒通常具有dv50值为约0.2μm~约5μm的粒径分布。粒径分布分析可利用与湿分散池结合的malvernspraytec通过激光衍射进行。通常,malvernspraytec的仪器参数如下:·颗粒–标准不透明颗粒;·折射率颗粒–1.50;·折射率(虚部)–0.50;·颗粒密度–1.00;·分散剂的折射率–1.33;·控制器单元–1000rpm;·测量类型–定时;·初始采样时间–30s;·遮蔽–20%~30%;·分散剂–1%polysorbate20的去离子水溶液。rpl554颗粒可以通过任何药学上可接受的尺寸减小方法或粒径控制的生产方法制备。例如,可以通过喷雾干燥rpl554的溶液、或通过受控结晶、或通过固体形式的rpl554的尺寸减小(例如通过空气喷射研磨、机械微粉化或介质研磨)来生产颗粒。液体药物组合物中rpl554颗粒的浓度通常为约0.01mg/ml~约40mg/ml。更通常地,液体药物组合物中rpl554颗粒的浓度为约0.1mg/ml~约20mg/ml。例如,液体药物组合物中rpl554颗粒的浓度可以为约0.01mg/ml~约5mg/ml或0.1mg/ml~5mg/ml。液体药物组合物中rpl554颗粒的浓度可以例如为0.1mg/ml~6mg/ml。优选地,悬浮液的ph为约6~约8,更优选约6.5~约7。液体药物组合物还可以包含一种或多种表面活性剂。表面活性剂是药学上可接受的表面活性剂。表面活性剂可以是非离子型表面活性剂、阴离子型表面活性剂、阳离子型表面活性剂或两性离子型表面活性剂。优选地,所述一种或多种表面活性剂选自一种或多种非离子型表面活性剂。所述一种或多种表面活性剂通常选自聚氧乙烯二醇烷基醚、聚氧丙烯二醇烷基醚、葡糖苷烷基醚、聚氧乙烯二醇辛基酚醚、聚氧乙烯二醇烷基酚醚、甘油烷基酯、聚氧乙烯二醇脱水山梨糖醇烷基酯(polysorbate)、脱水山梨糖醇烷基酯、椰油酰胺mea、椰油酰胺dea、十二烷基二甲基氧化胺、聚乙二醇和聚丙二醇的嵌段共聚物(泊洛沙姆)以及聚乙氧基化牛脂胺(poea)。优选地,所述一种或多种表面活性剂选自聚氧乙烯二醇脱水山梨糖醇烷基酯,例如polysorbate20(聚氧乙烯(20)脱水山梨糖醇单月桂酸酯)、polysorbate40(聚氧乙烯(20)脱水山梨糖醇单棕榈酸酯)、polysorbate60(聚氧乙烯(20)脱水山梨糖醇单硬脂酸酯)和polysorbate80(聚氧乙烯(20)脱水山梨糖醇单油酸酯);和脱水山梨糖醇烷基酯,例如脱水山梨糖醇单月桂酸酯、脱水山梨糖醇单棕榈酸酯、脱水山梨糖醇单硬脂酸酯、脱水山梨糖醇三硬脂酸酯和脱水山梨糖醇单油酸酯。所述一种或多种表面活性剂的总浓度通常为约0.01mg/ml~约2mg/ml。组合物通常包含两种以上表面活性剂,例如polysorbate和span(司盘)表面活性剂。通常,液体药物组合物还包含一种或多种缓冲剂。缓冲剂是药学上可接受的缓冲剂。缓冲剂可以是适用于适合吸入的液体药物组合物的任何缓冲剂。所述一种或多种缓冲剂通常选自柠檬酸盐或磷酸盐缓冲剂。柠檬酸盐缓冲剂包括柠檬酸、柠檬酸钠及其混合物。磷酸盐缓冲剂包括磷酸、磷酸二氢钠、磷酸氢二钠及其混合物。所述一种或多种缓冲剂的总浓度通常为约5mg/ml~约40mg/ml。所述组合物通常包含两种以上缓冲剂组分,例如两种磷酸盐,例如磷酸钠盐。本发明的液体药物组合物可以包含:(a)rlp554的颗粒,其浓度为约0.01mg/ml~约40mg/ml;(b)一种或多种表面活性剂,其浓度为约0.01mg/ml~约5mg/ml;和(c)缓冲剂,其浓度为约5mg/ml~约25mg/ml。液体药物组合物通常还包含张力调节剂。张力调节剂可以是任何药学上可接受的张力调节剂。张力调节剂的实例包括简单的无毒盐,例如碱金属卤化物,例如氯化钠和碘化钾。通常,张力调节剂是氯化钠。张力调节剂的浓度将取决于达到所需张力(例如与身体或肺的等张性)而需要的量。张力调节剂的浓度通常为约2mg/ml~约8mg/ml,更通常为约3.5mg/ml~6mg/ml。液体药物组合物可以包含其他组分。作为另一选择,可以不含其他组分。在一些情况下,液体药物组合物不包含β2-肾上腺素能受体激动剂或毒蕈碱受体拮抗剂(或不包含总量大于0.1重量%的β2-肾上腺素能受体激动剂和毒蕈碱受体拮抗剂)。稀释剂可以是任何药学上可接受的稀释剂。该稀释剂适合通过吸入施用。合适的稀释剂的实例包括水、乙醇和甘油。稀释剂优选为水。稀释剂优选是无菌的。本发明的液体药物组合物通常包含:(a)rlp554颗粒,其浓度为0.01mg/ml~40mg/ml;(b)聚氧乙烯二醇脱水山梨糖醇烷基酯,其浓度为0.1mg/ml~2mg/ml;(c)脱水山梨糖醇烷基酯,其浓度为0.01mg/ml~0.1mg/ml;(d)第一磷酸盐缓冲剂组分,其浓度为5mg/ml~10mg/ml;(e)第二磷酸盐缓冲剂组分,其浓度为5mg/ml~10mg/ml;和(f)张力调节剂,其浓度为2mg/ml~8mg/ml。例如,液体药物组合物可包含:(a)rlp554颗粒,其浓度为0.05mg/ml~25mg/ml;(b)聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(polysorbate20,吐温20),其浓度为0.1mg/ml~2mg/ml;(c)脱水山梨糖醇单月桂酸酯(司盘20),其浓度为0.01mg/ml~0.1mg/ml;(d)磷酸二氢钠一水合物,其浓度为5mg/ml~10mg/ml;(e)无水磷酸氢二钠,其浓度为5mg/ml~10mg/ml;和(f)氯化钠,其浓度为2mg/ml~8mg/ml。通常,液体药物组合物适合于通过雾化器施用。本发明还提供了包含本发明的液体药物组合物的雾化器。该雾化器通常装载有该液体药物组合物。雾化器通常包含约1ml~约200ml的液体药物组合物,更通常包含1ml~20ml的液体药物组合物。雾化器使用压缩空气将液体药物组合物雾化成吸入到对象的呼吸道中的气雾剂。雾化器的实例包括软雾雾化器、振动网雾化器、喷射式雾化器和超声波雾化器。合适的雾化器装置包括philipsi-nebtm(philips)、parilcsprint(parigmbh)、aerxrtm肺部递送系统(aradigmcorp.)和parilcplus可再利用式雾化器(parigmbh)。本发明还提供了用于治疗人体或动物体的液体药物组合物。组合物如本文所限定。液体药物组合物通常用于治疗人体或动物体,其中,治疗包括通过吸入施药。本发明的组合物实现了rpl554缓释到血流中。因此,在一定时间后的rpl554血浆浓度相对于使用已知的rpl554组合物增加。通常,在施用雾化剂量的组合物后大于或等于4小时的时间,rpl554的血浆浓度大于或等于1ng/ml。雾化剂量通常为0.02mg/kg~0.6mg/kg。例如,雾化剂量可以为0.2mg/kg~0.6mg/kg。例如,本发明提供了用于治疗人体或动物体的如本文限定的液体药物组合物,其中,在通过吸入本发明的雾化组合物而施用0.2mg/kg~0.6mg/kg的雾化剂量后大于或等于4小时的时间,rpl554的血浆浓度大于或等于1ng/ml。在施用雾化剂量的组合物后大于或等于3、4或5小时的时间,rpl554的血浆浓度通常大于或等于1ng/ml。本发明还提供了在对象中治疗或预防如本文限定的疾病或病况的方法,该方法包括对所述对象施用有效量的本文限定的液体药物组合物。通常,该方法用于治疗疾病或病况。所述疾病或病况通常选自哮喘、过敏性哮喘、花粉症、过敏性鼻炎、支气管炎、肺气肿、支气管扩张、慢性阻塞性肺病(copd)、成人呼吸窘迫综合征(ards)、类固醇抵抗性哮喘、重度哮喘、儿童哮喘、囊性纤维化、肺纤维化、肺间质纤维化、间质性肺病、皮肤病、特应性皮炎、牛皮癣、眼部炎症、脑缺血和自身免疫疾病。优选地,该方法包括治疗哮喘或慢性阻塞性肺病(copd),更优选copd。对于单剂量,rpl554的有效量通常为约0.01mg/kg~50mg/kg。对于单剂量,rpl554的有效量通常为约0.01mg/kg~1mg/kg。例如,有效量可以是约0.1mg~约500mg,或约0.1mg~100mg,优选约0.1mg~约6mg的剂量。有效量可以为0.1mg~12mg。rpl554的单剂量可以为0.5mg~3mg,例如约1.5mg。剂量可以每天施用。例如,rpl554的剂量可以为0.01mg/kg/天~50mg/kg/天,通常为0.01mg/kg/天~10mg/kg/天或0.01mg/kg/天~1mg/kg/天。这些剂量通常是从吸入器发出的标称剂量。液体药物组合物可以每天施用一次、两次或三次,或者可以每周施用两次、三次、四次或五次。组合物可以根据患者的需要经常施用。有效量可以是约0.1mg~约500mg,或约0.1mg~100mg,优选约0.5mg~约6mg的剂量。有效量可以为0.1mg~12mg。rpl554的单剂量可以是0.5mg~24mg,其可以通过雾化器施用。rpl554的单剂量可以为0.5mg~6mg,例如约1.5mg。剂量可以每天施用一次、两次或三次。例如,rpl554的剂量可以为0.1mg/天~50mg/天,通常为1.5mg/天~18mg/天。这些剂量通常是从吸入器发出的标称剂量。液体药物组合物可以每天施用一次、两次或三次,或者可以每周施用两次、三次、四次或五次。组合物可以根据患者的需要经常施用。本发明的令人惊讶的发现是,rpl554的悬浮液制剂允许向患者施用高剂量的rpl554,而没有伴随的心血管负担的增加。因此,液体药物组合物适用于治疗患有心血管障碍或有患心血管障碍的风险的患者。例如,所述组合物可用于在患有心血管易损的患者中治疗如上定义的疾病或病况。患有心血管易损的患者通常是那些由于心动过速或高血压引起的不良事件的风险增加的患者。更通常地,患有心血管易损的患者是那些患有预先存在的心脏病或者会由于心动过速或高血压而加重病况的患者。这些患者包括那些患有冠状动脉疾病、心肌病、高血压、高血压性心脏病、心力衰竭、心律失常、心律不齐、心内膜炎、心肌炎、瓣膜性心脏病和中风的患者。还包括已经患有心脏病发作的患者。通过以下实施例更详细地描述本发明。实施例实施例1–rpl554悬浮液制剂的配方和稳定性根据下表1和2中陈述的配方生产本发明的液体药物组合物。表1–变体1a(0.4mg/ml)的配方成分功能浓度(mg/ml)rpl554(微粉化)活性化合物0.4polysorbate20(吐温20)表面活性剂0.50脱水山梨糖醇单月桂酸酯(司盘20)表面活性剂0.05磷酸二氢钠一水合物缓冲剂6.58无水磷酸氢二钠缓冲剂6.80氯化钠张力调节剂4.80水稀释剂q.s.表2–变体1b(20.0mg/ml)的配方成分功能浓度(mg/ml)rpl554(微粉化)活性化合物20.0polysorbate20(吐温20)表面活性剂0.50脱水山梨糖醇单月桂酸酯(司盘20)表面活性剂0.05磷酸二氢钠一水合物缓冲剂6.58无水磷酸氢二钠缓冲剂6.80氯化钠张力调节剂4.80水稀释剂q.s.一式两份进行含量测定测试。关键方法参数如下:·流动相:乙腈:水:tfa(45:55:0.1);·柱:watersx-bridgephenyl,3.5μm,150mm×4.6mm;·流速:1.5ml/min;·进样体积:10μl;·检测:uv@254nm;·运行时间:6分钟;和·样品和标准浓度:0.1mg/ml。将变体1a在(i)温度为25℃且相对湿度(rh)为60%或(ii)温度为40℃且rh为75%的条件下储存。在初始、1个月、2个月和6个月(6个月仅针对25℃和rh为60%的条件)时测量外观、ph、含量测定、杂质和粒径分布(psd)。以所示杂质的相对保留时间(rrt)通过hplc测量杂质的量。结果在下表3和4中示出。表3–变体1a在25℃/60%rh条件下的稳定性表4–变体1a在40℃/75%rh条件下的稳定性将变体1b在(i)温度为25℃且相对湿度(rh)为60%或(ii)温度为40℃且rh为75%的条件下储存。在初始、1个月和2个月时测量外观、ph、杂质和粒径分布(psd)。以所示杂质的相对保留时间(rrt)通过hplc测量杂质的量。结果在下表5和6中示出。表5–变体1b在25℃/60%rh条件下的稳定性表6–变体1b在40℃/75%rh条件下的稳定性从表3至6可以看出,本发明的液体药物组合物显示出优异的长期稳定性,并且在ph或杂质存在量方面没有显著变化。甚至在40℃下2个月后也观察到这种稳定性。比较例1–rpl554溶液制剂的配方和稳定性对rpl554的溶液制剂进行类似的稳定性试验。将ph约3.2的rpl554在柠檬酸盐/磷酸盐缓冲剂水溶液中的1.0mg/ml溶液在温度为25℃且相对湿度(rh)为60%的条件下保持6个月。在初始和6个月时测量外观、ph、含量测定和存在的杂质。结果在下表7中示出。表7–rpl554溶液在25℃/60%rh条件下的稳定性虽然溶液的外观没有变化,但rrt值为0.87的杂质的量显著增加。该杂质已被鉴定为rpl554的水解产物。rpl554的溶液不如本发明的悬浮液制剂稳定。实施例2–粒径分布使用激光衍射评价适用于雾化制剂的微粉化rpl554样品的粒径分布。粒径分布分析利用与湿分散池结合的malvernspraytec通过激光衍射进行。结果如下:dv10=0.69μm;dv50=1.35μm;dv90=2.5μm。实施例3–制剂如下制备rpl554悬浮液和溶液制剂。在实施例4~6中使用这些制剂。制剂成分(悬浮20mg/mlrpl554悬浮液液)载体=如上,省略rpl554rpl554缓冲剂溶液rpl554润湿溶液制备方法(悬浮rpl554缓冲剂溶液:将所需量的载体赋形剂称量到合适的容器中,液)并用注射用水补足至所需体积。将赋形剂磁力搅拌10分钟,直到缓冲剂盐完全溶解。测量ph,记录,必要时使用hcl/naoh调节至ph7.0±0.3,并通过0.22μm过滤器过滤。rpl554润湿溶液:将所需量的polysorbate20称量到合适的容器中,并加入所需量的脱水山梨糖醇单月桂酸酯。将润湿溶液磁力搅拌10分钟,然后转移至具有缓冲剂溶液的较大容器中,并用缓冲剂溶液调节至最终体积。将溶液磁力搅拌10分钟,并通过0.22μm过滤器过滤。载体:将所需体积的rpl554润湿溶液称量到合适的容器中,并用rpl554缓冲剂溶液补足至最终体积,用磁力搅拌器混合10分钟。测量ph,记录,并且必要时使用hcl/naoh调节至ph7.0±0.3。20mg/mlrpl554悬浮液:将所需量的rpl554称量到小烧杯中,并加入所需量的润湿溶液。用配备有5/8”高剪切筛的silverson混合器在8000rpm下将悬浮液混合约1分钟。将混合物转移至用缓冲剂溶液漂洗的新的干净、干燥的烧杯中。用缓冲剂溶液补足所需重量,并用配备有1”高剪切筛的silverson混合器在8000rpm下混合约1分钟。测量ph,记录,并且必要时使用hcl/naoh调节至ph7.0±0.3。将溶液转移到最终容器中。对于较低浓度的rpl554悬浮液,称量所需量的20mg/ml制剂,并使用具有0.22μm过滤器的注射器用载体稀释至所需体积。将制剂在磁力搅拌器上轻轻混合5分钟。制剂成分(溶液)1mg/ml(ph3.5)rpl554溶液1.5mg/ml(ph2.5)rpl554溶液载体:如上,省略rpl554制备方法(溶液)rpl5540.1m柠檬酸溶液:将所需量的柠檬酸称量到合适的容器中,用0.9%盐水补足至所需体积,并磁力搅拌直至完全溶解。rpl5540.2m磷酸氢二钠溶液:将所需量的无水磷酸氢二钠称量到合适的容器中,用0.9%盐水补足至所需体积,并磁力搅拌直至完全溶解。载体:将所需体积的柠檬酸溶液、磷酸氢二钠溶液和0.9%盐水称量到合适的容器中并充分混合。测量ph,必要时通过根据需要滴加另外的柠檬酸或磷酸钠溶液来进行调节((ph3.5(±0.3)或ph2.5(±0.2))。rpl554溶液:将所需量的试验材料称量到合适的容器中,利用载体补足到最终体积,并磁力搅拌直至完全溶解。测量ph,必要时进行调节。实施例4–大鼠的毒代动力学特征小结连续7天以2.4mg/kg/天、8.4mg/kg/天或21.6mg/kg/天的目标剂量通过仅鼻部吸入每天一次对hanwistar大鼠(5只/性别/组)给予本发明的rpl554悬浮液(组2、3和4)。另外5只大鼠/性别/组接受载体悬浮液并充当对照(组1)。剂量施用的持续时间为每天240分钟。在处理期结束时将所有存活的动物安乐死并尸检。对卫星动物(satelliteanimal)(3只/性别/组)类似地给药并在第7天放血以供毒代动力学分析。以2.4mg/kg/天的目标剂量通过仅鼻部吸入每天一次对另一组卫星动物(3只/性别)给予rpl554溶液以便与rpl554悬浮液进行比较,并且在第7天放血以供毒代动力学分析(组5)。平均气雾剂浓度和达到的剂量呈现在下表8中。表8–平均气雾剂浓度和达到的剂量毒代动力学结果以不同的剂量测量rpl554悬浮液的毒代动力学特征(组2、3和4)。将其与已知rpl554溶液的毒代动力学特征(组5)进行比较。对组2和组5施用的剂量相似。组1为对照组。在使大鼠每日吸入接触rpl554组合物一周的第7天评价悬浮液(本发明)或溶液(比较)中rpl554的毒代动力学参数。结果在下表10和11中示出。测量的参数为大鼠血浆中rpl554的最大浓度(cmax)、达到cmax所需的时间(tmax)和8小时之后剂量曲线下方的面积(auc8h)。表10–雄性大鼠的毒代动力学结果表11–雌性大鼠的毒代动力学结果这些结果表面,与溶液组合物(组5)相比,利用本发明的液体药物组合物可以达到基本上更高的cmax值(例如组3和4)。由rpl554溶液可行的溶解度限制剂量防止了用溶液组合物实现这样的cmax值。悬浮液组合物也显示具有缓释性,并观察到组2至4具有较大的tmax值。实施例5–狗的毒代动力学特征对比格犬评价本发明的rpl554悬浮液的毒代动力学特征。研究设计如下表12中所列。表12–研究设计、剂量和标称浓度*假定接触持续时间为120分钟并且体重为12kg时计算的气雾剂浓度动物在可变剂量阶段(阶段1)中以各剂量通过吸入施用3天而接受试验物质rpl554,在剂量之间具有至少2天的清除期。在恒定剂量阶段(阶段2)中,动物连续7天接受试验物质。在交叉阶段(阶段3),动物以一次接触悬浮液制剂,然后停药2天,之后一次接触比较溶液制剂,而接受试验物质。毒代动力学结果在用rpl554悬浮液(组2)以9.82mg/kg/天施用7天后,雄性和雌性的cmax值分别为116ng/ml和95.9ng/ml,并且雄性和雌性的auc6h值分别为389ng.h/ml和289ng.h/ml。在一次接触0.395mg/kg的rpl554悬浮液之后,雄性和雌性的cmax值分别为13.4ng/ml和12.7ng/ml,并且雄性和雌性的auc6h值分别为33.9ng.h/ml和31.5ng.h/ml。在一次接触0.543mg/kg的rpl554溶液之后,雄性和雌性的cmax值分别为40.9ng/ml和34.2ng/ml,并且雄性和雌性的auc6h值分别为74.6ng.h/ml和62.8ng.h/ml。在此观察到使用本发明的rpl554悬浮液能够获得高cmax和auc值(例如,116ng/ml和95.9ng/ml)。毒代动力学结果还证实,与溶液制剂相比,悬浮液制剂提供缓释。这可从来自阶段3试验(分开的单剂量的悬浮液制剂)的数据看出。这些数据呈现在下表13中,其中将溶液制剂(目标剂量0.5mg/kg/天,实际0.543mg/kg/天)与悬浮液制剂(目标剂量0.5mg/kg/天,实际0.395mg/mg/天)进行比较。表13显示用单剂量的悬浮液或单剂量的溶液处理后随时间的血浆浓度(ng/ml)。这两种处理间隔两天进行。提供所有三只狗的数据:一只雄性狗(61)和两只雌性狗(62和64)。blq是指小于1.00ng/ml的血浆浓度。表13–在用rpl554悬浮液和rpl554溶液施用后3只狗的rpl554血浆浓度值(ng/ml)表13中的数据表明,rpl554的悬浮液制剂导致比rpl554的溶液制剂更延迟的释放特征。例如,在所有狗吸入溶液制剂后4小时,rpl554的血浆浓度低于可检测的极限,而在吸入悬浮液后,所有狗的血浆中在4小时后存在至少1.4ng/ml的rpl554。实施例6–豚鼠的肺功能引言当作为干粉施用时或当作为酸化(ph2.5)盐水中的溶液制备时,rpl554引起针对静脉内施用的促痉挛剂的支气管保护。这种对乙酰甲胆碱的功能性拮抗作用(1.5倍稀释,即2.8倍)也已在人类哮喘对象中得到验证(franciosi等,2013)。本实施例评价了当作为用于雾化的新型悬浮液制剂提供时由rpl554提供的支气管保护。方法药物接触将雄性dunkinhartley豚鼠(300g~400g)置于定制的气雾剂室中并接触载体(0.9%盐水ph2.5)、rpl554(2.5mg/ml溶液)或rpl554(1mg/ml溶液)15分钟的时间。使用超声雾化器(ultraneb99)生成气雾剂,并利用1l/min的流速将雾化的溶液引导至含有4个臂的气雾剂室,这些臂使动物被约束为其上呼吸道(即鼻子)伸出到气雾剂室中。在此15分钟接触期后,使动物恢复,然后在药物接触后2h和5h之前,用氨基甲酸乙酯(1.5g/kg)麻醉动物并进行中线切口以暴露气管。进行气管造口术,并将气管套管固定在适当位置并连接到呼吸速率计上,其再连接到validyne压力传感器(+2cmh2o)以检测流量。使用肺功能记录系统(lfr,version9,mumeduk)测量气流的每次呼吸的变化,并在pc上实时显示。将流量信号积分以提供潮气量的测量。将套管插入第三和第五肋间空间之间的胸腔中,并连接到validyne压力传感器(+20cmh2o)的反面。压力传感器的正面连接到邻近动物的呼吸速率计一侧,以便获得经肺压力(tpp:口和胸压之差)的测量。通过积分方法,由流量、潮气量和tpp的各测量值得到肺功能参数、总气道阻力(rl;cmh2o.s/l)和动态肺顺应性(ml/cmh2o)。将颈动脉分别插管测量血压。建立累积浓度-效应曲线,并且乙酰胆碱的激发浓度(pc)累积产生rl的50%增加(pc50)。乙酰胆碱接触在施用rpl554溶液(1mg/ml和2.5mg/ml)或载体(酸化盐水ph3.5或ph2.5)后2h和5h监测针对乙酰胆碱(0.25mg/ml~16mg/ml,4秒接触)的支气管收缩。使用雾化器(aerogeninc)生成乙酰胆碱的气雾剂。将流入物引导经过呼吸速率计以供测量呼吸肺力学,或通过雾化器分流以将药物直接递送到肺中(在4秒接触期间内未测量呼吸力学)。在单独的一系列实验中,在吸入rpl554(2.5mg/ml和10mg/ml)的新型悬浮液制剂和载体后的2h和5h进行肺功能。结果基线参数在先前接触载体对照(盐水ph2.5)和rpl554的溶液制剂(1mg/ml或2.5mg/ml,图1)以及rpl554的新型悬浮液(2.5mg/ml和10mg/ml,图2)的动物中测量基线总肺阻力(rl)、动态肺顺应性(cdyn)、平均动脉血压(bp)和雾化器输出。在乙酰胆碱接触前制定基线呼吸和心血管参数,并且在麻醉的豚鼠中在盐水或rpl554接触后2h和5h进行监测。肺功能参数一般而言,rl表示在肺部的中央气道内的气道平滑肌上的毒蕈碱受体活化后此区域中气道直径的变化。选择乙酰胆碱,因为其作用持续时间短。1.rpl554溶液制剂如通过在盐水和rpl554(1mg/ml、2.5mg/ml溶液)接触后2h和5h测量的rl的变化所测定的,通过吸入途径对麻醉的豚鼠施用的乙酰胆碱引起剂量依赖性支气管收缩反应。1.1-乙酰胆碱rlpc50的分析算术平均值的事后分析证实了以下时间点的显著支持管保护:rpl5541mg/ml溶液的2h点(平均差=3.5(0.11–8.83)mg/ml,p=0.0445)以及2.5mg/ml的2h(4.7(0.4–9)mg/ml,p=0.0357)和5h时间点(3.4(0.9–6)mg/ml,p=0.0133)。对于1mg/mlrpl554溶液在5h处支气管保护程度较不明显(2.5(-0.17-5.2)mg/ml,p=0.0628)。观察到2h(1mg/mlrpl554,p=0.0190未调整)和5h(2.5mg/ml,p=0.0095未调整)rpl554溶液与盐水组之间的显著差异(图1)。2.rpl554的新型悬浮液制剂如通过在盐水和rpl554悬浮液(2.5mg/ml和10mg/ml)接触后2h和5h测量的rl的变化所确定的,通过吸入途径对麻醉的豚鼠施用的乙酰胆碱引起剂量依赖性支气管收缩。在盐水和rpl554悬浮液(2.5mg/ml和10mg/ml)接触后2h和5h在乙酰胆碱的浓度增加后,也同时记录到基线肺顺应性(cdyn)的剂量依赖性降低。2.1-乙酰胆碱rlpc50的分析乙酰胆碱rlpc50的log2转化数据的方差分析揭示了2h的总体药物效果(p=0.0238)。对于2h时间组,这由10mg/mlrpl554悬浮液和载体组之间的显著差异所反映(平均倍数差=2.67(1.12–6.36),p<0.05)。尽管rpl554(10mg/ml悬浮液)与载体之间在5h时间点处有更大平均差,14倍位移(0.5-400),但宽置信区间是未达到统计差异的原因(图2,上图)。组合并重新分析2h和5h时间点的载体数据(图2,下图)。具有总体显著的处理效果(p=0.0016),这由利用2.5mg/mlrpl554悬浮液(2.52倍(1-5.72),p<0.05)和10mg/mlrpl554(4.67倍(2-11),p<0.05)的支气管保护的显著程度所反映。在5h时间点,rpl55410mg/ml悬浮液引起显著程度的支气管保护(2.77倍(1.3-6.0)(图2,下图)。小结当在药物接触后2h和5h测量时,rpl554抑制由雾化施用的乙酰胆碱诱导的支气管收缩。rpl554溶液制剂(1mg/ml,2.5mg/ml)和新rpl554悬浮液制剂(2.5mg/ml,10mg/ml)都产生统计学显著的支气管保护。实施例7–人类的药代动力学研究进行阶段i、随机、双盲、安慰剂对照的研究,以便评价通过雾化器对年龄18~50岁的健康男性对象施用单吸入剂量的rpl554悬浮液制剂的安全性、耐受性和药代动力学。悬浮液制剂的标称剂量为约1.5mg,基本上相当于先前在使用溶液制剂的临床研究中显示出良好耐受的0.018mg/kg剂量。所用悬浮液制剂是雾化用无菌悬浮液,其含有在ph为7的5ml磷酸盐缓冲盐水溶液中的1.5mg微粉化rpl554药物以及表面活性剂(吐温20和司盘20)(如上面实施例1中所述,但具有不同浓度的rpl554)。使用标准喷雾雾化器(parilcsprint)进行悬浮液的施用。在施用后以适当的时间间隔收集血液样品(每个时间点4ml)。通过静脉穿刺或经由前臂中的留置插管将样品收集到肝素锂管中,并立即急冷(冰浴)。在收集15分钟内将血液离心分离。在冷冻离心机(约4℃)中以1100g分离血浆15分钟,并将其转移到聚丙烯管中。然后测量活性物的浓度。平均结果呈现在表3中,其显示了对象在施用所述溶液或悬浮液制剂后的平均浓度曲线。溶液制剂的结果来自于先前的临床研究(thelancetrespiratorymedicinevolume1,no.9,p.714-727,2013年11月),其使用雾化用无菌溶液,该溶液含有溶解在ph为3.2的柠檬酸盐-磷酸盐缓冲盐水中的rpl554。经雾化器施用的量为使标称rpl554剂量为0.018mg/kg(对70kg的人为约1.26mg)。在研究期间测量的平均药代动力学参数呈现在下表14中。表14制剂cmax(pg/ml)aucinf(pg.h/ml)半衰期(h)溶液87018333悬浮液393379510表14中的值表明,与比较溶液制剂相比,本发明的悬浮液制剂具有显著改善的药代动力学特征。特别地,曲线下方的面积(auc)和半衰期都显著增加。这表明悬浮液制剂提供了可以通过吸入施用rpl554的预料不到的改进方式。实施例8–十二个月的稳定性研究用下表15中列出的组成制备三批本发明的悬浮液制剂。表15成分浓度(mg/ml)rpl554(热处理的api)0.5、2.5和10polysorbate20(吐温20)0.5脱水山梨糖醇单月桂酸酯(司盘20)0.05磷酸二氢钠一水合物6.58无水磷酸氢二钠6.80氯化钠4.80注射用水补足重量分析测试在将制剂于25℃和60%rh下储存1、3、6和12个月后进行分析测试。12个月的结果记载如下。外观在单个样品上目视进行外观测试。发现安慰剂样品是澄清无色的溶液。0.5mg/ml浓度样品是不含可见团聚体的浅黄色悬浮液,而2.5mg/ml和10mg/ml浓度样品显示为不含可见团聚体的黄色悬浮液。ph对单个样品进行ph测定。结果在表16中示出。表16批号浓度phbn011/140.5mg/ml6.656bn010/142.5mg/ml6.652bn009/1410mg/ml6.655bn008/14安慰剂6.661发现所有三种活性制剂和安慰剂在12个月的时间点具有6.7的ph。从初始时间点起没有观察到变化。含量测定一式两份进行含量测定测试。关键方法参数汇总如下:含量测定结果在表17中示出。在12个月时间点的各浓度的活性悬浮液的含量测定结果从初始时间点起没有显示任何变化。相关物质一式两份进行相关物质的测定。关键方法参数汇总如下。悬浮液的相关物质测定的结果呈现在表18中。表18-rpl554悬浮液的相关物质分析的结果(以%lc计)批次bn011/14-(0.5mg/ml)-25℃/60%rh批次bn010/14-(2.5mg/ml)-25℃/60%rh批次bn009/14-(10mg/ml)-25℃/60%rh在12个月时间点各浓度的活性悬浮液的相关物质结果与初始时间点相似。粒径分布(psd)使用具有详述以下的设置的spraytec执行粒径分布法。光学性质:颗粒:ri(实部):1.50(标准不透明颗粒);ri(虚部):0.50;密度:1.00;分散剂(水);分散剂ri:1.33用于样品分析的分散剂:1%polysorbate20的去离子水溶液控制器单元设置:搅拌器速度1000rpm测量时间:取样时间:30s;背景时间:10s结果在表19中示出。表19-通过rpl554悬浮液的激光衍射的粒径测定结果(以μm计)批号浓度dv10dv50dv90bn011/140.5mg/ml0.79461.5773.168bn010/142.5mg/ml0.78721.5893.119bn009/1410mg/ml0.80121.5662.976在12个月时间点的所有3个浓度的粒径分布曲线是相似的,并且与初始时间点相比没有显示任何变化。显微评价通过使用g3显微镜目视评价制剂进行显微评价。在所测试的任何批次中没有观察到聚集体,不过对于2.5mg/ml和10mg/ml悬浮液偶尔见到一些大的松散团聚体。评价确定与初始时间点相比没有变化。递送速率和总递送剂量递送速率和总递送剂量每批在3个小瓶上进行。用化器/pari压缩机组合分配和递送悬浮液。递送速率和总递送剂量的结果呈现在表20中。表20-利用parilcplus雾化器的递送速率和总递送剂量测定的结果批次bn011/140.5mg/ml批次bn010/142.5mg/ml批次bn009/1410mg/ml*含量测定是总递送的量%效率是递送的总实际剂量/递送的理论剂量(用来自含量测定的递送质量和制剂浓度计算)所有浓度的总递送剂量和递送速率与初始时间点相似。所有悬浮液的递送效率与之前的时间点一致。空气动力学粒径分布(apsd)使用nextgenerationimpactor(ngi),每个批次每种条件于3个小瓶上进行空气动力学粒径分布(apsd)测定。用parilc雾化器/pariturboboy压缩机组合分配和递送悬浮液。apsd测定的结果呈现在表21中。将该结果输入citdas程序(版本3.10)中,用5μm的截止值计算细颗粒剂量,并且由该计算获得的结果也呈现在表21中。表21-使用parilcplus雾化器通过ngi(以mgrpl554计)的空气动力学粒径分布结果批次bn011/14-(0.5mg/ml)25℃/60%rh批次bn010/14-(2.5mg/ml)25℃/60%rh批次bn009/14-(10mg/ml)25℃/60%rh*用citdas对未舍入数据计算。缩写:fpd:细颗粒剂量;fpf:细颗粒分数;gsd:几何尺寸分布;mmad:质量平均空气动力学直径;moc:微孔收集器。12个月的稳定性下面的表22(0.5mg/ml)、23(2.5mg/ml)和24(10mg/ml)将上述12个月的数据与本发明的rpl554悬浮液制剂的1、3和6个月时间点的相应数据组合。(注:在表22、23和24中用*标记的杂质峰被观察为双峰,但在初始时间点被观察为单峰。这可能是由于使用了提供更好的分离的新柱,并且不被认为是降解的迹象)。小结制造雾化用rpl554悬浮液0.5mg/ml(bn011/14)、2.5mg/ml(bn010/14)和10mg/ml(bn009/14)以及相关的安慰剂(bn008/14),并且在25℃/60%rh下放置,并在12个月时间点测试稳定性。结果表明,在12个月时间点试验的任何批次中都基本上没有变化,并且确认雾化用rpl554悬浮液在25℃/60%rh下稳定12个月。实施例9–在加速条件(40℃/75%rh)下的6个月分析在40℃/75%rh下的加速稳定性研究也持续到第6个月。这些结果在表25(0.5mg/ml)、表26(2.5mg/ml)和表27(10mg/ml)中示出。(如实施例8中标注的,用*标记的杂质峰被观察为双峰,但在初始时间点被观察为单峰。这可能是由于使用了提供更好的分离的新柱,不被认为是降解的迹象)。结果表明,在6个月时间点试验的任何批次中都基本上没有变化,并且确认雾化用rpl554悬浮液具有优异的稳定性,在40℃/75%rh下稳定6个月。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1