一种装载抗肿瘤药物的纳米药物载体、其制备方法及应用与流程
本发明属于纳米技术、免疫学和生物医药技术领域。具体的,本发明涉及一种装载抗肿瘤药物的纳米药物载体、其制备方法及应用。
背景技术:
癌症己经成为日益常见且严重威胁人类生命和生活质量的主要疾病之一。由于老龄化人群持续增加,预计癌症的发病率会继续增长。目前治疗癌症的方法主要是手术、放疗和化疗三种。癌症的治疗方式的选择,取决于癌症的类型、位置和散布情况。化疗是利用化学药物杀死肿瘤细胞、抑制肿瘤生长的一种治疗方式,它是一种全身性治疗手段,对原发灶、转移灶和亚临床转移灶均有治疗作用。对于不能进行手术和放疗的癌症,只能借助于化疗。目前,使用药物载体装载化疗药物靶向肿瘤组织治疗已成为化疗的一种重要手段。但体内摄入过多的药物载体又会带来新的副作用,因此提高药物载体的化疗药物装载量是目前癌症的治疗领域所需解决的一个难题。铁蛋白作为药物载体具有天然优势:1.铁蛋白的外径为12m,粒径均一,有很强的在肿瘤部位的渗透和滞留的效果(dreher,m.r.等,jnatlcancer1,2006);2.生物相容性良好;3.易于基因和化学修饰;4.包载药物制备简单。目前的研究认为,单个铁蛋白分子对一线化疗药物阿霉素的装载量在20-40个分子左右1-6,经过pas多肽修饰后的铁蛋白分子能装载90个左右阿霉素分子(elisabettafalvo.等,biomac,2015)。但如何进一步提高铁蛋白药物载体的阿霉素装载能力是目前所需解决的一个难题。。
技术实现要素:
本发明首先涉及一种装载抗肿瘤药物的纳米药物载体,所述的纳米药物载体为激烈火球菌铁蛋白及其衍生物(包括基于其改造的融合蛋白,和基于其蛋白壳内腔氨基酸序列改造的铁蛋白)的生理多聚体,优选的,所述的多聚体为激烈火球菌铁蛋白及其衍生物的24聚体,所述的抗肿瘤药物包括但不限于,小分子药物、寡核苷酸、功能性肽段,优选的,所述的抗肿瘤药物为蒽环类抗肿瘤药物或铂类抗肿瘤药物。
所述的纳米药物载体的药物装载量为50~500个药物分子/每个蛋白多聚体。
所述的激烈火球菌铁蛋白的氨基酸序列如seqidno.1所示:
seqidno.1:
mlsermlkalndqlnrelysaylyfamaayfedlglegfanwmkaqaeeeighalrfynyiydrngrveldeipkppkewesplkafeaayehekfisksiyelaalaeeekdystraflewfineqveeeasvkkildklkfakdspqilfmldkelsarapklpgllmqgge
所述的激烈火球菌铁蛋白衍生物为将靶向肿瘤组织的多肽与所述的激烈火球菌铁蛋白偶联而成的融合蛋白,优选的,通过连接序列将靶向肿瘤组织的多肽与所述的激烈火球菌铁蛋白偶联,更优选的,所述的靶向肿瘤组织的多肽为氨基酸序列如seqidno.2所示的靶向肝癌细胞的多肽:seqidno.2:sfsiihtpilpl;优选的,所述的连接序列为seqidno.3所示的连接序列多肽:seqidno.3:gggsggggsgggs;
优选的,所述的激烈火球菌铁蛋白衍生物为如seqidno.4所示的多肽,
seqidno.4:
msfsiihtpilplgggsggggsgggsmlsermlkalndqlnrelysaylyfamaayfedlglegfanwmkaqaeeeighalrfynyiydrngrveldeipkppkewesplkafeaayehekfisksiyelaalaeeekdystraflewfineqveeeasvkkildklkfakdspqilfmldkelsarapklpgllmqgge
本发明还涉及所述的纳米药物载体的制备方法,具体的,所述的方法包括如下步骤:
步骤(1)、制备并纯化所述激烈火球菌铁蛋白或其衍生物
步骤(2)、使用激烈火球菌铁蛋白装载阿霉素或铂类药物(顺铂、奥沙利铂、奈达铂)
将激烈火球菌铁蛋白加入到高浓度脲溶液中至终浓度为1mg/ml,室温混合反应1小时,使激烈火球菌铁蛋白壳解聚,优选的,所述的脲溶液的脲浓度大于4m;最优选的,所述的脲溶液的脲浓度大于或等于8m;
加入阿霉素或铂类药物至终浓度为1mg/ml,室温避光混合孵育2小时后,将反应液转入截留分子量为3kda的透析袋中,对反应液进行梯度脲透析复性;
在磷酸盐缓冲液(pbs)中透析,得到的纳米药物载体颗粒溶液经过superdex200pg分子筛纯化,得到单分散状态的纳米药物载体溶液;
步骤(3)、纳米载体载药量计算与定量。
所述的纳米载体载药量计算与定量的方法为:
利用bca蛋白定量试剂盒对载药纳米载体颗粒的蛋白含量进行定量,根据药物自身的性质对药物含量进行定量;
优选的,对装载阿霉素的载药颗粒中的阿霉素的定量方法为:测定载药纳米载体颗粒在485nm波长处的吸收值,根据阿霉素在485nm波长处的消光系数(ε=1.00×104m-1cm-1),计算出载药纳米载体颗粒中阿霉素的浓度,从而推算出载药纳米载体颗粒的阿霉素药物装载量;
优选的,对装载铂类药物的载药颗粒中的铂类物质的定量方法为:通过icp-ms来检测载药纳米载体颗粒中铂(pt)元素的含量,从而推算出载药纳米载体颗粒的铂类药物装载量。
步骤(1)所述的制备并纯化所述激烈火球菌铁蛋白或其衍生物的方法为,根据激烈火球菌铁蛋白或其衍生物的氨基酸序列设计出其cdna序列,构建在表达载体pet22b上,并转化入表达菌株bl21(de3)中,利用iptg诱导激烈火球菌铁蛋白表达后,再将激烈火球菌铁蛋白纯化出来。
所述纯化步骤如下:将菌体用20mmtris(ph8.0)缓冲液重悬后,超声裂解,离心去除大肠杆菌残片,上清液72℃加热15分钟,沉淀杂蛋白,离心去除,上清液在排阻色谱superdex200pg柱子上分离纯化,电泳鉴定纯度,bca测定蛋白浓度。
步骤(2)所述的透析条件为4度、避光透析,所述的梯度脲透析的浓度梯度为脲浓度7m、6m、5m、4m、3m、2m、1m、0,每个梯度透析12小时。
本发明还涉及所述的装载了抗肿瘤药物的纳米药物载体在制备抗肿瘤药物中的应用。
附图说明
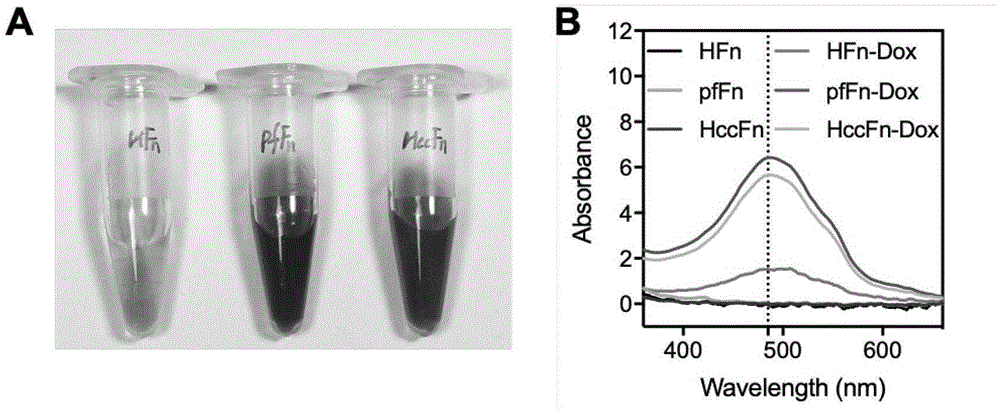
图1为人重链铁蛋白(humanhfn)、激烈火球菌铁蛋白(pffn)和激烈火球菌铁蛋白衍生物(hccfn)装载化疗药物阿霉素的表征。图1a为相同蛋白浓度条件下,hfn-dox,pffn-dox,hccfn-dox的照片,均呈现出阿霉素的红色;图1b为hfn,hfn-dox,pffn,pffn-dox,hccfn,hccfn-dox在pbs缓冲液中的紫外吸收光谱,阿霉素在pbs缓冲液中的最大吸收波长为485nm,其中pffn,pffn-dox,hccfn和hccfn-dox的蛋白浓度为0.75mg/ml,hfn和hfn-dox的蛋白浓度为2.25mg/ml。
图2为激烈火球菌铁蛋白衍生物(hccfn)纳米药物载体的制备及表征。图2a为肿瘤靶向性纳米药物载体(sp94-pffn)装载药物阿霉素(doxorubicin,dox)的过程示意图;图2b为装载药物阿霉素后,药物载体pffn和hccfn的分子筛表征图;图2c为装载药物阿霉素前后,药物载体pffn和hccfn的透射电镜表征图;图2d为装载药物阿霉素前后,药物载体pffn和hccfn的动态光散射表征粒径分布图;图2e为pffn,hccfn和hccfn-dox的非变性凝胶电泳表征图;图2f为在生理盐水及正常小鼠血清条件下,装载药物后的纳米载体(hccfn-dox)的稳定性;图2g为hccfn-dox在酸性条件下(ph5.0)和中性条件下(ph7.4)的药物释放。
图3为hccfn-dox在体外体内对肝细胞肝癌的靶向性表征。图3a为fitc标记的fn(pffn)-dox和hccfn-dox与肝癌细胞系hepg2的结合分析;图3b为sp94与hccfn对hepg2的流式亲和力分析;图3c为hccfn-dox被肝癌细胞内吞进入溶酶体后,在溶酶体酸性环境中释放阿霉素进入细胞核的过程;图3d为cy5.5标记的fn(pffn)-dox和hccfn-dox尾静脉注射入小鼠体内后,对hepg2肿瘤部位cy5.5信号的检测分析;图3e为尾静脉注射不同剂量的cy5.5标记的hccfn-dox后,对hepg2肿瘤部位cy5.5信号的检测分析。
图4为hccfn-dox对肝细胞肝癌皮下肿瘤模型的治疗效果表征。图4a为hccfn-dox的单次给药最大耐受剂量分析;图4b,c,d,e为分别在第9天和第34天,以25mg/kgdox等量尾静脉注射hccfn-dox治疗hepg2肿瘤过程中,hepg2肿瘤的体积变化(图4b),小鼠的体重变化(图4c),小鼠的生存期曲线(图4d)和hepg2肿瘤的形态变化(图4e)。
图5为包裹顺铂的肝癌靶向性铁蛋白纳米药物载体hccfn-pt在酸性环境中的药物释放(图5a)和对肝癌细胞hepg2的细胞靶向杀伤表征(图5b)。
具体实施方式
实施例1、激烈火球菌铁蛋白纳米药物载体fn-dox的制备及表征
激烈火球菌铁蛋白pffn(fn)与其他种属来源的铁蛋白(人、鼠)结构高度相似,在天然状态下能够自组装成为24聚体球状蛋白壳结构,内径8nm,外径12nm。如上文所述,铁蛋白的结构特点使其作为药物载体的优势明显。目前的研究认为,单个铁蛋白分子对一线化疗药物阿霉素的装载量在20-40个分子左右1-6,经过pas多肽修饰后的铁蛋白分子能装载90个左右阿霉素分子(elisabettafalvo.等,biomac,2015)。我们的工作发现,利用相对温和的脲变性复性的方法来制备铁蛋白阿霉素纳米颗粒,激烈火球菌铁蛋白的阿霉素装载量在400个分子左右(图1a)。相同装载条件下,人重组重链铁蛋白(hfn)的阿霉素装载量在33个分子左右。激烈火球菌铁蛋白的阿霉素装载量是人源铁蛋白的10倍以上。而且通过基因工程手段在激烈火球菌铁蛋白外表面展示多肽(hccfn)后,激烈火球菌铁蛋白的阿霉素装载量维持在400个分子左右(图1a)。由于阿霉素在pbs环境中的最大吸收波长是485nm,通过对比检测hfn-dox,fn-dox和hccfn-dox在485nm处的光吸收值(图1b),可以明显看出激烈火球菌铁蛋白的阿霉素装载量远高于人重组重链铁蛋白。
激烈火球菌铁蛋白壳在高浓度脲(例如4~6m,最优的为大于6m)的条件下蛋白壳实现解聚,同时向溶液中加入阿霉素(dox)。然后用梯度脲透析的方法实现激烈火球菌铁蛋白对dox的装载。因为dox的pka值为8.2(yang,s.c.等,japplpolymsci,2000),因此,在将激烈火球菌铁蛋白壳解聚一聚合的过程中,依靠dox分子与激烈火球菌铁蛋白壳内部表面的静电吸附作用(harrison,p.m.&arosio,p.biochimbiophysacta,1996),即可将dox分子包裹在激烈火球菌铁蛋白壳内部。
使用激烈火球菌铁蛋白装载阿霉素的方法如下
1、激烈火球菌铁蛋白的表达
根据激烈火球菌铁蛋白的氨基酸序列(seqidno:1)设计出其cdna序列,构建在表达载体pet22b上,并转化入表达菌株bl21(de3)中,利用iptg诱导激烈火球菌铁蛋白表达后,将激烈火球菌铁蛋白纯化出来。纯化步骤如下:将菌体用20mmtris(ph8.0)缓冲液重悬后,超声裂解,离心去除大肠杆菌残片,上清液72℃加热15分钟,沉淀杂蛋白,离心去除,上清液在排阻色谱superdex200pg柱子上分离纯化,电泳鉴定纯度,bca测定蛋白浓度。
2、使用激烈火球菌铁蛋白装载阿霉素
(1)将激烈火球菌铁蛋白加入到8m脲溶液(用水配置)中至终浓度为1mg/ml,室温混合反应1小时,使激烈火球菌铁蛋白壳解聚。
(2)然后加入盐酸阿霉素至终浓度为1mg/ml,室温避光混合孵育2小时后,将反应液转入透析袋(截留分子量为3kda)中,在4度,避光条件下,对反应液进行梯度脲(7m-6m-5m-4m-3m-2m-1m-0m,每个梯度12小时)透析复性。最后透析在磷酸盐缓冲液(pbs)中。透析得到的fn-dox纳米颗粒经过superdex200pg分子筛纯化,得到单分散状态的fn-dox纳米颗粒。
(3)利用bca蛋白定量试剂盒对fn-dox纳米颗粒进行蛋白定量,并测定fn-dox纳米颗粒在485nm波长处的吸收值,根据阿霉素在485nm波长处的消光系数,计算出fn-dox纳米颗粒中阿霉素的浓度,从而推算出fn-dox纳米颗粒的阿霉素装载量。
使用同样的方法制备humanhfn(人重链铁蛋白,与激烈火球菌铁蛋白一样,由24个相同亚基自组装成球壳状纳米颗粒)载药颗粒。
检测各种载药颗粒的药物装载能力显示:每分子纳米药物载体颗粒fn-dox(激烈火球菌铁蛋白24聚体颗粒)装载阿霉素的量约为413个,每分子纳米药物载体颗粒hfn-dox(人重链铁蛋白载药颗粒)的阿霉素装载量约为34个。激烈火球菌铁蛋白的阿霉素装载能力是人重链铁蛋白的10倍以上。
实施例2、肝癌靶向性铁蛋白纳米药物载体hccfn-dox的制备及表征
通过基因融合的手段将sp94肝癌靶向肽(seqidno:2)通过接头蛋白(seqidno:3)融合表达在激烈火球菌铁蛋白(seqidno:1)的n端,我们将此融合蛋白命名为hccfn(seqidno:4)。
用如实施例1所述的梯度脲透析的方法,把阿霉素包载到hccfn内腔中(图2a)。superdex200pg分子筛检测a280nm和a485nm的紫外吸收,可以看到阿霉素成功装载到hccfn内腔(图2b)。透射电镜(图2c)和动态光散射(图2d)分析结果也说明激烈火球菌铁蛋白(fn),hccfn和hccfn-dox都保持了良好的均一性和球壳状结构。非变性凝胶电泳结果(图2e)也说明加入靶向肽的hccfn分子量大于激烈火球菌铁蛋白,且阿霉素成功装载到hccfn内腔,经计算,每分子纳米药物载体颗粒hccfn-dox装载阿霉素的量约为408个。
为了研究装载药物后的肝癌靶向性药物载体hccfn-dox的稳定性和药物释放。我们将hccfn-dox(600微升,阿霉素含量1mg/ml)放入透析管d-tube中,放入pbs或者5%bsa中,在不同时间点取样,通过测定485nm处吸收值的方法来测定hccfn-dox中剩余阿霉素的量(图2f)。测定药物释放时,我们将hccfn-dox(600微升,阿霉素含量1mg/ml)放入透析管d-tube中,放入ph值5.0的醋酸盐溶液中,测定透析液中阿霉素的量(图2g)。可以发现,在ph5.0环境中,阿霉素能够从hccfn蛋白壳中释放出来。这提示在溶酶体的ph环境中(ph值接近5.0),阿霉素能够从hccfn蛋白壳中释放出来,杀伤肿瘤细胞。
实施例3、肝癌靶向性铁蛋白纳米药物载体hccfn-dox的体内外肝癌靶向性表征
1、hccfn-dox的细胞靶向
首先我们用fitc来荧光标记fn和hccfn蛋白质空壳,fitc荧光标记方法如下:分别将1mgfn或hccfn蛋白质空壳溶解于0.1m碳酸盐缓冲溶液(ph9.0)中(蛋白终浓度1mg/ml),加入50微升fitc溶液(1mg/ml,dmso溶解),4度避光混合过夜。12,000g离心10min取上清,用超滤浓缩管置换pbs缓冲液,至滤出液无色。通过uv吸收值测定fitc浓度(nanodrop2000)。
分别将1μg/mlfitc-fn和fitc-hccfn与100μl肝癌细胞hepg2(2.5x106cells/ml)共孵育30分钟后,通过激光共聚焦扫描显微镜观察,hccfn特异的结合到了hepg2细胞表面(图3a)。通过流式细胞分析,我们发现hccfn对hepg2细胞的亲和力较sp94肽相比提升了700倍(图3b)。这表明hccfn在细胞水平对肝癌具有特异靶向性。
将0.1mg/mlhccfn-dox与100μl肝癌细胞hepg2(2.5x106cells/ml)共孵育1小时后,通过激光共聚焦扫描显微镜观察,hccfn-dox内吞进入了hepg2细胞的溶酶体中,共孵育24小时后,阿霉素被递送进入了肝癌细胞细胞核(图3c)。
2、hccfn-dox的肿瘤靶向
用近红外荧光染料cy5.5来标记fn-dox和hccfn-dox,标记方法与上述fitc标记方法相同。我们将cy5.5-fn-dox和cy5.5-hccfn-dox通过尾静脉注射进肝癌hepg2皮下荷瘤小鼠体内,4小时后,我们发现cy5.5-hccfn特异地在hepg2肿瘤部位聚集(图3d),且cy5.5-hccfn在肿瘤组织富集量显著高于cy5.5-fn。cy5.5-hccfn在hepg2肿瘤部位的聚集呈现出注射剂量依赖性(图3e,高剂量为1nmol阿霉素,低剂量为0.5nmol阿霉素),剂量越高,肿瘤组织富集越多,进一步说明了cy5.5-hccfn在体内的肝癌靶向性。
实施例4、肝癌靶向性铁蛋白纳米药物载体hccfn-dox高效杀伤肝癌同时表现出良好的安全性
为了验证是否hccfn-dox能够有效治疗肝癌,我们首先通过单次给药耐受实验来确定hccfn-dox的给药剂量。
如图4a所示,hccfn-dox的小鼠单次给药最大耐受剂量为30mg/kg(按阿霉素质量/小鼠体重计算)。在hccfn-dox给药量为25mg/kg时,小鼠在经历短暂的体重下降后,很快实现了体重恢复,同时在给药1周和3周后,检测小鼠的血液和生化指标,发现hccfn-dox给药量为25mg/kg时表现出很好的安全性,未引起明显的血液生化指标异常(表1)。
相比之下,未以载体装载的游离形式的阿霉素对小鼠单次给药的最大耐受剂量为5mg/kg,阿霉素包裹入hccfn药物载体后,大大提升了小鼠对阿霉素的耐受,能够允许更大剂量的阿霉素应用于肝癌治疗。
为了验证hccfn-dox对肝癌的治疗效果,我们以单次25mg/kg(pbs溶剂)的剂量尾静脉注射对小鼠给药,同时以单次5mg/kg剂量的游离盐酸阿霉素,25mg/kg剂量的脂质体阿霉素(doxil),pbs做对照。分别在第9天和第34天给药,hccfn-dox治疗组的小鼠肝癌hepg肿瘤生长受到了明显抑制(图4b),而游离阿霉素对照组的小鼠肿瘤体积在第36天左右迅速超过了1000立方毫米(视为治疗无效)。
最终hccfn-dox治疗组的小鼠6只中有4只实现了肿瘤的完全消退(图4e)。hccfn-dox治疗组的小鼠在给药后的体重下降低于10%,并且停止给药后,体重迅速恢复,表明了hccfn-dox良好的安全性(图4c)。同时hccfn-dox治疗组的全部小鼠生存期达到了90天以上。
相比之下,doxil组,dox组和pbs组的平均生存期均低于36天(图4d)。doxil在单次25mg/kg的剂量下表现出较强的毒性,表明了hccfn-dox在安全性上的优势。
以上数据表明了hccfn-dox的肝癌治疗效果极好,同时表现出低毒性,与临床批准的doxil相比,安全性也大大提高。这表明在hccfn-dox的阿霉素装载能力大大提升后,其相应的体内安全性也大大提升。
表1、按照不同药物剂量给予纳米药物载体颗粒后检测的小鼠血液和生化参数
(五角星号表示参数与pbs组参数有显著性差异)
实施例5、肝癌靶向性铁蛋白纳米药物载体hccfn-pt的制备和表征
我们通过实验证实肝癌靶向性铁蛋白纳米药物载体hccfn也能够用来装载铂类化疗药物(顺铂、奥沙利铂、奈达铂)。装载方法如实施例1所述的方法类似,具体步骤为:
(1)将hccfn蛋白壳加入到8m脲溶液中至终浓度为1mg/ml,室温混合反应1小时,使hccfn蛋白壳解聚;
(2)加入铂类药物至终浓度为1mg/ml,室温避光混合孵育2小时后,将反应液转入截留分子量为3kda的透析袋中,对反应液进行梯度脲透析复性;
(3)最后在磷酸盐缓冲液(pbs)中透析,得到的纳米药物载体颗粒溶液经过superdex200pg分子筛纯化,得到单分散状态的纳米药物载体hccfn-pt溶液。
铂类药物的装载量计算是通过icp-ms来检测载药纳米载体颗粒中铂(pt)元素的含量,利用bca蛋白定量试剂盒对载药纳米载体颗粒进行蛋白定量,从而推算出载药纳米载体颗粒的铂类药物装载量。
经过计算,每分子肝癌靶向性铁蛋白纳米药物载体(激烈火球菌铁蛋白24聚体)hccfn-pt对不同种类铂类药物的装载量为:顺铂:220个;奥沙利铂:60个;奈达铂:50个。
以装载顺铂的肝癌靶向性铁蛋白纳米药物载体hccfn-pt为例,在药物释放实验中,我们将hccfn-pt(600微升,pt含量1mg/ml)放入透析管d-tube中,放入ph值5.0的醋酸盐溶液中,icp-ms测定透析液中pt的量。可以发现,在ph5.0环境中,pt能够从hccfn蛋白壳中释放出来(图5a)。这提示在溶酶体的ph环境中(ph值接近5.0),pt能够从hccfn蛋白壳中释放出来,杀伤肿瘤细胞。
在针对肝癌细胞hepg2的细胞杀伤实验中,相同蛋白浓度(0.01mg/ml)的hccfn蛋白壳和hccfn-pt,以及与hccfn-pt相同pt浓度的顺铂共同孵育hepg2肝癌细胞,可以发现hccfn不杀伤hepg2肝癌细胞,而hccfn-pt能够同单独的顺铂pt一样高效杀伤hepg2肝癌细胞(图5b)。
最后需要说明的是,以上实施例仅用作帮助本领域技术人员理解本发明的实质,不用做对本发明保护范围的限定。
sequencelisting
<110>中国科学院生物物理研究所
<120>一种装载抗肿瘤药物的纳米药物载体、其制备方法及应用
<130>cp11902024c
<160>4
<170>patentinversion3.3
<210>1
<211>174
<212>prt
<213>激烈火球菌铁蛋白
<400>1
metleusergluargmetleulysalaleuasnaspglnleuasnarg
151015
gluleutyrseralatyrleutyrphealametalaalatyrpheglu
202530
aspleuglyleugluglyphealaasntrpmetlysalaglnalaglu
354045
glugluileglyhisalaleuargphetyrasntyriletyrasparg
505560
asnglyargvalgluleuaspgluileprolysproprolysglutrp
65707580
gluserproleulysalapheglualaalatyrgluhisglulysphe
859095
ileserlysseriletyrgluleualaalaleualaglugluglulys
100105110
asptyrserthrargalapheleuglutrppheileasngluglnval
115120125
glugluglualaservallyslysileleuasplysleulyspheala
130135140
lysaspserproglnileleuphemetleuasplysgluleuserala
145150155160
argalaprolysleuproglyleuleumetglnglyglyglu
165170
<210>2
<211>12
<212>prt
<213>靶向肝癌细胞的多肽
<400>2
serpheserileilehisthrproileleuproleu
1510
<210>3
<211>13
<212>prt
<213>靶向肝癌细胞的多肽
<400>3
glyglyglyserglyglyglyglyserglyglyglyser
1510
<210>4
<211>200
<212>prt
<213>激烈火球菌铁蛋白衍生物
<400>4
metserpheserileilehisthrproileleuproleuglyglygly
151015
serglyglyglyglyserglyglyglysermetleusergluargmet
202530
leulysalaleuasnaspglnleuasnarggluleutyrseralatyr
354045
leutyrphealametalaalatyrphegluaspleuglyleuglugly
505560
phealaasntrpmetlysalaglnalagluglugluileglyhisala
65707580
leuargphetyrasntyriletyraspargasnglyargvalgluleu
859095
aspgluileprolysproprolysglutrpgluserproleulysala
100105110
pheglualaalatyrgluhisglulyspheileserlysseriletyr
115120125
gluleualaalaleualaglugluglulysasptyrserthrargala
130135140
pheleuglutrppheileasngluglnvalglugluglualaserval
145150155160
lyslysileleuasplysleulysphealalysaspserproglnile
165170175
leuphemetleuasplysgluleuseralaargalaprolysleupro
180185190
glyleuleumetglnglyglyglu
195200
- 还没有人留言评论。精彩留言会获得点赞!