草药组合物及其治疗神经退行性疾病的用途的制作方法
本申请要求2018年3月16日提交的美国临时专利申请序列号为62/643,774及2018年12月14日提交的美国专利申请序列号为16/219,976的优先权,该专利申请通过引用整体并入本文。本发明涉及药物、健康补品和工业化学产品领域。具体是指本发明提供用于通过靶向淀粉样蛋白-β(aβ)和与tau蛋白相关的神经原纤维缠结(nft)来治疗神经退行性疾病的草药组合物。
背景技术:
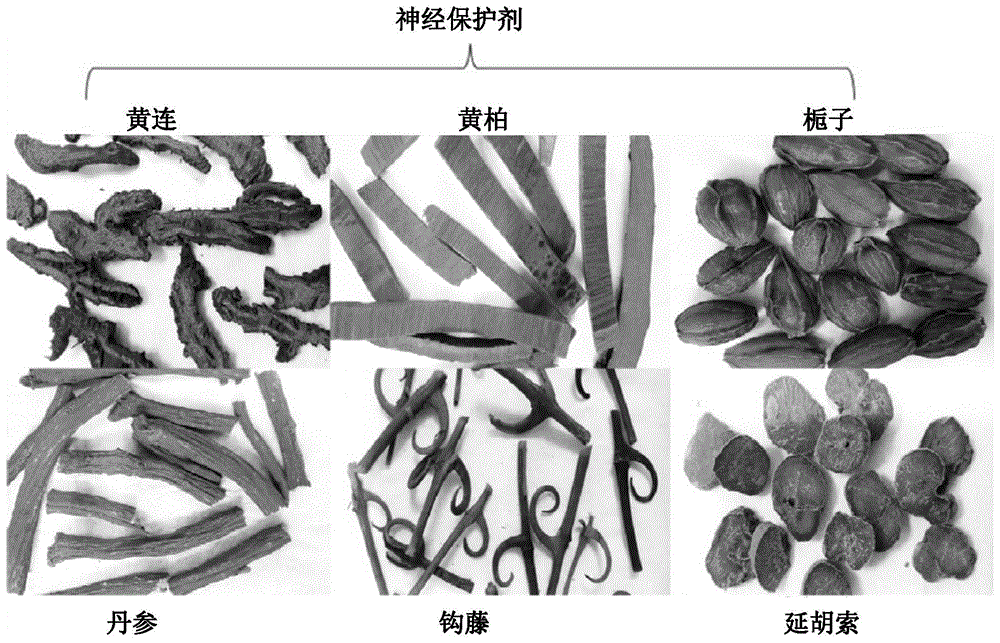
:阿尔茨海默病(ad)是一种常见的神经退行性病变,主要影响老年人群,目前尚没有特效药。ad是世界上最常见的神经退行性脑病,影响全世界4-8%的老年人。流行病学研究表明,到2050年,全球阿尔茨海默病(ad)人口将增加到1.14亿。仅在香港,轻度痴呆的患病率就达到总人口的17.5%。目前,市场上的ad药物尚不成熟,现有药物只能缓解某些症状,但无法治愈疾病。因此,目前需要有效且安全的药物来治愈ad。ad的关键标志性特征是:胆碱能神经元丧失;淀粉样蛋白前体蛋白(app)衍生的淀粉样蛋白β-肽(aβ)累积形成老年斑(sp);形成与tau蛋白相关的神经原纤维缠结(nft)。具有tau蛋白包涵体的神经退行性疾病被称为tau蛋白病变。在ad中,aβ和nft与认知障碍密切相关,应对aβ和nft在目前来看似乎是最有可能成功的策略,因为据报道联合治疗有益于治疗ad。本发明人先前的研究表明,与经典配方hljdt相比,改进的hljdt(即没有黄芩的hljdt:hljdt-m)在体外和体内降低淀粉样蛋白-β(aβ)负荷方面都具有阳性活性。尽管hljdt-m显示出降低aβ的作用,但它不具有降低tau蛋白的作用,因此,迫切需要优化hljdt-m以用于ad治疗。本部分或本申请的任何其他部分中的任何参考文献的引用或标识,不应被解释为承认这样的参考文献可用作本申请的现有技术。技术实现要素:因此,本发明的目的是提供用于通过靶向淀粉样蛋白-β(aβ)和与tau蛋白相关的神经原纤维缠结(nft)来治疗神经退行性疾病的具有显着有效治疗效果的草药组合物。本发明的第一方面提供了一种草药组合物,其包含黄连、黄柏、栀子、延胡索、丹参和钩藤的草药提取物。在本发明第一方面的一个实施方案中,该草药提取物包含黄连、黄柏、栀子、延胡索、丹参和钩藤,重量比为0.83-4.15:1.66-3.46:1.53-4.16:2.69-2.91:4.57-6.22:4.22-6.24。在本发明第一方面的一个实施方案中,该草药提取物包含黄连、黄柏、栀子、延胡索、丹参和钩藤,重量比为0.83:1.66:4.16:2.91:4.57:6.24。在本发明第一方面的一个实施方案中,该草药提取物包含黄连、黄柏、栀子、延胡索、丹参和钩藤,重量比为4.15:3.46:3.46:2.76:6.22:6.22。在本发明第一方面的一个实施方案中,该草药提取物包含黄连、黄柏、栀子、延胡索、丹参和钩藤,重量比为3.45:1.92:1.53:2.69:5.76:4.22。本发明的第二方面提供该草药组合物在制备用于治疗由淀粉样蛋白-β(aβ)和与tau蛋白相关的神经原纤维缠结引起的神经退行性疾病的药物组合物中的用途。本发明的第三方面提供通过以0.154g/kg/天至0.617g/kg/天的剂量给予该草药组合物来治疗由淀粉样蛋白-β(aβ)和与tau蛋白相关的神经原纤维缠结引起的人类神经退行性疾病的方法。在本发明第二和第三方面的一个实施方案中,该草药组合物口服给予。在本发明第二和第三方面的一个实施方案中,由淀粉样蛋白-β(aβ)和与tau蛋白相关的神经原纤维缠结引起的人类神经退行性疾病包括阿尔茨海默氏病。在整个说明书中,除非上下文另有要求,否则词语“包括”或“包含”或它们的变体将暗示涵括所陈述的一个整数或一组整数,但不排除任何其他整数其他组整数。还要指出的是,在本公开中,特别是在权利要求和/或段落中,诸如“包括”、“包含”等的术语应具有美国专利法中赋予它们的含义;例如,它们可以表示“包括”等;并且诸如“基本上由......组成”的术语具有美国专利法中赋予它的含义;例如,它允许未明确叙述的要素,但排除现有技术中发现的或影响本发明的基本或新颖特征的要素。此外,在整个说明书和权利要求书中,除非上下文另有要求,否则词语“包括”或其变体将被理解为暗示涵括所陈述的一个整数或一组整数,但不排除任何其他整数其他组整数。本文使用的所选术语的其他定义可以在本发明的“具体实施方式”中找到,并且适用于全文。除非另外定义,否则本文使用的所有其他技术术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。通过阅读后续的描述,本发明的其他方面和优点对于本领域技术人员将是显而易见的。附图说明由下文对本发明的描述并结合附图,本发明的上述和其他目的和特征将变得显而易见,附图中:图1a显示用于制备本发明神经保护剂(neurodefend,nd)组合物的草药提取物的草药部分。图1b显示通过lc-esi-q/tof色谱图确定的nd1中的生物活性组分。图1c显示通过lc-esi-q/tof色谱图确定的nd23中的生物活性组分。图1d显示通过lc-esi-q/tof色谱图确定的nd15中的生物活性组分。图1e显示nd1、nd23和nd15的主要组分的定量分析。图1f显示nd1、nd23和nd15的次要组分的定量分析。图2a显示通过硫黄素t(tht)荧光所监测的nd1至nd6和hljdt-m提取物对aβ1–42原纤维的形成的抑制。每个数据代表三次重复的平均值。图2b显示通过硫黄素t(tht)荧光所监测的nd7至nd12提取物对aβ1–42原纤维的形成的抑制。每个数据代表三次重复的平均值。图2c显示通过硫黄素t(tht)荧光所监测的nd13至nd18提取物对aβ1–42原纤维的形成的抑制。每个数据代表三次重复的平均值。图2d显示通过硫黄素t(tht)荧光所监测的nd19至nd24提取物对aβ1–42原纤维的形成的抑制。每个数据代表三次重复的平均值。图3a显示对不同浓度的nd1至nd5提取物的活力测定。用nd提取物对表达突变appv717f的cho细胞即7pa2(cho-appv717f)细胞进行处理48小时,并通过mtt活力测定法测定细胞的活力。图3b显示对不同浓度的nd6至nd10提取物的活力测定。用nd提取物对7pa2(cho-appv717f)细胞进行处理48小时,并通过mtt活力测定法测定细胞的活力。图3c显示对不同浓度的nd11至nd15提取物的活力测定。用nd提取物对7pa2(cho-appv717f)细胞进行处理48小时,并通过mtt活力测定法测定细胞的活力。图3d显示对不同浓度的nd16至nd20提取物的活力测定。用nd提取物对7pa2(cho-appv717f)细胞进行处理48小时,并通过mtt活力测定法测定细胞的活力。图3e显示对不同浓度的nd21至nd24提取物的活力测定。用nd提取物对7pa2(cho-appv717f)细胞进行处理48小时,并通过mtt活力测定法测定细胞的活力。图4a显示nd提取物在7pa2(cho-appv717f)细胞中的app调节作用。通过蛋白质印迹分析法测定nd1至nd5的fl-app、sappβ和β-肌动蛋白的水平。nd1剂量依赖性地降低sappβ的水平。图4b显示nd提取物在7pa2(cho-appv717f)细胞中的app调节作用。通过蛋白质印迹分析法测定nd6至nd13的fl-app、sappβ和β-肌动蛋白的水平。图4c显示nd提取物在7pa2(cho-appv717f)细胞中的app调节作用。通过蛋白质印迹分析法测定nd14至nd19的fl-app、sappβ和β-肌动蛋白的水平。nd15剂量依赖性地降低sappβ的水平。图4d显示nd提取物在7pa2(cho-appv717f)细胞中的app调节作用。通过蛋白质印迹分析法测定nd20至nd24的fl-app、sappβ和β-肌动蛋白的水平。nd23剂量依赖性地降低sappβ的水平。图4e显示nd1和nd15的定量,剂量依赖性地降低sappβ和ctf的水平,数据以平均值±sd表示,**p≤0.05,***p≤0.001。图5a显示nd1至nd6提取物对稳定表达p301l突变体的sh-sy5y细胞中的phf-1tau蛋白水平的影响。图5b显示nd7至nd12提取物对稳定表达p301l突变体的sh-sy5y细胞中的phf-1tau蛋白水平的影响。图5c显示nd13至nd18提取物对稳定表达p301l突变体的sh-sy5y细胞中的phf-1tau蛋白水平的影响。在筛选的提取物中,仅nd15(200µg/ml)以剂量依赖性方式降低phf1的水平。图5d显示nd19至nd24提取物对稳定表达p301l突变体的sh-sy5y细胞中的phf-1tau蛋白水平的影响。图6a显示通过双夹心elisa测定的nd1至nd12提取物对aβ1-40水平的影响。nd1提取物以剂量依赖性方式降低aβ1-40水平。图6b显示通过双夹心elisa测定的nd13至nd24提取物对aβ1-40水平的影响。nd15和nd23提取物以剂量依赖性方式降低aβ1-40水平。图6c显示通过双夹心elisa测定的nd1至nd12不同nd提取物对aβ1-42水平的影响。nd1提取物以剂量依赖性方式降低aβ1-42水平。图6d显示通过双夹心elisa测定的nd13至nd24不同nd提取物对aβ1-42水平的影响。nd15和nd23提取物以剂量依赖性方式降低aβ1-42水平。图7a显示nd1在野生型c57bl/6小鼠中的ld50。图7b显示nd1亚慢性毒性的野生型c57bl/6小鼠的体重。图7c显示nd1亚慢性毒性的野生型c57bl/6小鼠的器官重量。图7d显示nd1亚慢性毒性的野生型c57bl/6小鼠的组织病理学观察结果。图8a显示nd1不影响5xfad雄性小鼠的体重。图8b显示nd1不影响5xfad雌性小鼠的体重。图8c显示nd1通过情境恐惧条件作用(contextualfearconditioning)改善5xfad小鼠中的海马和杏仁核依赖性记忆缺陷。图8d显示通过蛋白质印迹分析表明,nd1显着地且剂量依赖性地降低5xfad小鼠中app、ctf、papp和pctf的水平。图8e显示通过蛋白质印迹分析对5xfad小鼠中app、ctf、papp和pctf的定量,数据以平均值±sd表示。图8f显示nd1减少5xfad小鼠大脑中的海马aβ斑块负荷。图8g显示5xfad小鼠大脑中海马aβ斑块负荷的定量,数据以平均值±sd表示。图8h显示了5xfad小鼠中nd治疗和行为实验方案的时间轴线。图9a显示nd1不影响3xtg-ad雄性小鼠的体重。图9b显示nd1不影响3xtg-ad雌性小鼠的体重。图9c显示在morris水迷宫实验中学习期间野生型介质组和tg介质组的记忆。图9d显示nd1在学习期间改善3xtg-ad小鼠中的海马依赖性记忆缺陷。图9e显示在探索试验中,nd1处理的tg组的定量,该组在探索目标象限中的平台所花费的时间比tg介质处理组长。数据以平均值±sd表示。图9f显示的图片描绘了在探索试验中nd1处理的tg组和tg介质处理组的记忆保留。图9g显示3xtg-ad小鼠中nd治疗和行为实验方案的时间轴线。图10a显示nd23在野生型c57bl/6小鼠中的ld50。图10b显示nd23亚慢性毒性的野生型c57bl/6小鼠的体重。图10c显示nd23亚慢性毒性的野生型c57bl/6小鼠的器官重量。图10d显示nd23亚慢性毒性的野生型c57bl/6小鼠的组织病理学观察结果。图11a显示nd23不影响5xfad雄性小鼠的体重。图11b显示nd23不影响5xfad雌性小鼠的体重。图11c显示nd23通过情境恐惧调理(contextualfearconditioning)改善5xfad小鼠中的海马和杏仁核依赖性记忆缺陷。图11d显示通过蛋白质印迹分析表明,nd23显着地且剂量依赖性地降低5xfad小鼠大脑中app、ctf、papp和pctf的水平。图11e显示通过蛋白质印迹分析对5xfad小鼠大脑中app、ctf、papp和pctf的定量,数据以平均值±sd表示。图11f显示nd23减少5xfad小鼠大脑中的海马aβ斑块负荷。图11g显示5xfad小鼠大脑中海马aβ斑块负荷的定量,数据以平均值±sd表示。图12a显示nd23不影响3xtg-ad雄性小鼠的体重。图12b显示nd23不影响3xtg-ad雌性小鼠的体重。图12c显示在morris水迷宫实验中学习期间野生型介质组和tg介质组的记忆。图12d显示nd23在学习期间改善3xtg-ad小鼠中的海马依赖性记忆缺陷。图12e显示在探索试验中,nd23处理的tg组的定量,该组在探索目标象限中的平台所花费的时间比tg介质处理组长。数据以平均值±sd表示。图12f显示的图片描绘了在探索试验中nd23处理的tg组和tg介质处理组的记忆保留。图13a显示nd15在野生型c57bl/6小鼠中的ld50。图13b显示nd15亚慢性毒性的野生型c57bl/6小鼠的体重。图13c显示nd15亚慢性毒性的野生型c57bl/6小鼠的器官重量。图13d显示nd15亚慢性毒性的野生型c57bl/6小鼠的组织病理学观察结果。图14a显示nd15不影响3xtg-ad雄性小鼠的体重。图14b显示nd15不影响3xtg-ad雌性小鼠的体重。图14c显示在morris水迷宫实验中学习期间野生型介质组和tg介质组的记忆。图14d显示nd15在学习期间改善3xtg-ad小鼠中的海马依赖性记忆缺陷。图14e显示nd15处理的tg组的定量,该组在探索目标象限中的平台所花费的时间比tg介质处理组长。数据以平均值±sd表示。图14f显示的图片描绘了在探索试验中nd15处理的tg组和tg介质处理组的记忆保留。图15a显示通过lcms对icr小鼠中nd1大脑可渗透生物活性组分的药代动力学定量分析。图15b显示通过lcms对icr小鼠血浆中nd1生物活性组分的药代动力学定量分析。图16a显示通过lcms对icr小鼠中nd23大脑可渗透生物活性组分的药代动力学定量分析。图16b显示通过lcms对icr小鼠血浆中nd23生物活性组分的药代动力学定量分析。图17a显示通过lcms对icr小鼠中nd15大脑可渗透生物活性组分的药代动力学定量分析。图17b显示通过lcms对icr小鼠血浆中nd15生物活性组分的药代动力学定量分析。图18a显示通过蛋白质印迹表明nd1降低3xtg-ad小鼠中不溶性磷酸化、错误折叠和总tau蛋白的水平。图18b显示nd1处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用mc1抗体来检测。图18c显示nd1处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用at8抗体来检测。图18d显示nd1处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用alz50抗体来检测。图18e显示nd1处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用cp13抗体来检测。图18f显示nd1处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用ht7抗体来检测。图18g显示nd1处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用phf1抗体来检测。图19a显示通过蛋白质印迹表明nd23降低3xtg-ad小鼠中不溶性磷酸化、错误折叠和总tau蛋白的水平。图19b显示nd23处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用mc1抗体来检测。图19c显示nd23处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用at8抗体来检测。图19d显示nd23处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用alz50抗体来检测。图19e显示nd23处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用cp13抗体来检测。图19f显示nd23处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用ht7抗体来检测。图19g显示nd23处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用phf1抗体来检测。图20a显示通过蛋白质印迹表明nd15降低3xtg-ad小鼠中不溶性磷酸化、错误折叠和总tau蛋白的水平。图20b显示nd15处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用mc1抗体来检测。图20c显示nd15处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用at8抗体来检测。图20d显示nd15处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用alz50抗体来检测。图20e显示nd15处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用cp13抗体来检测。图20f显示nd15处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用ht7抗体来检测。图20g显示nd15处理的3xtg-ad动物的不溶性tau蛋白水平的定量分析,使用phf1抗体来检测。图21a显示nd1处理的3xtg-ad动物的aβ斑块负荷的定量分析。图21b显示通过免疫组织化学表明nd1降低3xtg-ad小鼠中的海马aβ斑块负荷。图22a显示nd23处理的3xtg-ad动物的aβ斑块负荷的定量分析。图22b显示通过免疫组织化学表明nd23降低3xtg-ad小鼠中的海马aβ斑块负荷。图23a显示nd15处理的3xtg-ad动物的aβ斑块负荷的定量分析。图23b显示通过免疫组织化学表明nd15降低3xtg-ad小鼠中的海马aβ斑块负荷。图24a显示通过蛋白质印迹表明nd1降低3xtg-ad小鼠大脑匀浆中的ctf水平。图24b显示nd1处理的3xtg-ad动物的app和ctf水平的定量分析。图25a显示通过蛋白质印迹表明nd23降低3xtg-ad小鼠大脑匀浆中的ctf水平。图25b显示nd23处理的3xtg-ad动物的app和ctf水平的定量分析。图26a显示通过蛋白质印迹表明nd15降低3xtg-ad小鼠大脑匀浆中的ctf水平。图26b显示nd15处理的3xtg-ad动物的app和ctf水平的定量分析。图27a显示nd1处理的3xtg-ad动物的at8阳性nft负荷的定量分析,通过imagej软件来评估。图27b显示通过免疫组织化学表明nd1(1.9、3.8、7.6g/kg/天)降低3xtg-ad小鼠中的at8阳性神经元负荷。图28a显示nd23处理的3xtg-ad动物的at8阳性nft负荷的定量分析,通过imagej软件来评估。图28b显示通过免疫组织化学表明nd23(1.9、3.8、7.6g/kg/天)降低3xtg-ad小鼠中的at8阳性神经元负荷。图29a显示nd15处理的3xtg-ad动物的at8阳性nft负荷的定量分析,通过imagej软件来评估。图29b显示通过免疫组织化学表明nd15(1.9、3.8、7.6g/kg/天)降低3xtg-ad小鼠中的at8阳性神经元负荷。图30a显示nd1(1.9、3.8、7.6g/kg/天)处理组的血浆生化成分的定量结果,以表格表示。图30b显示nd23(1.9、3.8、7.6g/kg/天)处理组的血浆生化成分的定量结果,以表格表示。图30c显示nd15(1.9、3.8、7.6g/kg/天)处理组的血浆生化成分的定量结果,以表格表示。图31a显示nd1处理的3xtg-ad动物的iba1负荷的定量分析,通过imagej软件来评估。图31b显示的荧光图像通过免疫组织化学表明nd1(1.9、3.8、7.6g/kg/天)降低3xtg-ad小鼠中的iba1阳性细胞负荷。图32a显示nd23处理的3xtg-ad动物的iba1负荷的定量分析,通过imagej软件来评估。图32b显示的荧光图像通过免疫组织化学表明nd23(1.9、3.8、7.6g/kg/天)降低3xtg-ad小鼠中的iba1阳性细胞负荷。图33a显示nd15处理的3xtg-ad动物的iba1负荷的定量分析,通过imagej软件来评估。图33b显示的荧光图像通过免疫组织化学表明nd15(1.9、3.8、7.6g/kg/天)降低3xtg-ad小鼠中的iba1阳性细胞负荷。图34a显示nd1处理的5xfad动物的gfap负荷的定量分析,通过imagej软件来评估。图34b显示nd1处理的5xfad动物的iba1负荷的定量分析,通过imagej软件来评估。图34c显示的荧光图像通过免疫组织化学表明nd1(1.9和3.8g/kg/天)降低5xfad小鼠中的gfap和iba1阳性细胞负荷。图35a显示nd23处理的5xfad动物的gfap负荷的定量分析,通过imagej软件来评估。图35b显示nd23处理的5xfad动物的iba1负荷的定量分析,通过imagej软件来评估。图35c显示的荧光图像通过免疫组织化学表明nd23(3.8和7.6g/kg/天)降低5xfad小鼠中的gfap和iba1阳性细胞负荷。具体实施方式通过以下实施方案和实施例进一步说明本发明,这些实施方案和实施例仅可用于说明目的,但不意图限制本发明的范围。本发明提供一种基于传统中药的制剂,用于治疗或预防神经退行性疾病。发明人的结果表明,神经保护剂(neurodefend,nd)作为一种草药提取物,使用均匀设计来靶向aβ和nft,将是治疗ad的新方法。本发明提供nd,其作为一种按关键重量比组配的草药组合的提取物,经证实是一种改善和治疗ad的有效治疗策略。术语“草药组合”在本文中是指干黄连、黄柏、栀子、丹参、钩藤和延胡索的混合物。术语“草药提取物”在本文中是指草药组合的提取物,呈粉末形式,通过水煎煮该干燥草药、在酒精中浸泡并冻干获得。本发明的草药提取物可以配制成其他形式用于不同的给药目的。尽管所有上述药用植物已在中医中分别用于治疗多种神经疾病,但先前尚未公开上述活性成分组合在一起将产生在治疗神经退行性疾病方面具有显着协同治疗作用的组合物。本发明提供一种新的无毒的非常有效的治疗组合物,其用于治疗单独发生的或与其他疾病或病症并发的神经疾病。该治疗组合物包含由黄连、黄柏、栀子、丹参、钩藤和延胡索组成的草药组合(nd)的提取物(图1a)。该草药组合的提取物含有新的生物活性成分。本发明的草药提取物中的新的生物活性成分是指在该草药组合的提取过程中形成的生物活性化学成分,而不是在该草药组合的单独草药中天然且最初发现的生物活性化学成分。因此,本发明的草药提取物中的所得化学成分导致增强的治疗性能,这种治疗性能与这些草药未如本发明那样组合在一起时所能表现出的治疗性能不同。在一个实施方案中,该草药提取物包含重量比为0.83-4.15:1.66-3.46:1.53-4.16:2.69-2.91:4.57-6.22:4.22-6.24的黄连、黄柏、栀子、延胡索、丹参和钩藤。在一个实施方案中,草药提取物包含重量比为0.83:1.66:4.16:2.91:4.57:6.24的黄连、黄柏、栀子、延胡索、丹参和钩藤。在一个实施方案中,草药提取物包含重量比为4.15:3.46:3.46:2.76:6.22:6.22的黄连、黄柏、栀子、延胡索、丹参和钩藤。在一个实施方案中,草药提取物包含重量比为3.45:1.92:1.53:2.69:5.76:4.22的黄连、黄柏、栀子、延胡索、丹参和钩藤。这些草药的重量比是指这些草药在该草药提取物中的重量比。应理解,这些草药在该草药提取物和该草药组合中的重量比得到保持。本发明的组合物相对便宜,非常有效且毒性低。本发明提供24种草药提取物(即nd制剂,nd1至nd24),如表1所示。nd1、nd23和nd15可减少异常β-淀粉样蛋白前体蛋白(app)、其c-末端片段(ctf)和磷酸化tau蛋白(它们都是ad细胞模型中的神经保护靶标)的积累。在动物实验中,从急性和亚慢性毒性实验推断本发明的组合物在高至76-80g/kg/天的剂量以下无毒性。本发明经证实在小鼠中是口服生物可利用的和大脑可渗透的。nd1和nd23可减少5xfad转基因ad小鼠中异常app、其ctf和老年斑的积累。此外,证实nd1、nd15和nd23可改善3xtg三重转基因ad小鼠中的海马依赖性记忆、学习和记忆保留。这些nd制剂可用于预防或治疗与神经元损失有关的疾病。然后用计算机系统性地筛选这些nd制剂和其中包含的纯化合物,并在ad的细胞和动物模型中进行测试。最有效的化合物将被选择用于下一阶段的神经退行性疾病新药开发。本发明提供了三种组合物,以改变对处于上述疾病的不同阶段的ad小鼠的效力。这些组合物已被命名为nd1、nd15和nd23。nd15是最强、最有效的配方,因此适用于清除aβ和tau蛋白病理症状。nd23具有中等效力,特别适用于一般性症状。nd1是一种温和版本,特别适合长期护理和预防目的。组x1:黄连x2:黄柏x3:栀子x4:延胡索x5:丹参x6:钩藤总重量(g)124107111549226591284232975911434384413134553433812336310981595474768101348845910814509438613842105610514105011510561214521253410101042136881013115614677315155315655499381679109913571774681413521877361194319839412124820893914155821887788462291063111049239547151151249685101452表1显示本发明的24种草药提取物。质量测试和提取物的制备:nd制剂的单个草药的质量控制的初始测试,是根据中国药典通过测试每种草药的关键标志物的百分比来进行。nd的所有6种草药(图1a)均购自香港浸会大学(hkbu)中医诊所。每种药草的凭证样本(vouchersample)存放在香港浸会大学中医学院的植物标本室。这些草药用中文名称和植物学(拉丁双名)名称识别。按规定的重量比称取干黄连、黄柏、栀子、丹参、钩藤和延胡索并混合,得到草药组合。将该草药组合粉碎成粉末。在粉碎之前,可将根和根茎切成小块。将粉末状草药组合在水中煎煮并浸泡在70%醇(例如乙醇)中过夜,然后过滤。煎煮和浸泡步骤可以重复几次(例如2至3次)。将过滤的溶液在旋转蒸发器中在真空下在约50℃下浓缩,然后在真空下冻干以获得本发明的草药提取物。该草药提取物可以储存在4℃下。本领域技术人员所认识的其他提取方法也可用于获得本发明的草药提取物。该草药提取物的产率约为起始草药组合的10重量%至20重量%。通过lc-ms-q-tof分析法定性和定量分析nd1、nd15和nd23的含量(图1b)。nd的成分是小檗碱(berberine)、栀子苷(geniposide)、巴马汀(palmatine)、原阿片碱(protopine)、四氢巴马汀(tetrahydropalmatine)、别隐品碱(allocryptopine)、黄连碱(coptisine)、去氢钩藤碱(corynoxeine)、柯诺辛碱(corynoxine)、异钩藤碱(isorhyncophyline)、丹酚酸b(salvianolicacidb)、丹参酮2a(tanshinone2a)和隐丹参酮(cryptotanshinone)。对nd1、nd23和nd15制剂的定量分析进行了评估,并给出主要和次要生物活性组分的水平(图1c-1f)。nd是6种草药即黄连、黄柏、栀子、延胡索、丹参、钩藤的组合,给定的比例是用于制备nd的1公斤草药制剂。6种草药的nd1的重量比黄连:黄柏:栀子:延胡索:丹参:钩藤分别为0.83:1.66:4.16:2.91:4.57:6.24,6种草药的nd15的重量比黄连:黄柏:栀子:延胡索:丹参:钩藤分别为4.15:3.46:3.46:2.76:6.22:6.22,6种草药的nd23的重量比黄连:黄柏:栀子:延胡索:丹参:钩藤分别为3.45:1.92:1.53:2.69:5.76:4.22。基于ld50计算小鼠中的nd剂量,剂量为1.9g/kg/天、3.8g/kg/天和7.6g/kg/天。人等效剂量(hed)=动物剂量(g/kg)x[动物km/人类km]。校正因子(km)通过将物种的平均体重(kg)除以其体表面积(m2)来估算。人类的km因子为37,小鼠的km因子为3。人类的nd当量剂量为0.154g/kg/天、0.308g/kg/天和0.617g/kg/天。体外aβ聚集测定使用硫黄素t结合测定法,通过aβ1-42原纤维的抑制来评估nd的水提取物的抗aβ聚集效力。首先,如本发明人所述,本发明人研究了24种不同的nd提取物对aβ原纤维的形成的影响。本发明人发现nd的几种提取物以浓度依赖性方式对aβ1–42的原纤维形成具有强效的抑制作用;在经过筛选的24种nd提取物中,特别是仅有6种分离物;nd1、nd2、nd3、nd4、nd6和nd15最强烈地抑制aβ聚集(图2a-2d)。nd1-4和6的提取物在1.56至50μg/ml之间的剂量下以剂量依赖性方式抑制聚集。这五种提取物的近似ic50值在2-2.5μg/ml范围内。然而,nd15的ic50值约为7μg/ml。一般认为,神经功能障碍似乎是aβ的小寡聚集合体,称为addl(aβ衍生的可扩散配体),而不是在ad早期阶段在淀粉样蛋白斑中发现的大的不溶性原纤维。活力测试:在表达突变体appv717f的7pa2-cho细胞上测试制备的24种提取物的潜在细胞毒性。本发明人在48孔板中以五种不同浓度测试每种提取物48小时。在7pa2细胞中测试12.5至200μg/ml的浓度,表明活力超过70-80%。活力测试的结果在图3a-3e中显示。调节测定:对于app调节测定,在用提取物处理之前24小时,将0.15×106个7pa2细胞/孔接种到12孔板上。对于初步筛选,用两种不同剂量的nd(100和200μg/ml或者50和100μg/ml终浓度)处理细胞48小时,然后收集细胞外培养基用于检测sappβ,然后收获细胞以通过蛋白质印迹分析法观察fl-app、ctf和β-肌动蛋白。如免疫印迹(图4a-4d)所示,nd1和nd15提取物以剂量依赖性方式减少sappβ而不影响fl-app。为了进一步证实nd1和nd15的sappβ降低作用,本发明人已经重复该app调节测定三次。nd1和nd15剂量依赖性地降低sappβ和ctf的水平(图4e)。蛋白测定:然后,本发明人比较了24种不同nd提取物在稳定表达tau蛋白突变体p301l的sh-sy5y细胞中的抗tau蛋白活性,该细胞中磷酸tau蛋白和不溶性总tau蛋白(分子量为70kda)异常增加。用两种不同浓度的nd处理sh-sy5y-p301l细胞48小时(图5a-5d)。本发明人已经对不同浓度的nd进行了活力测定,并且将无毒浓度用于对这些nd的tau蛋白降低活性进行初始筛选。在筛选的提取物中,nd15和nd1降低了不溶性磷酸化tau蛋白(phf-1)的水平。通过elisa测定法分析aβ1-40和aβ1-42水平:对于aβ1-40和aβ1-42elisa测定法,在用提取物处理之前24小时,将0.15x106个7pa2细胞/孔接种到12孔板上。对于初始筛选,用三种不同剂量的nd(50、100和200μg/ml终浓度)处理细胞48小时,然后收集细胞外培养基用于通过双夹心elisa分析法检测aβ1-40和aβ1-42以观察水平。如结果所示,nd1、nd7、nd12、nd15和nd23提取物降低了aβ1-40的水平(图6a-6b)。为了进一步证实nd1、nd7、nd12、nd15和nd23的aβ1-42水平降低作用(图6c-6d),通过双夹心elisa进行评估。在elisa中测试的所有提取物中,仅nd1、nd15和nd23提取物以剂量依赖性方式持续降低aβ1-40和aβ1-42水平。体外测定的结论:由于nd1、nd23和nd15始终显示抗aβ聚集、抗sappβ、抗aβ和抗tau蛋白活性,因此本发明人选择nd1、nd23和nd15用于转基因小鼠模型5xfad和3xtg-ad中的体内研究。、nd23和nd15在野生型c57bl/6小鼠中的急性和亚慢性毒性:在初步实验中,发明人进行了急性毒性以研究nd1、nd23和nd15在野生型c57bl/6小鼠中的毒性。nd1在野生型c57bl/6小鼠中的ld50为约76g/kg(图7a)。nd23和nd15在野生型c57bl/6小鼠中的ld50为约80g/kg(图10a、13a)。此外,本发明人在野生型c57bl/6小鼠中进行了nd1、nd23和nd15的亚慢性毒性(1.9g/kg/天、3.8g/kg/天、7.6g/kg/天)。nd1、nd23和nd15在治疗过程中不影响动物体重(图7b、10b、13b)。在28天结束时,将动物实施安乐死并记录器官的重量,并与介质组和治疗组进行比较(图7c、10c、13c)。在亚慢性毒性研究中对每只小鼠的大脑、肝、肾、肺和脾的组织进行组织病理学检查。通过用苏木精和曙红(he)染色检查大体病变(grosslesions)。观察每个动物器官的组织病理学观察结果和大体尸检(grossnecropsy),以确定nd1、nd23和nd15亚慢性毒性(图7d、10d、13d)。和nd23在5xfad小鼠模型中的抗ad作用:本发明人进一步研究了nd1和nd23在体内的抗ad作用和生物活性,以测试nd1和nd23对aβ减少的长期作用。本发明人在5x家族性阿尔茨海默氏病(5xfad)小鼠模型中进行了研究,因为该模型显示出早期侵袭性aβ积累。本发明人在2月龄的5xfad小鼠中将nd1和nd23作为食物混合物口服施用,nd1浓度为1.9g/kg和3.8g/kg/天,nd23浓度为3.8g/kg和7.6g/kg/天,直到5月龄(图8h)。在治疗过程中,nd1和nd23不影响雄性和雌性体重(图8a-8b、11a-11b)。在5月龄结束时,通过情境恐惧条件作用测试海马和杏仁核依赖性记忆缺陷。nd1和nd23可改善5xfad小鼠中的海马和杏仁核依赖性记忆缺陷,经nd1和nd23处理的动物在冷冻行为和听觉信号测试中显着地比经介质处理的5xfad小鼠冻住更多(图8c、11c)。此外,本发明人用大脑匀浆进行蛋白质印迹分析以检测app、ctf、papp和pctf的sds级分。用nd1和nd23处理显着地且剂量依赖性地降低sds级分中的app、ctf、papp和pctf水平,并且由通过光密度分析进行的免疫印迹定量证实了这一点(图8d-8e、11d-11e)。为了进一步证实aβ斑块病理学,本发明人在不同区域(即前、中、后)的30μm大脑切片中进行免疫组织化学。在杏仁核、ca1、ca2、ca3和皮质区域中定量神经元内aβ斑块和细胞外aβ斑块的水平。nd1和nd23可降低5xfad小鼠大脑中的海马aβ斑块负荷(图8f-8g、11f-11g)。这些体内数据证实可使用nd1和nd23来减少ad中的aβ病理和逆转ad认知功能障碍。、nd23和nd15处理对3xtg-ad小鼠模型中记忆缺陷的作用:本发明人进一步证实了nd1、nd23和nd15对3xtg-ad小鼠获取空间记忆和学习的作用。为了评估nd1、nd23和nd15对改善认知缺陷的长期作用,本发明人使用3x转基因(3xtg)-ad小鼠模型,因为该模型显示症状的晚期发作与人类相似。本发明人用nd1、nd23和nd15(1.9g/kg/天、3.8g/kg/天、7.6g/kg/天)对6月龄的3xtg-ad小鼠口服施用食物混合物8个月(图9g)。在治疗过程中,nd1、nd23和nd15不影响雄性和雌性动物体重(图9a-9b、12a-12b、14a-14b)。为了评估nd1、nd23和nd15对改善3xtg-ad小鼠的认知缺陷的长期作用,本发明人进行了morris水迷宫实验。在nd1、nd23和nd15处理的3xtg-ad小鼠中评估空间记忆、学习和记忆保持的获得,在morris水迷宫中训练6天期间获取数据用于分析nd1、nd23和nd15处理的3xtg-ad小鼠在训练期间的逃避潜伏期。所有小组都在6天的训练中学会了定位平台,这由随着训练的进行逃避潜伏期缩短所表明,nd1、nd23和nd15治疗组在6天训练期间的逃避潜伏期表现出显着短于转基因(tg)介质组的行进距离(图9d、12d、14d)。此外,在学习的获得阶段,野生型(wt)组在训练中表现出比tg安慰剂组显着更短的行进距离(图9c、12c、14c)。为了测试nd1、nd23、nd15处理组和tg介质处理组中的记忆保留,本发明人在第6天训练后24小时进行了探索试验。在探索试验日,nd1、nd23和nd15处理组(图9e、12e、14e)比tg介质处理组(图9f,12f,14f)花费更长的时间用于探索目标象限中的平台。此外,本发明人得出结论,与tg介质相比,3xtg-ad小鼠的nd1、nd23和nd15治疗组的记忆保持和学习得到改善。在icr小鼠中定量nd1、nd23、nd15的药代动力学为了证实这些配方中的活性成分的大脑渗透性,本发明人在icr小鼠中对所选择的配方nd1、nd23和nd15进行了药代动力学实验。本发明人在大脑和血浆中进行了8个不同时间点的药代动力学。在该研究中使用icr小鼠来评估所选配方中的活性成分的大脑渗透性。每组由3-4只小鼠组成。研究中使用的每只小鼠都饥饿过夜,并且在所有时间点以7.6g/kg口服给予分别的药物。收集大脑和血浆并进行提取,用于在lcms三重四极杆系统中分析。nd配方的11种活性成分的定量在大脑和血浆中进行。有效成分的定量结果在图15-17中给出。本发明人定量了nd1的主要生物活性成分,并且我们分析了icr小鼠的大脑和血浆中11种关键生物活性小分子的量(图15a-15b)。nd1提取物中存在一些主要和次要的大脑可渗透的活性成分。在icr小鼠的大脑和血浆中分析nd23的主要生物活性成分(图16a-16b)。在nd23提取物中存在一些主要和次要的大脑可渗透的活性成分,通过药代动力学进行定量。在icr小鼠的大脑和血浆中分析nd15的生物活性组分的药代动力学(图17a-17b)。nd15提取物中存在一些主要和次要的大脑可渗透的活性成分,通过lcms三重四极杆进行定量。、nd23和nd15可降低3xtg-ad小鼠中不溶性磷酸化tau蛋白、错误折叠tau蛋白和总tau蛋白的水平:在本发明人的初步实验中,本发明人进行了体外研究,发现了24种配方中的三种配方在体外研究中显示出抗aβ和抗tau蛋白活性。本发明人选择nd1、nd23和nd15用于3xtg小鼠的体内研究。通过差异分离法分离了3xtg小鼠大脑中的不溶性tau蛋白。提取来自3xtg-ad小鼠的可溶性和不溶性tau蛋白级分。首先用ripa缓冲液提取大脑样品。用1%sarkosyl洗涤剂进一步提取所得的ripa级分,并以100,000xg超离心1小时。将得到的上清液和沉淀物分别称为可溶性tau蛋白和不溶性tau蛋白。通过at8、cp13、phf-1抗体检测可溶性和不溶性级分中的磷酸化tau蛋白种类。使用mc1、alz50和ht7抗体检测错误折叠的确认tau蛋白和总tau蛋白。将本发明的草药提取物口服给予6月龄的3xtg-ad小鼠8个月。在nd1、nd23和nd15处理组(1.9、3.8、7.6g/kg/天)的可溶性级分中,磷酸化tau蛋白、错误折叠tau蛋白和总tau蛋白没有显着差异。然而,在nd1、nd23和nd15处理组的sarkosyl不溶性级分中,磷酸化的、错误折叠的和总tau蛋白显着降低,但在介质处理组中没有显着降低(图18a-18g)、(图19a-19g)、(图20a-20g)。值得注意的是,这些作用伴随着不溶性tau蛋白水平的大幅降低,证实了可使用nd1、nd23和nd15来减少3xtg小鼠中的异常tau蛋白聚集。、nd23和nd15降低3xtg-ad小鼠中aβ斑块负荷的水平:本发明人进一步研究了nd1、nd23和nd15的体内抗ad作用和生物活性,以测试nd1、nd23和nd15(1.9、3.8、7.6g/kg/天)对减少aβ的长期作用。本发明人在3xtg-ad小鼠模型中进行了研究。将本发明的草药提取物口服给予6月龄的3xtg-ad小鼠8个月。为了进一步证实aβ斑块病理学,本发明人在不同区域(即前、中、后)的30μm大脑切片中进行了免疫组织化学试验。与tg介质组相比,nd1、nd23和nd15显着且剂量依赖性地降低大脑中的海马aβ斑块负荷。这些体内数据证实了可使用nd1、nd23和nd15来减少3xtg-ad小鼠模型中的tau蛋白病理和aβ病理。nd1、nd23和nd15以剂量依赖性方式降低大脑的海马aβ斑块负荷,并且通过imagej软件评估4g8阳性aβ斑块的定量(图21a-21b)(图22a-22b)(图23a-23b)。、nd23和nd15降低3xtg-ad小鼠中app加工的水平:本发明人进一步研究了nd1、nd23和nd15的体内抗ad作用和生物活性,以测试nd1、nd23和nd15(1.9、3.8、7.6g/kg/天)对减少aβ的长期作用。本发明人在3xtg-ad小鼠模型中进行了研究。将本发明的草药提取物口服给予6月龄的3xtg-ad小鼠8个月。此外,本发明人用大脑匀浆进行蛋白质印迹分析,用nd1、nd23和nd15(1.9、3.8、7.6g/kg/天)处理显着且剂量依赖性地降低了大脑匀浆中的ctf水平(图24a-图24b)(图25a-25b)(图26a-26b)。nd1、nd23和nd15以剂量依赖性方式降低ctf水平,并且通过imagej软件评估app和ctf的定量。这些体内数据证实了可使用nd1、nd23和nd15来减少3xtg-ad小鼠模型中的tau蛋白病理和aβ病理。、nd23和nd15治疗可减轻3xtg-ad小鼠中的tau蛋白病理为了评估3xtg-ad小鼠大脑中的tau蛋白病理,本发明人使用at8单克隆抗体通过免疫组织化学法评估大脑中不溶性tau蛋白病理负荷。at8的表位位于微管结合结构域(rt1-4)的内部重复序列的区域之外,并且需要se96/ser404的磷酸化。3xtg-ad小鼠大脑中at8阳性神经元的免疫染色显示了不溶性tau蛋白病理负荷和神经纤维缠结负荷。为了进一步证实抗tau蛋白病理,本发明人在不同区域(即前、中、后)的30μm大脑切片中进行免疫组织化学试验。与tg介质组相比,nd1、nd23和nd15显着且剂量依赖性地减少大脑中海马神经纤维缠结负荷。这些体内数据证实可使用nd1、nd23和nd15来减少3xtg-ad小鼠模型中的tau蛋白病理。nd1、nd23和nd15以剂量依赖性方式降低大脑的海马不溶性tau蛋白病理负荷和神经纤维缠结负荷,并且通过imagej软件评估at8阳性神经元负荷的定量(图27a-27b)(图28a-28b)(图29a-29b)。总之,这些结果证明了可使用nd1、nd23和nd15来减少3xtg-ad小鼠模型中的tau蛋白病理。针对nd1、nd23和nd15在野生型小鼠中的亚慢性毒性的血液生化试验:此外,本发明人在野生型c57bl/6小鼠中进行了nd1、nd23和nd15的亚慢性毒性试验。在28天结束时,对动物实施安乐死,收集血浆并储存在-80℃。进行血液生化试验以检测nd1、nd23和nd15是否影响肝、肾和心脏的功能。此外,使用商业试剂盒测试丙氨酸氨基转移酶(alt)、天冬氨酸氨基转移酶(ast)活性、血尿素氮(bun)、肌酸酐(cr)、总蛋白、白蛋白和球蛋白含量。对nd1、nd23和nd15(1.9、3.8、7.6g/kg/天)处理组评估血浆的生化成分。对nd1、nd23和nd15(1.9、3.8、7.6g/kg/天)处理组的血浆的生化成分的定量结果进行评估并列于表中(图30a-30c)。治疗减轻3xtg-ad和5xfad小鼠中的神经炎症我们进一步研究了nd1、nd23和nd15(1.9、3.8、7.6g/kg/天)是否会降低3xtg-ad小鼠的神经炎症。将本发明的草药提取物口服给予6月龄的3xtg-ad小鼠8个月。由于活化的小神经胶质细胞和反应性星形胶质细胞与神经原纤维缠结和aβ病理密切相关。评估了离子化钙结合衔接分子1(iba-1)的表达(小胶质细胞增生),以鉴定nd1、nd23和nd15(1.9、3.8、7.6g/kg/天)处理的3xtg-ad小鼠中神经炎症的状况。3xtg-ad小鼠大脑切片中iba-1阳性细胞的免疫染色显示了与3xtg-ad小鼠的tg介质处理组相比,nd1、nd23和nd15(1.9、3.8、7.6g/kg/天)处理以剂量依赖性方式降低反应性iba-1阳性细胞计数(图31a-31b)(图32a-32b)(图33a-33b)。为了进一步证实上述结果,我们研究了5xfad小鼠模型的大脑切片中的活化的小神经胶质细胞和反应性星形胶质细胞。将本发明的草药提取物口服给予6月龄的3xtg-ad小鼠8个月。为了评估神经炎症,我们在不同区域(即前、中、后)的30μm大脑切片中进行免疫组织化学试验。由于活化的小神经胶质细胞和反应性星形胶质细胞与神经原纤维缠结和aβ病理密切相关。评估了离子化钙结合衔接分子1(iba-1)的表达(小胶质细胞增生症)和胶质原纤维酸性蛋白(gfap)的表达(星形细胞增多症),以鉴定nd1和nd23处理的5xfad小鼠中神经炎症的情况。在5xfad小鼠的脑切片中iba-1和gfap的免疫染色显示,与tg-载体处理的5xfad小鼠组相比,nd1和nd23处理以剂量依赖性方式降低活化的gfap和反应性iba-1阳性细胞计数(图34a-34c)(图35a-35c)。总之,这些结果表明nd1、nd23和nd15具有减少3xtg-ad和5xfad小鼠模型中的神经炎症的潜力。结论:本发明提供了包含黄连、黄柏、栀子、丹参、钩藤和延胡索的提取物的组合物,以及该组合物用于治疗ad的用途。如体外和体内研究所证明,本发明的组合物显示出减少tau蛋白病理和aβ病理。本发明人的研究首次揭示了本发明组合物的口服饲料混合物分别在5xfad小鼠和3xtg-ad小鼠减少tau蛋白病理和aβ病理并增强记忆保持功能。在一个优选的实施方案中,配方nd1、nd23和nd15在小鼠模型中减少tau蛋白病理和aβ病理并增强记忆保留功能。此外,本发明人已经证实,本发明组合物的活性成分可穿过血脑屏障,是大脑可渗透的。不仅活性成分可到达大脑,而且nd还具有外周治疗模式。在另一实施方案中,本发明组合物配制成保健食品补充剂或药物以预防或治疗ad。在另一个实施方案中,提供了本发明组合物用于治疗阿尔茨海默病的用途。工业适用性本发明提供了一种草药组合物,其通过靶向淀粉样蛋白-β(aβ)和与tau蛋白相关的神经原纤维缠结(nft)来治疗神经退行性疾病,具有显着的有效治疗效果。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- SeZn7MT3的组成、制备方法及其在防治阿尔茨海默症中的应用与流程
- 纤维支架材料、其制备方法、及亚甲蓝负载量的调节方法与流程
- 大驳骨在制备预防和/或治疗神经退行性疾病的药物中的应用及药物的制造方法与工艺
- 花叶假杜鹃在制备预防和/或治疗神经退行性疾病的药物中的应用及药物的制造方法与工艺
- 大脑内稳态调节蛋白的组成、制备方法及其在防治阿尔茨海默症中的应用与流程
- 一种药物组合物及其制备方法和在制备防治神经退行性疾病的药物中的应用与流程
- 片层碳‑四氧化三铁复合体在抑制Aβ聚集中的应用的制造方法与工艺
- 一种干细胞球切割收集装置及干细胞球的切割分离传代方法与流程
- 一类抗氧化超短肽及其应用的制造方法与工艺
- 一种具有改善记忆功效的多肽及其分离制备方法和应用与制造工艺