一种预防和/或治疗缺血再灌注损伤的中药组合物的制作方法
本发明涉及中医药领域,具体涉及一种预防和/或治疗缺血再灌注损伤的中药组合物。
背景技术:
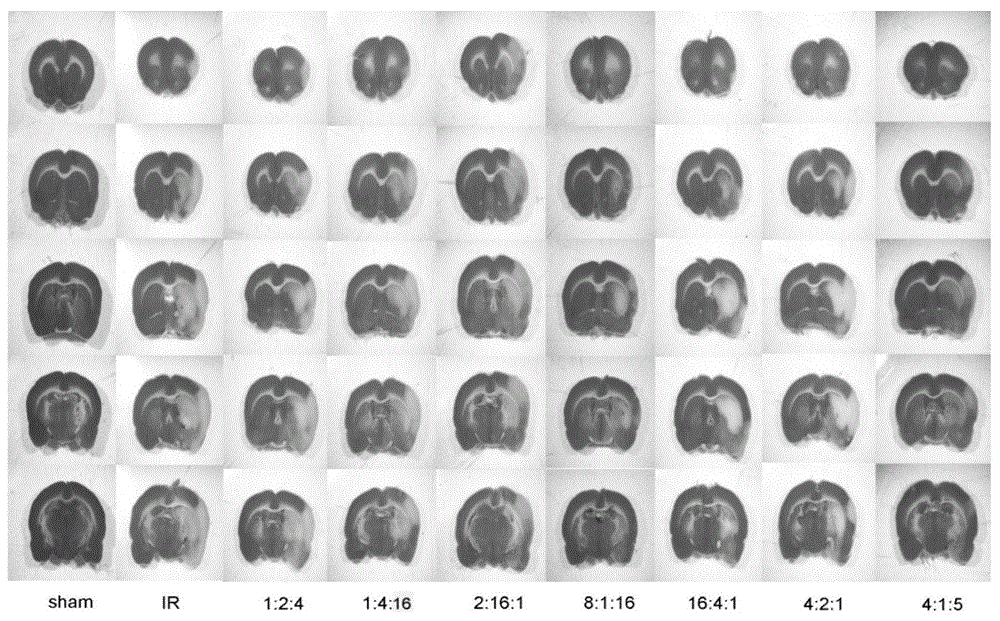
:1966年,jennings首先提出缺血再灌注损伤(ischemicreperfusioninjury)的概念:当组织细胞低灌流缺血后获得血液再供应时,不但未使组织细胞缺血性损害减轻或恢复,反而加重了缺血性损伤。它是高等动物机体缺血后再灌注发生的普遍现象。如心脏手术、冠脉搭桥、脏器血供梗塞后再通、器官移植以及休克脏器低灌流纠正后都可能发生再灌注损伤。其损伤的程度与缺血的时间、侧支循环的情况、需氧的程度、再灌注的条件等密切相关。对缺血性疾病的治疗,当然首要的是恢复血液灌注,目的在于解除组织的缺氧和营养物质供应不足的状态,以阻止缺血性损伤的发展或促使其恢复。近年来,随着休克治疗的进步以及动脉搭桥术、溶栓疗法、经皮腔内冠脉血管成形术、心脏外科体外循环、心肺脑复苏,断肢再植和器官移植等方法的建立和推广应用,使许多组织器官缺血后重新得到血液再灌注。大量临床实践证明,这种治疗在许多情况下都获得了较好的效果,因此,恢复血液灌注已成为治疗缺血性疾病的基本原则。相对应的,目前治疗缺血再灌注损伤的药物有自由基清除剂和抗氧化剂、钙拮抗剂和通道抑制剂、抗炎药物等等。丹参多酚酸,临床上使用的剂型是注射用丹参多酚酸,其作用是活血、化瘀、通脉。临床用于冠心病稳定型心绞痛,分级为ⅰ、ⅱ级,心绞痛症状表现为轻、中度,中医辨证为心血瘀阻证者,症见胸痛、胸闷、心悸。三七总皂甙(三七总皂苷),临床上剂型为注射用血塞通,其药理作用是:扩张冠脉和外周血管、降低外周阻力、减慢心率、减少和降低心肌耗氧量、增加心肌灌注量、增加脑血流量、对心肌和脑缺血有一定改善作用;具显著抑制血小板凝聚、降低血液粘稠度、抑制血栓形成的作用;此外,本品还具降血脂,抗疲劳,耐缺氧,提高和增强巨噬细胞功能等作用。临床上主要用于脑血管后遗症,视网膜中央静脉阻塞,眼前房出血等。黄芪总皂苷,临床上用于抗血栓形成,可以增强免疫、补中益气的作用。目前,尚未见到丹参多酚酸、三七总皂苷和黄芪总皂苷三者合用的报道。技术实现要素:本发明的目的,在于提供一种预防和/或治疗缺血再灌注损伤的中药组合物。该中药组合物由丹参多酚酸、三七总皂苷和黄芪总皂苷组成。丹参多酚酸、三七总皂苷和黄芪总皂苷的重量比为(1~16):(1~16):(1~16)。优选的,所述中药组合物中丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为(4~16):(1~8):(1~16)。进一步优选,所述中药组合物中丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为(4~16):(1~4):(1~16)。更进一步优选,所述中药组合物中丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为(4~8):(1~4):(1~16),或为(8~16):(1~4):(1~16)。再次优选,所述中药组合物中丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为(4~8):1:(5~16),或为(4~8):(1~2):(1~5)。效果最佳,所述中药组合物中丹参多酚酸(a)、三七总皂苷(b)、黄芪总皂苷(c)的重量比为4:1:5。本发明所用成分中:丹参多酚酸为提取物,含有丹酚酸b、丹参素钠、迷迭香酸、紫草酸和丹酚酸e,各成分的重量百分比分别为40-95%、20-95%、3-15%、2-10%和0.2-2.2%。丹参多酚酸可以由以下方法制备:丹参饮片用浓度为20-90%的乙醇提取,提取液浓缩至无醇,提取物经过聚酰胺层析,用水或浓度为30%以下的乙醇洗去杂质,以浓度为30-95%的乙醇或者浓度为0.05-0.3%的碳酸氢钠或者浓度为0.01-0.3%的碳酸钠洗脱,收集洗脱液,调ph1-5.5,通过弱极性或者非极性大孔树脂,水洗或20%以下乙醇洗去杂质,30-95%乙醇洗脱,收集洗脱液,浓缩,干燥,即得。三七总皂苷为提取物,含有的成分中:三七皂苷r1含量5-20%,人参皂苷rb1含量不少于20%,人参皂苷rd含量3-15%,人参皂苷rg1含量不少于30%,人参皂苷re含量不少于2%,五种皂苷含量总和不少于80%。三七总皂苷可以由以下方法制备:取三七药材,粉碎成粗颗粒,加入3-10倍量浓度为20-80%的乙醇回流提取两次,每次2-5小时,合并提取液,提取液减压浓缩至无醇,离心,上清液经大孔吸附树脂进行富集,3-10倍柱体积水洗去糖类成分和部分色素,继用5-10倍柱体积30-70%乙醇进行洗脱,收集醇洗脱液,减压浓缩至干粉,得三七总皂苷。黄芪总皂苷为提取物,黄芪总皂苷的重量百分含量为20-100%,其中黄芪甲苷含量为20-95%。黄芪总皂苷可以由以下方法提取:取黄芪饮片,粉碎成粗颗粒,用3-10倍量浓度为20-70%乙醇(含0.1-0.5%的碳酸氢钠)回流提取两次,每次2-5小时,合并提取液,提取液减压浓缩至药材2-5倍量体积,离心,上清液经大孔吸附树脂进行富集,先用2-8倍柱体积的浓度为0.1-1%的naoh溶液冲洗,再用2-8倍柱体积的浓度为20-60%乙醇洗脱,最后用2-8倍柱体积的浓度为70-95%乙醇进行洗脱,收集浓度为70-95%的乙醇洗脱液。再通过大孔树脂脱色,2-5倍柱体积的浓度为70-95%乙醇洗脱,收集流出液和洗脱液,减压浓缩至小体积,结晶析出固体,收集固体干燥,得黄芪总皂苷。本发明的另一目的是提供含该中药组合物的制剂,该制剂由中药组合物和药学上可接受的载体组成。所述药学上可接受的载体是指药学领域常规的药物载体,选自填充剂、粘合剂、崩解剂、润滑剂、增溶剂、助悬剂、润湿剂、色素、溶剂、表面活性剂或矫味剂中的一种或几种。所述填充剂选自淀粉、预胶化淀粉、糊精、葡萄糖、蔗糖、乳糖、乳糖醇、微晶纤维素、甘露醇、山梨醇或木糖醇;所述粘合剂选自羧甲基纤维素钠、羟丙甲基纤维素、乙基纤维素、聚维酮、淀粉浆、蔗糖、糖粉、胶浆、明胶或聚乙二醇;所述崩解剂选自交联羧甲基纤维素钠,交联聚维酮、低取代羟丙基纤维素或羧甲基淀粉钠或淀粉;所述润滑剂选自硬脂酸镁、滑石粉、微粉硅胶、peg4000、peg6000或月桂醇硫酸钠;所述增溶剂选自氢氧化钠、氢氧化钾、碳酸氢钠、葡甲胺、l-赖氨酸或l-精氨酸;所述助悬剂选自微粉硅胶、蜂蜡、纤维素或固态聚乙二醇;所述润湿剂选自甘油、吐温-80、乙氧基氢化蓖麻油或卵磷脂;所述溶剂选自乙醇、液态聚乙二醇、异丙醇、吐温-80、甘油、丙二醇或植物油,所述植物油选自大豆油、蓖麻油、花生油、调和油等;所述表面活性剂选自十二烷基苯磺酸钠、硬脂酸、聚氧乙烯-聚氧丙烯共聚物、脂肪酸山梨坦或聚山梨酯(吐温)等;所述矫味剂选自阿斯巴甜、蔗糖素、香精、甜菊素、安赛蜜、柠檬酸或糖精钠。本发明的另一个目的,在于提供该中药组合物的用途。其中一个用途,为本发明中药组合物在治疗和/或预防缺血再灌注损伤中的应用。本发明所述的缺血再灌注损伤,包括但不限于脑缺血再灌注损伤、心肌缺血再灌注损伤、肾缺血再灌注损伤、下肢缺血再灌注损伤、脊髓缺血再灌注损伤、视网膜缺血再灌注损伤、皮瓣缺血再灌注损伤等。本发明所述的缺血再灌注损伤,包括但不限于溶栓引起的缺血再灌注损伤,动脉搭桥术引起的缺血再灌注损伤,经皮腔内冠脉血管成形术引起的缺血再灌注损伤,心脏外科体外循环引起的缺血再灌注损伤,心肺脑复苏引起的缺血再灌注损伤,断肢再植和器官移植等引起的缺血再灌注损伤。本发明提供的中药组合物具有以下优点:本发明提供的中药组合物具有协同效果,可以治疗和/或预防缺血再灌注损伤,效果好,副作用少。附图说明图1a为各组大鼠再灌注24h后脑组织片ttc染色图像;图1b为是不同组ttc梗死面积的统计图;图2a、图2b分别表示了再灌注3h和24h后各组大鼠进行神经功能学评分的结果;图3为各组小鼠颈总动脉内血栓的动态变化。初始值是fecl3刺激前的基础值。10分钟表示的是fecl3刺激开始后10分钟(其中,fecl3滤纸包绕颈总动脉3分钟后去除)。4.5小时表示的是fecl3滤纸包绕血管开始后的4.5小时,也即给药开始的时间。5.5小时表示的是给药后1小时。6.5小时表示的是给药后2小时),24小时表示的是给药后24小时;图4为用激光多普勒血流量仪检测小鼠脑表面血流灌注的图像。初始值是fecl3刺激前的基础值。10分钟表示的是fecl3刺激开始后10分钟(其中,fecl3滤纸包绕颈总动脉3分钟后去除)。4.5小时表示的是fecl3滤纸包绕血管开始后的4.5小时,也即给药开始的时间。5.5小时表示的是给药后1小时。6.5小时表示的是给药后2小时),24小时表示的是给药后24小时;图5为给药后24小时脑组织中渗出的伊文斯蓝含量(evansblueleakage),图中:*与假手术组相比,p<0.05;#与tpa溶栓组相比p<0.05;n=6;图6为缺血半影区脑表面毛细血管后微静脉的血管通透性情况;图中:*与假手术组相比,p<0.05;#与tpa溶栓组相比p<0.05;n≤6;图7为给药后24小时脑血管周围水肿、微血管开放数及干湿重比的变化;图中:*与假手术组相比,p<0.05;#与tpa溶栓组相比p<0.05;n≤6;图8为给药后24小时后脑微血管内皮细胞缝隙连接蛋白的变化,脑血管内皮细胞细胞缝隙连接的透射电镜图像,箭头指示血管内皮细胞连接(tj)。右脑缺血半影区皮层zo-1,ve-cadherin,occluding和jam的蛋白质印迹及定量统计。图中:*与假手术组相比,p<0.05;#与本底组相比,p<0.05;与tpa溶栓组相比,p<0.05。电镜图像n=3,其余n≥6;图9为体外培养内皮细胞缺氧复氧后连接蛋白变化,脑微血管内皮细胞缺氧4.5小时,复氧同时给予tpa和/或t541,内皮细胞间的紧密连接claudin-5、jam-1和粘附连接ve-cadherin的蛋白质免疫印迹代表图及统计。缺氧/复氧,hypoxia/reoxygenation,h/r。图中:*与正常对照组相比,p<0.05vs;#与模型组相比,p<0.05。n≥4;图10为给药24小时后脑出血情况,给药24小时后脑出血和梗死代表图。取小鼠脑组织切成1毫米厚的薄片拍摄出血情况,迅速用ttc染液染色,记录梗死面积,其中图a为再灌注24小时后脑出血和梗死代表图,图b为血红蛋白分光光度测试盒检测各组右半脑组织中血红蛋白含量柱状图。图c为各组梗死面积统计。*与假手术组相比,p<0.05;#与本底组相比,p<0.05;与tpa溶栓组相比,p<0.05。n≥6;图11为给药24小时后脑缺血皮层基底膜及相关蛋白变化,图a,扫描电镜图示脑皮质血管基底膜变化,白色箭头指示。基底膜,basementmembrane,bm。n=3。图b,蛋白免疫印迹显示给药24小时后iv型胶原(collageniv)和层粘连蛋白(laminin)在右脑缺血半影区皮层的表达量。图c-d,iv型胶原(collageniv)和层粘连蛋白(laminin)的蛋白免疫印迹统计。*与假手术组相比p<0.05,#与本底组相比p<0.05,与tpa溶栓组相比p<0.05。n=6;图12为给药24小时后脑组织能量变化,图中:*与假手术组相比,p<0.05;与tpa溶栓组相比,p<0.05,n=6-7;图13为给药24小时后脑组织氧化应激损伤,图中:*与假手术组相比,p<0.05;与tpa溶栓组相比,p<0.05。n≥6;图14为给药24小时后脑组织atp5d含量变化,图中:*与假手术组相比,p<0.05;#与本底组相比,p<0.05;与tpa溶栓组相比,p<0.05。n=6;图15为给药24小时后脑组织细胞凋亡染色,其中,图a,第1行显示给药24小时半影区脑皮质的tunel染色。第2行显示给药24小时半影区脑皮质神经元凋亡的透射电镜代表图。图b,tunel阳性细胞计数统计。*与假手术组相比,p<0.05;#与本底组相比,p<0.05;与tpa溶栓组相比,p<0.05。n=6;图16为给药24小时后脑组织细胞凋亡情况,图中*与假手术组相比,p<0.05;#与tpa溶栓组相比,p<0.05。n=6;图17为体外培养内皮细胞缺氧/复氧后细胞凋亡情况,图中:*与正常对照组相比,p<0.05;#与模型组相比,p<0.05。n=6。具体实施方式实施例1:一种中药组合物丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为:1:2:4。实施例2:一种中药组合物丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为:1:4:16。实施例3:一种中药组合物丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为:2:16:1。实施例4:一种中药组合物丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为:8:1:16。实施例5:一种中药组合物丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为:16:4:1。实施例6:一种中药组合物丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为:16:8:4。实施例7:一种中药组合物丹参多酚酸、三七总皂苷、黄芪总皂苷的重量比为:4:1:5。实验例1:丹参多酚酸、三七总皂苷、黄芪甲苷比例筛选实验将三种药物根据均匀设计得到表1的前6组,剩余的一组是根据预实验结果计算得到,合计七个剂量组(比例):表1:丹参多酚酸、三七总皂苷、黄芪甲苷配比组别丹参多酚酸(a)三七总皂苷(b)黄芪总皂苷(c)11242141632161481165164164217415通过实验来验证7组的效果。每组总剂量为20mg/kg。1.实验方法1.1实验动物体重为270-290g的雄性spragu-dawley大鼠,购于北京大学医学部动物中心,合格证号:scxk(京)2006-0008。动物饲养在温度为22±2℃,湿度为40%±5%的条件下,自由饮食、饮水,12小时光照/黑暗交替。动物于实验前12小时,禁食自由饮水。1.2模型建立用线栓法造成大鼠大脑中动脉闭塞(middlecerebralarteryocclusion,mcao),建立大鼠大脑中动脉i/r型。详述如下,用复合麻醉剂实验前5分钟麻醉(腹腔注射),仰卧位固定大鼠,颈部正中去毛,75%酒精消毒,颈部行长度约3cm正中切口,沿胸锁乳突肌内缘分离肌肉和筋膜后,避开气管两侧甲状腺和其外上方甲状旁腺,小心分离出颈总、颈外和颈内动脉。6-0手术缝合线系于颈外动脉近心端,电凝颈外动脉及小分支。用微小动脉夹暂时夹闭颈内、颈总动脉,在颈外动脉上用显微手术剪剪一切口,将制备好的头端包有硅胶的栓线(线体直径0.38mm)经颈外动脉切口处缓慢插入颈内动脉至大脑中动脉起始处,堵塞大脑中动脉血液供应。进线长度约为距颈总动脉分叉处1.8cm-2.2cm。90min后,拔出栓线,缝合皮肤,建立大鼠脑i/r模型。模型建立后,各实验组分别给予上表中不同配比的中药组合物。假手术组采用同样的手术操作但不插入线栓。整个手术操作过程中维持大鼠肛温在(37.0±0.5℃),术后继续用加热毯维持大鼠肛温,直到恢复活动。24h后,再次麻醉大鼠并处死取材。1.3脑梗死区域染色用ttc(2,3,5-triphenyltetrazoliumchloride)染色方法检测i/r损伤后大鼠脑梗死。具体方法为:在再灌注24h后,取出各组大鼠的大脑,在脑定位器上由前向后切成5个薄片放入2%的ttc中在37℃下孵育15分钟,行ttc染色。非梗塞区被染成红色,梗塞区不着色仍为白色。拍摄脑片ttc染色图片,用图像分析软件iamgej(bethesda,md,usa)计算ttc染色梗死面积占全脑面积百分比值,评价脑梗死程度。1.4神经学评分在再灌注3h、24h,按照18分评分标准对各组大鼠进行神经学评分,见表2:表2:神经学评分18分改良小鼠神经学评分法(mnss),正常小鼠得分为0分,最大18分,得分越高表示神经缺损越严重,具体结果评价见表3表3:结果评价0分1-6分7-12分13-18分正常小鼠轻度损伤中等损严重损伤2.实验结果2.1ttc染色结果:见图1a和图1b。图1a是各组大鼠再灌注24h后脑组织片ttc染色图像。图中白色区域表示梗死区域。图1b是不同组ttc梗死面积的统计图(具体结果见表4)。与假手术组相比,i/r组大鼠右脑出现明显梗死。8:1:16、16:4:1、16:8:4及4:1:5四个配伍能减少脑梗死面积,其中8:1:16及4:1:5两个配伍能明显减少脑梗死面积(图1a,1b)。2.2神经学评分结果见图2a、图2b(分别表示了再灌注3h和24h后各组大鼠进行神经功能学评分的结果)和表4。表4.不同组大鼠的梗死面积、3小时和24小时的神经学评分(均值±标准误)注:*表示与假手术组比,p<0.05。#表示与缺血再灌注比,p<0.05。表示与1:2:4组比,p<0.05。表示与1:4:16组相比,p<0.05△表示与2:16:1组比,p<0.05。图2a、图2b和表4结果显示:与假手术组(control)相比,再灌注3h和24h,大鼠神经功能学评分显著降低,7个配伍组对再灌注3h的神经功能学评分的降低没有改善作用,但是,在再灌注24h,8:1:16、16:4:1、4:2:1、4:1:5四个配伍组能显著改善大鼠神经功能学评分。通过以上实验,可以得出当丹参多酚酸(a)、三七总皂苷(b)、黄芪总皂苷(c)三种药物的比例范围在(4~16):(1~8):(1~16),优选为(4~16):(1~4):(1~16)时,具有良好的改善缺血再灌注损伤的作用。以下实验以溶栓造成的缺血再灌注损伤为例,选取上述实验中所确定最优比例范围内的不同组别,考察本发明中药组合物对于溶栓后的缺血再灌注损伤的保护作用,以及促进溶栓的作用。但这并不造成对本申请的保护范围的限制,因为任何原因造成的缺血再灌注损伤,都会表现为自由基过多、细胞钙超载、炎症反应等,治疗方法也是一致的。本发明的实验证实了本申请的中药组合物可以治疗溶栓后引起的缺血再灌注损伤,也一样可以推导出本申请的中药组合物也可以治疗其他原因引起的缺血再灌注损伤。实验例2:对小鼠颈动脉血栓的促溶栓作用及溶栓后脑缺血再灌注损伤的保护作用1.动物实验模型建立及实验分组1.1动物模型建立体重为21±2克的雄性c57bl/6清洁级小鼠,购于北京大学医学部实验动物中心。动物饲养在温度23±2摄氏度,相对湿度45±5%的条件下,自由饮食饮水,12小时光照/黑暗交替。动物于实验前12小时,禁食并自由饮水。用戊巴比妥钠(2%,45毫克/千克)腹腔注射麻醉动物,颈部皮肤备皮消毒。做颈正中切口,暴露并分离颈总动脉,采用一个防水垫片隔离长约2.5-3毫米长的颈总动脉与周围组织。用浸润10%fecl3的滤纸包绕被分离的颈总动脉约1毫米宽,3分钟后除去滤纸,用0.9%的生理盐水清洗血管外侧。除去防水垫片。缝合颈部伤口。fe3+开始刺激定义为缺血开始,缺血10分钟后颈部血栓最大直径处堵塞血管,缺血15分钟后颈动脉远心端血流量小于基础值20%,且缺血4.5小时(即再灌注前)时血栓稳定,血栓面积直径最大处堵塞颈动脉血管直径60%及以上的动物入组。1.2实验分组1.2.1考察不同配比的本发明中药组合物对溶栓后缺血再灌注损伤的保护作用缺血4.5小时后,按照随机分组结果给予药物或生理盐水治疗。小鼠股静脉插管,左股静脉泵注tpa(组织型纤溶酶原激活物)或生理盐水,右股静脉泵注本发明中药组合物或生理盐水,总药量10%推注,剩余90%静脉持续泵注1小时,速度0.1毫升/小时。本发明中药组合物选取三个配比组,分别为:t541组(即黄芪总皂苷:丹参多酚酸:三七总皂苷=5:4:1);t141组(即黄芪总皂苷:丹参多酚酸:三七总皂苷=1:4:1);t582组(即黄芪总皂苷:丹参多酚酸:三七总皂苷=5:8:2)。依据随机数字表将c57bl/6小鼠分为以下10组:(1)假手术组,模型建立时用生理盐水替代fe3+刺激;(2)t541高剂量本底组(在假手术组的基础上给予t54120毫克/千克,简称本底组);(3)血栓组(给予等体积生理盐水);(4)t541高剂量溶栓组(单独给予t54120毫克/千克);(5)tpa溶栓组(给予tpa);(6)t541低剂量组(给予tpa+t5415毫克/千克);(7)t541中剂量组(给予tpa+t54110毫克/千克);(8)t541高剂量组(给予tpa+t54120毫克/千克)(9)t141组(给予tpa+t14112毫克/千克);(10)t582组(给予tpa+t58215毫克/千克)。其中tpa均给予临床等效使用剂量10毫克/千克。各组给药方式见表5。表5:动物实验分组方法及给药方式左股静脉给药右股静脉给药黄芪总皂苷:丹参多酚酸:三七总皂苷假手术组生理盐水生理盐水-t541高剂量本底组生理盐水t54120毫克/千克5:4:1血栓组生理盐水生理盐水-t541高剂量溶栓组生理盐水t54120毫克/千克5:4:1tpa溶栓组tpa10毫克/千克生理盐水-t541低剂量组tpa10毫克/千克t5415毫克/千克5:4:1t541中剂量组tpa10毫克/千克t54110毫克/千克5:4:1t541高剂量组tpa10毫克/千克t54120毫克/千克5:4:1t141组tpa10毫克/千克t14112毫克/千克1:4:1t582组tpa10毫克/千克t58215毫克/千克5:8:2左股静脉给予tpa临床等效使用剂量10毫克/千克或等体积生理盐水对照。右股静脉分别给予几组本发明中药组合物,分别为t541低、中、高剂量组、t141组、t582组或等体积生理盐水对照。其中,t541低剂量组、中剂量组、高剂量组以及t141组、t582组采用与tpa同时给药的形式,这样既可以评价本发明中药组合物的促溶栓作用,也可考察本发明中药组合物对于溶栓造成的缺血再灌注损伤的治疗作用,动物实验中各观测指标及各组动物使用数量见表6。表6.动物实验中各观测指标及各组动物使用数量24小时生存率及神经学评分各组数量不小于6,血栓观察、氯化三苯基四氮唑(triphenyltetrazoliumchloride,ttc)梗死面积染色、脑血流量及出血情况观察各组数量为6。选取假手术组、t541高剂量本底组、tpa溶栓组和最佳药物浓度组进行下一步观察。伊文斯兰渗出、微循环动态可视化观察、模型侧脑干湿重比和分子生物学指标检测各组数量为6;免疫荧光染色和电镜动物各组数量为3。记录小鼠再灌注后24小时生存率、神经学缺陷评分、颈动脉血栓面积变化和脑血流量灌注情况变化;选取最佳药物浓度进行下一步分析。再灌注24小时后采用正置显微镜动态微循环观测系统观察小鼠脑微循环动态变化,记录大脑中动脉区域、前动脉区域和脑表面毛细血管后微静脉的白蛋白渗出情况。再灌注24小时后处死小鼠取脑,观察脑组织出血情况和梗死面积大小,测量出血后脑组织中血红蛋白含量;检测脑组织干湿重比和伊文斯兰渗出程度,反映组织水肿情况;脑组织tunel染色观察细胞凋亡严重程度;连接蛋白occludin、claudin-5、jam-1、zo-1、ve-cadherin及基底膜成分层粘蛋白laminin蛋白质免疫印迹分析和部分连接蛋白及laminin免疫荧光染色,观察血管损伤时血脑屏障变化状态;扫描电镜和透射电镜检测脑缺血再灌注后结构变化;酶联免疫吸附测定脑组织mda、8-ohdg、atp/adp/amp及线粒体复合物i、ii和iv活性的变化。1.2.2对比本发明中药组合物与拆方后各组分对颈总动脉血栓溶栓后再灌注损伤的治疗作用为比较本发明中药组合物与拆方后各单独组分(黄芪总皂苷、丹参多酚酸、三七总皂苷)或两两配伍组对tpa溶栓引起的再灌注损伤的治疗作用,本实验采用了tpa联合t541及t541中各单独成分或两两配伍的组别,分别为tpa+黄芪总皂苷(tpa+hq)、tpa+丹参多酚酸(tpa+ds)、tpa+三七总皂苷(tpa+sq)、tpa+黄芪总皂苷+丹参多酚酸(tpa+hq+ds)、tpa+黄芪总皂苷+三七总皂苷(tpa+hq+sq)、tpa+丹参多酚酸+三七总皂苷(tpa+ds+sq)和tpa+t541。具体分组见表7。生理盐水为等体积对照。各组使用数量均为6。表7.t541拆方分组情况及各组给药情况左股静脉给药右股静脉给药数量假手术组生理盐水生理盐水6t541高剂量本底组生理盐水t54120毫克/千克6tpa溶栓组tpa10毫克/千克生理盐水6tpa+hq溶栓组tpa10毫克/千克黄芪总皂苷10毫克/千克6tpa+sq溶栓组tpa10毫克/千克三七总皂苷2毫克/千克6tpa+ds溶栓组tpa10毫克/千克丹参多酚酸8毫克/千克6tpa+hq+sq溶栓组tpa10毫克/千克黄芪总皂苷10毫克/千克,三七总皂苷2毫克/千克6tpa+hq+ds溶栓组tpa10毫克/千克黄芪总皂苷10毫克/千克,丹参多酚酸8毫克/千克6tpa+sq+ds溶栓组tpa10毫克/千克三七总皂苷2毫克/千克,丹参多酚酸8毫克/千克6t541高剂量组tpa10毫克/千克t54120毫克/千克6合计541.3细胞实验流程、分组及观测指标1.3.1细胞实验流程及分组建立大鼠脑内皮细胞缺氧复氧模型:大鼠脑内皮细胞购自atcc公司,正常培养传代至5至6代后进行实验。分为(1)正常对照组;(2)模型组:缺氧4.5小时,复氧3小时,复氧开始时加tpa20微克/毫升处理;(3)t541高剂量给药组:缺氧4.5小时,复氧3小时,复氧开始时加tpa20微克/毫升和t541400微克/毫升处理;(4)t541次高剂量给药组:缺氧4.5小时,复氧3小时,复氧开始时加tpa20微克/毫升和t54140微克/毫升处理;(5)t541中剂量给药组:缺氧4.5小时,复氧3小时,复氧开始时加tpa20微克/毫升和t5414微克/毫升处理;(6)t541次低剂量给药组:缺氧4.5小时,复氧3小时,复氧开始时加tpa20微克/毫升和t5410.4微克/毫升处理;(7)t541低剂量给药组:缺氧4.5小时,复氧3小时,复氧开始时加tpa20微克/毫升和t5410.04微克/毫升处理。用cellcountingkit-8(简称cck-8,medchemexpress,中国)试剂盒测试不同药物处理下细胞活力与正常组细胞的差异。实验中分组为(1)正常对照组;(2)t541高剂量药物本底组:正常细胞加t541400微克/毫升处理3小时;(3)次高剂量药物本底组:正常细胞加t54140微克/毫升处理3小时;(4)中剂量药物本底组:正常细胞加t5414微克/毫升处理3小时;(5)次低剂量药物本底组:正常细胞加t5410.4微克/毫升处理3小时;(6)低剂量药物本底组:正常细胞加t5410.04微克/毫升处理3小时。1.3.2细胞实验观测指标用cell-countingkit8(cck8)测试细胞活性,反映不同浓度的药物对于正常内皮细胞的影响;检测连接蛋白claudin-5(紧密连接蛋白-5)、jam-1(连接黏附分子一型蛋白)、ve-cadherin(血管内皮细胞钙粘连蛋白)含量变化;部分连接蛋白及细胞骨架f-actin免疫荧光染色;蛋白质免疫印迹分析检测凋亡相关蛋白bax(b细胞淋巴瘤2相关x蛋白)、bcl-2(b细胞淋巴瘤-2)含量变化;蛋白质免疫印迹分析检测基质金属蛋白酶(mmp)-3及其前体pro-mmp-3的含量变化。2.试验方法2.1小鼠颈部血栓观察采用正置显微镜动态观察小鼠颈动脉血栓。麻醉小鼠仰卧位置于鼠板上,做颈正中切口,暴露并分离颈总动脉,股静脉给予吖啶红荧光标记血小板,观察缺血前(即基础值)、缺血10分钟、缺血4.5小时(即再灌注前)、再灌注1小时、再灌注2小时及再灌注24小时小鼠颈动脉血栓变化。缺血前(即基础值)无血栓,缺血10分钟血栓最大直径处堵塞血管,缺血15分钟颈动脉远心端血流量降低为基础值20%以下,且缺血4.5小时(即再灌注前)时血栓稳定,血栓面积堵塞颈动脉血管面积60%及以上为颈动脉血栓模型成功标准,入组成功率达90.9%。除假手术组和各本底组外,其余各组为模型成功后随机分组。2.2脑血流量测定用连接计算机的激光多普勒血流灌注成像仪测定左右两侧大脑中动脉支配区域脑皮质血流量。麻醉小鼠俯卧位置于鼠板上,剪开左右侧顶骨上的皮肤使顶骨完全暴露,将连接计算机的低能量氦-氖激光器探头置于顶骨上16-18厘米处,检测缺血前(即基础值)、缺血10分钟、缺血4.5小时(即再灌注前)、再灌注1小时、再灌注2小时及再灌注24小时小鼠左右侧大脑中动脉血液供应区软脑膜血流量。用脑血流量分析软件ldpiwin3.1(periscanpim3system,perimed,stockholm,瑞典)计算左右侧mca支配的同样大小区域的脑皮质血流量。2.3神经学评分在再灌注24小时,按照15分评分标准(garciajhetal.stroke.1995;26:627–634.)稍作修改,对各组小鼠进行神经学评分:小鼠自主活动能力:将小鼠放在25×15厘米鼠笼中,记录其在3分钟内的活动轨迹,小鼠基本不活动记为0分,极少活动且未触碰鼠笼任何壁为1分,触碰任何一壁或为两壁为2分,触碰三壁及以上记为3分;小鼠肢体对称性实验,将小鼠尾巴提起,观察左右身体活动轨迹,左右完全不对称为0分,几乎不对称为1分,中等程度不对称为2分,几乎对称3分;开野试验测定实验,观察小鼠自由运动轨迹,不活动者为0分,原地转圈为1分,偏向一侧曲线运动为2分,直线运动为3分;平衡木实验,在距离地面10厘米处放置50×5×2厘米木条,将小鼠放在一端,观察其在平衡木上运动轨迹,小鼠从平衡木上掉下来记为0分,悬挂在平衡木上记为1分,在平衡木上站立但运动很少记为2分,在平衡木上运动记为3分;小鼠触须触摸实验,用小木棒触摸小鼠左右两侧触须,与右侧相比,左侧不反应者记为1分,左侧微弱反应记为2分,两侧反应相同记为3分。小鼠神经学评分计算以上五个实验单项得分总和,15分为正常小鼠,0分表示小鼠死亡。另一种评分方法介绍。改良神经损伤严重程度评分(modifiedneurologicalseverityscores,mnss),0-18分。评分方法参照实验例1中的1.4部分。2.4脑出血情况及梗死面积测定再灌注24小时,用4摄氏度预冷的pbs缓冲液由心脏灌流小鼠,开颅取脑,在脑立体定位器中由前向后切成5个薄片,用体视摄影显微镜迅速拍摄出血情况,置于-80摄氏度保存,用血红蛋白分光光度测量试剂盒测量血红蛋白含量。再灌注24小时,用4摄氏度预冷的pbs缓冲液由心脏灌流小鼠,开颅取脑,在脑立体定位器中由前向后切成5个薄片,在低温条件下迅速拍照记录出血情况,放入2%的氯化三苯基四氮唑(triphenyltetrazoliumchloride,ttc),中在37摄氏度下孵育15分钟,行ttc染色。非梗塞区被染成红色,梗塞区不着色仍为白色。拍摄脑片ttc染色图片,用图像分析软件imagej(bethesda,md,美国)计算ttc染色梗死面积占全脑面积百分比值,评价脑梗死程度。2.5微循环观察、伊文斯蓝渗出测定及脑组织干湿重比测定血浆白蛋白漏出:在体视显微镜下,行小鼠股静脉插管(pe/08,外径0.36毫米,内径0.20毫米)。小鼠以俯卧位固定在小鼠脑微循环观察板上,剪去小鼠颅顶皮肤,暴露右侧顶骨,在体视显微镜下,用手提式颅钻将整个顶骨磨薄,直至顶骨只剩一层柔软的骨皮质。将fitc标记的血浆白蛋白(激发波长420-490纳米,发射波长520纳米)按50毫克/千克用量,经股静脉缓慢推注。10分钟后,在连接超敏感荧光ccd的正立荧光显微镜下,记录再灌注24小时后,小鼠脑表面直径30-50微米之间的毛细血管后微静脉、大脑中动脉支配区域动脉、大脑前动脉支配区域动脉的荧光图像,分析血浆白蛋白的漏出情况。用图像分析软件imagej(bethesda,md,usa)计算细静脉血管内(iv)及血管外(ii)的荧光强度,血浆白蛋白漏出量用ii/iv表示。伊文斯蓝渗出:再灌注21小时后,将溶解于生理盐水的伊文斯蓝染料(2%,4毫升/千克)经股静脉缓慢推注至小鼠体内。3小时后,心脏灌注生理盐水15-20毫升(右心耳流出液体为无色时停止灌流),随即取脑至4%多聚甲醛中固定3小时,拿出后将脑切成5片,拍照并分开左右脑分别称重。将左右脑分别加入含有1毫升50%三氯乙酸ep管中,匀浆,离心取上清。配置伊文斯蓝标准品,用多功能酶标仪检测伊文斯蓝含量(激发光620纳米,发射光680纳米)。用每克脑组织中含有的伊文斯蓝微克数表示伊文斯蓝含量。脑组织干湿重比:再灌注24小时后,立即麻醉小鼠,断头取脑,左右脑分别称重(记为湿重)。随后将脑置于60摄氏度干燥箱中放置72小时烘干,并称重(记为干重)。小鼠脑干湿重比按照(湿重-干重)/湿重×100%计算。2.6电镜观察透射电镜:在再灌注24小时后,麻醉小鼠经左心室以3毫升/分钟的速度灌注3%戊二醛40分钟,取脑,切小鼠右侧皮质成1毫米×1毫米×1毫米小块,3%戊二醛室温后固定30分钟或4摄氏度过夜。蔗糖于摇床上冲洗3次×15分钟;锇酸室温固定2小时;0.2摩尔/升pbs冲洗3次×5分钟;30%、50%、70%和90%丙酮分别脱水15分钟,100%丙酮脱水3次×5分钟;100%丙酮与包埋剂1:1混合的预包埋剂中预浸,37摄氏度过夜;纯包埋剂浸润,37摄氏度24小时后60摄氏度固化48小时,自然冷却;包埋剂结束后修块、切片,切片厚度为60nm。用醋酸铀和柠檬酸铅对超薄片进行染色,在透射电镜(jem1230,jeol,tokyo,japan)下观察、拍片。扫描电镜:在再灌注24小时后,麻醉小鼠经左心室以3毫升/分钟的速度灌注3%戊二醛40分钟,取脑,切取右侧皮质半影区,置于戊二醛中后固定2小时。pbs磷酸盐缓冲液冲洗后,在1%四氧化锇中后固定2小时,取合适剖面固定于金属托上。组织块镀金,并在扫描显微镜(jsm-5600lv,jeol,tokyo,japan)下观察、拍片。2.7蛋白质免疫印迹分析及酶联免疫吸附实验再灌注24小时,用生理盐水心脏灌流动物,取右脑皮质梗死半影区进行蛋白质免疫印迹分析。灌流后取出小鼠脑组织,切去小脑和前额叶,沿矢状位切去右脑靠近左右半脑中缝1厘米的脑组织,剩余组织沿45度角切取梗死半影区,剥下半影区脑皮质,低温保存。取右脑皮质,加入1×ripa裂解液及cocktail蛋白酶抑制剂(1:100,cellsignalingtechnology,美国)充分裂解后超声,17000g离心30分钟。取上清,按体积加入5×上样缓冲液,在沸水中煮沸20分钟,放入-80摄氏度保存。取多余上清用bca蛋白定量液(thermoscientific,美国)蛋白定量,在酶标仪560纳米处测定吸光度值,根据标准曲线计算出蛋白浓度。在每个聚丙烯酰胺凝胶孔里加入等量的各组蛋白,浓缩胶80v分离胶100v恒压电泳分离,将分离好的蛋白条带通过电转转移至pvdf膜上(millipore,美国),220毫安120分钟转膜。膜在5%的脱脂奶中室温封闭1小时,去除非特异性结合位点后,加入用5%脱脂奶粉稀释的一抗β-actin、claudin-5、occludin、zo-1(abcam,美国),ve-cadherin、jam-1、mmp-3(santacruzbiotechnology,美国),caveolin-1(cellsignalingtechnology,美国),bcl-2、bax、laminin,4摄氏度孵育过夜。隔天用tbst10分钟×3次洗膜后,加入用5%脱脂奶粉稀释的二抗室温孵育1小时,加发光剂(普利莱,中国)显色,暗室中显影。用图像分析软件quantityone分析电泳条带密度值。所有蛋白条带大小均为与内参β-actin或总目的蛋白所比而得的相对值表示。使用酶联免疫吸附试剂盒测定模型侧脑组织皮质半影区mda(丙二醛)、8-ohdg(8-羟基-2′-脱氧鸟苷)、atp(三磷酸腺苷)、adp(腺苷二磷酸)、amp(腺苷一磷酸)的含量变化及线粒体复合物i、ii、iv、v的活性变化。每组数据至少使用六个样本进行至少重复三次的独立实验。2.8免疫荧光染色实验再灌注24小时,用4摄氏度预冷的pbs缓冲液由心脏灌流小鼠,开颅取脑,后固定12小时,30%蔗糖脱水后,otc包埋,用冰冻切片机(cm1800,leica,bensheim,germany)切成10微米厚冰冻切片,风干后,置入0.1摩尔/升pbs洗片5分钟,600瓦,90摄氏度条件下,在微波炉内用0.01摩尔/升的枸橼酸钠进行抗原修复10分钟,室温自然冷却2小时。pbst37摄氏度恒温恒湿1小时破膜后,pbs缓冲液冲洗5分钟×3次,胃蛋白酶消化15分钟,pbs缓冲液再次冲洗5分钟×3次。羊血清封闭30分钟后,pbs缓冲液冲洗5分钟×3次,加一抗vwf(1:100,millipore,temecula,ca,usa)+jam-1/occludin/laminin(1:50,invitrogen,camarillo,ca,usa),4摄氏度过夜。隔天取出复温1小时,pbs缓冲液冲洗5分钟×3次,加入二抗2小时后,再加入hoechst33342(1:100,molecularprobes)标记细胞核,室温下避光孵育10分钟。用抗荧光淬灭封片剂进行封片。用激光扫描共聚焦显微镜(tcssp5,leica,mannheim,germany),在63倍物镜下观察和拍照。2.9统计分析所有数据用mean±sem表示,用graphpadprism6.0统计软件,one-wayanova或two-wayanova(脑血流量、神经学评分)的方法对数据进行统计,组间两两比较用bonferroni矫正,p<0.05表示差异具有统计学意义。3.实验结果3.1颈动脉血栓变化3.1.1各组小鼠颈总动脉内血栓的动态变化:见图3图3结果显示:与假手术组相比,其他各组的血栓在fecl3滤纸刺激后10分钟,都见可观察到颈总动脉内的血栓形成,在4.5小时血栓稳定。tpa给药后,血栓被部分地溶解,但是,在24小时后,仍可观察到颈动脉内的血栓。t541剂量依赖地增加了tpa的溶栓效果,特别是大剂量的t541与tpa联用时,溶栓效果明显增加,在给药后1小时,颈动脉内的血栓就明显的溶解了。3.1.2各个时间点的血栓面积:见表8表8.不同时间点血栓面积数据(n=6)注:*与假手术组相比,p<0.05;#与血栓组相比,p<0.05;与tpa溶栓组相比,p<0.05;与t541低剂量组相比,p<0.05;$与t541中剂量组相比,p<0.05。表8结果显示:与血栓组相比,tpa组在24小时,血栓面积明显减少。单纯地给予t541,没有显示出溶栓作用。但是,与tpa联用时,t541低、中、高三个剂量组,在1小时开始,就增加了tpa的溶栓效果。而,t141组和t582组增加溶栓效果的作用不佳。3.2脑血流量灌注激光多普勒血流量仪检测小鼠脑表面血流灌注的结果见图4和表9表9.不同时间点各组小鼠脑血流量数据(n=6)注:*与假手术组相比,p<0.05;#与血栓组相比,p<0.05;与tpa溶栓组相比,p<0.05;与t541低剂量组相比,p<0.05。表9结果显示:各组小鼠在初始条件下脑表面血流量无差异,且左右半脑血流量分布均匀。除假手术组外,各组小鼠在颈动脉血栓建立10分钟的患侧脑表面血流量明显下降,且4.5小时脑血流量仍无恢复。单纯地给予t541高剂量和tpa,脑血流量没有明显的恢复。中剂量的t541与tpa联合使用,在给药后24小时,小鼠脑血流量明显的恢复。高剂量的t541与tpa联合使用,在给药后2小时,脑血流量明显地高于tpa组,24小时后的脑血流量明显高于高剂量的t541与tpa联合使用组。而t141和t582联合tpa组的脑血流量没有明显的恢复。3.3生存率、神经学评分3.3.1各组小鼠给药后24小时的生存率表10.各组小鼠生存率(%)24小时内变化注:*与假手术组相比,p<0.05;#与血栓组相比,p<0.05;与tpa溶栓组相比,p<0.05;与t541低剂量组相比,p<0.05;$与t541中剂量组相比,p<0.05。表10结果显示:假手术组和本底组,在观察期间内没有死亡。血栓组在给药后18和24小时的生存率均为81.82%。t541高剂量溶栓组的24小时生存率为90%。tpa给药后的24小时生存率为50%,t541的低剂量和中剂量没有改善tpa引起的24小时生存率的降低。t541高剂量的24小时生存率为81.82%,与血栓组比较生存率明显提升(81.82%vs50%)。t141和t582也没有改善tpa引起的的生存率降低。3.3.2给药后24小时神经学缺陷评分采用的是18分改良小鼠神经学评分法(正常小鼠得分为0分,得分越高表示神经缺损越严重);15分评分标准(15分为正常小鼠,0分表示小鼠死亡)。表11.各组小鼠给药后24小时神经学缺陷评分表注:*与假手术组相比,p<0.05;#与血栓组相比,p<0.05;与tpa溶栓组相比,p<0.05;与t541低剂量组相比,p<0.05。表11结果显示:与假手术组和本底组相比,血栓组小鼠24小时的神经学平分,分别为9.82(18分改良学评分)和6.2(15分评分)。t541高剂量组为4(18分改良学评分)。tpa没有改善神经学评分。t541的低、中、高剂量组都明显地改善了神经学评分,高剂量的作用明显地优于低剂量。通过生存率、神经学缺陷评分、颈部血栓面积和脑血流量灌注情况选取t541高剂量组为最佳药物使用浓度,进行进一步分析。3.4伊文斯兰渗出、脑微循环损伤及血管周围水肿3.4.1伊文斯兰渗出:图5和表12结果显示:在给药后21小时时小鼠静脉给予伊文斯蓝全身循环,3小时后生理盐水冲去血管循环中的伊文斯蓝,取脑后切成1毫米厚的薄片观察渗入到脑组织中的伊文斯蓝。tpa溶栓组脑组织有明显的伊文斯蓝渗出,相比假手术组,含量检测也有同样的结果,渗出的伊文斯蓝含量可以被20mg/kg的t541抑制。tpa溶栓组伊文斯兰蓝渗出明显,该渗出可以被高剂量t541联合使用减弱。3.4.2缺血半影区脑表面毛细血管后微静脉的血管通透性情况:图6和表12结果显示:溶栓给药后24小时后,用动态可视化方法观察小鼠活体状态下缺血半影区脑表面毛细血管后微静脉的血管通透性情况。观察30分钟内血管内白蛋白漏出情况。tpa溶栓组血浆白蛋白明显地渗出,t541高剂量组可以显著地抑制血浆白蛋白的渗出。3.4.3给药后24小时脑血管周围水肿、微血管开放数及干湿重比:透射电镜图像显示,假手术组和t541高剂量本底组血管结构完整,血管内皮光滑连续,与周围组织紧密相连。tpa溶栓组中血管内皮粗糙,与周围组织间有明显水肿空隙,周围组织线粒体水肿。t541高剂量组血管内皮相对光滑,血管周围水肿显著减少,线粒体结构致密,血管周围组织内也无水肿空隙。(见图7的第一、二行图)扫描电镜显示:假手术组和t541高剂量本底组脑皮质整体结构平整,血栓形成4.5小时后给予tpa后24小时,脑皮质整体组织结构紊乱表面凹凸不平,联合给予t541明显改善整体组织状态。随机选取5个视野计数不同组别动物脑皮质血管开放数,可见tpa溶栓组与假手术组和t541高剂量本底组相比,脑组织血管数显著减少。扫描电镜下每只小鼠随机选取5个500倍视野,计数右脑半影区脑皮质微血管开放数。n=3。(见图7的第三、四行图)表12.脑组织伊文斯兰含量、白蛋白渗出比值、干湿重比注:*与假手术组相比,p<0.05;#与tpa溶栓组相比,p<0.05。n≤6。表12和图7的柱状图显示:给药后24小时,脑组织伊文斯蓝、血浆白蛋白渗出、干湿重比的统计结果。tpa可引起伊文斯蓝渗出、血浆白蛋白渗出增加,脑微血管开放数减少,干湿重比的增加。t541可以抑制tpa引起的上述变化。该结果提示,tpa溶栓可以引起脑微血管渗出和脑水肿,而t541可以抑制tpa引起的脑微血管渗出和脑水肿。3.5给药后24小时脑微血管内皮细胞缝隙连接蛋白变化t541可改善半影区脑皮质给药后24小时后脑微血管内皮细胞缝隙连接蛋白的变化。透射电镜显示tpa溶栓组半影区脑皮质血管紧密连接结构打开,t541联合tpa使用可以使得打开的内皮细胞连接结构关闭,恢复细胞正常连接。(见图8)蛋白免疫印迹检测右脑皮质半影区中连接蛋白含量变化(见图8,表13),发现紧密连接蛋白zo-1、occludin、jam和粘附连接蛋白ve-cadherin在tpa溶栓组中均显著下降,该下降可以被t541联合tpa使用逆转。表13.给药后24小时脑组织连接蛋白定量统计数据注:*与假手术组相比,p<0.05;#与本底组相比p<0.05;与tpa溶栓组相比,p<0.05。图8和表13结果提示:血栓形成4.5小时给予tpa溶栓后24小时,脑血管内皮间的紧密连接和与基底膜间的粘附连接均明显下降,血管结构不完整,可能导致后续的血管通透性增加,血管外渗出增加,进而增加潜在出血风险。t541可以抑制tpa引起的脑血管内皮细胞缝隙连接蛋白损伤。3.6体外培养内皮细胞缺氧复氧后连接蛋白变化:见图9和表14为研究tpa和t541对血脑屏障,特别是血管内皮细胞和基底膜的影响,体外培养了大鼠脑微血管内皮细胞,缺氧4.5小时处理,复氧3小时,模拟体内缺血、溶栓后再灌注状态,复氧同时给予tpa及t541治疗。用cck8试剂盒测试正常细胞和正常细胞给予不同浓度t541的活性变化,结果发现:除了t541高剂量药物本底组对内皮细胞活性有抑制作用,其他t541组对内皮细胞活性与正常对照相比无明显差异。在体外培养的脑内皮细胞中,缺氧/复氧后给予tpa治疗引起连接蛋白ve-cadherin、claudin-5和jam-1含量的下降,不同浓度的t541(400,40,4,0.40.04μg/ml)可以不同程度恢复连接蛋白表达量,其中40μg/mlt541对ve-cadherin、claudin-5和jam-1蛋白量的降低都有恢复作用。t541与tpa联用可以细胞连接蛋白含量降低,有助于维持内皮细胞的正常细胞形态。t541可改善体外培养内皮细胞缺氧/复氧(hypoxia/reoxygenation,h/r)后连接蛋白变化损伤表14体外培养内皮细胞缺氧复氧后连接蛋白定量统计数据*与正常对照组相比,p<0.05vs;#与模型组相比,p<0.05。n≥4。蛋白免疫印迹检测显示(图9和表14):体外培养脑微血管内皮细胞,在经历缺氧复氧和tpa损伤后细胞紧密连接蛋白claudin-5、jam-1和粘附连蛋白接ve-cadherin表达量下降,与体内实验脑皮质组织的细胞连接蛋白含量变化一致,该降低的表达可以被t541和tpa联合使用,且根据使用药物的浓度依存性改善,其中40微克/毫升浓度的t541在细胞培养中对三种连接蛋白均有作用。上述结果提示t541可以通过改善脑血管内皮细胞的紧密连接和粘附连接蛋白,减少tpa损伤脑微血管,降低渗出、水肿风险。3.7脑出血及基底膜主要蛋白变化3.7.1脑组织中血红蛋白含量及梗死面积变化:见图10和表15表15.脑组织中血红蛋白含量及梗死面积*与假手术组相比,p<0.05;#与本底组相比,p<0.05;与tpa溶栓组相比,p<0.05。n≥6。将各组小鼠脑组织切成1毫米厚的薄片,可以观察到tpa溶栓组模型侧脑皮层和实质区域有出血和梗死,该现象可以被联合使用t541和tpa减轻(见图10)。取各组小鼠右侧半脑组织检测出血情况,发现tpa溶栓组血红蛋白含量明显上升,而t541高剂量组降低了升高的血红蛋白含量,可以恢复到假手术组和本底组水平(见图10和表15)。3.7.2给药24小时后脑缺血皮层基底膜变化:见图11和表16表16给药后24小时脑组织中基底膜主要蛋白表达统计结果*与假手术组相比,p<0.05;#与本底组相比,p<0.05;与tpa溶栓组相比,p<0.05。图11和表16结果显示:蛋白免疫印迹检测右脑皮质半影区中基底膜的主要成分iv型胶原(collageniv)和层粘连蛋白(laminin)含量变化,发现collageniv和laminin表达量在tpa溶栓组中明显下降,该下降可以被t541联合tpa使用逆转(见图11)。提示缺血4.5小时给予tpa溶栓后24小时,不仅脑血管的紧密连接和粘附连接下降,还会减少collageniv和laminin的表达,影响内皮细胞和基底膜正常结构,破坏血脑屏障,可能tpa造成出血风险增加的重要原因。联合使用tpa和t541可以维持collageniv和laminin的表达,降低溶栓后出血风险。3.8给药后24小时脑组织能量变化:见图12和表17表17.给药后24小时脑组织中atp、adp、amp含量*与假手术组相比,p<0.05;;与tpa溶栓组相比,p<0.05。取t541的三种主要成分:黄芪总皂苷、丹参多酚酸、三七总皂苷单成分和两两组合分组与t541比较。用酶联免疫吸附实验检测给药后24小时缺血半影区脑皮质的atp,adp,amp含量变化,计算adp/atp和amp/atp比值。给药24小时后,tpa溶栓组的脑组织atp含量明显减少,adp和amp的含量增加,t541联合tpa使用可以恢复减少的atp,降低增加的adp和amp。adp/atp与amp/atp的比值在tpa溶栓组中增加,前者被t541联合tpa使用逆转,后者在tpa+黄芪组、tpa+三七组、两两给药组和tpa联合t541高剂量治疗组别中好转。3.9给药后24小时脑组织氧化应激损伤及细胞凋亡3.9.1给药后24小时脑组织中mda、8-ohdg含量及线粒体复合物活性t541改善缺血给药后24小时脑组织氧化应激损伤。取t541的三种主要成分:黄芪总皂苷、丹参多酚酸、三七总皂苷单成分和两两组合分组与t541比较。用酶联免疫吸附实验检测给药后24小时缺血半影区脑皮质的mda、8-ohdg含量变化及线粒体复合物(complex)i、ii、iv活性。表18.给药后24小时脑组织中mda、8-ohdg含量及线粒体复合物活性*与假手术组相比,p<0.05;与tpa溶栓组相比,p<0.05。图13(给药24小时后脑组织氧化应激损伤)和表18结果显示:t541高剂量组显著抑制tpa溶栓组增加的脑皮质半影区中丙二醛(mda)含量,tpa加单独黄芪、丹参、三七或加黄芪+丹参、黄芪+三七、丹参+三七两两配伍组效果均不如三味药联用的t541。同样的,t541高剂量组能明显抑制tpa溶栓组增加的脑缺血半影区皮质中8羟基脱氧鸟苷酸(8-ohdg),除了tpa+黄芪+三七组可以达到治疗效果外,其余tpa加黄芪、丹参、三七单味药或黄芪+丹参、丹参+三七两味药均不能达到显著效果。在线粒体复合物活性检测中,tpa溶栓后24小时线粒体复合物i、ii、iv的活性降低。tpa+丹参+三七组可以显著恢复溶栓后下降的线粒体复合物i活性,tpa+黄芪+三七可以恢复线粒体复合物ii活性,t541高剂量组可以同时恢复线粒体复合物i、ii、iv活性。而且t541高剂量组还可以将线粒体复合物i、ii、iv活性恢复到假手术组水平,这是单味药和两两配伍组别不能达到的效果。该实验结果提示t541中不同组分发挥不同作用,特别是在线粒体复合物活性改善方面各司其职。更有趣的是,即使单独使用黄芪总皂苷、丹参多酚酸、三七总皂苷单味药没有显著差异,配伍成t541联合使用时能够发挥减少脑组织中mda的增加、恢复线粒体复合物i、iv的活性的作用。表明多种药物配伍使用时不仅是简单相加的结果,而是产生了协同效应。3.9.2给药24小时后脑组织atp5d含量变化:见图14和表19表19.给药后24小时脑组织atp5d含量*与假手术组相比,p<0.05;#与本底组相比,p<0.05;与tpa溶栓组相比,p<0.05。n=6图14和表19结果表明:t541恢复给药后24小时脑组织中atp5d表达量降低。综上,小鼠右颈总动脉血栓形成4.5小时,tpa溶栓后24小时,小鼠缺血半影区脑皮层组织中不仅线粒体复合物i、ii、iv活性下降,atp5d的表达量也降低。细胞缺乏能量时会导致细胞骨架f-actin丧失结构、排列紊乱,进而引起内皮细胞间的紧密连接和与基底膜之间的粘附连接蛋白断裂、降解,形成血管周围渗出、水肿。t541不仅可以抑制线粒体复合物i/ii/iv的活性下降,也逆转了atp5d的低表达,加快线粒体复合物恢复,改善了氧化应激损伤。线粒体功能恢复进一步降低了tpa给药24小时之后的adp/atp、amp/atp的增加,改善了血管末端的能量供应,维持正常的血脑屏障。3.9.3给药24小时后脑组织细胞凋亡染色:见图15和表20表20.给药后24小时脑组织tunel阳性细胞统计*与假手术组相比,p<0.05;#与本底组相比,p<0.05;与tpa溶栓组相比,p<0.05。n=6图15和表20结果表明:溶栓给药后模型侧脑皮质中,tpa溶栓组明显有大量的tunel阳性细胞,联合使用t541后tunel阳性细胞数显著减少,可能意味着t541可以减少单纯tpa溶栓后的凋亡细胞数量(图15)。透射电镜有相似的结果,图中可见tpa溶栓组神经元胞体皱缩变形,细胞质中细胞器结构异常且密度明显增加,核膜凹凸不平,核内出现异染色质。使用t541后神经元基本恢复正常胞体密度,线粒体等细胞器结构恢复,核膜平滑。3.9.4给药24小时后脑组织细胞凋亡:见图16和表21表21.脑组织细胞凋亡蛋白bax、bcl-2定量组别(平均值±标准误)数量bcl-2baxbax/bcl-2假手术组61.00±01.00±01.00±0tpa溶栓组61.51±0.145.52±0.78*3.82±0.57*t541高剂量组61.41±0.121.43±0.20#1.14±0.24#tpa+黄芪组61.47±0.143.17±0.35*#2.32±0.39tpa+丹参组61.35±0.173.29±0.48*#2.65±0.48tpa+三七组61.17±0.204.10±0.93*4.09±1.34*tpa+黄芪+丹参组61.14±0.151.78±0.08#1.79±0.37tpa+黄芪+三七组61.12±0.032.68±0.24#2.37±0.16tpa+丹参+三七组61.43±0.102.01±0.10#1.43±0.12*与假手术组相比,p<0.05;#与tpa溶栓组相比,p<0.05。n=6图16和表21结果表明:t541改善缺血给药后24小时脑组织细胞凋亡。取t541的三种主要成分:黄芪总皂苷、丹参多酚酸、三七总皂苷单成分和两两组合分组与t541比较。用蛋白质免疫印迹法检测给药后24小时缺血半影区脑皮质的凋亡相关蛋白bax、bcl-2的含量及其比值变化。tpa溶栓24小时后小鼠脑组织提取蛋白中的bax表达明显升高。黄芪总皂苷、丹参多酚酸、三七总皂苷,及其两两和三三配伍都可抑制bax的高表达。3.9.5体外培养内皮细胞缺氧/复氧后细胞凋亡情况:见图17和表22表22.体外培养内皮细胞凋亡蛋白bax、bcl-2定量组别(平均值±标准误)数量bcl-2baxbax/bcl-2正常对照组61.00±01.00±01.00±0模型组60.69±0.122.44±0.514.57±0.75*t541高剂量给药组60.79±0.101.92±0.272.60±0.25t541次高剂量给药组60.88±0.102.01±0.511.78±0.18#t541中剂量给药组60.99±0.162.33±0.472.31±0.45t541次低剂量给药组60.83±0.112.72±0.673.41±0.83*t541低剂量给药组60.56±0.112.81±0.484.55±0.47**与假手术组相比,p<0.05;#与模型组相比,p<0.05;与tpa溶栓组相比,p<0.05。n=6图17和表22结果表明:t541可改善体外培养内皮细胞缺氧/复氧后细胞凋亡程度。蛋白质免疫印迹法检测体外培养脑微血管内皮细胞缺氧/复氧后的bcl-2、bax表达及其比值变化。体内颈动脉血栓溶栓实验和体外缺氧/复氧实验均发现了缺血缺氧4.5小时后给予tpa,脑内皮细胞凋亡相关蛋白bax/bcl-2比值显著增加,细胞凋亡增加。该结果与tunel染色及电镜一致。t541联合给药能够减轻tpa引起的细胞凋亡现象。该作用可能与t541促进细胞线粒体能量代谢的恢复,进而保护血管内皮细胞连接蛋白与基底膜主要蛋白的表达有关。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种利用回收发泡餐具制备的消失模模型加工材料的制造方法与工艺
- TNF受体相关因子5(Traf5)在肝缺血再灌注损伤中的应用的制造方法与工艺
- 单核细胞趋化蛋白‑1诱导蛋白1(Mcpip1)在肝缺血再灌注损伤中的应用的制造方法与工艺
- 预防或治疗缺血/再灌注损伤之后无复流的方法与制造工艺
- 一种高稳定性黄芪注射液的精制方法及黄芪注射液与制造工艺
- 一种慢性低灌注帕金森病小鼠模型及其制备方法与装置与制造工艺
- 3-烯基吲哚酮类衍生物在制备治疗MIRI药物中的用途及其药物组合物的制造方法与工艺
- 一种晒后修复面膜及其制备方法与制造工艺
- 一种经皮穿刺微创心脏灌注装置的制造方法
- 一种能够降低围术期心肌梗死的远端缺血预适应装置的制造方法