单核细胞趋化蛋白‑1诱导蛋白1(Mcpip1)在肝缺血再灌注损伤中的应用的制作方法
本发明属于基因的功能与应用领域,涉及单核细胞趋化蛋白-1诱导蛋白1(Mcpip1)在肝缺血再灌注损伤中的应用,具体涉及Mcpip1在筛选或制备预防、缓解和/或治疗肝缺血再灌注损伤物中的应用。
背景技术:
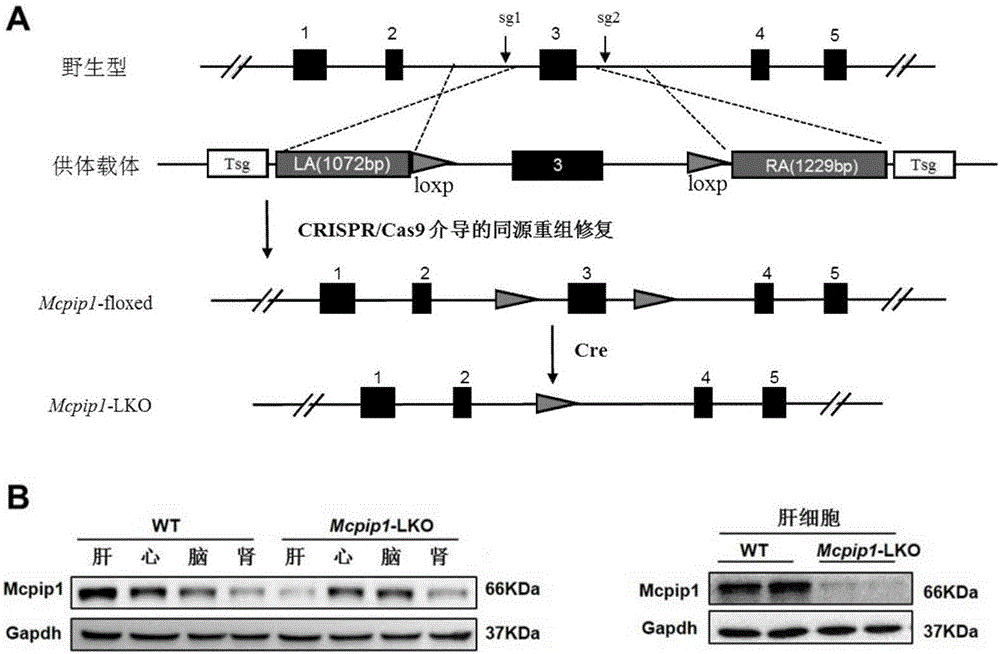
:临床上在肝脏切除、处理肝脏严重创伤及肝脏移植手术过程中,通常需要阻断肝门血流,原本缺血时受损的肝细胞在血供恢复后损伤非但没有减轻,反而出现加重的现象,称为肝脏缺血再灌注损伤(hepaticischemiareperfusioninjury,HIRI)[1]。HIRI可使肝脏代谢、解毒功能降低,严重者引起肝功能衰竭,直接影响到疾病的预后、手术成功率和患者生存率。如何减轻HIRI,是当前肝脏外科面临的重大难题。HIRI是一个多因素参与、多种信号通路共同发挥作用的病理生理过程,其发病机制至今尚未完全阐明。HIRI涉及肝细胞与多种非实质细胞如肝窦内皮细胞、kupffer细胞、星状细胞以及浸润的炎性细胞之间的相互作用,活化的补体系统也参与其中[2]。其病理特点主要是:(1)kupffer细胞、淋巴细胞及中性粒细胞的活化引起肝组织细胞受损;(2)钙超载、氧自由基及细胞因子的释放和活化引起炎症反应、细胞凋亡、坏死;(3)肝窦内皮细胞的损害导致微循环障碍,进一步加重组织缺血、引起细胞坏死凋亡等不可逆损害[3]。从上世纪80年代开始,人们开始寻找能减轻HIRI的途径和方法,外科手术干预、缺血预处理、药物预处理和缺血后处理等[4]已逐渐应用于临床。但迄今为止,上述策略尚未能妥善解决临床上HIRI对肝脏的损伤问题。随着分子生物学和基因工程技术等领域的深入研究,针对HIRI相关的重要功能基因的靶向治疗为HIRI的防治开辟了新的途径。单核细胞趋化蛋白-1诱导蛋白1(monocytechemotacticprotein-1inducedprotein1,Mcpip1)是一类具有免疫调节作用的CCCH型锌指家族分子,最初被发现于经MCP-1处理的人外周血单核细胞中[5]。目前的研究表明,Mcpip1的功能主要集中于以下四个方面:(1)作为转录因子,Mcpip1能够激活凋亡相关基因如JNK、p38等的转录,诱发细胞凋亡[6];(2)作为RNA酶,Mcpip1能够降解炎症相关细胞因子如IL-2、IL-6、IL12p40、Calcr、IL-1β等的mRNA,发挥其对炎症反应负向调控的作用[7];(3)作为去泛素化酶,Mcpip1可去泛素化一系列信号级联分子如TRAFs、RIP、NEMO等[8]。Mcpip1可以通过上述多种机制参与细胞内的多种病理过程,维持机体的免疫稳态。HIRI的发病机理与炎症反应及细胞凋亡密切相关,研究Mcpip1在HIRI发病过程中的功能作用,望其成为防治HIRI的一个重要潜在靶点。参考文献:1.Serracino-Inglott,F.,N.A.Habib,andR.T.Mathie,Hepaticischemia-reperfusioninjury.AmJSurg,2001.181(2):p.160-6.2.Li,A.M.,etal.,Effectsoftherapeutichypercapniaoninflammationandapoptosisafterhepaticischemia-reperfusioninjuryinrats.ChinMedJ(Engl),2010.123(16):p.2254-8.3.deRougemont,O.,P.Dutkowski,andP.A.Clavien,Biologicalmodulationofliverischemia-reperfusioninjury.CurrOpinOrganTransplant,2010.15(2):p.183-9.4.Li,J.,etal.,Themechanismsandstrategiestoprotectfromhepaticischemia-reperfusioninjury.EurRevMedPharmacolSci,2015.19(11):p.2036-47.5.Zhou,L.,etal.,Monocytechemoattractantprotein-1inducesanoveltranscriptionfactorthatcausescardiacmyocyteapoptosisandventriculardysfunction.CircRes,2006.98(9):p.1177-85.6.Qi,D.,etal.,Monocytechemotacticprotein-inducedprotein1(Mcpip1)suppressesstressgranuleformationanddeterminesapoptosisunderstress.JBiolChem,2011.286(48):p.41692-700.7.Matsushita,K.,etal.,Zc3h12aisanRNaseessentialforcontrollingimmuneresponsesbyregulatingmRNAdecay.Nature,2009.458(7242):p.1185-90.8.Liang,J.,etal.,MCP-inducedprotein1deubiquitinatesTRAFproteinsandnegativelyregulatesJNKandNF-kappaBsignaling.JExpMed,2010.207(13):p.2959-73。技术实现要素:为解决临床防治肝缺血疾病现有技术的缺陷和不足,本发明的目的在于确定Mcpip1基因的表达与肝缺血再灌注损伤之间的相互关系,提供一种用于治疗肝缺血再灌注损伤的靶基因Mcpip1的新应用,即Mcpip1作为药物靶标在筛选预防、缓解和/或治疗肝缺血再灌注损伤的药物中的应用,以及Mcpip1在制备用于预防、缓解和/或治疗肝缺血再灌注损伤的药物中的应用,进而把Mcpip1基因应用于肝缺血疾病的治疗。本发明的目的通过下述技术方案实现:本发明以肝细胞特异性Mcpip1基因敲除小鼠和Mcpip1转基因小鼠为实验对象,通过肝缺血再灌注损伤模型研究Mcpip1基因的功能。结果表明:与野生型C57BL/6小鼠相比,肝细胞特异性Mcpip1基因敲除小鼠肝脏坏死面积明显增加;与非转基因小鼠相比,Mcpip1转基因小鼠的肝脏坏死面积则明显减少。这提示Mcpip1基因具有保护肝功能的作用,为Mcpip1在研究防治肝缺血的新靶点和新策略中所发挥的作用提供了理论依据和临床基础。本发明的研究证明了:在肝缺血再灌注损伤模型中,Mcpip1具有抑制肝脏坏死、减少肝细胞凋亡、保护肝功能的作用。一种Mcpip1基因在肝缺血再灌注损伤中的功能,主要体现在Mcpip1具有保护肝功能的作用,特别是Mcpip1具有改善肝缺血再灌注损伤的作用。针对Mcpip1改善肝缺血再灌注损伤的功能,Mcpip1具有如下应用:Mcpip1作为药物靶标在筛选预防、缓解和/或治疗肝缺血再灌注损伤的药物中的应用。该应用是非诊断和治疗的目的;所述的筛选预防、缓解和/或治疗肝缺血再灌注损伤的药物,是指筛选够促进Mcpip1基因表达的药物。Mcpip1在制备预防、缓解和/或治疗肝缺血再灌注损伤的药物中的应用。本发明相对于现有技术具有如下的优点及效果:(1)本发明发现Mcpip1基因的新功能,即Mcpip1基因能够抑制肝缺血再灌注损伤,且与肝细胞凋亡密切相关。(2)基于Mcpip1在抑制肝缺血再灌注损伤中的作用,其可以用于筛选或制备预防、缓解和/或治疗肝缺血再灌注损伤的药物。附图说明图1是肝细胞特异性Mcpip1基因敲除小鼠的构建策略图及所构建小鼠组织中Mcpip1蛋白表达量检测结果图。A为肝细胞特异性Mcpip1基因敲除小鼠的构建策略图;B为组织中Mcpip1蛋白表达量的WesternBlot检测结果图。图2是肝细胞特异性Mcpip1转基因小鼠的构建策略图及所构建小鼠肝脏组织中Mcpip1蛋白表达量检测结果图。A为肝细胞特异性Mcpip1转基因小鼠的构建策略图;B为肝脏组织中Mcpip1蛋白表达量的WesternBlot检测结果图(TG1、TG2、TG3、TG4为不同的转基因小鼠个体)。图3是小鼠在不同时间点肝脏的坏死情况对比图。A为WT和Mcpip1-LKO小鼠在不同时间点肝脏HE染色图及坏死面积统计柱状图;B为NTG和Mcpip1-TG小鼠在不同时间点肝脏HE染色图及坏死面积统计柱状图(*:P<0.05vsWTI/R组;#:P<0.05vsNTGI/R组)。图4是小鼠在不同时间点血清中ALT及AST的含量统计比较图。A为WT和Mcpip1-LKO小鼠在不同时间点肝脏血清中ALT及AST的含量统计柱状图;B为NTG和Mcpip1-TG小鼠在不同时间点肝脏血清中ALT及AST的含量统计柱状图(*:P<0.05vsWTSham组;#:P<0.05vsWT/NTG对应时间点I/R组)。图5是小鼠缺血在再灌注24h时TUNEL细胞数的柱状统计图。A为WT和Mcpip1-LKO小鼠在再灌注24h时TUNEL免疫荧光及柱状统计图;B为NTG和Mcpip1-TG小鼠在再灌注12h时TUNEL免疫荧光及柱状统计图(*:P<0.05vsWT/NTGI/R组)。具体实施方式下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。实验用动物及饲养:实验动物:选用8-10周龄、体重在24g-27g、背景为雄性C57BL/6品系的野生型小鼠(WT,购自北京华阜康生物科技股份有限公司)、肝细胞特异性Mcpip1基因敲除小鼠(Mcpip1-LKO)及Mcpip1转基因小鼠(Mcpip1-TG)(由武汉大学动物实验中心李红良老师实验室构建)、非转基因小鼠(NTG,同窝对照非转基因小鼠)为实验对象。饲养环境:所有实验小鼠均饲养在武汉大学SPF级实验动物中心。SRF级小鼠饲料购自北京华阜康生物科技股份有限公司。饲养条件:室温在22-24℃之间,湿度在40-70%之间,明暗交替照明时间为12h,自由饮水摄食。实施例1肝细胞特异性Mcpip1基因敲除小鼠以及Mcpip1转基因小鼠的构建(1)肝细胞特异性Mcpip1基因敲除小鼠的构建(构建策略见图1A)根据Mcpip1基因的信息,利用CRISPRDesign分别在内含子2和3中各设计一个CRISPR的打靶位点,靶序列分别为:Mcpip1-sRNA1:ggCACTGGCTCCCCACGTAGAGGGGMcpip1-sRNA2:gGCCCTTACCTGAGTAACTTAGGG此外还设计了一个用于同源修复的供体载体(DonorVector),它包括两侧同源臂、中间的外显子3以及两个同向的loxp序列。1)打靶载体的构建:分别将sgRNA1和sgRNA2对应的两条引物融合成双链DNA,然后用T4DNA连接酶连入经过限制性内切酶BsaI处理过的pUC57-sgRNA(Addgene51132)载体中。该载体上游有一个T7启动子,可以用于后续的体外转录实验。2)条件性敲除骨架载体pBluescriptSK(+)-2loxp的构建:分别合成4条寡聚单链核苷酸序列:loxp1-F:AGCTTGACGTCATAACTTCGTATAGCATACATTATAGCAATTTATACCGGTGAT;loxp1-R:ATCACCGGTATAAATTGCTATAATGTATGCTATACGAAGTTATGACGTCA;loxp2-F:GATCCCTTAAGATAACTTCGTATAGCATACATTATAGCAATTTATACGCGTA;loxp2-R:CTAGTACGCGTATAAATTGCTATAATGTATGCTATACGAAGTTATCTTAAGG;上述寡核苷酸序列退火后形成loxp1和loxp2两条双链。将pBluescriptIISK(+)载体用HindIII(NEB,R0104L)和EcoRV(NEB,R0195L)双酶切后连接入loxp1退火双链,再将测序正确的载体用BamHI(NEB,R0136L)和SpeI(NEB,R0133L)双酶切,连接入loxp2退火双链,得到条件性敲除骨架载体,命名为pBluescriptSK(+)-2loxp。3)供体载体(DonorVector)的构建:根据引物设计原则,设计如下引物(表1),以小鼠gDNA为模板,扩增供体载体的左右同源臂(LA和RA)以及中间的外显子部分(M)。上述扩增得到的产物及pBluescriptSK(+)-2loxp载体经表1中所示限制性内切酶酶切后一一连接,得到供体载体。表1构建供体载体所需引物序列及对应酶切位点引物名称引物序列酶切位点Mcpip1LA-FCCGCTCGAGCTTCTGGTTTTGCTTGCTGAXhoIMcpip1LA-RATGGACGTCGAGGGGGAGGGTCGGGCCATTTGCAACAatIIMcpip1M-FTCTACCGGTTACGTGGGGAGCCAGTGTAgeIMcpip1M-RCCGGAATTCTTAGGGCCAAGCCCTTTACCEcoRIMcpip1RA-FCGACGCGTGTTACTCAGGTAAGGGCTTCAAGMluIMcpip1RA-RATAAGAATGCGGCCGCAGAGAGCCACCTAGGAACGANotI4)打靶载体的转录:对CRIPR/Cas9系统包含的两个部分(负责切割作用的Cas9蛋白和引导Cas9蛋白定位到靶位点的gRNA)分别进行转录。对于Cas9蛋白,将其表达载体pST1374-Cas9(Addgene44758)用PmeI进行酶切,以纯化后回收线性化质粒为转录模板,用T7mMESSAGEmMACHINE试剂盒(AM1345,Ambion)进行体外转录,获得加帽的mRNA产物。并用Poly(A)Tailing试剂盒(Ambion)对上述产物加尾,获得成熟的mRNA产物;对于sgRNA,使用MEGAshortscript™Kit(AM1354,Ambion公司)进行体外转录。将转录得到的Cas9和sgRNA的mRNA使用miRNeasyMicroKit(Qiagen,217084)进行纯化。5)Mcpip1-floxed条件性敲除小鼠的制作将上述成熟的mRNA产物与供体质粒一同注入小鼠受精卵中,移植到代孕母鼠体内进行培育。得到的小鼠进行鉴定。取出生一周后的小鼠脚趾或尾部组织,提取基因组,并通过PCR方法筛选阳性首建鼠。从确定发生同源重组的小鼠中随机挑选一只作为F0代进行后续的繁殖,最终获得Mcpip1-floxed纯合小鼠。6)肝细胞特异性Mcpip1基因敲除小鼠的制作将上述Mcpip1-floxed小鼠与肝脏特异性Alb-Cre(购自TheJacksonLaboratory,货号003574)转基因小鼠交配,筛选得到Mcpip1floxed/floxed/Alb-Cre小鼠,待该小鼠长至6周龄左右后,腹腔注射Tamoxifen,诱导Cre酶的表达,Cre酶特异性的识别两个同向的loxp,并切除两者之间的序列及其中的一个loxp,最后得到肝细胞特异性Mcpip1基因敲除小鼠。通过蛋白质印迹法(WesternBlot)实验检测肝细胞特异性Mcpip1基因敲除小鼠肝脏中Mcpip1蛋白的表达量。提取肝脏、心脏、脑组织、肾脏组织蛋白,通过聚丙烯酰胺凝胶电泳(SDS-PAGE),验证Mcpip1表达,结果见图1B。在小鼠心脏、脑、肾脏组织中,WT型小鼠和基因敲除小鼠Mcpip1蛋白表达含量变化不大;而在肝脏组织中,相比于WT型小鼠,基因敲除小鼠Mcpip1蛋白表达含量明显降低,且在肝细胞中Mcpip1蛋白几乎不表达。(2)肝细胞特异性Mcpip1转基因小鼠的构建(构建策略见图2A)以野生型C57BL/6小鼠Mcpip1基因cDNA为模板,用上游引物(5’-AGCTTTGTTTAAACGCCACCATGAGTGACCCTTGTGGAACGA-3’)、下游引物(5’-CTAGCTAGCTTACTCACTGAGGTGCTGGGACT-3’)扩增小鼠Mcpip1基因(NCBI,GeneID:230738,NM_153159.2),把扩增得到的产物以及pCAG-CAT-LacZ载体(北京协和医学院基础学院杨青林老师实验室,制备过程参见参考文献:KimT,ZhelyabovskaO,LiuJ,etal.GenerationofanInducible,Cardiomyocyte-SpecificTransgenicMouseModelwithPPARb/dOverexpression[J].PeroxisomeProliferator-ActivatedReceptors(PPARs),57.)用PmeI(NEB,#R0560L)和NheI(NEB,#R0131L)双酶切后连接,得到转基因载体pCAG-loxP-CAT-loxP-Mcpip1-hGHpA,Mcpip1的表达由CAG启动子驱动得到。将构建的载体通过显微注射构造成受精胚胎(C57BL/6J背景),得到Mcpip1-floxed转基因小鼠。肝细胞特异性Mcpip1转基因小鼠由Mcpip1-floxed转基因小鼠和Alb-Cre(购自TheJacksonLaboratory,货号003574)小鼠杂交繁殖得到。通过蛋白质印迹法(WesternBlot)实验检测不同转基因小鼠肝脏中Mcpip1蛋白的表达量。提取不同转基因小鼠肝脏组织蛋白,通过聚丙烯酰胺凝胶电泳(SDS-PAGE),验证Mcpip1过表达,结果见图2B。相比于野生型小鼠,肝细胞特异性Mcpip1转基因小鼠肝脏组织中Mcpip1蛋白表达含量显著提高。实施例2小鼠肝缺血再灌注损伤模型(ischemia/reperfusioninjury,I/R)的获得(1)实验动物分组:雄性C57BL/6品系野生型小鼠、肝细胞特异性Mcpip1基因敲除小鼠及Mcpip1转基因小鼠、非转基因小鼠,通过肝脏缺血再灌注建立肝缺血/再灌注(I/R)模型。随机分为8组:C57BL/6J品系野生型小鼠假手术组(WTSham)及I/R手术组(WTI/R)、肝细胞特异性Mcpip1基因敲除小鼠假手术组(LKOSham)及I/R手术组(LKOI/R)、非转基因小鼠假手术组(NTGSham)及I/R手术组(NTGI/R)、Mcpip1转基因小鼠假手术组(TGSham)及I/R手术组(TGI/R)。(2)肝缺血再灌注损伤I/R模型手术(采用无创血管夹夹闭中叶和左叶的门静脉和肝动脉,使约70%的肝脏缺血)操作流程:1)手术前12h给小鼠禁食,可自由饮水。2)手术前用3%戊巴比妥钠成功麻醉小鼠后,将其平卧固定肢体,用剃毛器将小鼠腹部术区毛刮净,用10%碘酒和75%乙醇对术区消毒。3)取腹正中切口进腹,暴露肝脏左、中叶之肝蒂。4)用无创血管夹夹闭中叶和左叶的门静脉和肝动脉,使约70%的肝脏缺血,以防止发生严重肠系膜静脉淤血。0.5min后,与非阻断的右叶相比,可见阻断叶变白,说明阻断成功。此时,注意记录缺血开始时间,维持缺血约60分钟,期间用湿的盐水纱布覆盖切口,并注意小鼠的保温(Sham组的小鼠在阻断成功即刻去除血管夹,恢复缺血肝血流)。5)缺血60分钟后去除血管夹,恢复缺血的肝脏血流,然后关闭腹腔,分两层关腹,先把内层缝好,再缝皮,将手术后的小鼠置于干净的笼子中单独饲养,观察。实施例3肝脏坏死面积及肝功能指标(AST,ALT)的测定肝脏缺血再灌注损伤严重程度的评估指标主要包括肝脏坏死面积和肝功能指标(AST,ALT),这些指标均与肝脏缺血再灌注损伤严重程度正相关。(1)取材分别于术后1h、3h、6h、24h取假手术组(Sham)以及缺血/再灌注组小鼠,颈椎脱臼处死,立即自下腔静脉取血1mL,分离血清。同时统一取缺血区肝左叶组织大小约1.5cm×1cm×0.2cm于10%中性福尔马林中固定24h后脱水,包埋,进行石蜡切片后进行HE染色。分离血清:收集血液的EP管于室温下静置1-2h使血液自然凝固。4℃、4000rpm/min离心30min,充分分离血清。用微量移液器分别吸取血清20μL、20μL、30μL、30μL置0.2mL无菌EP管中,对EP管进行标记,随后保存于-80℃冰箱备用。(2)制备石蜡标本切片1)主要操作程序包括:包埋框处理→流水冲洗→脱水→透明→浸蜡→包埋→切片→摊片→晾干或烘烤后备用。2)用石蜡切片机的标准程序切5μm的石蜡切片备用。(3)HE染色主要步骤为:55℃烘烤30min→二甲苯5min,3次→100%酒精1min→95%酒精1min→70%酒精1min→双蒸水1min→苏木素溶液5min→水洗1min→1%盐酸酒精1-3s→水洗1min→Scott液(碳酸氢钠0.35g,硫酸镁2g,蒸馏水100mL)1min→水洗1min→伊红溶液3-5min→蒸馏水洗去浮色→70%酒精1s→95%酒精1s→100%酒精30s,3次→二甲苯2min,3次→趁二甲苯未干立即封片→通风橱内吹干,显微镜拍照。(4)小鼠血清ALT、AST含量测定1)从-80℃冰箱中取出血清样本,迅速置于冰上,在室温下待样品融化;2)在室温下,4000转/分钟离心1分钟,让EP管壁的血清聚集至管底。3)按照操作流程,打开全自动生化分析仪(Sysmex,Chemix180i),清洗加样器。4)按照全自动生化分析仪样品盘的标记顺序,逐一放入待测的EP管。5)准确安装试剂检测盘,开始使用全自动生化分析仪检测ALT、AST水平。WT和Mcpip1-LKO组在肝脏缺血再灌注损伤后的HE染色结果见图3A:显微镜下可见Sham组肝组织基本正常,肝组织结构整齐,无明显的纤维组织增生。I/R组随着再灌注的时间的延长,肝组织结构模糊,排列紊乱。其内有大小不等、形状不规则的坏死灶,坏死灶内肝细胞结构模糊,排列紊乱,离断,与正常肝脏比较,坏死肝脏的肝小叶内见大片坏死灶,坏死组织边缘可见炎性反应带,肝细胞核发生典型的坏死改变,可见核固缩。这种现象在缺血再灌注后24h达到高峰。实验结果表明,给予Mcpip1-LKO小鼠I/R后的梗死面积明显大于WT组小鼠(图3A);相反地,Mcpip1-TG小鼠I/R后的梗死面积明显小于NTG组小鼠(图3B),因此,Mcpip1在肝脏缺血再灌注引起的损伤中起到重要作用。血清中ALT及AST的含量统计结果见图4。结果表明在I/R组各时间点ALT、AST水平均明显高于Sham组,在再灌注后6h达到高峰,随后下降,Mcpip1-LKO小鼠I/R后的ALT、AST水平明显高于WT组小鼠(图4A);Mcpip1-TG小鼠I/R后的ALT、AST水平显著低于NTG组小鼠(图4B)。实施例4缺血再灌注后肝细胞凋亡情况测定用TUNEL试剂盒染色检测凋亡,TUNEL试剂盒:ApopTag®PlusInSituApoptosisFluoresceinDetectionKit(S7111,Chemicon)。具体过程为:1)将石蜡切片置于烤箱中,60℃烤片30分钟;2)二甲苯,5分钟×3次;3)100%乙醇,5分钟×2次;95%乙醇,5分钟;70%乙醇,5分钟;4)ddH2O漂洗,5分钟×2次;5)蛋白酶K37℃孵育15分钟;6)PBS漂洗5min×2次;7)直接滴加EquilibrationBuffer于组织上(13μL/cm2),室温孵育至少10s;8)弃去EquilibrationBuffer,滴加TdTEnzyme工作液(77μLReactionBuffer+33μLTdTEnzyme)于组织上(11μL/cm2),置湿盒于37℃孵育1h;9)将切片置于盛有Stop/WashBuffer工作液(1mLStop/WashBuffer+34mLddH2O)的染色缸中振荡15s后室温孵育10min(等待过程中,将适当量的Anti-DigoxigeninConjugate吸出,至于EP管中,避光放置在室温下,使其平衡至室温);10)PBS漂洗1min×3次;11)轻轻甩去组织多余残留的液体,将组织周围液体吸3滴加Anti-DigoxigeninFluorescein工作液(53%BlockingSolution+47%Anti-DigoxigeninConjugate)于组织上(13μL/cm2),置湿盒中室温避光孵育30min;12)PBS漂洗2min×4次(每次换新的PBS);13)SlowFadeGoldantifadereagentwithDAPI(Invitrogen,S36939)封片;荧光镜下观察,拍照。若需保存,于暗湿盒中4℃保存。通过TUNEL试剂盒检测了各组小鼠I/R术后24小时肝细胞凋亡情况,结果如图5所示,Mcpip1-LKO小鼠肝细胞凋亡数量明显比野生型小鼠增加(图5A),Mcpip1-TG小鼠肝细胞凋亡数量明显比非转基因小鼠降低(图5B),这表明Mcpip1与肝细胞缺血再灌注时凋亡相关。这些结果表明,Mcpip1过表达可以抑制肝组织缺血再灌注损伤,且与肝细胞凋亡密切相关。上述成果表明,Mcpip1转基因小鼠在肝脏缺血再灌注引起的损伤中,小鼠肝脏坏死面积显著减少,肝功能明显改善,肝细胞凋亡数量也明显减少。证明Mcpip1基因在肝脏缺血疾病模型中有着重要的保护作用。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。SEQUENCELISTING<110>武汉大学<120>单核细胞趋化蛋白-1诱导蛋白1(Mcpip1)在肝缺血再灌注损伤中的应用<130>1<160>14<170>PatentInversion3.5<210>1<211>25<212>DNA<213>Musmusculus<400>1ggcactggctccccacgtagagggg25<210>2<211>24<212>DNA<213>Musmusculus<400>2ggcccttacctgagtaacttaggg24<210>3<211>54<212>DNA<213>ArtificialSequence<220><223>loxp1-F<400>3agcttgacgtcataacttcgtatagcatacattatagcaatttataccggtgat54<210>4<211>50<212>DNA<213>ArtificialSequence<220><223>loxp1-R<400>4atcaccggtataaattgctataatgtatgctatacgaagttatgacgtca50<210>5<211>52<212>DNA<213>ArtificialSequence<220><223>loxp2-F<400>5gatcccttaagataacttcgtatagcatacattatagcaatttatacgcgta52<210>6<211>52<212>DNA<213>ArtificialSequence<220><223>loxp2-R<400>6ctagtacgcgtataaattgctataatgtatgctatacgaagttatcttaagg52<210>7<211>29<212>DNA<213>ArtificialSequence<220><223>Mcpip1LA-F<400>7ccgctcgagcttctggttttgcttgctga29<210>8<211>36<212>DNA<213>ArtificialSequence<220><223>Mcpip1LA-R<400>8atggacgtcgagggggagggtcgggccatttgcaac36<210>9<211>27<212>DNA<213>ArtificialSequence<220><223>Mcpip1M-F<400>9tctaccggttacgtggggagccagtgt27<210>10<211>29<212>DNA<213>ArtificialSequence<220><223>Mcpip1M-R<400>10ccggaattcttagggccaagccctttacc29<210>11<211>31<212>DNA<213>ArtificialSequence<220><223>Mcpip1RA-F<400>11cgacgcgtgttactcaggtaagggcttcaag31<210>12<211>36<212>DNA<213>ArtificialSequence<220><223>Mcpip1RA-R<400>12ataagaatgcggccgcagagagccacctaggaacga36<210>13<211>42<212>DNA<213>ArtificialSequence<220><223>上游引物<400>13agctttgtttaaacgccaccatgagtgacccttgtggaacga42<210>14<211>32<212>DNA<213>ArtificialSequence<220><223>下游引物<400>14ctagctagcttactcactgaggtgctgggact32当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1