无免疫抑制活性的维持神经再生活性的FK506衍生物及其用途的制作方法
技术领域
本发明涉及一种具有降低的免疫抑制活性但维持神经再生活性的FK506衍生物、其制备方法、以及包含其的用于预防或治疗神经系统疾病的药物组合物。
背景技术:
FK506,也称为他克莫司或藤霉素,是一种23元大环内酰胺,并且可以从链霉菌属(Streptomyces tsukubaensis)中分离。已知FK506及其类似的药物与细胞质的抑免蛋白(通常称为FK506结合蛋白(FKBP))相互作用以修饰若干生物化学反应(Kang,C.B.等,Neurosignals 2008)。
特别地,FK506在临床上防止同种异体移植排斥(Kino,H.等,J.Antibiot.1987;Kino,H.等,J.Antibiot.1987;Fung,J.J.等,Transplantation 2004)并作为用于治疗自身免疫疾病(例如特应性)的免疫抑制剂使用(Parsons,W.H.等,Ann.N.Y.Acad.Sci.1993)。FK506是T细胞受体信号传导中的重要成分并抑制能抑制T淋巴细胞活性的钙调神经磷酸酶的活性。
在FK506的免疫抑制活性机制的特定研究中,FK506的化学结构可以分为两个区域:结合至钙调神经磷酸酶的效应区(Goulet,M.T.等,Perspect.Drug Discov.1994;Parsons,W.H.等,Ann.N.Y.Acad.Sci.1993;Griffith,J.P等,Cell1995)和与FKBP形成复合物的结合位点。FKBP结合位点包含哌啶酸酯部分、三羰基和环己烷环,并且在与FKBP12蛋白的复合物形成中起重要作用。这允许剩余的效应区自由地结合钙调神经磷酸酶从而形成三重复合物。
为了发挥上述免疫抑制作用,重要的是FK506首先结合FKBP12蛋白。一旦形成两部分复合物,则该复合物可以与钙调神经磷酸酶相互作用(Goulet,M.T.等,Perspect.Drug Discov.1994;Parsons,W.H.等,Ann.N.Y.Acad.Sci.1993)。FK506-FKBP复合物与钙调神经磷酸酶的相互作用抑制由T细胞增殖介导的白细胞介素-2,导致免疫抑制作用。
FK506由杂合PKS/NRPS(聚酮合酶/非核糖体肽合成酶)系统合成。使用从分支酸盐衍生的DHCHC(4,5-二羟基环己-1-烯羧酸)作为起始材料进行生物合成过程,其中DHCHC通过使用两分子丙二酰辅酶A、两分子甲氧基丙二酰基-酰基载体蛋白(ACP)、五分子甲基丙二酰辅酶A和一分子烯丙基丙二酰辅酶A的10步缩合延伸(Andexer,J.N.等,Proc.Natl.Acad.Sci.U.S.A.2011;Mo,S.J.等,J.Am.Chem.Soc.2011)。通过FkbL作用从赖氨酸衍生的哌啶酸酯通过NRPS KfbL与线性聚酮化物链缩合并环化以产生大环内酯环。该环通过后PKS修饰过程进一步修饰,例如由FkbM(S-腺苷甲硫氨酸(SAM)-依赖性甲基转移酶)导致的C-31上的氧甲基化或由FkbD(P450羟化酶)在C-9上的氧化反应(Motamedi,H.等,J.Bacteriol.1996;Shafiee,A.等,J.Antibiot.1997)。
最近,本发明人已经确定,后PKS修饰途径包括通过表征所有FK506生物合成中间体的两个独立的平行途径(Ban,Y.H.等,J.Nat.Prod.2013)。
除了上述免疫抑制活性之外,已报道FK506或其衍生物具有抗真菌(Nakagawa,H.等,Clin.Drug Invest.1996)、抗炎症(Migita,K.等,Curr.Med.Chem.2003)、以及神经保护和神经再生作用(Gold,B.G.Expert Opin.Invest.Drugs 2000;Gold,B.G.等,J.Pharmacol.Exp.Ther.1999)。然而,尽管具有上述药理活性,但FK506或其衍生物具有免疫抑制活性,从而导致问题,例如难以用于需要免疫反应的一般患者。
技术实现要素:
[技术问题]
在这种情况下,本发明人的深入研究努力旨在确定PKS变形后参与途径的FK506的几个特征,导致证实了一种通过FK506生物合成基因的失活制备9-脱氧-脯氨酰-FK506(9-脱氧-脯氨酰-FK506)、一种新型FK506衍生物的方法,并发现作为9-脱氧-脯氨酰-FK506、31-O-脱甲基-FK506(31-O-脱甲基-FK506)或9-脱氧-31-O-脱甲基FK506(9-脱氧-31-O-脱甲基-FK506)的FK506衍生物具有降低的免疫抑制活性并具有神经再生和保护作用,因此可用于治疗神经系统疾病。
[技术方案]
本发明的主要目的是提供一种用于预防或治疗神经系统疾病的药物组合物,其包含选自31-O-脱甲基-FK506、9-脱氧-31-O-脱甲基-FK506或9-脱氧-脯氨酰-FK506中的一种或多种FK506衍生物,具有降低的免疫抑制活性。
本发明的另一个目的是提供一种制备9-脱氧-脯氨酰-FK506的方法,包括培养其中fkbD基因失活的链霉菌菌株的步骤。
本发明的另一个目的是提供9-脱氧-脯氨酰-FK506、其异构体或其药学上可接受的盐。
本发明的另一个目的是提供一种用于促进神经再生的组合物,其具有降低的免疫抑制活性,包含选自31-O-脱甲基-FK506、9-脱氧-31-O-脱甲基-FK506或9-脱氧-脯氨酰-FK506中的一种或多种FK506衍生物。
[本发明的有利效果]
根据本发明的包含9-脱氧-脯氨酰-FKS06、31-O-脱甲基-FK506或9-脱氧-31-O-脱甲基-FK506的组合物具有降低的免疫抑制活性,可以促进神经再生并减少治疗神经系统疾病的副作用。
附图说明
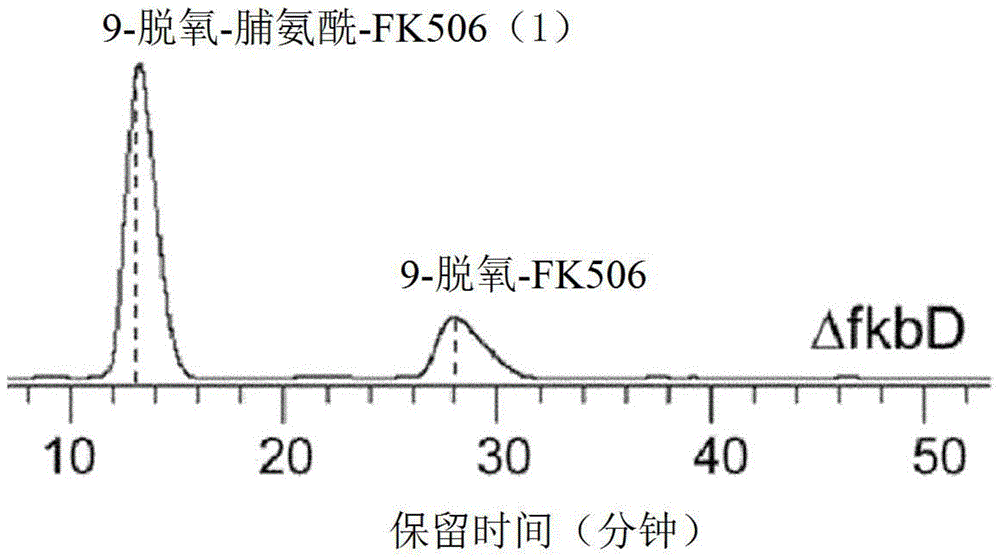
图1是显示从通过fkbD基因的框内缺失而失活的菌株(ΔfkbD框内)获得的9-脱氧-脯氨酰-FK506的HPLC ESI-MS分析结果的图。
图2是9-脱氧-脯氨酰-FKS06的ESI-MS/MS分析的结果,其中(A)显示ESI-MS/MS片段的图谱,(B)显示MS/MS光谱。
图3a和3b是溶于CDCl3中的9-脱氧-脯氨酰-FK506的NMR波谱,图3a是1H NMR波谱,图3b是13C NMR波谱。
图4是溶于CDCl3中的9-脱氧-脯氨酰-FK506的HSQC波谱。
图5a至5c是9-脱氧-脯氨酰-FK506的COSY和HMBC分析的结果,其中图5a显示上述化合物的COSY和主要HMBC相关性,图5b显示溶于CDCl3中的9-脱氧-脯氨酰-FK506的COSY波谱,图5c显示溶于CDCl3中的9-脱氧-脯氨酰-FK506的HMBC波谱。
图6显示9-脱氧-脯氨酰-FK506与FK506相比的免疫抑制活性。
图7a显示9-脱氧-脯氨酰-FK506与FK506相比的神经再生活性,图7b显示在用9-脱氧-脯氨酰-FK506处理的PC12细胞上生长的神经突。
图8显示31-O-脱甲基-FK506与FK506相比的免疫抑制活性。
图9a显示31-O-脱甲基-FK506与FK506相比的神经再生活性,图9b显示在用31-O-脱甲基-FK506处理的PC12细胞上生长的神经突。
图10显示9-脱氧-31-O-脱甲基-FK506与FK506相比的免疫抑制活性。
图11a显示9-脱氧-31-O-脱甲基-FK506与FK506相比的神经再生活性,图11b显示在用9-脱氧-31-O-脱甲基-FK506处理的PC12细胞上生长的神经突。
具体实施方式
为了实现上述目的,一方面,本发明提供由式2表示的9-脱氧-脯氨酰基-FK506(其是由式1表示的FK506的新型衍生物)、其异构体、或其药学上可接受的盐。
[式1]
[式2]
为了实现上述目的,另一方面,本发明提供一种制备9-脱氧-脯氨酰-FK506的方法。
作为一个实施方式,上述制备方法可以包括培养其中缺失fkbD(P450羟化酶)基因的链霉菌菌株的步骤。已知在后PKS修饰中起作用的FkbD酶在C-9处导致氧化反应,但是从未报道过FkbD酶与脯氨酰基的相关性。
作为另一个实施方式,上述制备方法可以还包括将通过使用乙酸乙酯离心分离fkbD基因缺失菌株的培养液而获得的上清液进行分配并通过使用60%甲醇水溶液的制备型反相HPLC进行分段的步骤。作为另一个实施方式,在分段步骤后可以还包括使用50%乙腈的半制备型反相HPLC的步骤。
此外,用于制备9-脱氧-脯氨酰-FK506的菌株可以是能够在生物体内部产生FK506的链霉菌的菌株。例如,菌株可以选自链霉菌属(Streptomyces sp.)KCTC11604BP、链霉菌属(Streptomyces kanamyceticus)KCTC9225、链霉菌属(Streptomyces sp.)ATCC55098、链霉菌属(Streptomyces tsukubaensis)No.9993、链霉菌属(Streptomyces sp.)ATCC53770、链霉菌属(Streptomyces sp.)6260、链霉菌属(Streptomyces sp.)49A、链霉菌属(Streptomyces sp.)94128、链霉菌属(Streptomyces glaucescens)MTCC5115和链霉菌属(Streptomyces sp.)BICC7522,但不限于此,只要可以制备FK506即可。
菌株可以在含有微生物可利用的营养源的培养基中培养。作为菌株的营养源,可以使用但不限于本领域的常规营养源,例如含有丙二酸、乙醇、甲硫氨酸和碳氮源的培养基。
本发明人使用化学物理分析鉴定了制备的物质为9-脱氧-脯氨酰-FK506(FK506的新型衍生物),其通过双交换同源重组产生的框内缺失使链霉菌属(Streptomyces sp.)KCTC11604BP的fkbD基因失活。
分析的9-脱氧-脯氨酰-FK506的化学物理特性如下:(a)无定形白色粉末;(b)旋光率:[α]23D=1.64(c=0.1,甲醇);(c)UV吸收光谱(甲醇):λmax为(log e)227nm(2.0);(d)IR吸收光谱(膜):vmax3450,2960,1750,1640,1170,1050cm-1;(e)1H和13C-NMR,参见表1;(f)(+)-ESI-MS:m/z 793.1[M+NH4]+;(+)-MS/MS:m/z 776.1,758.1,740.1,547.9;(+)-HR-ESI-MS:m/z776.4940[M+H]+;和(g)分子式和分子量:C43H70NO11,776.4949。
作为具体的实施方式,本发明的化合物可以包含异构体或其药学上可接受的盐。
异构体是指具有相同化学式的不同化合物,并且作为实例可以包括9-脱氧-脯氨酰-FK506的结构异构体、几何异构体、光学异构体(对映异构体)、立体异构体或非对映异构体。
药学上可接受的盐可以是具有对患者相对无毒的浓度、无害的有效作用和不降低9-脱氧-脯氨酰-FK506的有益作用的副作用的任何有机或无机酸加成盐。例如,该盐可以是由药学上可接受的游离酸形成的酸加成盐。酸加成盐可以通过常规方法制备,即将化合物溶于过量的酸水溶液中,并使用水混溶有机溶剂例如甲醇、乙醇、丙酮或乙腈沉淀该盐。该盐也可以通过加热酸或醇(例如,乙二醇单甲醚)的水溶液和等摩尔化合物,然后通过蒸发或抽滤沉淀的盐以干燥该化合物来制备。有机或无机酸可用作游离酸。药学上可接受的盐可以是使用碱制备的药学上可接受的金属盐。
作为另一个具体实施方式,本发明的化合物可以是处于本发明范围内的溶剂合物或前药的形式。溶剂合物可优选地包括水合物或乙醇溶剂合物。
本发明的化合物可以根据本领域中的常规方法合成。例如,可以使用本发明的制备方法由变体制备化合物。
为了实现上述目的,另一方面,本发明提供用于预防或治疗神经系统疾病的药物组合物,其包含选自9-脱氧-脯氨酰-FK506、由下式3表示的31-O-脱甲基-FK506和由下式4表示的9-脱氧-31-O-脱甲基-FK506中的一种FK506衍生物。
[式3]
[式4]
由于FK506是T细胞受体信号传导中的重要酶,并抑制能抑制T淋巴细胞活性的钙调神经磷酸酶的活性,因此其用作临床预防同种异体移植排斥和治疗自身免疫疾病(例如特应性)的免疫抑制剂。除了免疫抑制活性之外,已经报道FK506具有抗真菌、抗炎、神经保护和神经再生作用。然而,尽管具有药理活性,但由于免疫抑制活性,因此存在着难以用于需要免疫反应的一般患者的问题。
用9-脱氧-脯氨酰-FK506、31-O-脱甲基-FK506或9-脱氧-31-O-脱甲基-FK506处理CD3/CD28激活的人T细胞的结果,本发明人证实了白细胞介素-2的分泌显著增加以达到正常水平。还证实了FK506衍生物显示出优异的神经再生活性。因此,根据本发明的药物组合物可以显示对神经系统疾病的治疗效果,而没有免疫抑制活性。
作为一个实施方式,神经系统疾病可以是神经变性疾病。神经变性疾病是指以中枢神经系统神经元的退化变化为特征的疾病,引起几种症状,例如痴呆、阿尔茨海默氏病、帕金森病、进行性核上性麻痹、多系统萎缩、橄榄体脑桥小脑萎缩(OPCA)、Shy-Drager综合征:纹状体黑质变性、亨廷顿病、肌萎缩性侧索硬化(ALS)、特发性震颤、皮质基底神经节变性、弥漫性路易体病、关岛的帕金森-ALS-痴呆复合体或皮克氏病。
作为另一个实施方式,神经系统疾病可以包括癫痫、麻痹、中风、缺血性脑疾病、脊髓损伤疾病、周围神经疾病、行为障碍、发育障碍、智力迟钝、唐氏综合征或精神分裂症,但不限于此。
作为另一个实施方式,神经系统疾病可以是由神经元损伤或细胞死亡引起的疾病。
本发明人证实了9-脱氧-脯氨酰-FK506、31-O-脱甲基-FK506或9-脱氧-31-O-脱甲基-FK506促进PC12细胞中的神经突生长并诱导神经再生,因此可用于促进神经再生或用于预防或治疗神经系统疾病。
如本文所用,术语“预防”可以指通过将根据本发明的用于预防或治疗神经系统疾病的组合物施用于受试者来抑制或延缓神经系统疾病发作的所有作用。
如本文所用,术语“治疗”可以指通过将本发明的组合物施用于疑似发生神经系统疾病的受试者来改善或缓解神经系统疾病的症状的所有作用。
本发明的药物组合物可以作为单一制剂或通过另外含有使用药学上可接受的载体或者赋形剂配制的单位剂型的已公知对神经元疾病具有治疗效果的药物而制备的组合制剂,或包封在多剂量容器中。
如本文所用,术语“药学上可接受的载体”可以指不抑制待引入受试者的化合物的生物活性和性质而不刺激受试者的载体或稀释剂。可用于本发明的载体的类型没有特别限制,可以使用任何载体,只要其是本领域通常使用的药学上可接受的载体即可。载体的非限制性实例可以包括生理盐水、无菌水、林格氏溶液、缓冲盐水、白蛋白注射溶液、葡萄糖溶液、麦芽糖糊精溶液、甘油和乙醇。载体可以单独使用或以两种或更多种的组合使用,并且可以包括非天然存在的载体。
此外,如果需要,可以加入其它常规添加剂,例如抗氧化剂、缓冲剂和/或抑菌剂,并且还可以加入稀释剂、分散剂、表面活性剂、粘合剂或润滑剂以用于可注射制剂,例如,水溶液、悬浮液和乳液;丸剂;胶囊剂;颗粒剂;或片剂。
此外,本发明的药物组合物可以含有药学有效量的9-脱氧-脯氨酰-FK506、31-O-脱甲基-FK506或9-脱氧-31-O-脱甲基-FK506。如本文所用,术语“药学有效量”是指足以以适用于医学治疗的合理的利益/风险比治疗疾病的量,并且化合物通常可以以0.001至1000mg/kg、优选地0.05至200mg/kg、更优选地0.1至100mg/kg的量每天单剂量或多剂量施用。然而,对于本发明的目的,优选根据所需反应的类型和程度、是否在一些情况下使用其它制剂、具体组合物、年龄、体重、一般健康状况、性别、饮食、给药时间和途径、组合物的分泌速率、治疗周期、以及同时或与特定组合物组合使用的药物、以及其它在制药领域中公知的各种因素和类似因素来给予特定患者特定治疗有效量。
本发明的药物组合物可以作为独立的治疗剂或与其它治疗剂组合施用,并且与常规治疗剂相继或同时施用。本发明的药物组合物可以作为单剂量或多剂量施用。重要的是根据所有上述因素进行施用,使得可以以最小量获得最大效果而没有任何副作用,并且组合物可以容易地由本领域普通技术人员确定。
如本文所用,术语“施用”是指以适当的方式将本发明的药物组合物引入患者。本发明的组合物可以通过能够将组合物递送至靶组织的口服或各种肠胃外途径施用。
对施用根据本发明的药物组合物的方法没有特别限制,并且可以遵循本领域中常规使用的方法。作为给药方法的非限制性实例,组合物可以以口服或肠胃外途径给药。根据预期的给药方法,根据本发明的药物组合物可以配制成各种剂型。
本发明的药物组合物可以例如以1至20mg/kg、优选地1至10mg/kg的量施用于包括人的哺乳动物。对组合物的给药频率没有特别限制,并可以是每天一次或数次。
作为实现上述目的的另一方面,本发明提供用于促进神经再生的具有降低的免疫抑制活性的组合物,其包含选自31-O-脱甲基-FK506、9-脱氧-31-O-脱甲基-FK506和9-脱氧-脯氨酰-FK506中的一种或多种FK506衍生物。
作为实例,组合物可以用作促进体外神经突生长的组合物。
为了实现上述目的,另一方面,本发明提供用于预防或治疗神经系统疾病的方法,包括向受试者施用用于加速神经再生的组合物的步骤。
如本文所用,术语“受试者”可以指所有动物,包括其中已经开展或可能发展神经系统疾病的人。动物不仅可以是人,还可以是需要治疗相似症状的牛、马、羊、猪、山羊、骆驼、羚羊、狗、猫和其它哺乳动物,但不限于此。
本发明的预防或治疗方法可以具体包括以药学有效量将组合物施用于已经发展或正在发展神经系统疾病的风险的受试者的步骤。
如本文所用,术语“施用”是指以任何适当的方式将本发明的药物组合物引入患者,并且只要该组合物可以递送至靶组织,该组合物可以通过口服或各种胃肠外途径施用。
实施例
在下文中,将参考以下实施例更详细地描述本发明。然而,这些实施例仅用于说明的目的,并且本发明不受这些实施例的限制。
实施例1.材料制备方法和条件
(1)变体和培养条件的构建
根据Ban,Y.H.等人公开的制备方法(J.Nat.Prod.2013,76,1091-1098),通过双交换同源重组产生的框内缺失来灭活链霉菌属(Streptomyces sp.)KCTC11604BP的fkbD基因,以制备ΔfkbD框内菌株。
将KCTC11604BP菌株的孢子和fkbD基因缺失的ΔfkbD框内在ISP4-琼脂板上传代培养,并在R2YE培养基中制备种子培养物。将在种子培养物中生长6天的50mg营养细胞接种到包含在250mL带挡板烧瓶中的50mL R2YE培养基中,然后在定轨摇床(固定在180rpm)中在28℃下温育6天。
(2)提取和分离
将4L的ΔfkbD框内菌株的培养肉汤离心分离,并将上清液用乙酸乙酯进行溶剂-溶剂分配两次。分离溶于乙酸乙酯中的层并在减压下蒸发以得到深红色提取物。通过制备型反相HPLC使用60%甲醇水溶液作为流动相以2mL/min的流速对提取物进行分级,然后进行HPLC-ESI-MS分析。
在Waters/Micromass Quattro micro MS界面上记录使用ACQUITY UPLC BEH C18柱(50×2.1mm,1.7μm;Waters)的HPLC-ESI-MS/MS光谱,其由直接连接到Micromass Quattro微型MS的Waters 2695分离模块组成。
通过在多反应监测模式下操作的MS/MS进行追踪,其中选择对于所选分析物特异性的质量对,以检测从母离子例如铵加合物到产物离子的转变。
为了将级分分离成两个亚级分,还以2mL/min的流速和50%乙腈水溶液作为流动相进行半制备型反相HPLC。在相同柱和HPLC条件下纯化亚级分的结果是获得无定形白色粉末(7.4mg,tR 90分钟)。
(3)数据测量方法
使用Jasco P-1010旋光计,使用具有0.1dm路径长度的池测量旋光度。
用Scinco S-3100分光光度计记录UV光谱,并在Varian FTS-800FTIR光谱仪上获得IR光谱。
使用在500MHz操作的Varian INOVA 500谱仪(13C,125MHz)记录NMR波谱1小时。使用四甲基硅烷(TMS)作为内标,以ppm表示化学位移。将Mnova软件(Mestrelab Research S.L.)用于处理所有NMR数据。通过将纯化合物溶解在250μL的CDCl3(Sigma)中,然后将溶液置于对应于溶剂的5mm Shigemi Advanced NMR微管(Sigma)中,从而制备用于NMR分析的样品。
使用与UPLC联接的Waters SYNAPT G2质谱仪收集HR-ESI-MS数据。在Acme 9000HPLC系统(YL Instrument Co.Ltd.,韩国)上使用半分离Watchers 120ODS-BP(250×10mm,5μm)进行HPLC纯化,所述HPLC系统由与UV 730DUV检测器组(205nm)连接的SP930D梯度泵和CTS 30柱温箱组(50℃)组成。用于实验的HPLC级溶剂购自J.T.Baker。
实施例2:观察实施例1的结果
无定形白色固体分析的结果如下。
(1)HPLC-ESI-MS
图1是ΔfkbD框内菌株的培养物提取物的HPLC-ESI-MS分析的结果,其中铵加合物离子峰于13分钟在m/z 793.1处和于28分钟在m/z 807.1处洗脱。因此,基于776.1、758.1、740.1和547.9处的碎片离子,预测于13分钟在m/z 793.1洗脱的峰为9-脱氧-脯氨酰-FK506,如图2中所示。9-脱氧-脯氨酰-FK506的断裂模式类似于9-脱氧-FK506的断裂模式在于每个碎片离子之间的距离为14Da。特征C-1-C-24碎片离子出现在9-脱氧-FK506中的m/z 561.9处,而本发明的9-脱氧-脯氨酰-FK506的离子峰用m/z 547.9处的离子峰表示。这意味着9-脱氧-脯氨酰-FK506在特征C-1-C-24碎片中比9-脱氧-FK506和其它9-脱氧-FK506衍生物少一个亚甲基。
因此,假定无定形白色固体(即9-脱氧-脯氨酰-FK506)含有脯氨酸。
(2)1D-和2D-NMR
[表1]
1D和2D-NMR数据
如上表1和图3a中所示,1H NMR波谱分析的结果是观察到FK506骨架的特征信号:对应于甲基的三个双峰(δH 0.95/H3-38、0.90/H3-41和0.75/H3-39);两个甲基单峰(δH1.67/H3-40和1.66/H3-42);三个甲氧基单峰(δH 3.40/H3-45、3.37/H3-43和3.36/H3-44);和烯烃质子的多重峰(δH 5.70/H-36)。
此外,如图3b中所示,13C NMR波谱分析的结果是考虑到来自13C NMR波谱的42个碳信号和来自HMBC波谱的一个羰基碳,预期化合物总共具有43个碳。然而,仔细比较化合物(9-脱氧-脯氨酰-FK506)的NMR数据与9-脱氧-FK506的NMR数据表明,对应于9-脱氧-FK506的哌啶酸酯部分(C-2-C-6)的化合物的信号转移。
此外,图4中对所得化合物的上述1H和13C波谱和HSQC波谱的分析示出了在δc58.9/C-2(δH 4.35/H-2)、47.4/C-6(δR 3.63/H-6a,3.54/H-6b)、29.2/C-3(δH 2.19/H-3a,1.98/H-3b)和24.7/C-4(δH 1.96/H2-4)处的四个碳信号,证实了化合物中脯氨酸部分的存在,而不是哌啶酸酯。
通过COZY和HMBC分析证实了化合物的脯氨酸部分的存在,如图5a至5c中所示。在δH 4.35至δH 3.54的范围内的COSY交叉峰提供H-2/H-3/H-4/H-6连通性。此外,观察到δH4.35/H-2、2.19/H-3a和1.98/H-3b处的质子信号与δC 169.9/C-1处的羰基酯碳信号之间以及δH 3.63/H-6a和3.54/H-6b处的质子信号与δc 58.9/C-2和29.2/C-3处的碳信号之间的关键HMBC相关性。
图4中的HSQC光谱显示δH 2.64(d,J=15Hz)和2.56(d,J=15Hz)处的质子信号与δC39.2处的碳信号相关。这些质子信号显示了与C-8(δc 171.8)和C-10(δc 98.6)的HMBC相关性(图5a和5c),表明该化合物是类似于9-脱氧-FK506的9-脱氧-FK506衍生物。
同时,化合物的COSY波谱显示剩余的4个自旋系统,其基于HMBC相关性连接(图5a至5c)。基于相对HMBC相关性确定甲基和甲氧基的位置,如图5a中所示。
因此,确定该化合物为9-脱氧-脯氨酰-FK506,本发明人首次揭示了含有脯氨酸部分而不是普通哌啶酸酯环的9-脱氧-FK506衍生物。此外,该化合物的立体化学与母体化合物FK506的立体化学相同。
(3)HR-ESI-MS
无定形白色固体的HR-ESI-MS分析的结果是:在m/z 776.4940处获得[M+H]+离子,其与分子式C43H70NO11(计算的m/z 776.4949)一致。
(+)-ESI-MS
m/z 793.1[M+NH4]+;(+)-MS/MS:m/z 776.1,758.1,740.1,547.9
(+)-HR-ESI-MS
m/z 776.4940[M+H]+(对C43H70NO11的计算值:776.4949)。
基于上述结果,在通过链霉菌属(Streptomyces sp.)KCTC11604BP的fkbD基因的框内缺失而失活的菌株的培养肉汤中分离的无定形白色粉末具有如下的化学物理特性,并因此已经鉴定为9-脱氧-脯氨酰-FK506。
(a)无定形白色粉末;
(b)旋光率:[α]23D=1.64(c=0.1,甲醇);
(c)UV吸收光谱(甲醇):λmax(log e)227nm(2.0);
(d)IR吸收光谱(膜):vmax3450,2960,1750,1640,1170,1050cm-1;
(e)1H和13C-NMR波谱(参见表1);
(f)(+)-ESI-MS:m/z 793.1[M+NH4]+;
(+)-MS/MS:m/z 776.1,758.1,740.1,547.9;
(+)-HR-ESI-MS:m/z 776.4940[M+H]+;
(g)分子式和分子量:C43H70NO11,776.4949。
实施例3. 9-脱氧-脯氨酰-FK506活性的分析
(1)体外T细胞活性的分析
如Mo,S.J.等人(J.Am.Chem.Soc.2011,133,976-985)中描述那样,使用T淋巴细胞测定化合物与真实FK506相比的相对免疫抑制性质。简单地,在用CD3/CD28激活的人T细胞处理该化合物(0.1nM)后,用该化合物定量白细胞介素-2分泌物16-20小时。
结果如图6中所示,当用FK506处理CD3/CD28激活的人T细胞时,白介素-2分泌减少与CD3/CD28失活的人T细胞一样多的数目,从而增加免疫抑制活性。相反地,当用根据本发明的9-脱氧-脯氨酰-FK506(标记为1)处理CD3/CD28激活的人T细胞时,白细胞介素-2分泌显著增加以到达正常组的分泌,表现出与母离子FK506及其衍生物的免疫抑制活性相反的结果。
(2)神经再生活性的分析
通过Mo,S.J.等人描述的方法(J.Am.Chem.Soc.2011,133,976-985),使用大鼠嗜铬细胞瘤细胞(PC12)测定化合物与真正的FK506相比的相对神经再生活性。PCI2细胞用诱导神经突增生的神经生长因子(NGF;KOMA Biotech;10ng/mL)处理96小时。将10nM的FK506或9-脱氧-脯氨酰-FK506一起处理或排除。通过Revill,W.P.等人描述的方法(J.Pharmaco1.Exp.Ther.2002,302,1278-1285)在照片上测量神经突长度。
结果如图7a和7b中所示,根据本发明的9-脱氧-脯氨酰-FK506(标记为1)显示出对神经突增生促进的优异效果。在图7b中,A是指未处理的细胞,B是指仅用神经生长因子处理的细胞,C是指在FK506存在下用神经生长因子处理的细胞,并且D是指在9-脱氧脯氨酰-FK506存在下用神经生长因子处理的细胞。
免疫抑制和神经再生活性通过不同的机制产生,即通过FKBP12或FKBP52的复合物(Gold,B.G.Expert Opin.Invest.Drugs 2000,9,2331-42)。因此,由于与FKBP12形成二元复合物的能力降低而引起的免疫抑制活性的丧失不抑制FKBP52复合物的形成,因此可以维持神经再生活性。这同样适用于下面的31-O-脱甲基-FK506和9-脱氧-31-O-脱甲基-FK506。
实施例4. 31-O-脱甲基-FK506活性的分析
(1)T细胞的体外活性分析
使用与实施例3.(1)相同的方法测定31-O-脱甲基-FK506与真实FK506相比的相对免疫抑制性质。
结果如图8中所示,当用FK506处理CD3/CD28激活的人T细胞时,白细胞介素-2分泌减少与CD3/CD28失活的人T细胞一样多的数目,从而增加免疫抑制活性。相反地,当用根据本发明的31-O-脱甲基-FK506(标记为2)处理CD3/CD28激活的人T细胞时,白细胞介素-2分泌的水平显著增加以达到正常组的分泌,表现出与母体分子FK506及其衍生物的免疫抑制活性相反的结果。
(2)神经再生活性的分析
使用与实施例3.(2)相同的方法测定31-O-脱甲基-FK506与真实FK506相比的相对神经再生性质。
结果如图9a和9b中所示,根据本发明的31-O-脱甲基-FK506(标记为2)显示出对神经突增生促进的优异效果。图9b中,A是指未处理的细胞,B是指仅用神经生长因子处理的细胞,C是指在FK506存在下用神经生长因子处理的细胞,并且D是指在31-O-脱甲基-FK506存在下用神经生长因子处理的细胞。
实施例5. 9-脱氧-31-O-脱甲基-FK506活性的分析
(1)T细胞的体外活性分析
使用与实施例3.(1)相同的方法测定31-O-脱甲基-FK506与真实FK506相比的相对免疫抑制性质。
结果如图10中所示,当用FK506处理CD3/CD28激活的人T细胞时,白细胞介素-2分泌减少与CD3/CD28失活的人T细胞一样多的数目,从而增加免疫抑制活性。相反地,当用根据本发明的9-脱氧-31-O-脱甲基-FK506(标记为3)处理CD3/CD28激活的人T细胞时,白细胞介素-2分泌的水平显著增加以到达正常组的分泌,表现出与母体分子FK506及其衍生物的免疫抑制活性相反的结果。
(2)神经再生活性的分析
使用与实施例3.(2)相同的方法测定9-脱氧-31-O-脱甲基-FK506与真实FK506相比的相对神经再生性质。
结果如图11a和11b中所示,根据本发明的9-脱氧-31-O-脱甲基-FK506显示出对神经突增生促进的优异效果。在图11中,A是指未处理的细胞,B是指仅用神经生长因子处理的细胞,C是指在FK506存在下用神经生长因子处理的细胞,并且D是指在9-脱氧-31-O-脱甲基-FK506存在下用神经生长因子处理的细胞。
因此,根据本发明的包含9-脱氧-脯氨酰-FK506、31-O-脱甲基-FK506或9-脱氧-31-O-脱甲基-FK506的组合物具有降低的免疫抑制活性,可以促进神经再生并减少治疗神经系统疾病中的副作用。
根据前述内容,本发明所属领域的技术人员将能够理解,在不改变本发明的技术概念或本质特征的情况下,本发明可以以其它具体形式实施。在这点上,本文中公开的示例性实施方式仅用于说明性目的,而不应被解释为限制本发明的范围。相反地,本发明旨在不仅涵盖示例性实施方式,而且涵盖由所附权利要求限定的本发明的精神和范围内可以包括的各种替代、修改、等同物和其它实施方式。
[工业实用性]
根据本发明的组合物具有降低的免疫抑制活性,可以促进神经再生并且可以用于治疗神经系统疾病。
- 还没有人留言评论。精彩留言会获得点赞!