可表征药物控释效果的医用缝线及其制备方法与流程
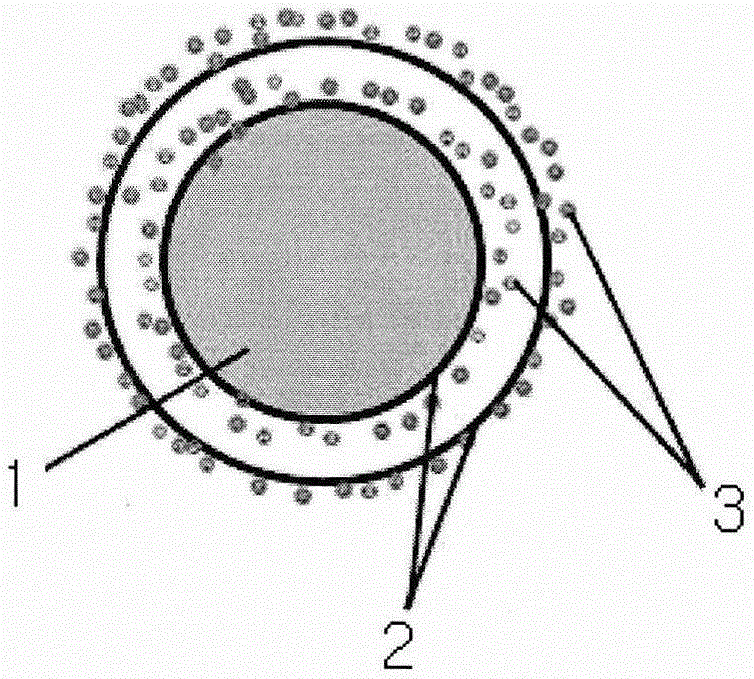
本发明涉及一种医用缝线及其制备方法,尤其涉及一种可表征药物控释效果的医用缝线及其制备方法。
背景技术:
:目前报道的载药微粒缝合线,主要通过直接浸扎的方法将载药微粒负载到缝线表面,但我们研究后发现,这些载药纳微粒缝线缝合组织时由于有些组织,特别是致密的组织,缝线表面的药物微粒很容易受到阻力而脱落,无法将药物微粒随缝线递送到组织内,治疗效果很差,基本上没什么疗效。也有研究通过直接将药物制备到缝线内,但这必将影响缝线的强度,特别是对有些组织要求一定缝合强度的,这种缝线很难符合要求。为此,我们研究了具有黏附涂层的医用缝线,具有强力的黏附功能,可以黏附载药纳米微粒,通过纳米微粒的降解速度来控制药物释放;我们首先制备不同降解速度的载药纳米微粒,然后再将载药纳米微粒负载到黏附剂修饰的医用缝线上,发现这种载纳米微粒缝线在缝合组织特别是致密的组织时,缝线表面负载的纳米微粒不受缝合阻力影响,缝合后,仍然牢牢的黏附在缝线表面,达到将药物递送到组织内的目的。同时实现了药物的可控释放、增加组织局部药物浓度,提高了治疗效果。在手术切口或损伤组织常需要缝线来缝合修复,为了加快组织愈合,需要载促进组织愈合的药物缝线,但不同组织的愈合速度不一样,有快有慢,为了满足不同愈合速度的损伤组织要求,我们需要了解吸附有载药纳米微粒的医用缝线在组织里面药物缓释效果。技术实现要素:本发明所要解决的技术问题是使吸附有载药纳米微粒的医用缝线可以表征药物在组织中的控释效果。为了解决上述技术问题,本发明的可表征药物控释效果的医用缝线,包括缝线本体,在所述缝线本体上覆盖有至少一层黏附涂层,所述黏附涂层上均吸附有载药纳米微粒。上述技术方案的进一步优化,所述黏附涂层为聚儿茶酚胺类化合物和/或多聚赖氨酸和/或明胶黏附剂。上述技术方案的进一步优化,所述聚儿茶酚胺类化合物为多巴胺和/或左旋多巴和/或去甲肾上腺素和/或其衍生物通过氧化自聚形成。上述技术方案的进一步优化,所述黏附涂层可以由聚儿茶酚胺类化合物,多聚赖氨酸,明胶的不同占比组成的黏附涂层。上述技术方案的进一步优化,所述载药纳米微粒为载罗丹明纳米微粒。上述技术方案的进一步优化,所述每层黏附涂层上吸附载罗丹明纳米微粒量为0.01~10μg/cm,载罗丹明纳米微粒构成总厚度为10纳米到100微米层厚。上述技术方案的进一步优化,所述罗丹明在载药纳米微粒中的含量为0.1~20wt%,载罗丹明纳米微粒的直径为5纳米到1000纳米。本发明可表征药物控释效果的医用缝线的制备方法,具体步骤如下1)、将儿茶酚胺类化合物和/或多聚赖氨酸和/或明胶溶于ph值8.0~8.9的弱碱性溶液中,溶液浓度为0.1-10mg/ml,溶解温度为4-50度,制得黏附剂溶液;2)、将缝线浸泡在黏附剂溶液中,浸泡时间为0.5-5小时,浸泡温度为4-50度,使缝线上形成黏附涂层;3)、再将缝线放入载罗丹明纳米微粒溶液中,载罗丹明纳米微粒溶液浓度为0.1-1000mg/ml,浸泡时间为0.5-5小时,浸泡温度为4-50度,使黏附涂层上吸附载罗丹明纳米微粒。上述制备方法中,重复步骤2和3,使缝线上形成多层黏附涂层和载罗丹明纳米微粒层。每层黏附涂层上除了吸附载罗丹明纳米微粒外,还可同时吸附促进组织愈合的载药纳米微粒。上述制备方法中,所述载罗丹明纳米微粒通过如下方法制得,称取30mgplga加入到3ml的氯仿和/或二氯甲烷中得到10mg/ml的plga溶液;然后配置150μl浓度为1μg/μl罗丹明的磷酸盐缓冲液得到罗丹明溶液;称取112.5mgpva加到7.5mlddh2o中,制备15mg/ml的pva溶液;将plga溶液与罗丹明溶液混合并用超声破碎仪超声1分钟产生乳状液,然后将乳状液加入15mg/ml的pva水溶液中继续超声2分钟,然后在搅拌器上持续搅拌24小时充分去除氯仿和/或二氯甲烷,用离心机收集纳米微粒,用ddh2o洗涤两次,最后重悬到20mlddh2o中,得到负载罗丹明的纳米微粒。上述载药纳米微粒,其粒径范围为5纳米到1000纳米,通过差速离心,即通过不同离心力和不同离心时间,可将纳米微粒分成不同大小,粒径分布较窄的几个区间。上述载药纳米微粒的医用缝线的制备方法的进一步优化,将不同粒径的载药纳米微粒负载到不同黏附层上。本发明的可表征药物控释效果的医用缝线,包括可吸收缝线和不可吸收缝线;通过将罗丹明负载到纳米微粒,然后再将载罗丹明纳米微粒负载到黏附剂修饰的医用缝线上,通过载罗丹明缓释纳米微粒,可研究其在肌腱组织,肌肉组织,表皮组织等不同组织中的控释效果。附图说明图1为一种实施方式的医用缝线截面示意图;图2是聚多巴胺修饰的缝线和普通缝线的对比图,其中a为普通缝线,b为聚多巴胺修饰的缝线;图3是载罗丹明纳米微粒的电镜扫描图及粒径分布图;图4是聚多巴胺修饰的载罗丹明纳米微粒手术缝线的电镜扫描图;图5是不同降解速度的载罗丹明纳米微粒手术缝线的药物释放曲线;图6是载罗丹明纳米微粒手术缝线在肌腱组织中荧光的分布图。具体实施方式参见图1,可表征药物控释效果的医用缝线,包括缝线本体1,在所述缝线本体上覆盖有至少一层黏附涂层2,所述黏附涂层2上均吸附有载药纳米微粒3。缝线本体1为可吸收缝线和不可吸收缝线。所述黏附涂层2可为聚儿茶酚胺类化合物和/或多聚赖氨酸和/或明胶黏附剂,其中聚儿茶酚胺类化合物为多巴胺和/或左旋多巴和/或去甲肾上腺素和/或其衍生物通过氧化自聚形成的,优选为聚多巴胺修饰的黏附涂层。上述技术方案的进一步优化,所述黏附涂层可以由聚儿茶酚胺类化合物,多聚赖氨酸,明胶的不同占比组成的黏附涂层。优选聚儿茶酚胺类化合物,多聚赖氨酸,明胶不同占比为(60~100)∶(20~0)∶(20~0),具体可为90∶5∶5。不同占比的黏附剂混合物形成的黏附涂层负载和释放率如下表所示:所述聚多巴胺为多巴胺单体在弱碱性条件下氧化自聚形成的聚合物。一种上述技术方案所述聚多巴胺修饰的载药纳米微粒缝线的制备方法,包括以下步骤:a)、将多巴胺单体溶于弱碱性的溶液中,得到多巴胺溶液;b)、将所述多巴胺溶液来浸泡缝线本体1,得到聚多巴胺修饰的缝线;c)、所述聚多巴胺修饰的缝线放入载药纳米微粒溶液中,得到聚多巴胺修饰的载药纳米微粒缝线。上述方法中,所述多巴胺溶液的浓度优选为0.1~10mg/ml,更优选为1~5mg/ml,具体可选择为2mg/ml;所述tris-hcl浓度优选为0.01-0.1m,具体可选择为0.05m;所述tris-hclph值优选为8.0-8.9,具体可选择为8.5。上述方法中,所述多巴胺溶于tris-hcl的温度优选为4-50度,具体可选择为25度。上述方法中,所述多巴胺溶液来浸泡缝线,浸泡的时间为1~6小时,具体可选择为2小时;浸渍的温度优选为4-50度,具体可选择为25度;所述缝线为可吸收缝合线和/或不可吸收缝线,具体可选择外科手术上常用的缝线。上述方法中,所述黏附剂修饰的缝线浸入载药纳米微粒溶液中,得到黏附剂修饰的载药纳米微粒缝线,缝线浸泡载药纳米微粒溶液的时间为1-10小时,更优选为2~5小时,具体可选择为4小时;浸泡温度优选为4-50度,具体可选择为25度;所述纳米微粒在缝线上负载量为0.05~50μg/cm;所述负载方式可以多层黏附,优选为1-20层,具体可选择为5层,可以将不同降解速度的载药纳米微粒按照需要分层黏附到缝线上。一种载药纳米微粒的制备方法,包括以下步骤:a)、将药物溶液、载体和有机溶剂混合超声,得到混合溶液;b)、将所述混合溶液、乳化剂和水混合再次超声,得到乳状液;c)、所述乳状液除去有机溶剂,得到载药纳米微粒。优选的,所述有机溶剂包括氯仿和/或二氯甲烷;所述乳化剂包括聚乙二醇和/或聚乙烯醇;所述载体包括不同的单体比例制备出不同降解速度的plga。为了验证缝线负载药纳米微粒的效率和体内递送情况,以及缝线缝合到组织中,纳米微粒上的药物降解和在组织中的扩散情况,本发明中制备了载罗丹明纳米微粒。所述纳米微粒载体为聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolicacid),plga),该共聚物由羟基乙酸单体和乳酸单体共聚而成,共聚物具有乳酸结构的重复单元和具有羟基乙酸结构的重复单元。在本发明提供的一个实施例中,所述聚乳酸-羟基乙酸共聚物的重均分子量(mw)为30000~95000。在本发明提供的一个实施例中,所述乳酸-羟基乙酸共聚物中具有乳酸结构的重复单元与具有羟基乙酸结构的重复单元的摩尔比为(50~90)∶(50~10),优选为50∶50,65∶35,75∶25,85∶15。优选的,所述聚乳酸-羟基乙酸共聚物的重均分子量为30000~95000。在载药纳米微粒的制备方法中,所述有机溶剂包括但不限于二氯甲烷和/或氯仿。在本发明中,所述药物与载体的质量比优选为1∶(5~100),具体可选择为1∶10;所述载体和有机溶剂的质量体积比优选为(10~100)mg∶(1~10)ml。在本发明中,所述药物、载体和有机溶剂混合的温度优选为室温;本发明对混合所用的设备没有特别限定,优选本领域技术人员熟知的超声破碎仪。超声后,得到混合溶液。得到混合溶液后,将所述混合溶液、乳化剂混合。其中,所述乳化剂包括但不限于聚乙烯醇和/或聚乙二醇。在本发明中所述聚乙烯醇的分子量优选为8000~25000000,聚乙二醇的分子量优选为4000~2500000。在本发明中,所述乳化剂与所述混合溶液中载体的质量比优选为(30~1000)∶(10~100);所述乳化剂溶液与所述混合溶液体积比优选为(1~100)ml∶(1~10)ml。在本发明中,所述混合溶液、乳化剂的混合优选在超声条件下进行;所述超声的功率优选为100~500w;所述超声的时间优选为0.5~3min。在本发明中,除去有机溶剂的方式优选为对所述复乳液进行室温搅拌来缓慢挥发。复乳液中的有机溶剂除净后,得到纳米微粒。在本发明中,优选对得到的纳米微粒进行水洗,来纯化纳米微粒。在本发明提供的实施例中,所述药物在载药纳米微粒中的含量为0.1~20wt%。在本发明提供的实施例中载药纳米微粒,其粒径范围为5纳米到1000纳米,通过差速离心,即通过不同离心力和不同离心时间,可将纳米微粒分成不同大小,粒径分布较窄的几个区间。优选为330-1100nm;210-450nm;120-280nm;60-150nm;10-70nm。离心机不同离心力和不同离心时间分离出不同的纳米微粒粒径分布区间具体情况如下表:离心力(g)离心时间(min)纳米微粒粒径分布(nm)1005330-110050005210-4501000010120-280150003060-150200006010-70本发明提供的方法能够制得粒径均一、分散性好的载药纳米微粒。在本发明提供的实施例中,所述在载药缓释纳米微粒的粒径为5~1000nm,具体可为100~300nm。在本发明提供的一个实施例中,所述载药缓释纳米微粒缝线为医用缝合线,所述药物在缝线上负载量为0.01~10μg/cm。在本发明提供的实施例中,载蛋白纳米微粒的医用缝线的制备方法的进一步优化,将不同粒径的载蛋白纳米微粒负载到不同黏附层上。上述技术方案提供的可控释药物的医用缝线,具有良好的缓释效果。具体实施例聚多巴胺修饰的缝线制备步骤1)称取0.6g三羟甲基氨基甲烷(tris,mw=121.14)加到500ml的ddh2o中,充分溶解后用盐酸调ph值8.5左右,配置出tris-hcl缓冲液(0.01m)。步骤2)称取50mg多巴胺(dopamine,mw=153)加到步骤1)配置的25mltris-hcl缓冲液,充分溶解后,得到2mg/ml的多巴胺溶液,然后将手术缝合线ethicon的5-0ethilon,浸入到多巴胺溶液,并室温缓慢搅拌,以使多巴胺氧化自聚,约2-4小时,即在缝线表面形成一层聚多巴胺涂层,如图2所示,图2是涂有聚多巴胺涂层的pdsii缝合线。载罗丹明缓释纳米微粒的制备步骤1)称取30mgplga(lactide∶glycolide=65∶35(n∶n),mw=40000~75000)加入到3ml的二氯甲烷中得到10mg/ml的plga溶液;然后配置150μl浓度为1μg/μl罗丹明的磷酸盐缓冲液得到罗丹明溶液;称取112.5mgpva(mw=9000~2000000)加到7.5mlddh2o中,制备15mg/ml的pva溶液。步骤2)将步骤1)制取的plga溶液与罗丹明溶液混合并用超声破碎仪超声1分钟(功率200w)产生乳状液,然后将乳状液加入步骤1)制取的15mg/ml的pva水溶液中继续超声2分钟(功率200w),然后在搅拌器上持续搅拌24小时充分去除二氯甲烷,最后用ddh2o洗涤两次(15000g离心5分钟),最后重悬到20mlddh2o中,得到负载罗丹明的纳米微粒。通过动态光散射测定上述纳米微粒的粒径分布,结果如图3所示,图3是纳米微粒粒径分布图,通过图3可以看出,纳米微粒的粒径分布在180~260nm。不同离心力和不同离心时间分离出不同粒径分布区间的载罗丹明纳米微粒。将上述制备的载罗丹明纳米微粒溶液通过不同离心力和不同离心时间来分离出不同大小的载罗丹明纳米微粒,如表1,通过不同离心力和不同离心时间,可将载罗丹明纳米微粒分成不同大小,粒径分布较窄的几个区间(330-1100nm;210-450nm;120-280nm;60-150nm;10-70nm)。聚多巴胺修饰的载罗丹明纳米微粒缝线的制备将聚多巴胺修饰的ethicon的5-0ethilon缝线放入1mg/ml载罗丹明纳米缓释微粒的溶液,室温搅拌3小时,然后ddh2o清洗3遍,晾干。通过扫描电镜检测缝合线上载纳米微粒情况,结果如图4所示,图4载药纳米微粒缝线的形态图,通过图4可以看出,缝线表面均匀负载着罗丹明纳米微粒。表明聚多巴胺修饰的缝线可以黏附载药纳米微粒,具有强烈的粘附性能。不同降解速度的载罗丹明纳米微粒手术缝线的药物释放曲线将不同单体比例(乳酸和羟基乙酸的比例分别为50∶50,65∶35,75∶25,85∶15)的载罗丹明纳米微粒的ethilon缝线,加入到10ml的磷酸盐缓冲液中(0.01m,ph=7.4)缓慢搅拌,每隔1天进行取样,利用荧光分光光度计分别测罗丹明的浓度,并绘制释放曲线,如图5所示,图5是不同单体比例的载罗丹明纳米微粒的ethilon缝线的体外释放曲线图。通过图5可以看出不同单体比例的载罗丹明纳米微粒的ethilon缝线具有不同的缓释效果。不同占比的黏附剂混合物形成的黏附涂层负载纳米微粒量和药物释放率。称取1.21g三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,mw=121.14)加到1l的双蒸水中,充分溶解后用hcl调ph值8.5左右,配置出浓度为0.01mtris-hcl弱碱性溶液液。称取不同质量的多巴胺,聚赖氨酸和明胶加到100mltris-hcl缓冲液,充分溶解后,得到1mg/ml的混合溶液,然后将手术缝合线ethicon的5-0ethilon,浸入到混合溶液,并室温缓慢搅拌,约1-3小时,使黏附剂黏附到缝线上,然后将黏附剂修饰的ethicon的5-0ethilon缝合线浸入1mg/ml载罗丹明纳米缓释微粒的溶液中,室温搅拌3小时,然后双蒸水清洗3遍,晾干,称取缝线重量,计算负载量(表2);将载罗丹明缓释纳米微粒ethibond缝线加入到10ml的磷酸盐缓冲液中(0.01m,ph=7.4)透析,检测21天的释放率(表2)。载罗丹明纳米微粒缝线在组织中的分布情况将载罗丹明纳米微粒缝线,用于缝合大鼠损伤跟腱,一周后,取跟腱组织进行石蜡切片,荧光显微镜观察罗丹明(红色荧光)在肌腱组织中的分布情况,如图6所示,图6是载罗丹明纳米微粒的ethilon缝线在组织内罗丹明分布情况。通过图6可以看出载罗丹明纳米微粒ethilon缝线在组织内也具有良好的扩散能力,可将所载罗丹明扩散到缝线周围组织。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1