一种卡巴他赛前药脂质体及其制备方法和应用与流程
本发明涉及将卡巴他赛(ctx)与多不饱和脂肪酸二十二碳六烯酸(dha)偶联形成的前药和卵磷脂、胆固醇、spe-peg2k等脂质非共价形成前药脂质体进行体内递送,该递药系统不仅增加了药物的水溶性,降低了药物的毒性,还增加了药物的抗肿瘤效果和药物的最大耐受剂量。
背景技术:
作为第四代靶向性药物载体脂质体,因为具有高生物活性,低毒性和高效包裹各类包括亲水性的和疏水性药物的特性而具有很大的临床应用价值。脂质体的运用能明显改善小分子化疗药物的代谢和药效情况,改善了这些药物的应用前景。临床第一个被批准上市的脂质体为阿霉素脂质体
卡巴他赛(cabazitaxel)是一种紫杉烷类衍生物,于2010年6月经美国fda批准上市用于激素难治性转移性前列腺癌的治疗。相比于紫杉醇和多西他赛,卡巴他赛具有更强的抑制肿瘤增殖的活性,并且卡巴他赛与p-糖蛋白(p-glycoprotein)的亲和力较低,药物耐受性的几率低,可以用于治疗多药耐药性肿瘤。其作用机制主要是通过与肿瘤细胞内的微管蛋白结合,抑制微管解聚,影响有丝分裂的进行,从而抑制肿瘤细胞增殖,促进细胞凋亡。
卡巴他赛虽然药物耐受性几率低、抗肿瘤效果强,但是其水溶性差,需要通过添加表面活性剂(氢化蓖麻油、吐温80)和乙醇来助溶。而这些添加剂表现出一定的生理毒性,例如吐温80就具有明显的溶血性。另外卡巴他赛本身也具有较强的骨髓抑制毒性,影响白细胞数量。这两点均较大程度地影响了其在临床上的应用。在临床ⅰ期试验中,卡巴他赛的最大耐受剂量(mtd)仅为25mg/m2,远小于紫杉醇的175mg/m2以及多西他赛的60-100mg/m2。为了降低卡巴他赛的毒副作用,延长其在体内的循环周期,需要对卡巴他赛进行结构设计和改善递药方式。
目前主要是将卡巴他赛制成脂质体制剂以增加其水溶性。单纯的卡巴他赛不能被包裹形成脂质体。为了结合卡巴他赛抗肿瘤分子和脂质体递药体系的优点,本发明是在卡巴他赛羟基位点偶联多不饱和脂肪酸dha形成卡巴他赛前药再与脂质分子使用乙醇注入法形成稳定的粒径约为130nm大小的前药脂质体(lipoprodrug)。该脂质体能明显改善卡巴他赛的水溶性,明显延长卡巴他赛的药代动力学特性,延长卡巴他赛的体内循环时间,而且能通过epr效应在肿瘤部位有很好的聚集,明显提高了抗肿瘤效果,极大地降低了卡巴他赛的毒性,提高了卡巴他赛的最大耐受剂量(mtd)。
技术实现要素:
本发明提供了一种卡巴他赛前药脂质体及其制备方法和应用,该卡巴他赛前药脂质体提高了卡巴他赛的抗肿瘤效果,降低了卡巴他赛的毒性。
一种卡巴他赛前药脂质体,包括脂质双分子层和装载于所述脂质双分子层中的卡巴他赛前药;
所述的脂质双分子层由胆固醇和卵磷脂作为骨架,同时以dspe-peg2k双亲性聚合物作为添加剂;
所述的卡巴他赛前药的结构如下:
卡巴他赛-dha前药可以按照现有方法制备得到,例如cn106432141a。
本发明利用不饱和脂肪酸结构的灵活性,将卡巴他赛与不饱和脂肪酸dha相连降低产物前药的刚性,同时增加药物的亲脂性,使其能稳定插入于脂质双分子层中。同时利用胆固醇和卵磷脂制备作为磷脂双分子层的骨架分子,同时添加dspe-peg2k双亲性聚合物提供peg基团,减少网状内皮系统巨噬细胞对脂质体的吞噬,延长脂质体的体内循环。
本发明还提供了卡巴他赛前药脂质体的制备方法,包括:
将卵磷脂、胆固醇和dspe-peg2k的脂质混合物溶于有机溶剂中,再将溶于有机溶剂的卡巴他赛-dha前药与以上脂质混合物混合后再直接注入水中,得到均匀分散的脂质颗粒,提高了脂质体的水溶性。
本发明制备卡巴他赛最终浓度为0.1mg/ml的前药脂质体,卡巴他赛-dha的载药量为4%,将卵磷脂、胆固醇和dspe-peg2k质量比为35:5:8的脂质混合物溶于乙醇中,三者总质量为24g,再将0.1ml10mg/mldmso的卡巴他赛-dha前药与以上脂质混合物混合后再直接注入到10ml水中,得到脂质颗粒。
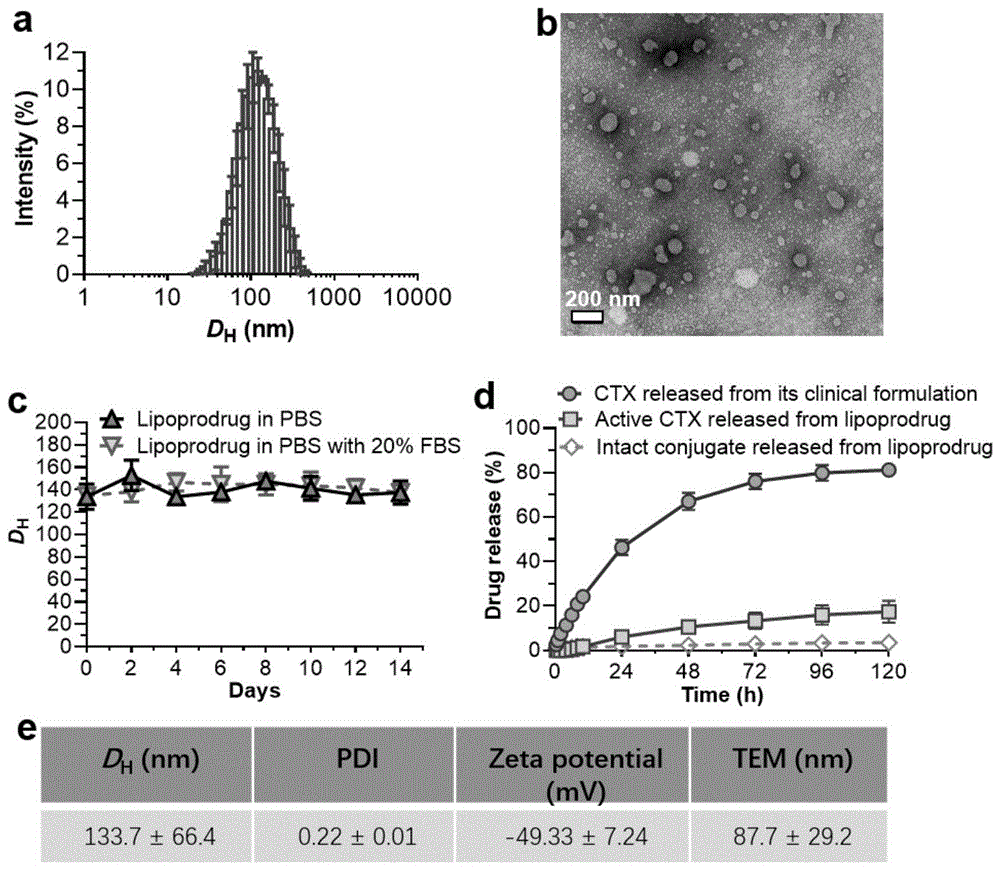
本发明提供了以上卡巴他赛前药脂质体的粒径分布图以及扫描电镜图,其平均粒径均在80-140nm范围内。
本发明提供了以上卡巴他赛前药脂质体的电位分析,电位在-50mv左右。
本发明还提供了前药脂质体在37℃、含有0.3%吐温80的磷酸缓冲液中的释放实验。实验结果表明卡巴他赛前药脂质体中卡巴他赛比临床型卡巴他赛剂型释放缓慢,而且释放出来的大部分都是抗肿瘤活性分子卡巴他赛而不是前药分子。
本发明提供了卡巴他赛前药脂质体的稳定性分析,室温下分别在磷酸盐缓冲液和20%的胎牛血清中测试稳定性2周,结果显示该脂质体稳定性良好,粒径变化上下不超过40nm。脂质体粒径较小,易通过肿瘤部位的epr效应在肿瘤部位积聚,降低对正常组织的损害,更好地发挥抗肿瘤效果。
本发明提供了卡巴他赛前药脂质体的体外细胞毒试验和凋亡实验,实验结果显示脂质体形式的卡巴他赛体外维持卡巴他赛的抗肿瘤效果,但比临床型的效果略差,进一步说明了前药脂质体形式的卡巴他赛释放缓慢,体内循环时间长,作用效果长。
本发明提供了卡巴他赛前药脂质体的体内药代动力学研究,结果表明静脉注射后卡巴他赛在前药脂质体中缓慢释放,血液循环时间明显长于临床型卡巴他赛。同时缓慢释放的卡巴他赛对组织的毒副作用明显减小。
本发明还提供了卡巴他赛前药脂质体的体内抗肿瘤效果分析实验和毒性分析。药效实验显示高剂量的脂质体型的卡巴他赛不仅对小鼠体重无明显影响,又能显著提高卡巴他赛的药效。动物毒性实验结果进一步表明相比于临床型的卡巴他赛,高剂量的脂质体型的卡巴他赛对白细胞数量没有明显影响,未表现出任何骨髓抑制的现象。
与现有技术相比,本发明的有益效果体现在:
⑴本发明用于构成脂质双分子层骨架的卵磷脂和胆固醇及用于修饰改造卡巴他赛形成卡巴他赛前药的不饱和脂肪酸dha为人体正常代谢所必需的化学成分,生物相容性好,便于临床转化;
2)本发明使用了双亲性分子dspe-peg2k提供了peg基团,能保护脂质体不被网状内皮系统中的巨噬细胞吞噬,延长在血液循环中的时间;
3)本发明构建的卡巴他赛前药脂质体明显提高了卡巴他赛的水溶性,避免了使用吐温80等有生物毒性的辅料作为溶剂;
4)本发明所提供的前药脂质体能明显提高卡巴他赛的血液循环时间,改善卡巴他赛的药代动力学特性,提高药物的生物利用度;
5)本发明提供的卡巴他赛前药脂质体明显降低了卡巴他赛的本身毒性,例如对白细胞和体重的影响;
6)本发明提供的卡巴他赛前药脂质体高剂量下相比于临床型的卡巴他赛抗肿瘤效果更好,毒性更低,提高了卡巴他赛的最大耐受剂量。
附图说明
图1为卡巴他赛前药脂质体的表征。(a):脂质体的粒径分布;(b):脂质体的电镜;(c):脂质体的体外稳定性测试;(d):脂质体的体外释放;(e):脂质体的各项表征参数。
图2.卡巴他赛前药脂质体的体外毒性分析。脂质体在前列腺癌细胞du145(a)和乳腺癌细胞hcc1937(b)上的细胞毒性分析;脂质体对du145细胞的凋亡诱导情况分析(c)。
图3为实施例7卡巴他赛前药脂质体的药代动力学分析。卡巴他赛前药脂质体的药物代谢动力学曲线(a)及各项参数(b)。
图4为实施例8卡巴他赛前药脂质体的体内药效分析。(a)裸鼠皮下du145移植瘤生长曲线;(b)小鼠体重变化分析;(c)不同给药组小鼠的最终肿瘤图片。
图5为实施例9卡巴他赛前药脂质体的体内毒性分析。脂质体对icr鼠的白细胞(wbc)(a)和中性粒细胞(ne)(b)数量的影响。
具体实施方式
实施例1卡巴他赛前药脂质体的制备
为了制备卡巴他赛载药量为4%,最终药物浓度为0.1mg/ml的卡巴他赛前药脂质体,首先将卵磷脂、胆固醇和dspe-peg2k(该物质在脂质体合成中已报道,专利号:cn1343118-a,cn101091890-a)质量比为35:5:8的脂质混合物溶于0.9ml乙醇中,再将0.1ml,10mg/ml溶于dmso的卡巴他赛-dha前药与以上0.9ml脂质混合物混合后直接注入到10ml水中,得到脂质体颗粒。利用超高速离心机离心100000g×10min去除有机溶剂,取沉淀得到高纯度的脂质颗粒稀释后利用高效液相测浓度。根据高效液相测出的脂质体浓度再将脂质体稀释到0.1mg/ml。
实施例2前药脂质体的粒径和电位。
脂质体的粒径分布(pdi)和zeta电位测试由动态光散射仪测得激光以90°入射,入射波长为633nm。所有样品均在塑料比色皿或电位样品池中测量。每个样品平行测试3次,测试温度为25℃,平衡时间为2min。所得粒径和电位均为样品的平均值。脂质体的粒径检测结果和透射电子显微镜观察的结果如图1(a)、(b)所示。通过透射电子显微镜(tem)观察粒子的形貌。制样:取上述0.1mg/ml的脂质体1ml到浓缩管中2500rpm转速下离心5-10分钟,待浓缩至400μl左右时,即可得到浓度约为0.25mg/ml的脂质体。取一滴0.25mg/ml的脂质体溶液点样于铜网上,用2%醋酸铀负染,在空气中干燥后在透射电子显微镜下进行观察。
实施例3前药脂质体的体外稳定性测试
将1mg/ml的前药脂质体稀释到pbs和20%的胎牛血清中,使得最终卡巴他赛的浓度为0.01mg/ml。将稀释的前药脂质体室温保存,每两天使用动态光散射仪测量一次粒径。每次每组测量三个样品。结果如图1(c)所示。
实施例4前药脂质体的体外释放
将实施例1中制备的前药脂质体3ml分别置于分子量为3500kda的透析袋中,置于外界20mlph为7.4的磷酸缓冲液中,在温度为37℃,转速为150r/min的环境中,分别在0.5、1、2、4、6、8、10、24、48、72、96和120h取出外界磷酸缓冲液,用高效液相测得卡巴他赛前药和卡巴他赛的含量,从而得到卡巴他赛前药脂质体和临床型卡巴他赛药物相应的体外释放情况。如图1(d)可知,前药脂质体中卡巴他赛释放的速率明显慢于临床型的卡巴他赛,同时脂质体中释放出的卡巴他赛大部分为卡巴他赛活性分子,仅释放出很少量的卡巴他赛-dha前药分子,为脂质体能在肿瘤部位迅速产生效果提供了基础。
实施例5前药脂质体对前列腺癌和乳腺癌细胞的毒性作用。
考察实施例1中对肿瘤细胞增长的抑制作用,采用的方法为mtt。将贴壁的前列腺癌细胞du145和三阴性乳腺癌细胞hcc1937用胰酶消化下来,用dmem培养基将细胞吹打均匀,经细胞计数后稀释成适当浓度的细胞悬液。将肿瘤细胞接种于96孔板中,每孔5000个,100μl,4个复孔,过夜后,用移液枪小心地将原液吸走,加入预先配置好的一系列浓度梯度的游离和脂质体形式的卡巴他赛。空白组的培养基不加任何药物。继续培养72小时。向每孔加入30ul浓度为5mg/ml的mtt溶液,孵育4小时,加入二甲基亚砜(dmso)后用酶标仪检测各孔吸光度,测定波长为492nm。推算药物ic50。细胞相对活性计算公式为cellviability=(asample/acontrol)×100%。其中,a代表在492nm处的吸收值。细胞相对活性为实验组和空白组吸光度的比值,每组数据均取四个复孔的平均值。统计方法:细胞毒性评价通过t-检验分析,p<0.05即认为存在显著统计学差异。如图2a&b所示,可以观察到游离的卡巴他赛在体外对肿瘤细胞的杀伤力大于脂质体形式的卡巴他赛。游离的卡巴他赛ic50小于卡巴他赛前药脂质体。这更进一步验证了脂质体中的卡巴他赛释放慢于游离型的卡巴他赛。
实施例6前药脂质体对前列腺癌细胞的促凋亡效应。
实施例5中的du145细胞以1.5×105每孔的密度接种于六孔板中,过夜贴壁后再加入20nmol/l的游离卡巴他赛或卡巴他赛前药脂质体,24小时后将原细胞培养液全部转入5ml离心管中(含全部悬浮细胞),pbs洗涤贴壁细胞一次,用不含edta的0.25%的膜蛋白酶消化细胞,达到合适消化状态后,加入上一步骤中收集的细胞培养液终止消化,将细胞轻轻吹打下来后,一起转到离心管中,800转/分离心5分钟,去除上清。收集来的细胞用pbs重悬,再次800转/分离心5分钟,去除上清,用1xbindingbuffer500μl重悬细胞,计数,调整细胞数至1x106个/ml。取100μl细胞悬液加入5ml的上样管中,并将细胞凋亡较多的细胞株中剩余的细胞悬液等分到3个校正上样管中(空白,fitc单阳,pi单阳),每个样本的上样管中均加入5μlfitcaimexinv和5μl;校正上样管按需要加(空白管不加,fitc单阳加5μlfitc,pi单阳加5μl的pi),轻弹上样管底部使之混匀,室温下避光孵育15分钟。最后在各个上样管中再各加入1xbindingbuffer400μl,随即使用流式细胞仪枪测。如图2c所示,与细胞毒性实验类似,脂质体形式的卡巴他赛引起的凋亡少于游离型的卡巴他赛引起的细胞凋亡。但相比于未处理组,两者都引起了明显的细胞凋亡。
实施例7药代动力学实验
在体重约为250g左右的sd大鼠上进行卡巴他赛脂质体的药代动力学研究。向sd大鼠中静脉注射给药,脂质体给药剂量为12.5mg/kg。于给药后5min、30min、1h、2h、4h、7h分别采血0.5ml,血液样品静置2h后离心取上清后利用高效液相进行分析。实验共使用4只鼠。如图3a&b所示,结合我们之前的研究数据得出相比于临床型卡巴他赛,前药脂质体中的卡巴他赛明显具有更长的血液循环时间,明显延长了卡巴他赛的半衰期和血药浓度。
实施例8前药脂质体的抑肿瘤效果实验
本发明采用du145人前列腺癌异种移植裸鼠模型对实施例1前药脂质体进行抑瘤效果评价。当裸鼠皮下肿瘤体积达到100mm3时,开始给药。以尾静脉注射的方式进行给药,共4组,分别为生理盐水、游离型卡巴他赛(freectx,8mg/kg)、前药脂质体(lipoprodrug,8mg/kg)及高剂量前药脂质体(lipoprodrug,15mg/kg),对照组pbs组注射相同的体积,每隔两天注射一次,总共注射三次。给药结束后,继续观察并测量肿瘤的长宽以及裸鼠体重,根据肿瘤体积以及裸鼠体重变化,判断药物的抑肿瘤效果。脂质体卡巴他赛抑瘤效果图如图4所示。由图可知,相比于生理盐水对照组,游离型和前药脂质体型卡巴他赛都表现出优越的抗肿瘤效果。但游离型卡巴他赛治疗的小鼠表现出非常明显的体重下降现象,说明游离型卡巴他赛具有很大的毒副作用。但高剂量的前药脂质体不仅表现出非常好的治疗效果(7个瘤中有5个完全消除)还对体重变化无影响。说明前药脂质体的包裹形式能在明显提高卡巴他赛疗效的同时还能减少毒性,这为卡巴他赛的进一步临床转化提供了很好的策略。
实施例9前药脂质体的体内毒性分析实验
主要限制卡巴他赛的临床应用的缺陷是毒性太大,骨髓抑制明显,病人白细胞数量明显下降。本发明利用icr鼠评估卡巴他赛前药脂质体的骨髓抑制毒性。动物的给药方式,给药时间间隔和给药分组等均参照实施例8。在给药的第0,6,9和15天取血50μl使用血常规检测仪测定白细胞和中性粒细胞数量。如图5所示,游离型的卡巴他赛在给药后第6和第9天引起了明显的白细胞和中性粒细胞减少,而前药脂质体型卡巴他赛则对这两者数量没有任何影响。这说明本发明提供的前药脂质体能明显降低卡巴他赛的毒性。
- 还没有人留言评论。精彩留言会获得点赞!