一种防治雾霾的活性成分、制剂及其应用的制作方法
[0001]
本发明属于药物领域,具体涉及一种可以修复雾霾损伤的活性成分。
背景技术:
[0002]
环境空气中的颗粒物是城市主要空气污染物之一,其中包含多种对人体健康 有害的成分。根据颗粒的空气动力学当量直径大小,颗粒物主要分为pm2.5(即 颗粒物空气动力学当量直径≤2.5μm)和pm10(空气动力学当量直径≤10μm)。 其中,细微颗粒pm2.5在空气中的悬浮时间较长,严重影响大气环境空气质量 及能见度等,此外,pm2.5颗粒具有空气动力学当量直径小、相对面积大并且容 易携带有毒有害物质的特点,其主要有害成分包括重金属成分、可溶性无机离子、 有机污染物以及各种细菌、病毒等微生物。因此,pm2.5颗粒对人体健康的损害 大于pm10。
[0003]
pm2.5中的主要有害成分包括金属离子、可溶性无机离子、碳成分和有机污 染物四大类。其中,金属离子主要包括钠(na)、钾(k)、钙(ca)、铝(al)、 锌(zn)及砷(as)、汞(hg)、镉(cd)、铬(cr)等重金属,可溶性无机 离子包含硝酸盐(no
3-)、硫酸盐(so
42-)、铵盐(nh
4+
)、钠盐(na
+
)等,碳成分包 括有机碳(oc),元素碳(ec),有机污染物主要是多环芳烃类化合物。pm2.5 颗粒能通过机体的呼吸作用进入人体,并附着沉积在呼吸道和肺泡中,其中一些 可溶性成分还能进入血液循环系统,pm2.5的吸入对机体会造成不可逆转的损伤, 对人体健康产生极大威胁。有研究报道,我国pm2.5相关的死亡,包括卒中、 脑缺血性心脏病和肺癌的病例从2004年的约80万增加到2017年的超过196万。
[0004]
近年来我国大部分城市的空气污染越来越严重,而传统的雾霾防治是相对被 动的,人们通常会选择避免暴露在雾霾环境、选用空气净化器、防治口罩等防治 方式。目前对于雾霾防治主流还是使用pm2.5口罩,市面上出售的口罩有以下 几种,一是普通的棉口罩,这类口罩能滤除花粉之类的大颗粒物,对于pm2.5 这样的细颗粒物没有什么防治作用。二是活性炭口罩,但活性炭层只是增加了对 异味的滤除作用,并不能增加对颗粒物的防治效果。三是工业用的防尘口罩,这 类口罩对细颗粒物的防治有很好的效果,但是呼吸阻力很大,长时间佩戴,会引 起头晕、恶心等症状。四是医用口罩,主要用于防治细菌,对pm2.5颗粒也有 一定防治效果。五是医用防治口罩,也就是常说的n95口罩,对pm2.5防治率 达95%,但是这类口罩呼吸阻力过高,主要是通过物理阻碍和过滤起防治作用。 此外,还有一些口罩带有呼吸阀,可以使呼吸更顺畅一些,但不会增加对颗粒物 的防治效果。因此想要对pm2.5颗粒进行全面防治及人体接触细胞损伤后修复, 使用口罩这一方式必然会有以下缺点:
[0005]
1、材质:纤维和无纺布口罩,仅能起到机械阻挡作用,把大颗粒阻挡住,对于 直径小于2.5微米的颗粒物则很难阻挡。
[0006]
2、设计:口罩的一大先天缺陷,就是呼吸阻力大,不宜长期佩戴,德国劳 保条例规定戴n95口罩超过半小时需取下自由呼吸半小时并非无稽之谈,最流 行的医用n95口罩也爆出老人、孕妇、小孩等应谨慎使用的新闻。
[0007]
3、舒适性:女性群体最为头疼的是,口罩纤维直接刺激皮肤,引发不适甚 至皮肤炎症,一旦出汗还会损妆。
[0008]
4、卫生问题:纤维结构吸附污染物很难清洗,自身也成了污染源。
[0009]
5、气密性:中国人面部轮廓较浅,口罩不贴脸,四处漏风则起不到防霾作 用。
[0010]
6、垂坠感:工业和防尘口罩材质普遍较重,导致面部易疲劳。
[0011]
此外,市面上也有用于防止pm2.5的雾霾喷剂,其主要作用机制是在人的 皮肤上喷涂一层保护膜,通过物理阻隔达到隔绝效果,但对防止雾霾的吸入以及 损伤的治疗防治并无明显效果。
[0012]
现有降低pm2.5的危害的手段主要为一些降低pm2.5吸入的被动防御性手 段,但该方面的防御手段还存在诸多不足,难于有效拦截pm2.5的吸附。因此, 针对pm2.5损伤的治疗就显得尤为重要,然而现有技术中尚无兼备防治与损伤 后的治疗双重功能的技术报道。
技术实现要素:
[0013]
为解决现有pm2.5技术手段存在的不足,本发明旨在提供一种兼备防护与 损伤后的治疗双重功能的防治雾霾的活性成分,旨在治疗pm2.5所致的dna损 伤。
[0014]
本发明第二目的在于,提供一种所述的防治雾霾的活性成分在治疗pm2.5 所致的dna损伤药物中的应用。
[0015]
本发明第三目的在于,提供一种包含所述的防治雾霾的活性成分的制剂(药 物)。
[0016]
一种防治雾霾的活性成分,包括活性成分a、活性成分b、活性成分c中的 至少一种;
[0017]
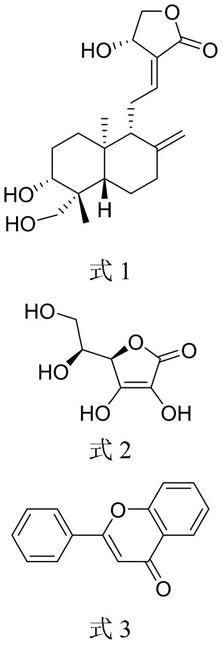
所述的活性成分a为具有式1结构式的化合物,或者由所述的式1结构式 化合物衍生的药学上可接受的盐、溶剂化物、酯以及糖苷化合物;
[0018]
所述的活性成分b为具有式2结构式的化合物,或者由所述的式2结构式 化合物衍生的药学上可接受的盐、溶剂化物、酯以及糖苷化合物;
[0019]
所述的活性成分c为具有式3结构式的化合物,或者为由所述的式3结构 式取代衍生的化合物;
[0020][0021]
本发明研究发现,所述的活性成分a、b、c特别是两种或者三种联用,可 以有效降低pm2.5所致的dna损伤,可以实现pm2.5损伤后的治疗。
[0022]
本发明中,活性成分a、b可以为具有各自结构式的化合物,或者该化合物 的溶剂化物(例如含结晶水的结晶)、药学上可接受的盐、或者酯(例如乙酯等 其他形式的有机酸酯),或者和糖类形成的糖苷类化合物。所述的活性成分c 可以是包含式3结构母核的任意化合物,例如在所述的式3的母核上进行取代或 者未取代的化合物。
[0023]
作为优选,所述的防治雾霾的活性成分为所述的活性成分a。
[0024]
本发明研究发现,单独使用活性成分a、b、c也能达到一定的治疗pm2.5 损伤的效果,特别是单独使用活性成分a,具有更优的修复pm2.5所致的损伤 的效果。
[0025]
作为优选,所述的防治雾霾的活性成分为活性成分a、活性成分b、活性成 分c中的两种的二元复合物。
[0026]
例如,所述的防治雾霾的活性成分为活性成分a、活性成分b的二元复合 物;或者为活性成分a、活性成分c的二元复合物;或者为活性成分b、活性成 分c的二元复合物。研究发现,所述的二元复合,有助于进一步提升对pm2.5 的修复效果,并减少活性成分a与活性成分b的用量。
[0027]
进一步优选,所述的防治雾霾的活性成分为活性成分b和活性成分c的二 元复合物。
[0028]
更进一步优选,所述的防治雾霾的活性成分中,活性成分b和活性成分c 的摩尔比为60~120:10~80;进一步优选为85~95:10~20。
[0029]
作为优选,所述的防治雾霾的活性成分包含活性成分a、活性成分b和活 性成分c的三元复合物。
[0030]
作为优选,所述的防治雾霾的活性成分中,活性成分a、活性成分b、活性 成分c的摩尔比为10~100:60~120:0~80;进一步优选为25~35:85~95:7~8。
[0031]
本发明所述的防治雾霾的活性成分,可以是各活性成分的混合物,也可以是 各活性成分在使用前相互独立存在的ab料。
[0032]
本发明通过所述的活性成分a、b、c的二元或者三元的复合,可以产生联 合协同药用防治特性,有助于协同修复雾霾造成的人体细胞dna损伤。
[0033]
本发明还提供了一种所述的防治雾霾的活性成分的应用,将其用于制备治疗 pm2.5所致dna损伤的药物。
[0034]
作为优选,所述的应用,将其和药学上可接受的添加剂联合,制得药学上可 接受的任意药物剂型。
[0035]
进一步优选,将其制得药学上可接受的经胃肠道给药剂型、非胃肠道给药剂 型;优选为非胃肠道给药剂型。所述的非胃肠道给药剂型优选为注射给药剂型、 呼吸道给药剂型、皮肤给药剂型等剂型,优选为呼吸道给药剂型。
[0036]
所述的呼吸道给药剂型为喷雾剂、气雾剂、粉雾剂、雾化剂等。
[0037]
所述的添加剂例如为赋形剂、抗氧剂等药学上允许添加的物料。
[0038]
本发明还提供了一种防治pm2.5的口罩,其复合有所述的防治雾霾的活性 成分。
[0039]
本发明所述的口罩和现有常规的口罩的区别仅在于,本申请所述的口罩中添 加有所述的防治雾霾的活性成分。
[0040]
例如,所述的口罩包括罩体,以及将罩体固定在佩戴者口、臂部位的固定部 件,所述的罩体面层、过滤层和与机体接触的基底层。
[0041]
本发明通过所述的活性成分,装载在口罩过滤层和/或基底层,通过机体细 胞吸收,在雾霾损伤细胞dna时能够及时对其进行dna修复,已达到日常防 治与修复的作用。
[0042]
本发明还公开了一种防治pm2.5的溶液制剂,其包含溶解有所述的防治雾 霾的活性成分的溶液。
[0043]
作为优选,所述的溶液中,活性成分a的摩尔浓度为25~35μm;活性成分 b的摩尔浓度为85~95μm;活性成分c的摩尔浓度为7~8μm。
[0044]
作为优选,所述的溶液制剂可以为喷雾剂、气雾剂、粉雾剂、雾化剂等。
[0045]
所述的防治pm2.5的溶液制剂,还包括容置所述防治雾霾的活性成分的溶 液的容器以及将其进行喷雾或者雾化的装置。
[0046]
本发明可通过主要是通过添加或喷涂等方式,覆盖肌肤或口罩装置中,实时 对人体进行雾霾损伤修复,制剂配方可用于生产喷剂、香水、过滤内芯等。
[0047]
有益效果
[0048]
1、不同于现有的被动防御技术手段,本发明首次提出一种用于pm2.5所致 损伤的治疗手段。
[0049]
2、本发明通过所述的活性成分,可有效提高雾霾影响下的细胞存活率,修 复pm2.5导致的机体细胞dna损伤,具有安全、高效、使用方便,无毒、无污 染的特点。
[0050]
3、本发明研究发现,通过所述的二元活性成分、特别是三元活性成分联合, 可以带来协同效果,进一步提升pm2.5的修复效果。
附图说明
[0051]
图1 mtt检测pm2.5对hbe细胞的影响;
[0052]
图2(a)cck-8检测不同浓度pm2.5对hbe细胞活性的影响;
[0053]
(b)cck-8检测pm2.5处理时间对细胞活性影响;
[0054]
图3 elisa实验检测细胞培养液中8-ohdg的含量;
[0055]
图4免疫荧光检测γ-h
2
ax与brca1的核内聚集点;
[0056]
图5 mtt实验检测b1修复雾霾损伤的人呼吸道上皮hbe细胞的最适浓 度;
[0057]
图6 mtt检测不同浓度pm2.5处理下b1对hbe细胞的修复作用;
[0058]
图7 cck-8检测不同浓度的c1对hbe细胞增殖活性的影响;
[0059]
图8 7aad-annexinv染色并用流式细胞仪检测细胞凋亡水平;
[0060]
图9免疫荧光检测不同药物处理的hbe细胞中γ-h
2
ax的聚集情况;
[0061]
图10 western blot检测dna损伤蛋白;
[0062]
图11 western blot检测dna双链断裂修复相关蛋白;
[0063]
图12 western blot检测dna双链断裂修复相关蛋白;
[0064]
图13 western blot检测dna双链断裂修复相关蛋白;
[0065]
图14 mtt检测a1对pm2.5处理的hbe细胞修复效果;
[0066]
图15 b1与c1联用对pm2.5处理的hbe细胞修复效果;
[0067]
图16 a1、b1、c1三药联用对pm2.5处理的hbe细胞修复效果;
[0068]
图17 a1、b1、c1三药联用最佳剂量对pm2.5处理的hbe细胞修复效果。
具体实施方式
[0069]
药剂以及物料
[0070]
活性成分a1:为式1结构式的化合物,分子式c
20
h
30
o
5
,购买于macklin, 纯度>98%;
[0071]
活性成分b1:为式2结构式的化合物,购于medchemexpress;
[0072]
活性成分c1:为式3结构式的化合物,购买于日本tci化学试剂公司,纯 度>98%;
[0073]
在本发明的研究中,通过mtt实验、cck-8实验、免疫荧光实验、单细胞 凝胶电泳实验、流式细胞术、免疫蛋白印迹等发现pm2.5能够引起人支气管上 皮细胞的氧化性dna双链断裂损伤,而活性成分复合制剂能够减少这种dna 损伤,并且能够增强细胞活性,对细胞具有一定的保护作用,其保护作用的机制 可能与dna损伤修复通路相关。
[0074]
第一部分:pm2.5引发疾病的主要机制
[0075]
pm2.5进入体内导致细胞内活性氧的积累并引发机体产生氧化应激;pm2.5能抑 制细胞的抗氧化机制,进而导致细胞dna损伤。
[0076]
实验结果
[0077]
1.雾霾可溶物造成的呼吸道上皮细胞损伤影响
[0078]
mtt实验使用人呼吸道上皮hbe细胞,通过雾霾pm2.5对hbe细胞进行 24小时处理。如图1所示,雾霾对人呼吸道上皮hbe细胞有损伤,并且随着雾 霾浓度的升高,人呼吸道上皮hbe细胞的活力值下降,即损伤更严重。
[0079]
同样使用cck-8检测人呼吸道上皮hbe细胞。
[0080]
cck-8检测
[0081]
(1)当hbe细胞生长到对数期时,往培养瓶里加入一定量的胰蛋白酶,放 在37℃环境中消化,800转/分钟离心5分钟后收集单细胞悬浮液,对细胞进行 计数,用dmem细胞培养液将细胞密度调节到每毫升含3
×
104个细胞。轻轻吹 匀之后接种于九十六孔板,每个孔加100μl细胞悬液,每个组至少做5个重复 孔。
[0082]
(2)细胞贴壁之后,按照实验需要,加入预先配置好的不同浓度的pm2.5 悬液,放到细胞培养箱内处理一定时间。
[0083]
(3)处理结束后,将每孔中的细胞培养基弃掉,用pbs清洗2~3次,随后 加入100μl不含血清的dmem培养基和10μl的cck-8,置于37℃环境下培 养2小时。
[0084]
(4)培养结束后用酶标仪检测450nm波长下的吸光度值。
[0085]
(5)根据测得的吸光度值在excel中制作细胞生长曲线。
[0086]
如图2:用不同浓度的pm2.5悬液(浓度分别为0μg/ml、16μg/ml、32μg/ml、 64μg/ml和128μg/ml)处理hbe细胞24小时,并用cck-8实验检测细胞活性。 结果如图2a所示,pm2.5能够减少hbe细胞的活性并呈现浓度依赖性的增加 趋势,pm2.5浓度越高,细胞dna损伤越多在32、64、和128μg/ml时均有统 计学意义。图2b是用128μg/ml的pm2.5悬液处理hbe细胞,检测0~48小时 后的细胞活性,发现pm2.5处理24小时后细胞活性开始降低,在48小时活性 降低较为明显,可能出现凋亡。
[0087]
2.pm2.5导致hbe细胞dna双链断裂
[0088]
8-ohdg检测
[0089]
(1)当hbe细胞生长到对数期时,用适量胰酶处理,进行消化,铺于12 孔板中,每孔5
×
105个细胞,加2ml细胞培养液,37℃稳定培养12小时后加 pm2.5悬液,使终浓度分别为0,16,32,64,128,256mg/ml,培养24小时 后收集细胞培养上清液于干净的2ml ep管中。
[0090]
(2)进行预实验预测8-ohdg的浓度范围,由于本实验样品中8-ohdg浓 度偏低,故使用真空冷冻干燥机对样品进行浓缩至完全干燥,检测时每管加入 200μl无血清dmem培养基重新溶解,使样品浓缩10倍以符合试剂盒的浓度检 测范围。
[0091]
(3)将保存于4℃冰箱的8-ohdg检测试剂盒各组分放室温下30分钟,进 行回温。
[0092]
(4)按照两个复孔的原则,计算需要的孔数量,将剩下的孔室放回试剂盒 干燥袋内,并塑封好,4℃保存。
[0093]
(5)设置空白对照孔、标准品孔及样品孔,其中,空白对照孔不加任何试 剂,其余孔分别加50μl的标准品或样品并加50μl的hrp-结合剂,轻轻混合均 匀,放置于37℃孵育1小时。
[0094]
(6)弃掉孔内液体,用稀释好的洗涤液洗涤三次,每次保持10s,洗涤后 弃净洗涤液,最后一次洗涤完,用吸水纸充分吸干孔中液体,或将孔倒置于干净 滤纸上,吸干孔内液体。
[0095]
(7)向孔内加入50μl a液和50μl b液,轻轻混匀,放置于37℃,避光孵 育15分钟,保持恒温并尽量避免温度波动。
[0096]
(8)加入50μl终止液,轻轻混匀,在10分钟内检测450nm波长下的吸光 度。根据试剂盒提供的分析方法进行8-ohdg浓度的计算,并将计算结果进行统 计学分析。注意样品中目的分子的浓度是否在试剂盒检测范围之内,可通过预实 验来大致判断样品中目的分子
的浓度,若浓度低于检测值可对样品低温干燥浓缩 处理,若浓度过高可对样品进行适当稀。
[0097]
8-ohdg是细胞氧化性损伤的最初标志物,通过检测不同浓度的pm2.5悬液 (浓度分别为0μg/ml、16μg/ml、32μg/ml、64μg/ml、128μg/ml和256μg/ml) 处理的hbe细胞培养液中8-ohdg的浓度来评价细胞dna的损伤程度。结果 如图3所示,细胞培养液中的8-ohdg浓度随pm2.5处理浓度的增加而增高, 在64、128和256μg/ml时具有统计学意义。
[0098]
免疫荧光
[0099]
(1)爬片:消化好的细胞制成单细胞悬液,接种于十二孔板中进行爬片, 每孔约5
×
105个细胞,根据实验需要对细胞进行药物处理。
[0100]
(2)固定:处理结束后,弃掉细胞培养液,pbs轻洗两次,每孔加入500μl 4%的多聚甲醛,室温下固定15分钟,弃掉4%多聚甲醛,用pbs浸洗三次。
[0101]
(3)破膜:加入500μl新鲜配制的0.1%的triton x-100进行破膜处理15分 钟,用pbs浸洗三次。
[0102]
(4)封闭:加入500μl新鲜配制的5%bsa溶液进行封闭,静置于室温1~2 小时。
[0103]
(5)孵一抗:根据目的蛋白抗体的使用比例加入一抗,4℃孵育过夜,回 收一抗,加pbs浸洗3次,每次持续5~10分钟。
[0104]
(6)孵二抗:根据二抗使用比例加入与一抗对应的荧光二抗,在室温条件 下下避光孵育1到2个小时,在用pbs浸洗3次,每次持续5~10分钟。
[0105]
(7)染核:根据dapi使用比例加入dapi染色液,在室温条件下避光染 色15分钟,在用pbs浸洗3次,5分钟/每次。
[0106]
(8)封片:准备干净的载玻片,于正中心滴加20~30μl的50%甘油,用镊 子小心取出细胞爬片,轻轻倒放在甘油位置,注意不要产生气泡,并注意避光操 作。
[0107]
(9)观察:将玻片至于荧光显微镜或激光共聚焦显微镜下观察,随机取多个视 野进行拍照并保存。
[0108]
γ-h
2
ax是磷酸化的h
2
ax,是细胞应对dna损伤时的早期产物,γ-h
2
ax 在核内断裂位点的聚集是dna双链断裂标志蛋白质分子。此外,brca1也是 一种dna损伤应激分子,能够迅速募集到损伤位点,这两个分子的核内聚集暗 示dna的损伤。采用免疫荧光实验检测γ-h
2
ax和brca1的细胞内定位,发现 128μg/ml的pm2.5处理后的细胞核内聚集有明显的γ-h
2
ax和brca1亮点,结 果如图4。由此,可以证明128μg/ml的pm2.5确实导致了hbe细胞的dna双 链断裂损伤。(*p<0.05)。
[0109]
第二部分:实施案例
[0110]
实施例1:
[0111]
活性成分b1对雾霾可溶物造成的呼吸道上皮细胞损伤修复
[0112]
mtt细胞增殖检测
[0113]
(1)收集对数期细胞,调整细胞悬液浓度,每孔加入100ul,铺板使待测细 胞调密度至1000-10000孔,(边缘孔用无菌pbs填充)。
[0114]
(2)5%co2,37℃孵育,至细胞单层铺满孔底(96孔平底板),加入浓度 梯度的药物,一般5-7个梯度,每孔100ul,继续孵育24小时,倒置显微 镜下观察。
[0115]
(3)孵育完成后,每孔加入20ulmtt溶液(5mg/ml,即0.5%mtt), 继续培养4h。若药
物与mtt能够反应,可先离心后弃去培养液,小 心用pbs冲2-3遍后,再加入含mtt的培养液。
[0116]
(4)终止培养,小心吸去孔内培养液。每孔加入150ul二甲基亚砜,置摇 床上低速振荡10min,使结晶物充分溶解。
[0117]
(5)在酶联免疫检测仪od490nm处测量各孔的吸光值。同时设置调零孔 (培养基、mtt、二甲基亚砜),对照孔(细胞、相同浓度的药物 溶解介质、培养液、mtt、二甲基亚砜)。
[0118]
通过mtt实验检测b1修复雾霾损伤24小时的人呼吸道上皮hbe细胞的 最适浓度,如图5所示,发现其最佳浓度范围为60~120μm。
[0119]
图6mtt实验使用人呼吸道上皮hbe细胞,雾霾处理24小时,雾霾浓度 为15μg/ml和30μg/ml时,最适b1溶液浓度为75~90μm,但是通过实验组和 对照组的比较发现,雾霾浓度过高(30μg/ml)会对人呼吸道上皮hbe细胞造 成不可逆的损伤,b1不能有效修复。
[0120]
实施例2:
[0121]
活性成分c1对雾霾可溶物造成的呼吸道上皮细胞损伤修复;
[0122]
cck-8检测
[0123]
(1)当hbe细胞生长到对数期时,往培养瓶里加入一定量的胰蛋白酶,放 在37℃环境中消化,800转/分钟离心5分钟后收集单细胞悬浮液,对细胞进行 计数,用dmem细胞培养液将细胞密度调节到每毫升含3
×
104个细胞。轻轻吹 匀之后接种于九十六孔板,每个孔加100μl细胞悬液,每个组至少做5个重复 孔。
[0124]
(2)细胞贴壁之后,按照实验需要,加入预先配置好的不同浓度的c1溶 液与pm2.5悬液,放到细胞培养箱内处理一定时间。
[0125]
(3)处理结束后,将每孔中的细胞培养基弃掉,用pbs清洗2~3次,随后 加入100μl不含血清的dmem培养基和10μl的cck-8,置于37℃环境下培 养2小时。
[0126]
(4)培养结束后用酶标仪检测450nm波长下的吸光度值。
[0127]
(5)根据测得的吸光度值在excel中制作细胞生长曲线。
[0128]
cck-8检测不同浓度的pm2.5和c1对hbe细胞活性的影响。
[0129]
为了确定用于处理细胞的c1浓度,本实验用0μm、5μm、25μm、50μm、 100μm、150μm的c1处理hbe细胞4小时,弃去细胞培养液,再培养24小时, 通过cck-8实验检测细胞增殖活性,如图7的左图所示,随着c1浓度的增加, 细胞活性不断增强,在50μm和100μm时达到峰值,150μm时其增殖活性有所 下降。此外,本发明还设置了pm2.5+c1组,即用c1预处理hbe细胞4小时后, 再加128mg/ml的pm2.5处理细胞24小时,结果如图7的右图所示,当c1浓 度为50μm和100μm时仍能最大强度的提高细胞增殖活性,因此,确定实验组 加c1的浓度为100μm。
[0130]
pm2.5造成人呼吸道上皮hbe细胞dna损伤,而严重的细胞dna损伤会 导致细胞凋亡,由于证实了c1能够降低细胞dna双链断裂程度,因此,通过 流式细胞仪检测了细胞凋亡情况。采用7aad-annexin v凋亡试剂盒对细胞进行 双染,再用流式细胞仪检测相应的荧光值,结果如图8所示,pm2.5能够引起部 分细胞的凋亡,包括早期凋亡和晚期凋亡,而c1的加入能够减少凋亡细胞。(*p <0.05)
[0131]
流式检测凋亡
[0132]
(1)取对数生长期的hbe细胞,用胰蛋白酶进行消化,接种于六孔板中, 每孔5
×
106个细胞,稳定生长12小时后,加一定浓度c1和雾霾处理细胞。
[0133]
(2)用胰蛋白酶消化处理好的hbe细胞,1000转/分钟,4℃离心5分钟, 收集细胞,并用4℃预冷的pbs洗涤细胞2次。注意操作要轻柔,尽量减少细胞 的人为损伤。
[0134]
(3)用4℃预冷的去离子水配制1
×
binding buffer,并用此buffer将细胞密 度调节到至1
×
106个/ml。
[0135]
(4)取100μl调节好密度的细胞,转移到另一ep管中,并向其中加入5μl pe annexin v和5μl 7-aad,轻柔混匀,室温条件下避光孵育15分钟。
[0136]
(5)向ep管中加入400μl的1
×
binding buffer,1小时内进行流式上机检 测。
[0137]
(6)用flowjo7.0软件对结果进行分析,多次实验后作统计学分析。
[0138]
γ-h
2
ax是细胞dna损伤的一种经典标志物。为了探究c1是否能够减少 pm2.5引起的γ-h
2
ax的核内聚集,利用免疫荧光实验检测γ-h
2
ax,并用激光共 聚焦显微镜进行观察拍照。实验分为三组:nc组、pm2.5组、c1+pm2.5组, 结果如图9所示,nc组只有极少数细胞核中出现少量微弱的亮斑,而pm2.5处 理组有明显的γ-h
2
ax的亮斑聚集在核内,c1+pm2.5组相对于pm2.5组核内亮 斑明显减少并趋于消失。由此,证明c1能够减少pm2.5引起的细胞核内γ-h
2
ax 的聚集。
[0139]
之前的结果表明,一定浓度的pm2.5导致细胞dna损伤和双链断裂,而一 定浓度的c1则能减少甚至清除这种损伤。接下来用western blot实验进一步探 索c1减少pm2.5引起的细胞dna损伤的机制。
[0140]
免疫印迹实验
[0141]
(1)sds-page胶的制备:分离胶的浓度根据目的蛋白的分子量进行选择, 具体配方见前文试剂配制。配胶前先将配胶板和孔梳彻底清洗干净,放入烘箱烘 干或用吹风机吹干,配胶板夹好后放置在配胶架上夹紧。按照配方配制分离胶, 充分混匀后缓慢均匀加入两层玻璃板中,并加入1ml无水乙醇压胶,使分离胶 胶面平整无气泡。室温下静置30分钟以上或37℃静置10分钟以上使胶彻底凝 固,胶凝后用滤纸尖吸净无水乙醇。将配好的浓缩胶混匀后缓慢加入分离胶上, 注意不要产生气泡,加完浓缩胶后迅速插上洁净的孔梳,室温静置20分钟以上 使其凝固。
[0142]
(2)蛋白质变性:将计算好的蛋白样品量(20μg至50μg)加到预冷的ep管 中,做好标记,再根据比例加入5
×
sds上样缓冲液,使得蛋白质样品与上样缓 冲液的体积比为4:1,混合均匀,在沸水浴中煮沸5~10分钟,使蛋白质变性, 结束后迅速将蛋白管取出,置于冰浴降温。
[0143]
(3)电泳上样:上样前将变性后的蛋白质样品放入离心机瞬时离心,使管 壁上的液体通过离心聚集下来。配制1l电泳缓冲液,将配好的胶板和电泳芯放 入电泳槽,加入电泳液,使其没过孔梳,在液面下将梳子垂直拔出。根据计算好 的蛋白质上样量将蛋白样品缓慢加入每个孔,盖上电泳槽盖子,注意电泳槽和电 泳仪正负极要对应,通电,设置80v电压,电泳30分钟后再用100v电压, 电泳直至溴酚蓝条带跑至胶的低端时,结束电泳。
[0144]
(4)转膜:配制1l转膜缓冲液,裁剪出稍大于凝胶面积大小的nc膜或 pvdf膜。电泳结束后,取出分离胶,浸于转膜缓冲液中2分钟。之后按照夹子 正极侧
→
海绵
→
滤纸
→
nc膜
→
分离胶
→
滤纸
→
海绵
→
夹子负极侧的顺序夹好夹 子,在夹紧前要赶走各层之间的气泡。将夹子放入电泳转移槽时检查夹子正负极 与槽子的正负极是否对应,将电泳槽埋在冰中进行转膜,80~100v,1~1.5小时, 具体转膜条件根据检测的目的蛋白分子量大小来确定。
[0145]
(6)封闭:转膜后,用镊子夹住nc膜的边缘,小心将其取出,在加5毫 升5%的脱脂牛奶封闭液,置于摇床最低转速,40转/分钟左右,室温封闭2小 时。
[0146]
(7)剪膜:根据实验目的查好所需蛋白质的分子量大小,依据protein ladder 对膜进行剪切,切取大于目的蛋白大小范围的膜,进行下一步抗体孵育。
[0147]
(8)一抗孵育:弃去封闭液,根据抗体使用比例加入一抗,4℃孵育12小 时以上或者过夜,孵育结束后用tbst洗膜三次,摇床70转/分钟左右,每次10 分钟。
[0148]
(9)二抗孵育:依照一抗的来源选择相应的二抗,室温孵育1~2小时,用 tbst洗涤三次,放在70转/分钟左右的摇床上洗,摇床70转/分钟左右,每次 10分钟。
[0149]
(10)显影:洗膜结束后将nc膜置于平板上,用滤纸吸干膜上液体,暗环 境下滴加显影液,使之均匀覆盖nc膜,放入凝胶扫描成像系统中进行显影。
[0150]
(11)用灰度扫描软件对结果进行灰度扫描,并进行统计学分析。
[0151]
实验检测了经典的损伤及修复相关蛋白,包括nhej修复通路和hr修复通 路的部分蛋白。结果显示c1预处理的hbe细胞dna损伤蛋白γ-h
2
ax和atm 水平明显下降(如图10);hr修复通路蛋白,包括brca1、磷酸化p53和ercc1 的水平随着c1浓度的增加明显增加(如图11),而rad51和53bp1的则随c1 浓度的增加而降低(如图12);nhej通路相关蛋白,包括dna-pkcs、ku80 的表达水平没有明显的变化(如图13)。说明c1预处理上调了细胞的hr修复 通路相关蛋白的水平,而对nhej修复通路影响不大,提示c1可能通过增强细 胞的hr修复通路来减少dna损伤。
[0152]
实施例3
[0153]
活性成分a1对雾霾可溶物造成的呼吸道上皮细胞损伤影响
[0154]
mtt细胞增殖检测
[0155]
(1)收集对数期细胞,调整细胞悬液浓度,每孔加入100ul,铺板使待测细 胞调密度至1000-10000孔,(边缘孔用无菌pbs填充)。
[0156]
(2)5%co2,37℃孵育,至细胞单层铺满孔底(96孔平底板),加入相应 浓度梯度的活性成分a1与pm2.5悬液,一般5-7个梯度,每孔100ul, 继续孵育24小时,倒置显微镜下观察。
[0157]
(3)孵育完成后,每孔加入20ulmtt溶液(5mg/ml,即0.5%mtt), 继续培养4h。若药物与mtt能够反应,可先离心后弃去培养液,小 心用pbs冲2-3遍后,再加入含mtt的培养液。
[0158]
(4)终止培养,小心吸去孔内培养液。每孔加入150ul二甲基亚砜,置摇 床上低速振荡10min,使结晶物充分溶解。
[0159]
(5)在酶联免疫检测仪od490nm处测量各孔的吸光值。同时设置调零孔 (培养基、mtt、二甲基亚砜),对照孔(细胞、相同浓度的药物 溶解介质、培养液、mtt、二甲基亚砜)。
[0160]
本mtt实验使用hbe细胞,通过雾霾pm2.5以浓度40μg/ml对人呼吸道 上皮细胞进行24小时处理,同时在各组中添加a1,并逐步提高a1含量。如图 14所示,40μg/ml雾霾对人呼吸道上皮hbe细胞损伤极大,并且随着a1浓度的 升高,人呼吸道上皮hbe细胞的活力值并出现明显上调,a1对40μg/ml雾霾造 成的损伤修复显著。
[0161]
实施例4-二元联合用药
[0162]
mtt细胞增殖检测
[0163]
(1)收集对数期细胞,调整细胞悬液浓度,每孔加入100ul,铺板使待测细 胞调密
度至1000-10000孔,(边缘孔用无菌pbs填充)。
[0164]
(2)5%co2,37℃孵育,至细胞单层铺满孔底(96孔平底板),加入相应 浓度梯度的活性成分b1、活性成分c1与pm2.5悬液,一般5-7个梯 度,每孔100ul,继续孵育24小时,倒置显微镜下观察。
[0165]
(3)孵育完成后,每孔加入20ulmtt溶液(5mg/ml,即0.5%mtt), 继续培养4h。若药物与mtt能够反应,可先离心后弃去培养液,小 心用pbs冲2-3遍后,再加入含mtt的培养液。
[0166]
(4)终止培养,小心吸去孔内培养液。每孔加入150ul二甲基亚砜,置摇 床上低速振荡10min,使结晶物充分溶解。
[0167]
(5)在酶联免疫检测仪od490nm处测量各孔的吸光值。同时设置调零孔 (培养基、mtt、二甲基亚砜),对照孔(细胞、相同浓度的药物 溶解介质、培养液、mtt、二甲基亚砜)。
[0168]
活性成分b1与活性成分c1联用对雾霾可溶物造成的呼吸道上皮细胞损伤 影响
[0169]
本mtt实验使用人呼吸道上皮hbe细胞,通过雾霾pm2.5以浓度15μg/ml 对细胞进行24小时处理,并逐步提高b1的添加,同时在各组中添加不同浓度 的c1进行联用,如图15所示,15μg/ml雾霾对人呼吸道上皮hbe细胞造成的 损伤,能被两药联用修复并且在c1浓度较低,b1浓度较高时,人呼吸道上皮 hbe细胞的活力值上调最为明显,修复效果最佳。
[0170]
实施例5-三元联合用药
[0171]
活性成分a1、活性成分b1与活性成分c1三药联用对雾霾可溶物造成的呼 吸道上皮细胞损伤影响
[0172]
mtt细胞增殖检测
[0173]
(1)收集对数期细胞,调整细胞悬液浓度,每孔加入100ul,铺板使待测细 胞调密度至1000-10000孔,(边缘孔用无菌pbs填充)。
[0174]
(2)5%co2,37℃孵育,至细胞单层铺满孔底(96孔平底板),加入相应 浓度梯度活性成分a1、活性成分b1、活性成分c1与pm2.5悬液, 一般5-7个梯度,每孔100ul,继续孵育24小时,倒置显微镜下观察。
[0175]
(3)孵育完成后,每孔加入20ulmtt溶液(5mg/ml,即0.5%mtt), 继续培养4h。若药物与mtt能够反应,可先离心后弃去培养液,小 心用pbs冲2-3遍后,再加入含mtt的培养液。
[0176]
(4)终止培养,小心吸去孔内培养液。每孔加入150ul二甲基亚砜,置摇 床上低速振荡10min,使结晶物充分溶解。
[0177]
(5)在酶联免疫检测仪od490nm处测量各孔的吸光值。同时设置调零孔 (培养基、mtt、二甲基亚砜),对照孔(细胞、相同浓度的药物 溶解介质、培养液、mtt、二甲基亚砜)。
[0178]
本mtt实验使用人呼吸道上皮hbe细胞,通过雾霾pm2.5以浓度40μg/ml 对细胞进行24小时处理,并添加90μm b1与10μm c1,同时在各组中逐步增 加a1浓度进行三药联用,40μg/ml雾霾对人呼吸道上皮hbe细胞造成的损伤, 能被三药联用修复,随着a1浓度增高,修复效果先上升再下降,这暗示着a1 在三药联用中,低浓度具有更好的治疗效果。
[0179]
最后根据均匀药物设计,得到三药联用最佳剂量范围:a1=30μm
±
5μm,mb1 =90μm
±
5μm,c1=7.5μm
±
0.5μm。如图16所示。
[0180]
对最佳浓度范围进行验证
[0181]
最佳药物剂量范围内的浓度配比效果与其他药物剂量配比药效相比有显著 提升,如图17所示。综上,发现pm2.5能够引起人支气管上皮细胞的氧化性dna双链断裂损伤,
而新筛选的植物提取物复合制剂能够减少这种dna损伤, 并且能够增强细胞活性,对细胞具有一定的保护作用,其保护作用的机制可能与 dna损伤修复通路相关。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1