单基因遗传病基因分析报告的生成方法及其电子设备与流程
本发明涉及生物信息技术领域,特别是指一种单基因遗传病基因分析报告的生成方法及其电子设备。
背景技术:
单基因遗传病是指受一对等位基因控制的遗传病,罕见病是指患病人数占总人口的0.65‰-1‰的疾病,多为慢性、严重性疾病,常危及生命。目前已知80%的单基因遗传病是罕见病。虽然单基因遗传病患病率低,但病种繁多,全球约6000至7000种,占人类疾病的10%左右。由于单基因遗传病种类多、每种病的患病人群少,以至于确诊时间平均高达五年,严重影响患者诊治。
在精准医学的热潮下,基因检测技术得到飞速的发展和应用。基因检测技术在单基因遗传病筛查与诊断中的应用,正在为有效筛查、控制和治疗单基因遗传病,提供有效的支撑与保障。然而,基因检测结果具有变异位点数据量非常大,导致临床研究人员需要付出大量的时间和精力分析变异位点数据,效率非常低。
技术实现要素:
有鉴于此,本发明实施例的目的在于提出一种单基因遗传病基因分析报告的生成方法及其电子设备,解决单基因遗传病基因分析耗时长、效率低的问题。
基于上述目的本发明提供的一种单基因遗传病基因分析报告的生成方法,包括:
获取样本,所述样本包括至少一个变异位点数据;
根据判定条件对所述变异位点数据进行筛选,得到至少一个目标变异位点数据;
依据所述目标变异位点数据,查询解读数据库得到所述目标变异位点数据对应的医学解读数据;
依据所述样本、所述至少一个目标变异位点数据及相应的医学解读数据,生成单基因遗传病基因分析报告。
可选的,当样本数为多个且具有亲属关系时,还包括:比较不同样本的所述至少一个目标变异位点数据及相应的医学解读数据,得到疾病的遗传规律及疾病致病基因,并记录于所述单基因遗传病基因分析报告中。
可选的,所述根据判定条件对所述变异位点数据进行筛选的过程中,如果任何一个所述变异位点数据均不符合所述判定条件,则依据所述样本生成阴性单基因遗传病基因分析报告。
可选的,还包括:根据所述样本确定所述判定条件,所述判定条件选自遗传模式、变异致病性、人群频率、基因组合、变异类型、基因和测序数据质控中的至少一者。
可选的,当所述判定条件为多个时,使用所述多个判定条件分别对所述变异位点数据进行筛选,将同时符合多个判定条件的所述变异位点数据确定为目标变异位点数据。
可选的,当所述样本包括表型信息时,所述判断条件还包括表型;
所述根据判定条件对所述变异位点数据进行筛选,得到至少一个目标变异位点数据,包括:
查询生物医学数据库中所述表型信息对应的库中变异位点数据,且所述至少一个变异位点数据中存在能够与所述库中变异位点数据相匹配的变异位点数据时,则该变异位点数据通过所述表型的筛选。
可选的,当所述判断条件包括人群频率时;
所述根据判定条件对所述变异位点数据进行筛选,得到至少一个目标变异位点数据,包括:
利用生物医学数据库查询所述变异位点数据的人群频率信息,依据查询结果对所述变异位点数据进行筛选。
可选的,所述判定条件包括变异致病性、人群频率和测序数据质控。
可选的,所述解读数据库包括疾病-介绍数据表、基因-疾病-第一参考文献数据表、基因-风险提示数据表、基因-风险提示-第二参考文献数据表、疾病-指导建议数据表和疾病-指导建议-第三参考文献数据表。
本发明实施例的另一个方面,提供了一种电子设备,包括:
至少一个处理器;以及,
与所述至少一个处理器连接的存储器;其中,
所述存储器存储可被所述一个处理器执行指令,所述指令被所述至少一个处理器执行,以使所述至少一个处理器能够执行如前所述的生成方法。
从上面所述可以看出,本发明实施例提供的一种单基因遗传病基因分析报告的生成方法及其电子设备,通过判定条件对多个变异位点数据进行筛选,缩小进入解读数据库的变异位点数据量,减少对无关变异位点数据的分析,提高解读的针对性和分析效率。再利用解读数据库对目标变异位点数据进行高效率的解读,获得相应医学解读数据并呈现于分析报告中。这样的方法不仅提高了对单基因遗传病基因的分析效率,而且符合科学规律、准确率高。受检者和临床医护人员通过阅读分析报告,即可了解目标变异位点数据与疾病间存在的可能关联,极大提高变异位点数据的可读性和实用性。
附图说明
图1为本发明提供的单基因遗传病基因分析报告的生成方法的一个实施例的流程示意图;
图2为本发明提供的单基因遗传病基因分析报告的生成方法实施例中筛选步骤的一种流程示意图;
图3为本发明提供的单基因遗传病基因分析报告的生成方法实施例中解读步骤的流程示意图;
图4为本发明提供的单基因遗传病基因分析报告的生成装置的一个实施例的结构示意图;
图5为本发明提供的电子设备的一个实施例的结构示意图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
需要说明的是,本发明实施例中所有使用“第一”和“第二”的表述均是为了区分两个相同名称非相同的实体或者非相同的参量,可见“第一”“第二”仅为了表述的方便,不应理解为对本发明实施例的限定,后续实施例对此不再一一说明。
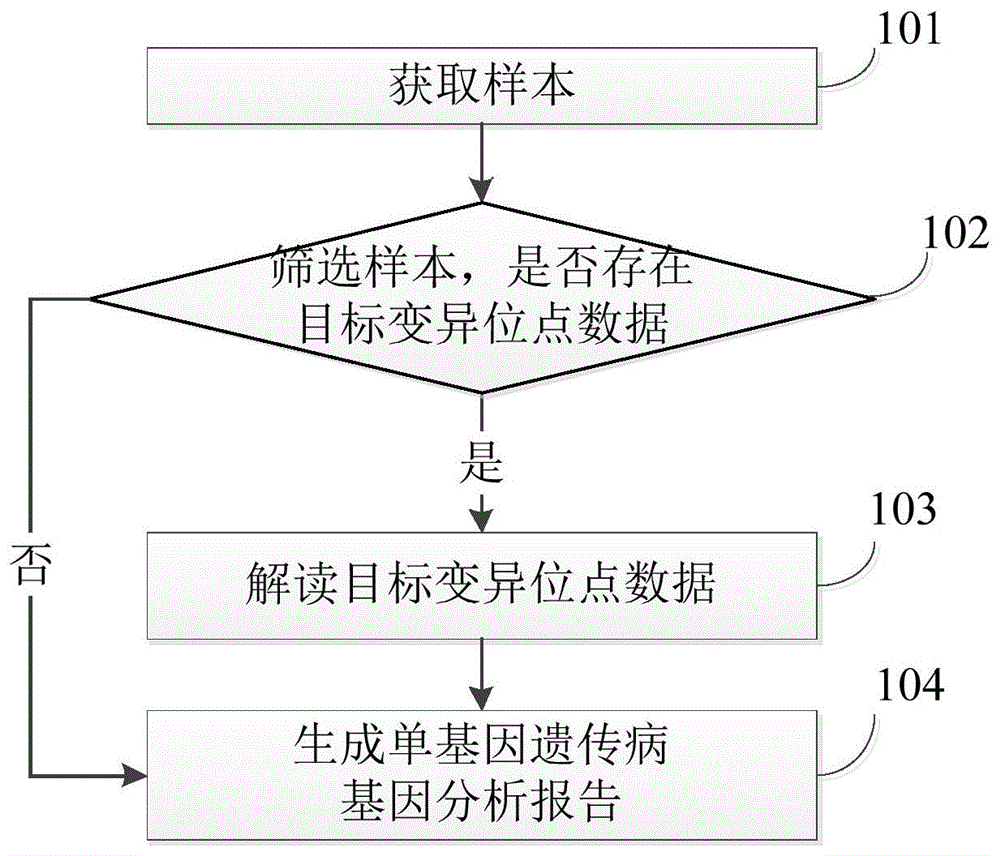
基于上述目的,本发明实施例的第一个方面,提出了一种科学准确、分析效率高的单基因遗传病基因分析报告的生成方法。如图1所示,为本发明提供的单基因遗传病分析报告的生成方法的一个实施例的流程示意图。
所示单基因遗传病分析报告的生成方法,包括:
步骤101:获取样本,所述样本包括至少一个变异位点数据;
步骤102:根据判定条件对所述变异位点数据进行筛选,得到至少一个目标变异位点数据;
步骤103:依据所述目标变异位点数据,查询解读数据库得到所述目标变异位点数据对应的医学解读数据;
步骤104:依据所述样本、所述至少一个目标变异位点数据及相应的医学解读数据,生成单基因遗传病基因分析报告。
从上述实施例可以看出,本发明实施例提供的单基因遗传病基因分析报告的生成方法,通过判定条件对多个变异位点数据进行筛选,缩小进入解读数据库的变异位点数据量,减少对无关变异位点数据的分析,提高解读的针对性和分析效率。再利用解读数据库对目标变异位点数据进行高效率的解读,获得相应医学解读数据并呈现于分析报告中。这样的方法不仅提高了对单基因遗传病基因的分析效率,而且符合科学规律、准备率高。受检者和临床医护人员通过阅读分析报告,即可了解目标变异位点数据与疾病间存在的可能关联,极大提高变异位点数据的可读性和实用性。
可选的,所述变异位点数据包括注释信息、测序数据质控和变异致病性。
其中,所述注释信息可利用基因注释工具对单基因遗传病检测得到的基因数据进行注释得到。所述注释信息包括但不限于phred质量值、等位基因状态、等位基因频率、变异类型、遗传模式、基因标识(用于标识基因)、转录本标识、hgvsc标识(hgvsc表示人类基因组织变异协会命名dna参考序列)、hgvsp(hgvsp表示人类基因组变异协会命名蛋白质参考序列)、外显子起始位置、外显子终止位置、外显子数目、内含子起始位置、内含子终止位置、内含子数目数和父/母检测状态等。
其中,所述测序数据质控直接来源于样本检测结果,能够用于评价变异位点的测序可靠性。
其中,所述变异致病性用于评价变异位点的致病性,例如:致病、疑似致病、临床意义未明、疑似良性、良性。
可选的,所述样本还包括受检者姓名、性别、年龄、临床诊断、治疗史、家族史、样本检测时间或样本检测机构等信息。这里,临床诊断包括表型信息,所述表型信息经过人类表型标准用语联盟(hpo)数据库匹配,可直接用于查询hpo数据库。
在一些可选实施方式中,当样本数为多个且具有亲属关系时,还包括:比较不同样本的所述至少一个目标变异位点数据及相应的医学解读数据,得到疾病的遗传规律及疾病致病基因,并记录于所述单基因遗传病基因分析报告中。可选的,以先证者及父亲/母亲样本为基础,设置遗传模式,能够快速、准确分析出与疾病遗传模式有临床意义的目标变异位点数据。
在一些可选实施方式中,所述根据判定条件对所述变异位点数据进行筛选的过程中,如果任何一个所述变异位点数据均不符合所述判定条件,则依据所述样本生成阴性单基因遗传病基因分析报告。本领域技术人员能够理解,这种情况下,所述样本包括的变异位点数据与单基因遗传病无关联,可以通过重新进行基因检测扩大样本中变异位点数据后再分析的方式,进一步确认。
在一些可选实施方式中,还包括:根据所述样本确定所述判定条件,所述判定条件选自遗传模式、变异致病性、变异类型、基因组合、基因、人群频率和测序数据质控中的至少一者。
其中,遗传模式条件用于对遗传模式进行筛选。具体的,遗传模式包括常染色体显性、常染色体隐性、x连锁显性、x连锁隐性等。例如:目前已知甲基丙二酸尿症的遗传模式为常染色体隐性,当已知样本的表型为甲基丙二酸尿症时,那么遗传模式条件确定为常染色体隐性,可针对多个所述变异位点数据中的遗传模式为常染色体隐性的变异位点数据进行分析,过滤掉其它遗传模式的变异位点数据,节省后续解读变异位点数据时间,更具针对性。
其中,变异致病性条件用于对变异位点数据中的变异致病性进行筛选。通常,变异致病性条件过滤所述变异位点数据中变异致病性为良性和疑似良性的数据,这样的变异位点数据显然与单基因遗传病基因分析无关,有利于提高分析效率。
其中,变异类型条件用于选择变异类型,以筛选出特定的变异类型。这里,变异类型具体包括但不限于剪接受体变异、剪接供体变异、移码突变、终止密码子获得、终止密码子缺失、起始密码子缺失、错义突变、无义突变、同义突变、编码框插入、编码框缺失、剪接区域突变、5’utr变异、3’utr变异、内含子变异、转录起始位点上游变异和转录起始位点下游变异等。
其中,基因组合(panel)条件用于确定关注的基因组合,以筛选出目标区域内的变异位点数据。
其中,基因条件用于选择关注的基因,以筛选出目标基因上的变异位点数据。
其中,测序数据质控条件用于筛选测序结果可靠的变异位点数据。例如,测序深度高的变异位点数据可靠性更好,利用测序数据质控条件能够将测序深度达到某一数值的变异位点数据筛选出,而未达到某一数值的变异位点数据过滤(未达到某一数据表明变异位点数据受限于测序结果,本身不可靠),以保障分析结果的科学准确性。
根据所述变异位点数据中包括遗传模式、变异致病性、变异类型、基因、测序数据质控等信息的具体情况,确定所述判定条件。
在一些可选实施方式中,当所述判定条件为多个时,使用所述多个判定条件分别对所述变异位点数据进行筛选,将同时符合多个判定条件的所述变异位点数据确定为目标变异位点数据。
参考图2,作为一种可选的实施方式,所述判定条件包括第一判定条件、第二判定条件……以及第n判定条件时,对所述至少一个变异位点数据201进行筛选的过程如下:
步骤202:判断所述变异位点数据是否符合第一判定条件,如果符合进行下一步;
步骤203:判断符合第一判定条件的变异位点数据是否符合第二判定条件,如果符合进行下一步;
按照这样的方式,直到步骤204,变异位点数据满足第n判定条件,也就是变异位点数据同时符合n条判定条件,则该变异位点数据为目标变异位点数据205。
这样的技术方案,不满足前一个判定条件的变异位点数据不需要下一个判定条件对其进行判断,能够有效减少变异位点数据筛选过程的数据处理量和处理时间,有助于提高整体的分析效率。
可选的,在筛选过程中,当没有变异位点数据满足某一判定条件时,整个筛选过程即可停止,生成以样本为依据的单基因遗传病基因分析报告。
作为另一个可选的实施方式,所述判定条件包括第一判定条件、第二判定条件……以及第n判定条件时,利用所述第一判定条件、第二判定条件……以及第n判定条件分别对所述至少一个变异位点数据进行筛选,对应得到满足第一判定条件的变异位点数据集合即第一集合,满足第二判定条件的变异位点数据集合即第二集合……满足第n判定条件的变异位点数据结合即第n集合,对第一集合、第二集合……和第n集合取交集即可得到目标变异位点数据。
可选的,如果交集为零,则生成以样本为依据的单基因遗传病基因分析报告。
在一些可选实施方式中,当所述样本包括表型信息时,所述判断条件还包括表型;
所述根据判定条件对所述变异位点数据进行筛选,得到至少一个目标变异位点数据的步骤102,具体包括:
查询生物医学数据库中所述表型信息对应的库中变异位点数据,且所述至少一个变异位点数据中存在能够与所述库中变异位点数据相匹配的变异位点数据时,则该变异位点数据通过所述表型的筛选。
当样本中存在大量变异位点数据时,利用表型信息结合生物医学数据的方式;一方面迅速减少变异位点数据的总量,缩短分析时间,另一方面由于表型信息和变异位点数据间的对应关系,使得对单基因遗传病的基因分析更加具有针对性,更加科学准确。例如,样本的表型信息是癫痫性脑病、婴儿痉挛,则通过表型条件可选筛选出癫痫性脑病、婴儿痉挛的变异位点数据,后续分析的目标变异位点数据均与癫痫性脑病、婴儿痉挛相关。
可选的,所述生物医学数据库包括人类表型标准用语联盟(hpo)数据库、公共人群频率数据库、dbsnp数据库和clinvar数据库。公共人群频率数据库、hpo数据库、dbsnp数据库和clinvar数据库均为公开较权威的数据库,具体内容不进行详细说明,仅举例说明生物医学数据的利用方式。例如,hpo数据库中包括表型信息及其对应的库中变异位点数据,通过样本的表型信息,可以查询到该表型信息对应的库中变异位点数据,当样本中的变异位点数据能够和所述库中变异位点数据匹配时,则该变异位点数据符合表型判定条件。
在一些可选实施方式中,当所述判断条件包括人群频率时;所述根据判定条件对所述变异位点数据进行筛选,得到至少一个目标变异位点数据的步骤102,具体包括:利用生物医学数据库查询所述变异位点数据的人群频率信息,依据查询结果对所述变异位点数据进行筛选。例如,公共人群频率数据库包括多种数据库,例如千人基因组全球,千人基因组东亚,esp6500全球,exac数据库,gnomad全球,gnomad东亚,gnomad南亚等,根据样本所属种族可确定适宜的人群频率数据库,通过查询变异位点数据在数据库中的人群频率信息,进而过滤掉在对照人群或普通人群中的变异,实现对变异位点数据的筛选。
在一些可选实施方式中,所述判定条件包括变异致病性、人群频率和测序数据质控。这里,测序数据质控用于筛选出高质量的测序结果对应的变异位点数据,过滤测序结果不可靠的变异位点数据,减少后续分析工作量同时有效避免不可靠变异位点数据对分析结果的影响,这是保障分析报告的科学准确性的基础。关于人群频率,如前所述,对于普通人群或对照人群较常见的变异,显然和单基因遗传病无关,因此通过人群频率条件,筛选单基因遗传病特异的变异位点数据,针对性更强,分析报告结果更可靠。此外,通过变异致病性条件过滤良性对应的变异位点数据,同样减少后续分析工作量。通过这三个判定条件,能够同时实现过滤变异位点数据和保障分析结果科学准确的目的。
在一些可选实施方式中,所述解读数据库包括疾病-介绍数据表、基因-疾病-第一参考文献数据表、基因-风险提示数据表、基因-风险提示-第二参考文献数据表、疾病-指导建议数据表和疾病-指导建议-第三参考文献数据表。
参考图3,对解读数据库的结构和使用方式进行详细的说明如下:
疾病-介绍数据表包括疾病标识、基因标识、疾病描述。可根据目标变异位点数据中的基因标识提取疾病-介绍数据表中的疾病标识和疾病描述。
基因-疾病-第一参考文献数据表包括疾病标识、基因标识、第一参考文献标识、第一参考文献内容。可根据疾病-介绍数据表已经确认的基因标识和疾病标识匹配基因-疾病-第一参考文献数据表的基因标识和疾病标识,提取相应的第一参考文献标识和第一参考文献内容。
基因-风险提示数据表包括疾病标识、基因标识、基因功能内容标识(图3中简写为功能标识)、基因功能内容(图3中简写为基因功能)、风险提示内容标识(图3中简写为风险标识)、风险提示内容(图3中简写为风险提示)。可根据疾病-介绍数据表已经确认的疾病标识和基因标识匹配基因-风险提示数据表的疾病标识和基因标识,提取相应的基因功能内容和风险提示内容。单基因遗传病检测报告中显示风险提示内容的另一个前提条件是acmg变异智能判定系统对基因变异判断的结果为致病或疑似致病的结果。
基因-风险提示-第二参考文献数据表包括基因功能内容标识、风险提示内容标识、第二参考文献标识、第二参考文献内容。可根据基因-风险提示数据表经确认的基因功能内容标识匹配基因-风险提示-第二参考文献数据表的基因功能内容标识,提取相应的第二参考文献标识和第二参考文献内容。可根据基因-风险提示数据表经确认的风险提示内容标识匹配基因-风险提示-参考文献数据表的风险提示内容标识,提取相应的第二参考文献标识和第二参考文献内容。
疾病-指导建议数据表包括疾病标识、疾病指导建议内容标识(图3中简写为建议标识)、疾病指导建议内容(图3中简写为指导建议)。可根据疾病-介绍数据表已确认的疾病标识匹配疾病-指导建议数据表的疾病标识,提取相应的疾病指导建议内容。
疾病-指导建议-第三参考文献数据表包括疾病指导建议内容标识、第三参考文献标识、第三参考文献内容。可根据疾病-指导建议数据表已确认的疾病指导建议内容标识匹配疾病-指导建议-第三参考文献数据表的疾病指导建议内容标识,提取相应的第三参考文献标识、第三参考文献内容。
根据样本、所述至少一个目标变异位点数据及相应的医学解读数据,本发明实施例生成的单基因遗传病分析报告可以包括以下内容中的一项或多项:
受检者姓名、性别、年龄、临床诊断、治疗史、家族史、样本检测时间或样本检测机构等信息;
样本质控:根据目标变异位点数据的测序数据质控获取;
变异统计:根据对至少一个目标变异位点数据中的基因标识、变异致病性进行统计获得;
基因:根据目标变异位点数据中的基因标识获取;
变异类型:根据目标变异位点数据中的变异类型获取;
遗传方式:根据目标变异位点数据中的遗传模式获取;
基因亚区;根据目标变异位点数据中的外显子起始位置,外显子终止位置,总外显子数,内含子起始位置,内含子终止位置,总内含子数等获取;
杂合/纯合:根据目标变异位点数据中的等位基因状态获取;
家属验证结果:根据目标变异位点数据的父/母检测状态确定(若父/母检测状态为未检测,则家属验证结果为父/母未检测;若父/母检测状态为未检测该变异,则家属验证结果为父/母未携带该变异;若父/母检测状态为检出该变异,则家属验证结果为父/母杂合或纯合的变异状态);
变异致病性:根据目标变异位点数据的变异致病性获取;
基因功能描述:根据解读数据库中基因-风险提示数据表获取;
基因相关单基因遗传病疾病:根据解读数据库中疾病-介绍数据表获取;
疾病风险提示:根据解读数据库中基因-风险提示数据表获取;
指导建议:根据解读数据库中疾病-指导建议数据表获取;
参考文献:根据解读数据库中基因-疾病-第一参考文献数据表、基因-风险提示-第二参考文献数据表、疾病-指导建议-第三参考文献数据表获取。
生成的单基因遗传病分析报告包括样本质控、基因、基因功能、疾病描述、疾病风险提示、指导建议、参考文献等,可供受检者与临床医生参考。单基因遗传病分析报告的形式、内容均可以根据样本、所述至少一个目标变异位点数据及相应的医学解读数据中获取的相关信息进行适应性调整,能够简洁、清晰展示本发明实施例中对样本中变异位点数据进行分析的结果即可。
可选的,单基因遗传病分析报告直接匹配至适宜的模板,这样的方式更加快捷,通过标准化的模板展现单基因遗传病分析报告也方便临床研究人员以熟悉的方式查看分析报告。
基于上述目的,本发明实施例的第二个方面,提出了一种科学准确、分析效率高的单基因遗传病基因分析报告的生成装置。如图4所示,为本发明提供的单基因遗传病分析报告的生成装置的一个实施例的结构示意图。
所述单基因遗传病基因分析报告的生成装置,包括:
获取样本模块301,用于获取样本,所述样本包括至少一个变异位点数据;
筛选模块302,用于根据判定条件对所述变异位点数据进行筛选,得到至少一个目标变异位点数据;
解读模块303,用于依据所述目标变异位点数据,查询解读数据库得到所述目标变异位点数据对应的医学解读数据;
生成报告模块304,用于依据所述样本、所述至少一个目标变异位点数据及相应的医学解读数据,生成单基因遗传病基因分析报告。
在一些可选实施方式中,当样本数为多个且具有亲属关系时,还包括:比较模块,所述比较模块用于比较不同样本的所述至少一个目标变异位点数据及相应的医学解读数据,得到疾病的遗传规律及疾病致病基因,并记录于所述单基因遗传病基因分析报告中。
在一些可选实施方式中,所述筛选模块302还用于:所述根据判定条件对所述变异位点数据进行筛选的过程中,如果任何一个所述变异位点数据均不符合所述判定条件,则所述生成报告模块304还用于依据所述样本生成阴性单基因遗传病基因分析报告。
在一些可选实施方式中,所述筛选模块302还用于:根据所述样本确定所述判定条件,所述判定条件选自遗传模式、变异致病性、人群频率、基因组合、变异类型、基因和测序数据质控中的至少一者。
在一些可选实施方式中,所述筛选模块302还用于:当所述判定条件为多个时,使用所述多个判定条件分别对所述变异位点数据进行筛选,将同时符合多个判定条件的所述变异位点数据确定为目标变异位点数据。
在一些可选实施方式中,当所述样本包括表型信息时,所述判断条件还包括表型;所述筛选模块302还用于:查询生物医学数据库中所述表型信息对应的库中变异位点数据,且所述至少一个变异位点数据中存在能够与所述库中变异位点数据相匹配的变异位点数据时,则该变异位点数据通过所述表型的筛选。
在一些可选实施方式中,当所述判断条件包括人群频率时;所述筛选模块302还用于:利用生物医学数据库查询所述变异位点数据的人群频率信息,依据查询结果对所述变异位点数据进行筛选。
在一些可选实施方式中,所述判定条件包括变异致病性、人群频率和测序数据质控。
在一些可选实施方式中,所述解读数据库包括疾病-介绍数据表、基因-疾病-第一参考文献数据表、基因-风险提示数据表、基因-风险提示-第二参考文献数据表、疾病-指导建议数据表和疾病-指导建议-第三参考文献数据表。
基于上述目的,本发明实施例的第三个方面,提出了一种单基因遗传病基因分析报告的生成装置的一个实施例。如图5所示,为本发明提供的单基因遗传病基因分析报告的生成方法的装置的一个实施例的硬件结构示意图。
如图5所示,所述装置包括:
一个或多个处理器401以及存储器402,图4中以一个处理器401为例。
所述单基因遗传病基因分析报告的生成方法的装置还可以包括:输入装置403和输出装置404。
处理器401、存储器402、输入装置403和输出装置404可以通过总线或者其他方式连接,图5中以通过总线连接为例。
存储器402作为一种非易失性计算机可读存储介质,可用于存储非易失性软件程序、非易失性计算机可执行程序以及模块,如本申请实施例中的所述单基因遗传病基因分析报告的生成方法对应的程序指令/模块(例如,附图4所示的获取样本模块301、筛选模块302、解读模块303和生成报告模块304)。处理器401通过运行存储在存储器402中的非易失性软件程序、指令以及模块,从而执行服务器的各种功能应用以及数据处理,即实现上述方法实施例的单基因遗传病基因分析报告的生成方法。
存储器402可以包括存储程序区和存储数据区,其中,存储程序区可存储操作系统、至少一个功能所需要的应用程序;存储数据区可存储根据单基因遗传病基因分析报告的生成装置的使用所创建的数据等。此外,存储器402可以包括高速随机存取存储器,还可以包括非易失性存储器,例如至少一个磁盘存储器件、闪存器件、或其他非易失性固态存储器件。在一些实施例中,存储器402可选包括相对于处理器401远程设置的存储器,这些远程存储器可以通过网络连接至会员用户行为监控装置。上述网络的实例包括但不限于互联网、企业内部网、局域网、移动通信网及其组合。
输入装置403可接收输入的数字或字符信息,以及产生与基因样本分析装置的用户设置以及功能控制有关的键信号输入。输出装置404可包括显示屏等显示设备。
所述一个或者多个模块存储在所述存储器402中,当被所述一个或者多个处理器401执行时,执行上述任意方法实施例中的单基因遗传病基因分析报告的生成方法。所述执行所述单基因遗传病基因分析报告的生成方法的装置的实施例,其技术效果与前述任意方法实施例相同或者类似。
本发明实施例提供了一种非暂态计算机存储介质,所述计算机存储介质存储有计算机可执行指令,该计算机可执行指令可执行上述任意方法实施例中的列表项操作的处理方法。所述非暂态计算机存储介质的实施例,其技术效果与前述任意方法实施例相同或者类似。
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。
另外,为简化说明和讨论,并且为了不会使本发明难以理解,在所提供的附图中可以示出或可以不示出与集成电路(ic)芯片和其它部件的公知的电源/接地连接。此外,可以以框图的形式示出装置,以便避免使本发明难以理解,并且这也考虑了以下事实,即关于这些框图装置的实施方式的细节是高度取决于将要实施本发明的平台的(即,这些细节应当完全处于本领域技术人员的理解范围内)。在阐述了具体细节(例如,电路)以描述本发明的示例性实施例的情况下,对本领域技术人员来说显而易见的是,可以在没有这些具体细节的情况下或者这些具体细节有变化的情况下实施本发明。因此,这些描述应被认为是说明性的而不是限制性的。
尽管已经结合了本发明的具体实施例对本发明进行了描述,但是根据前面的描述,这些实施例的很多替换、修改和变型对本领域普通技术人员来说将是显而易见的。例如,其它存储器架构(例如,动态ram(dram))可以使用所讨论的实施例。
本发明的实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!