一种复合纳米给药系统及其在妇科肿瘤治疗中的应用的制作方法
本发明涉及生物医药技术领域,尤其涉及一种复合纳米给药系统及其在妇科肿瘤治疗中的应用。
背景技术:
卵巢癌是最常见的妇科肿瘤之一,其发病率仅次于子宫颈癌和子宫体癌而位居第三位。卵巢癌不仅有极高的发病率,其死亡率也高居女性生殖系统恶性肿瘤之首,这对广大女性健康的和无数家庭的幸福造成了严重影响:目前,我国卵巢癌发病率为8.14/10万,死亡率为3.13/10万。卵巢癌不易在早期诊断发现,所以约70%的患者在首次就诊时已经确诊为晚期,这让疾病的有效治疗面临着巨大的挑战,并且根据国内外治疗经验,卵巢癌患者的五年生存率仅为20%~30%,近年来并没有显著的提高。
手术和化疗是肿瘤治疗的常用手段,化疗药的毒副作用是临床上普遍存在的问题,因其导致的病人生活质量下降,最终不得不放弃治疗的情况很常见。因此在治疗肿瘤的同时解决化疗的毒副作用,改善生活质量成为当前研究的热点。
纳米技术近几十年来应用于医药研究中,取得了初步的成果。脂质体是一种纳米给药系统,因其成分和结构与细胞膜相似,其生物相容性与合成材料相比具有独特的优势。并且由于制备工艺较简单,材料易得(如大豆磷脂已有供注射用的药用辅料批文),已经有部分剂型进入工业化生产,但是脂质体存在容易泄漏的缺点,导致脂质体的稳定性降低,载药量减少,最终减马脂质体的治疗效果。
因此,本领域亟需开发一种能够降低抗肿瘤药物的毒性,提高抗肿瘤效果和患者顺应性的给药系统。
技术实现要素:
本发明的目的是针对现有技术存在的问题,提供一种复合纳米给药系统及其在妇科肿瘤治疗中的应用。
为实现上述目的,本发明采用的技术方案是:
一种复合纳米给药系统,包括:(a)作为活性成分的紫杉醇与姜黄素组合物;(b)作为靶向材料的mirna-ha;(c)作为载体的羧基化的磁性介孔二氧化硅;
所述羧基化的磁性介孔二氧化硅纳米给药系统对肿瘤细胞具有主动靶向结合与靶向抑制能力,能够有效地抑制肿瘤细胞的迁移与侵袭;靶向材料中的mirna作为发生靶向抑制剂;靶向材料中的透明质酸(ha)作为主动靶向递送的靶头分子,利用其与肿瘤细胞表面cd44受体的特异性结合,实现对肿瘤细胞的靶向识别,同时ha还作为mirna与所述羧基化的磁性介孔二氧化硅之间的偶联分子。
作为上述方案的进一步限定,所述羧基化的磁性介孔二氧化硅的制备方法,包括如下步骤:
a)磁核(fe3o4)的制备:
使用250ml的三口烧瓶,加入蒸馏水120ml,通氮气,再向烧瓶中加入4.81gfecl3.6h2o和2.12gfec12.4h2o,机械搅拌,加热到65℃,加入10ml28%氨水溶液,向其中加入0.85ml油酸,反应3h,水洗至中性,再用无水乙醇洗两到三次,得到fe3o4纳米粒子,把所得到的fe3o4纳米粒子分散在氯仿中,约超声30min至溶解,得到fe3o4的含量为0.1g/ml;
b)磁性介孔二氧化硅的制备:
取1.0gctab分散在50ml的水溶液中,完全溶解之后,加入2ml四氧化三铁的氯仿分散液,超声分散均匀,然后升温至60~70℃,使氯仿蒸发完全,得到fe3o4的水分散液,再加入350ml水和2.8mlnaoh(2m),搅拌使之混合均匀后,升温至35~40℃,再加入5mlteos和20ml乙酸乙酯,反应6~10h,分别水洗三次,无水乙醇洗三次,得到fe3o4/msio2纳米粒子;再将得到的fe3o4/msio2纳米粒子分散到400ml含有4.0g的nh3no3的95%乙醇溶液中,在70~90℃条件下回流6~10h,得到的产物先用乙醇洗涤然后再用水洗涤,真空条件下40℃烘干得到磁性介孔二氧化硅备用;
c)氨基化的磁性介孔二氧化硅的制备:
取1g磁性介孔二氧化硅和250ml无水甲苯混合,超声分散均匀,加入20mlaptes,并于80℃下搅拌反应12h,用甲苯洗两次,用无水甲醇洗两次,最后于8000rpm离心10min,真空干燥后得到氨基化的磁性介孔二氧化硅;
d)羧基化的磁性介孔二氧化硅的制备:
取10mg氨基化的磁性介孔二氧化硅分散在20ml的dmso溶液中,加入15mg丁二酸酐和10mg三乙胺,并于60℃下搅拌反应24h,所得到的产物先用乙醇洗再用水洗,真空干燥后即得到羧基化的磁性介孔二氧化硅。
作为上述方案的进一步限定,所述活性成分中紫杉醇的浓度为0.05~10mg/ml,所述姜黄素的浓度为20~80ng/ml。
作为上述方案的进一步限定,所述靶向材料的浓度为10~30mg/ml。
作为上述方案的进一步限定,所述靶向材料与羧基化的磁性介孔二氧化硅的质量比为1:0.5~2。
作为上述方案的进一步限定,所述透明质酸钠的分子量为37kda。
作为上述方案的进一步限定,所述mirna为mir-124。
本发明还提供所述的一种复合纳米给药系统的制备方法,包括如下步骤:
s1、合成靶向材料mirna-ha
s11)将透明质酸钠溶于去离子水中,室温下溶胀12~24h,得到透明质酸钠水溶液;所述的透明质酸钠水溶液的浓度为10~30mg/ml;
s12)将1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)依次滴加到透明质酸钠水溶液中,活化透明质酸钠中的羧基1~2h,得到混合溶液;所述的edc与nhs的摩尔比为1:1~0.5,透明质酸钠中的羧基与edc的摩尔比为1:0.5~2;
s13)将mirna加到上述混合溶液中,室温、搅拌条件下反应24~48h;反应结束后将反应液转移至透析袋中,两端夹紧,去离子水进行透析纯化后,将透析袋中的溶液冷冻干燥,得到产物mirna-ha;所述的透明质酸钠中的羧基与mirna的摩尔比为10~5:1;
s2、合成复合纳米给药系统
s21)将靶向材料mirna-ha溶于去离子水中,室温下溶胀12~24h;
s22)将edc与nhs依次滴加到步骤s21)得到的溶液中,活化1~2h后,将羧基化的磁性介孔二氧化硅滴加到上述溶液中,室温条件下搅拌2~4h得到反应液;所述的edc/nhs的摩尔比为1:1~0.5,靶向材料mirna-ha上的羧基与edc的摩尔比为1:1~2;
s23)反应液离心并用去离子水洗涤后进行纯化,冷冻干燥即得复合纳米给药系统。
作为上述方案的进一步限定,所述透析袋的截留分子量为3500~375000,透析纯化时间为24~48h。
本发明还提供所述的一种复合纳米给药系统在妇科肿瘤治疗中的应用,用于制备用于治疗妇科肿瘤的药物。
作为上述方案的进一步限定,所述肿瘤为卵巢癌、乳腺癌、子宫癌或其组合。
与现有技术相比,本发明的有益效果是:
(1)本发明提供一种复合纳米给药系统,利用羧基化的磁性介孔二氧化硅作为药物载体,一方面保证了较大的药物包载量,另一方面为功能团的修饰提供了可修饰点;通过靶向材料mirna-ha的修饰,可以增加羧基化的磁性介孔二氧化硅纳米给药系统的肿瘤细胞靶向性及对发生妇科肿瘤细胞的靶向抑制,提高对肿瘤细胞迁移与侵袭的抑制率。
(2)本发明经过广泛而深入的研究,首次开发了一种具有磁靶向作用并经过功能修饰的介孔二氧化硅为载体材料包裹抗肿瘤活性物质及能与之协同产生抗肿瘤作用物质的复合纳米给药系统。本发明开发的复合纳米给药系统包括紫杉醇、姜黄素、靶向抑制性mirna(尤其是靶向抑制ets-1表达的mirna)和具有磁靶向作用并经过功能修饰的介孔二氧化硅,其紫杉醇、姜黄素和mirna协同产生抗肿瘤作用,该复合纳米给药系统具有增强抗肿瘤效果,减弱毒副作用,提高药物的稳定性和降低耐药等功能,提高患者的顺应性。
(3)本发明制备的复合纳给药系统能够发挥约物的协同抗癌效果,具有运送活性物质、肿瘤治疗、逆转或降低耐药等功能,被动靶向于肿瘤细胞,可生物降解、缓控释、被动靶向的载体材料,适于抗肿瘤活性物质的递送。
(4)本发明方法设计合理,制备工艺简单,具有广阔的应用前景,同时也为相应给药系统的设计和发展打下基础。
附图说明
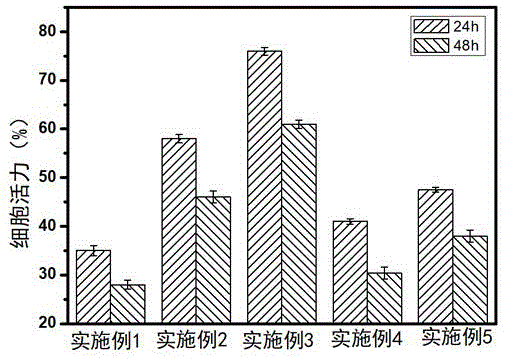
图1为本发明实施例1~5制得的复合纳米给药系统对人卵巢癌skov-3细胞的毒性试验结果。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明;应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明;除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
下面通过具体的实施例子对本发明做进一步的详细描述。
在本发明的复合纳米给药系统中还可以含有额外的和/或辅助的其他抑制肿瘤生长的活性成分。
在本发明药物中,所述羧基化的磁性介孔二氧化硅纳米给药系统对肿瘤细胞具有主动靶向结合与靶向抑制能力,能够有效地抑制肿瘤细胞的迁移与侵袭;靶向材料中的mirna作为靶向抑制剂;靶向材料中的透明质酸(ha)作为主动靶向递送的靶头分子,利用其与肿瘤细胞表面cd44受体的特异性结合,实现对肿瘤细胞的靶向识别,同时ha还作为mirna与所述羧基化的磁性介孔二氧化硅之间的偶联分子。采用紫杉醇、姜黄素和靶向抑制性mirna作为主要的活性成分,紫杉醇、姜黄素和靶向抑制性mirna能够协同产生抗肿瘤作用,增强抗肿瘤效果,减弱毒副作用,降低耐药性。
在本发明中,作为第一活性成分之一的紫杉醇是一种具有抗肿瘤活性的药物,对发病率较高的卵巢癌、子宫癌和乳腺癌等癌症有效,紫杉醇可结合于微管蛋白的特异性位点,能够促进微管的聚合,并使之稳定化,从而干扰微管的功能,如细胞运动性、细胞内转运以及有丝分裂,从而抑制影响肿瘤细胞的生长。紫杉醇作为一种非特异性抗肿瘤药物,在杀死肿瘤肿瘤细胞的同时,对正常细胞也具有较强的杀伤作用,从而产生许多副作用,如恶心、呕吐、脱发、全身酸痛,造成患者的生活质量下降。姜黄素是从姜科姜黄属植物姜黄、郁金、莪术的干燥根茎中提取的一种天然有效成分,药理作用广泛,毒性低,耐受性好。姜黄素已被证明能够诱导细胞凋亡,抑制信号通路,抗血管形成,发挥抗肿瘤作用。本发明选择将姜黄素于紫杉醇联用作为抗肿瘤的主要活性成分,可进一步提高协同治疗效果,并降低毒副作用。
除了紫杉醇之外,第一活性成分还包括紫杉醇的类似物或衍生物,例如多西紫杉醇。
在本发明中,另一种主要的活性成分为靶向抑制性mirna(作为第二活性成分)。
微小rna(microrna)是一类单链小分子非编码rna,长度约22个核苷酸,广泛存在于真核生物中,主要通过与靶mrna3’非翻译区完全或部分互补结合,导致靶mrna降解或转录后翻译抑制,从而调控靶基因的表达。
本发明人通过大量筛选,发现靶向抑制性mirna与紫杉醇具有优异的协同效果。
mir-124是一种乳腺癌凋亡相关的微小rna(microrna)。有研究报道mir-124可通过靶向于ets-1抑制乳腺癌mcf-7和mda-mb-231细胞的增殖。可通过抑制细胞周期蛋白而抑制肿瘤细胞增殖,并具有调节细胞粘附分子的功能,mirna相对于一般药物也存在分子量较大,不易被细胞摄取,以及体内稳定性问题。因此,本发明选择将mirna与透明质酸结合作为靶向材料,透明质酸(ha)作为主动靶向递送的靶头分子,利用其与肿瘤细胞表面cd44受体的特异性结合,实现对肿瘤细胞的靶向识别,以提高协同治疗效果。
紫杉醇和靶向抑制性mirna通过不同的作用机制协同抑制肿瘤细胞生长,提高抗肿瘤效果,同时与紫杉醇和靶向抑制性mirna的单独给药相比,紫杉醇和靶向抑制性mirna协同给药能够分别降低紫杉醇和靶向抑制性mirna的给药用量,从而降低副作用,提高患者的顺应性。
本发明的复合纳米给药系统的施用方式没有特别限制,代表性的施用方式包括(但并不限于):局部给药、瘤旁、瘤内、腹膜内、静脉内、口服、外用等。
一种优选的方法是将复合纳米给药系统通过注射进行给药,例如静脉注射,肌肉注射、皮下注射、皮内注射、瘤内注射、瘤旁注射、透皮给药、术后给药等方式。
药物制剂应与给药方式相匹配。本发明的药物组合物优选被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约1微克/千克体重-约5毫克/千克体重。此外,本发明药物还可与其他治疗剂(如抗肿瘤剂)一起使用(包括之前、之中或之后使用)。
使用药物组合物时,是将安全有效量的药物施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约8毫克/干克体重,较佳地该剂量是约10微克/千克体重-约1毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
在本发明中,复合纳米给药系统适用于制备用于治疗癌症的药物,尤其适合制备用于治疗卵巢癌、乳腺癌等及其术后复发的癌症的药物,在本发明的一个优选实施例中,所述的癌症选自下组:卵巢癌、乳腺癌、子宫癌或其组合。
实施例1
本实施例提供一种复合纳米给药系统,包括:(a)作为活性成分的紫杉醇与姜黄素组合物;(b)作为靶向材料的mirna-ha;(c)作为载体的羧基化的磁性介孔二氧化硅;
所述活性成分中紫杉醇的浓度为5mg/ml,所述姜黄素的浓度为50ng/ml;所述靶向材料的浓度为20mg/ml;所述靶向材料与羧基化的磁性介孔二氧化硅的质量比为1:1;所述透明质酸钠的分子量为37kda;所述mirna为mir-124,所述mir-124的序列为uaaggcacgcggugaaugcc。
所述羧基化的磁性介孔二氧化硅的制备方法,包括如下步骤:
a)磁核(fe3o4)的制备:
使用250ml的三口烧瓶,加入蒸馏水120ml,通氮气,再向烧瓶中加入4.81gfecl3.6h2o和2.12gfec12.4h2o,机械搅拌,加热到65℃,加入10ml28%氨水溶液,向其中加入0.85ml油酸,反应3h,水洗至中性,再用无水乙醇洗两到三次,得到fe3o4纳米粒子,把所得到的fe3o4纳米粒子分散在氯仿中,约超声30min至溶解,得到fe3o4的含量为0.1g/ml;
b)磁性介孔二氧化硅的制备:
取1.0gctab分散在50ml的水溶液中,完全溶解之后,加入2ml四氧化三铁的氯仿分散液,超声分散均匀,然后升温至65℃,使氯仿蒸发完全,得到fe3o4的水分散液,再加入350ml水和2.8mlnaoh(2m),搅拌使之混合均匀后,升温至35~40℃,再加入5mlteos和20ml乙酸乙酯,反应8h,分别水洗三次,无水乙醇洗三次,得到fe3o4/msio2纳米粒子;再将得到的fe3o4/msio2纳米粒子分散到400ml含有4.0g的nh3no3的95%乙醇溶液中,在80℃条件下回流8h,得到的产物先用乙醇洗涤然后再用水洗涤,真空条件下40℃烘干得到磁性介孔二氧化硅备用;
c)氨基化的磁性介孔二氧化硅的制备:
取1g磁性介孔二氧化硅和250ml无水甲苯混合,超声分散均匀,加入20mlaptes,并于80℃下搅拌反应12h,用甲苯洗两次,用无水甲醇洗两次,最后于8000rpm离心10min,真空干燥后得到氨基化的磁性介孔二氧化硅;
d)羧基化的磁性介孔二氧化硅的制备:
取10mg氨基化的磁性介孔二氧化硅分散在20ml的dmso溶液中,加入15mg丁二酸酐和10mg三乙胺,并于60℃下搅拌反应24h,所得到的产物先用乙醇洗再用水洗,真空干燥后即得到羧基化的磁性介孔二氧化硅。
上述的一种复合纳米给药系统的制备方法,包括如下步骤:
s1、合成靶向材料mirna-ha
s11)将透明质酸钠溶于去离子水中,室温下溶胀18h,得到透明质酸钠水溶液;所述的透明质酸钠水溶液的浓度为10~30mg/ml;
s12)将1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)依次滴加到透明质酸钠水溶液中,活化透明质酸钠中的羧基1.5h,得到混合溶液;所述的edc与nhs的摩尔比为1:1,透明质酸钠中的羧基与edc的摩尔比为1:1;
s13)将mirna加到上述混合溶液中,室温、搅拌条件下反应36h;反应结束后将反应液转移至截留分子量为3500的透析袋中,两端夹紧,去离子水进行透析纯化36h后,将透析袋中的溶液冷冻干燥,得到产物mirna-ha;所述的透明质酸钠中的羧基与mirna的摩尔比为8:1;
s2、合成复合纳米给药系统
s21)将靶向材料mirna-ha溶于去离子水中,室温下溶胀18h;
s22)将edc与nhs依次滴加到步骤s21)得到的溶液中,活化1h后,将羧基化的磁性介孔二氧化硅滴加到上述溶液中,室温条件下搅拌3h得到反应液;所述的edc/nhs的摩尔比为1:1,靶向材料mirna-ha上的羧基与edc的摩尔比为1:1.5;
s23)反应液以8000r/min的转速离心并用去离子水洗涤后进行纯化,冷冻干燥即得复合纳米给药系统。
本实施例制得的复合纳米给药系统的平均粒径为125.9nm,多分散系数为0.168,包封率>97%,紫杉醇的载药量为3.752%,姜黄素的载药量为3.148%,mir-124的载药量为0.1476nmmol/mg。
实施例2
本实施例提供一种复合纳米给药系统,与实施例1相比,不同之处在于:仅采用紫杉醇作为活性成分,所述活性成分中紫杉醇的浓度为5mg/ml。
其余与实施例1均相同。
实施例3
本实施例提供一种复合纳米给药系统,与实施例1相比,不同之处在于:仅采用姜黄素作为活性成分,所述活性成分中姜黄素的浓度为50ng/ml。
其余与实施例1均相同。
实施例4
本实施例提供一种复合纳米给药系统,与实施例1相比,不同之处在于:靶向材料为ha。
其余与实施例1均相同。
实施例5
本实施例提供一种复合纳米给药系统,与实施例1相比,不同之处在于:作为载体的为氨基化的磁性介孔二氧化硅。
其余与实施例1均相同。
试验例
体外抑制实验
采用mtt法检测本发明实施例1~5制得的复合纳米给药系统对卵巢癌细胞skov-3细胞增殖的抑制作用。取对数生长期的skov-3细胞接种于96孔培养板,贴壁后分别加入实施例1~5制得的5种制剂,各组的紫杉醇和姜黄素的浓度保持一致,分别为5mg/ml和50ng/ml。空白对照组加入不含药的培养基(control),分别培养24/48h后将含药培液吸出,进行mtt法测定。
结果如图1所示,48小时的相对增值率共载紫杉醇和姜黄素的纳米粒组(实施例)最小,明显小于两个单药组。
上述结果表明,在本发明中,将姜黄素作为活性成分与紫杉醇联用时,可产生协同作用。联用时的对肿瘤细胞的抑制效果明显优于单用。且本发明通过采用羧基化的磁性介孔二氧化硅作为载体形成纳米给药系统,其对肿瘤细胞具有主动靶向结合与靶向抑制能力,能够有效地抑制肿瘤细胞的迁移与侵袭;同时靶向材料中的mirna可作为靶向抑制剂;靶向材料中的透明质酸(ha)作为主动靶向递送的靶头分子,利用其与肿瘤细胞表面cd44受体的特异性结合,实现对肿瘤细胞的靶向识别,同时ha还作为mirna与所述羧基化的磁性介孔二氧化硅之间的偶联分子。通过采用紫杉醇、姜黄素和靶向抑制性mirna作为主要的活性成分,紫杉醇、姜黄素和靶向抑制性mirna能够协同产生抗肿瘤作用,增强抗肿瘤效果,减弱毒副作用,降低耐药性。
以上所述,仅为本发明的说明实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,做出的若干改进和补充也应视为本发明的保护范围;凡熟悉本专业的技术人员,在不脱离本发明精神和范围的情况下,利用以上所揭示的技术内容做出的些许更改、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所做的任何等同变化的更改、修饰与演变,均仍属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!