PIWIL4作为激活HIV-1潜伏感染的药物的靶点的应用的制作方法
本发明涉及hiv-1病毒的治疗技术领域,更具体地,涉及piwil4作为激活hiv-1潜伏感染的药物的靶点的应用。
背景技术:
i型人类免疫缺陷病毒(humanimmunodificiencyvirus1,hiv-1)是导致获得性免疫缺陷综合症(acquiredimmunodeficiencysyndrome,aids)的病原体。尽管联合抗逆转录病毒疗法(combinedantiretroviraltherapy,cart)可以有效地抑制hiv-1在病毒感染患者体内复制,但无法清除hiv-1潜伏感染过程中形成并稳定存在的病毒储藏库,因而不能够达到根治疾病的目的。病毒储藏库是hiv-1整合至宿主细胞基因组并形成稳定的原病毒长期存在,一旦停止cart,患者体内病毒复制即能在短时间内再度反弹形成病毒血症,因此,患者需要终生服药。
以当前治疗手段几乎难以治愈hiv-1感染,利用“shockandkill”即“激活并杀灭”的治疗手段实现“功能性治愈艾滋病”的概念应运而生。即整合在宿主染色体上的hiv-1原病毒在潜伏激活剂(latency-reversingagent,lra)的作用下,由转录沉默向转录活跃转变并重新表达病毒相关抗原,继而通过内源性和外源性介导的杀伤作用清除hiv-1病毒储藏库,在这个过程中始终保持cart,以防止新的感染建立及病毒储藏库的扩大。
然而利用现有的lras开展的临床试验的数据显示,这一策略并没有能够有效缩减储藏库大小。临床试验结果提示需要往两个方向继续努力,其一是需要提高免疫系统识别、清除hiv-1抗原特异性免疫反应的能力,另外一个亟需解决的重要问题就是如何有效的激活hiv-1潜伏感染。
目前,针对新靶点的药物发展迫在眉睫,更重要的是,未来的发展方向应该是多靶点药物的开发,或者发展针对新通路或新靶点的药物能够与当前成熟的lras联合使用下,显示出良好的共激活效应。
技术实现要素:
本发明的目的是为了克服现有技术的不足,提供piwil4作为激活hiv-1潜伏感染的药物的靶点的应用。
本发明的第一个目的是提供piwil4基因或piwil4蛋白任一在作为激活hiv-1潜伏感染的药物的靶点的应用。
本发明的第二个目的是提供piwil4基因或piwil4蛋白任一的抑制剂在制备促进hiv-1病毒潜伏感染的细胞对于潜伏激活剂的响应激活的药物的中的应用。
本发明的第三个目的是提供piwil4基因或piwil4蛋白任一的抑制剂作为潜伏激活剂的增强剂的应用。
本发明的第四个目的是提供piwil4基因或piwil4蛋白任一作为筛选激活hiv-1病毒潜伏感染的药物的靶点的应用。
为了实现上述目的,本发明是通过以下技术方案予以实现的:
piwi蛋白属于ago蛋白家族中的亚家族,与果蝇(drosophilamelanogaster)piwi蛋白同源。piwi蛋白家族成员均含有两个保守的功能结构域:位于蛋白序列n端,负责结合pirna发挥相应功能的(p-elementinducedwimpytestispiwi-ago-zwille)paz结构域和位于蛋白序列c端具有双链特异性rnaase核酸内切酶活性的piwi结构域。人类基因组共有4种piwi蛋白表达,特别的命名为piwilikernamediatedgenesilencing(piwil)蛋白。piwil4在ncbi上面的登录号为:143689。
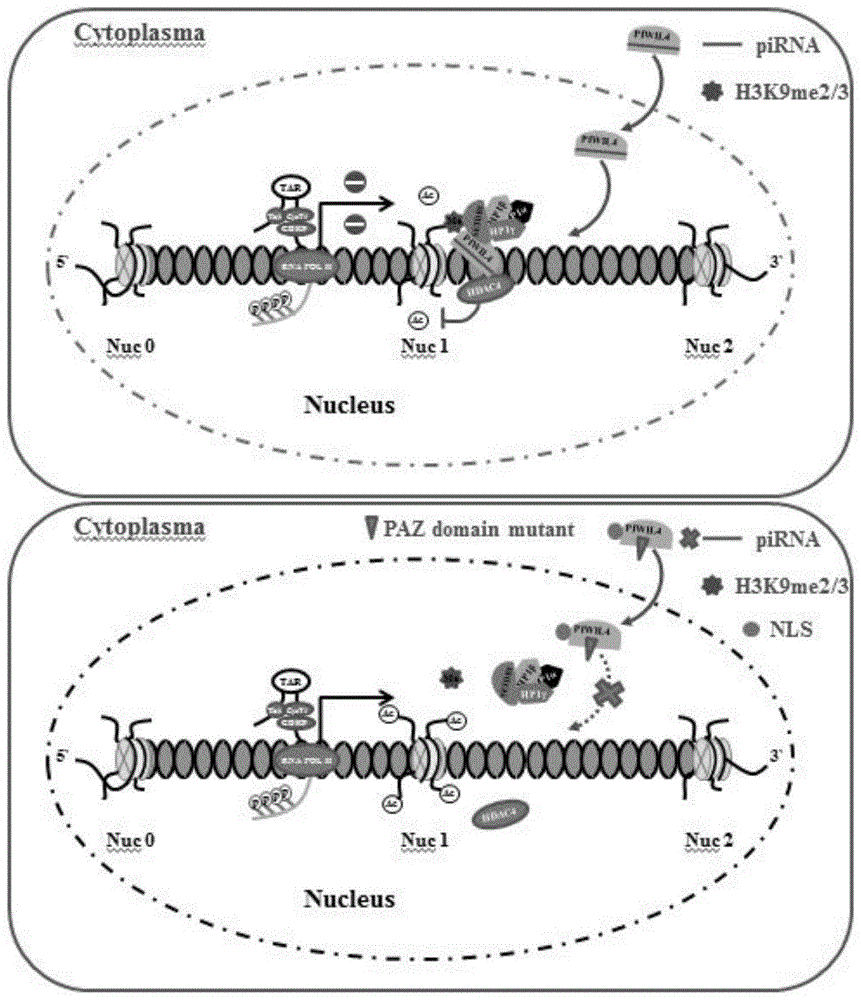
本发明利用蛋白质免疫印迹实验检测了piwil4蛋白在静息和激活状态下的外周cd4+t淋巴细胞中的表达情况,发现,piwil4在静息与激活状态下的人外周血cd4+t淋巴细胞中都有表达;通过sirna干扰实验发现野生型hiv-1病毒在激活的外周cd4+t淋巴细胞中的复制会受到内源性piwil4表达的影响,piwil4被敲减后hiv-1复制增强;利用tzm-bl(整合的hiv-1ltr活性检测)细胞系统验证piwil4对于hiv-15’ltr启动子活性的调控,发现piwil4特异性抑制了hiv-1启动子活性;通过慢病毒感染实现的shrna干扰实验,发现piwil4被敲减后能够导致hiv-1启动子驱动的gfp的表达抬高,证明piwil4被敲减后可以激活潜伏的hiv-1,同时还发现piwil4被敲减后可以显著促进hiv-1潜伏对诸如vorinostat(saha),jq1,prostratin或decitabine等lras的响应激活,以及piwil4在hiv-1感染的jurkat细胞维持hiv-1潜伏感染状态的功能;采用染色质免疫沉淀-定量pcr(chip-qpcr)实验比较了各种piwil4截段突变体作用在hiv-15’ltr特定区域能力的变化,首先发现了piwil4在hiv-15’ltr上的作用区域在核小体1(nucleosome,nuc1)和nuc2之间;并通过在tzm-bl的系列实验发现了paz结构域对于piwil4入核并作用于hiv-15’ltr发挥抑制功能是所必需的;通过蛋白质免疫共沉淀和染色质免疫共沉淀-定量pcr实验,发现了piwil4招募了一系列表观遗传学上的抑制性修饰因子作用于hiv-15’ltr并介导该区域抑制性h3k9的表观遗传学修饰(h3k9me2/3)的形成;利用慢病毒感染jurkatlatency(j-lat)10.6细胞构建稳定表达带ha标签的piwil4的细胞系,经ha标签抗体免疫共沉淀的方法富集与ha-piwil4相互作用的蛋白,再通过质谱分析鉴定和免疫共沉淀实验证明组蛋白去乙酰化酶(histonedeacetylase4,hdac4)是piwil4的结合蛋白;更进一步通过chip-qpcr和shrna干扰实验发现hdac4是通过piwil4的介导作用于hiv-15’ltr并参与调控hiv-1潜伏感染;最后,利用sirna干扰实验和病毒生长实验(virusoutgrowthassays,voa)确定在感染hiv-1病人来源的外周血cd4+t淋巴细胞中敲减piwil4能激活出具有复制能力的hiv-1病毒(图1所示)。
在hiv-1感染的cd4+t淋巴细胞中,piwil4能够通过募集包括setdb1和hp1α/β/γ在内的h3k9抑制性修饰因子和hdac4在hiv-15’ltr启动子区域形成相应的抑制性表观遗传学修饰并促进该区域异染色质的形成,最终导致对hiv-15’ltr启动子的转录抑制并维持hiv-1的潜伏感染状态。
因此本发明要求保护以下内容:
piwil4基因或piwil4蛋白任一在作为激活hiv-1病毒潜伏感染的药物的靶点的应用。
优选地,piwil4蛋白通过招募组蛋白h3k9抑制性修饰性蛋白作用于hiv-15’ltr,以抑制hiv-1病毒复制。
优选地,paz结构域的活性对于piwil4蛋白作用于hiv-15’ltr,并抑制hiv-1病毒复制是所必需的。
piwil4基因或piwil4蛋白任一的抑制剂在制备促进hiv-1病毒潜伏感染的细胞对于潜伏激活剂的响应激活的药物的中的应用。
piwil4基因或piwil4蛋白任一的抑制剂作为潜伏激活剂的增强剂的应用。
根据权利要求4或5所述的应用,其特征在于,所述潜伏逆转录剂为saha、jq1、prostratin、或decitabine中的一种或几种。
piwil4基因或piwil4蛋白任一作为筛选激活hiv-1病毒潜伏感染的药物的靶点的应用。
与现有技术相比,本发明具有如下有益效果:
本发明发现了一个新靶点发展新的激活hiv-1潜伏感染的治疗方案。所述新靶点是piwil4,在感染hiv-1病人来源的外周血cd4+t淋巴细胞中敲减piwil4能够激活出具有复制能力的hiv-1病毒。新的靶点piwil4敲减以后,可以显著促进hiv-1潜伏感染的细胞对于saha,jq1,prostratin或者decitabine等lras的响应激活的应用。
附图说明
图1为piwil4能够通过募集包括setdb1和hp1α/β/γ在内的h3k9抑制性修饰因子和hdac4在hiv-15’ltr启动子区域形成相应的抑制性表观遗传学修饰并促进该区域异染色质的形成,最终导致对hiv-15’ltr启动子的转录抑制并维持hiv-1的潜伏感染状态的模式图。
图2为piwil4在静息和激活的外周血cd4+t淋巴细胞中表达的检测。
图3为piwil4被敲减后hiv-1复制增强。
图4为piwil4特异性抑制了hiv-1启动子活性。
图5为piwil4被敲减后可以激活j-lat细胞系中潜伏的病毒储藏库,同时还可以显著促进hiv-1潜伏对诸如vorinostat(saha),jq1,prostratin或decitabine等lras的响应激活;a:j-lat10.6细胞;b:j-lat8.4细胞。*p<0.05;**p<0.01;***p<0.001。
图6为paz结构域介导piwil4作用于hiv-15’ltr上nuc-1和nuc-2之间区域;a:chip-qpcr检测结果显示piwil4作用在j-lat10.6细胞dna中hiv-1基因组5’ltr区域;b:piwil4作用在j-lat10.6细胞dna中hiv-15’ltr上nuc-1和nuc-2之间区域;c:paz结构域介导piwil4作用在hiv-15’ltr上nuc-1和nuc-2之间区域。*p<0.05;**p<0.01;***p<0.001。
图7为chip-qpcr实验结果表明piwil4可以招募组蛋白h3k9抑制性修饰性蛋白作用于hiv-15’ltr并介导该区域抑制性h3k9的表观遗传学修饰的形成;a:piwil4招募组蛋白h3k9抑制性修饰性蛋白作用于hiv-15’ltr;b:piwil4介导该区域抑制性h3k9的表观遗传学修饰的形成。*p<0.05;**p<0.01;***p<0.001。
图8为hdac4可以经piwil4的介导作用于hiv-15’ltr;a:hdac4与piwil4存在相互作用;b:piwil4招募hdac4作用于hiv-15’ltr。*p<0.05;**p<0.01;***p<0.001。
图9为在感染hiv-1病人来源的外周血cd4+t淋巴细胞中敲减piwil4能够激活出具有复制能力的hiv-1病毒;a:piwil4敲减增加了cd4+t淋巴细胞内病毒rna的含量;b:piwil4敲减增加了hiv-1病毒颗粒在上清中的分泌量;c:piwil4敲减激活出来的hiv-1病毒颗粒具有感染活性。***p<0.001。
具体实施方式
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1piwil4在外周血cd4+t淋巴细胞中的表达
一、实验方法
使用室温的pbs或0.9%nac1溶液稀释采集的患者全血样本,将20ml全血样本稀释至50ml。将每25ml细胞悬浮液覆盖到20mlficoll上(密度1.077g/ml),注意不能破坏相连液面,20℃、450g离心25分钟。离心后,小心吸取中间层单个核细胞,使用1×pbs(含肝素0.5u/ml)洗3次,首次4℃、450g离心10分钟,后续均220g离心8分钟。将分离得到的pbmc用pbs重悬至108细胞/ml。加入cd4enrichmentcocktail抗体,用量按bd磁珠阴选cd4+t淋巴细胞试剂盒的说明书进行操作。
磁珠分选所得细胞,室温350g离心5分钟收集后冻存,或重悬于适量rpmi1640完全培养基,细胞用anti-cd3(1μgml-1),anti-cd28(1μgml-1)和细胞因子il-2(10ng/ml)进行刺激,培养48~72小时后收集后冻存与之前冻存的细胞用含pmsf和cocktail的裂解液重悬细胞,冰上裂解60分钟。每隔十分钟涡旋振荡10秒。12000g,4℃,离心10分钟。吸取上清,按比例加入5×loadingbuffer,100℃,振荡加热10分钟。制备10%浓度的sds-page蛋白电泳胶。取适量体积样品依次上样,60v,30分钟,120v,55分钟。电泳结束后,利用湿转法将蛋白从page胶转移至nc膜,转膜条件为60v,2小时。将nc膜用5%脱脂奶粉tbs溶液室温封闭1小时。用tbs溶液洗去膜上残留的牛奶,孵育一抗,4℃过夜。用0.1%tbs-t洗膜三次,避光条件下孵育荧光二抗,室温1小时。使用0.1%tbs-t洗膜三次,用odyssey双色红外激光成像系统扫膜。
二、实验结果
通过免疫印迹法检测,piwil4在静息和激活的外周血cd4+t淋巴细胞中稳定表达(图2)。
实施例2敲减piwil4对hiv-1复制的影响
一、实验方法
(一)、hiv-1病毒感染实验:
cd4+t淋巴细胞经激活后,使用lipofectaminernaimax转染试剂转染由广州锐博生物公司设计合成的sirna进行rna干扰实验。将200pmolsirna和10μl转染试剂分别用100μlopti-mem孵育,室温静置5分钟后将两者混匀,静置15~20分钟,加到培养有1mlcd4+t淋巴细胞(2×106/ml)的24孔板板孔中并拍打混匀。细胞转染后12-24小时可进行hiv-1病毒感染。每毫升细胞用5ngp24量的病毒感染,培养箱中孵育6h后收集细胞,去除旧培养基,用pbs洗涤3遍。用加有il-2(10ng/ml)的rpmi1640培养基培养。感染后第6小时(0天)、3天、6天、9天分别从培养上清取出原体积的一半收样。收样后添加il-2(10ng/ml)的新培养基到原体积。利用p24检测试剂盒对细胞培养上清进行检测。
(二)、病毒的包装:
利用磷酸钙沉淀法,非hiv-1野生型病毒利用peg6000浓缩。具体的如下:
1.用1.5~2×106hek293t细胞在10厘米培养皿中进行铺板,经过37℃培养24小时,细胞密度达到60%-90%后进行转染。
2.将不超过30μg的野生型病毒质粒或按比例混好的病毒包膜质粒,辅助质粒和病毒骨架质粒加入1.5毫升离心管,加入50微升2.5m过滤灭菌的cacl2,加水补齐500微升,充分吹打混匀,逐滴加入等体积的2×hebs溶液,剧烈混匀,静置5分钟以上,加入10厘米培养皿中,37℃培养9-12小时以后换新鲜培养基,转染48小时收上清液,用0.45μm滤器过滤后装入15ml离心管,野生型病毒立即使用或分装后-80℃保存。
3.在每6.75毫升培养基上清中加入2毫升50%peg6000,1.25毫升4mnacl。颠倒混匀置于4℃至少12小时。
4.将混合液3100g4℃离心30分钟,彻底去除全部上清,加入适量体积的新鲜培养基重悬病毒,立即使用或分装后-80℃保存。
二、实验结果
结果显示,sirna干扰敲减激活的cd4+t淋巴细胞中piwil4的表达量(图3左);hiv-1病毒感染实验证明了,piwil4抑制了hiv-1的病毒复制(图3右)。
实施例3piwil4对了hiv-1的影响
一、实验方法
tzm-bl细胞用dmem完全培养基培养,当细胞密度达到90%左右时进行传代,实验操作在生物安全柜中进行。除去旧培养基,用pbs洗涤细胞一遍,加入1毫升0.05%trypsin/edta于37℃进行消化3分钟。在细胞脱落之际除
去trypsin/edta并加入适量新鲜培养基终止消化,用无菌的滴管将细胞吹打脱落打散形成细胞悬液,取适当1/4~1/6体积转移到培养皿或培养瓶中,加入新鲜培养基,晃荡混匀后继续培养。
tzm-bl按2×104每孔的密度铺到48孔板中。12~24小时候,每孔先转染30pmolsirna,12小时后转染10ngpcdna3.1-tat-ha,收样前24小时往相应组细胞加入tnf-α(50ng/ml)。质粒转染后48小时收样,弃去上清培养基,用pbs洗涤细胞两次,每孔加100μlpassivelysisbuffer,室温振荡裂解30分钟,短暂离心后,将样品加到白色酶标板,10μl/孔,利用配制好的荧光素酶双报告试剂在检测化学发光检测仪进行测定。
二、实验结果
结果如图4所示,piwil4特异性抑制了hiv-1启动子活性。**p<0.01;***p<0.001。
实施例4敲减piwil4对hiv-1潜伏感染的激活作用和lras的影响
一、实验方法
j-lat10.6和j-lat8.4细胞系是由dr.ericverdin及其同事构建并由dr.robertf.siliciano(departmentofmedicine,johnshopkinsuniversityschoolofmedicine,baltimore,md,usa)实验室馈赠所得。shrna慢病毒载体是利用正反向引物合成,退火配对,t4dna连接酶连接法将目的序列克隆到plko.1-rfp载体。所有克隆都经测序确认。引物序列来源于sigma官网(f:ccggccgaccatatgcagagacttactcgagtaagtctctgcatatggtcggtttttg;r:aattcaaaaaccgaccatatgcagagacttactcgagtaagtctctgcatatggtcgg)
j-lat10.6和j-lat8.4细胞系用rpmi1640完全培养基培养。如实施例1所示方法分别包装、浓缩piwl4特异性或对照shrna慢病毒,并分别感染j-lat10.6或j-lat8.4细胞。
shrna感染后的流式细胞术的检测如下所示:室温350g离心5分钟,收集感染shrna浓缩病毒4天以后并继续在培养箱培养的细胞。用pbs洗涤一次。用含2-4%多聚甲醛的pbs重悬细胞,避光条件下4℃暂存或直接进行流式细胞术分析。rfp+细胞表示感染上shrna病毒的细胞,由此基础上分析gfp+细胞比例和平均荧光强度。数据由bdlsriifortessa流式细胞仪采集,flowjo软件(v10.0.7)分析。
二、实验结果
流式细胞术的结果分析表明piwil4敲减以后,j-lat10.6和j-lat8.4细胞都在不同程度上逆转了hiv-1潜伏状态。
此外,敲减piwil4的情况下并单独用saha、jq1或者prostratin继续刺激24小时。通过flowjo软件分析gfp+细胞的细胞比例和mfi,证明敲减piwil4可以显著增强上述三种lras对j-lat10.6和j-lat8.4细胞中hiv-1潜伏感染的激活作用。
用dna胞嘧啶甲基化酶抑制剂decitabine处理piwil4敲减的j-lat8.4细胞4天后再用流式细胞术检测,结果显示,敲减piwil4同样可以显著增强decitabine对j-lat8.4细胞中hiv-1潜伏感染的激活效果(图5)。
*p<0.05;**p<0.01;***p<0.001。
实施例5piwil4作用区域
一、实验方法
(一)、克隆与质粒构建
利用双酶切-t4dna连接酶连接法将由特异性引物pcr扩增获取的dna目的片段克隆到目的载体上。piwil4是以pbmc的总cdna为模板pcr得到,然后克隆到pcdna3.1载体。ha标签序列或入核信号(nls)由pcr引入。piwil4的片段缺失突变都以重叠pcr的方式引入,并克隆到pcdna3.1载体。paz结构域活性位点突变体piwil4-pazmut由广州天一辉远生物科技有限公司合成、克隆得到。
表1pcr所用引物:
(二)、chip-qpcr
1.染色质免疫共沉淀实验按照cst公司chip试剂盒(9003s)提供的试验方案开展。简单描述如下:单个的免疫共沉淀实验需要4×106个tzm-bl细胞或8×106个j-lat10.6细胞。研究piwil4在hiv-15’ltr上结合区域时,敲减内源性piwil4的情况下,tzm-bl细胞转染带ha标签的野生型或突变型piwil4;研究piwil4招募蛋白聚集在hiv-15’ltr上时,tzm-bl细胞和j-lat10.6细胞均设立敲减内源性piwil4实验组和对照组。收集下来的细胞首先用1%甲醛室温固定10分钟,然后用0.125m甘氨酸处理5分钟中止交联。500g离心5分钟,除去上清,用预冷pbs清洗2遍后,用含dtt的a液破细胞膜,离心细胞核,用含dtt的b液洗涤一遍以后,再用b液重悬细胞,加入0.5μl的微球菌酶37℃消化20分钟,期间每隔4分钟轻柔颠倒混匀一次,然后用50mmedta终止消化,13000rpm4℃离心1分钟。用500μlchip缓冲液重悬细胞核,冰浴条件下,超声破核膜(40%振幅,20son,30soff,3个循环),超声结束后,10000rpm4℃离心10分钟,转移上清至干净的1.5毫升ep管,冻-80℃或直接进行下游实验。染色质dna的浓度通过测定od260读值得到。dna酶解消化以后的长度通过dna凝胶电泳判断,长度范围应该在150到900bp之间。每一组免疫共沉淀实验需要大约10μg染色质dna在500μl反应体系,取2%质量的染色质dna作为input用于计算聚集效率。每一组反应体系的染色质dna孵育相应抗体,4℃过夜。加入30μlchip级别的偶联proteing的磁珠继续4℃孵育2小时。孵育完以后,分别用低盐洗脱液洗脱3次,高盐洗脱液1次。将input样本和孵育完抗体并经洗脱除去非特异性结合的样本进行解交联,蛋白酶k消化和纯化dna,并进行下游荧光定量pcr实验。
2.按以下反应体系混合各反应成分:
3.采用两步法pcr扩增,条件为:95℃预变性1分钟;然后共40个循环的:95℃变性10秒,60度退火延伸30秒;从60℃升至95℃,每5秒升1℃,获取溶解曲线。
4.通过扩增得到各目标rna的起跳循环数(ct)。根据2-δδct法计算相对表达量,以gapdh的表达量作为内参。
二、实验结果
piwil4抗体组和igg抗体组各自纯化得到的inputdna和经免疫沉淀后得到的dna,用8对覆盖hiv-1基因组不同区域的引物进行检测。定量pcr结果表明,相对于igg组,piwil4抗体组在指示hiv-15’ltr区域有明显的聚集(图6a)。在hiv-15’ltr及其末端gagleadersequence(gls)上存在3个连续的核小体,特别命名为nuc0、nuc1和nuc2。
为了进一步细化piwil4在5’ltr上聚集的区域,继续用新的4对引物进行定量pcr检测,结果表明,piwil4主要聚集在nuc1和nuc2之间的区域(图6b)。实验结果表明paz结构域的失活或者缺失会显著降低piwil4在hiv-15’ltr上的聚集程度,而nls序列的引进并不能够逆转这种效应(图6c)。*p<0.05;**p<0.01;***p<0.001。
综上,paz结构域介导piwil4作用于hiv-15’ltr上nuc-1和nuc-2之间区域。
实施例6piwil4对招募组蛋白h3k9的影响
1、实验方法
包装并浓缩piwil4特异性或对照shrna慢病毒感染j-lat10.6细胞,感染后收集细胞进行下游chip-qpcr实验。
2、实验结果
piwil4能够招募包括setdb1和hp1α/β/γ等组蛋白h3k9抑制性修饰性蛋白作用于hiv-15’ltr(图7a);piwil4同样能够介导该区域抑制性h3k9的表观遗传学修饰的形成(图7b)。*p<0.05;**p<0.01;***p<0.001。
- 还没有人留言评论。精彩留言会获得点赞!