药物调配物的制作方法
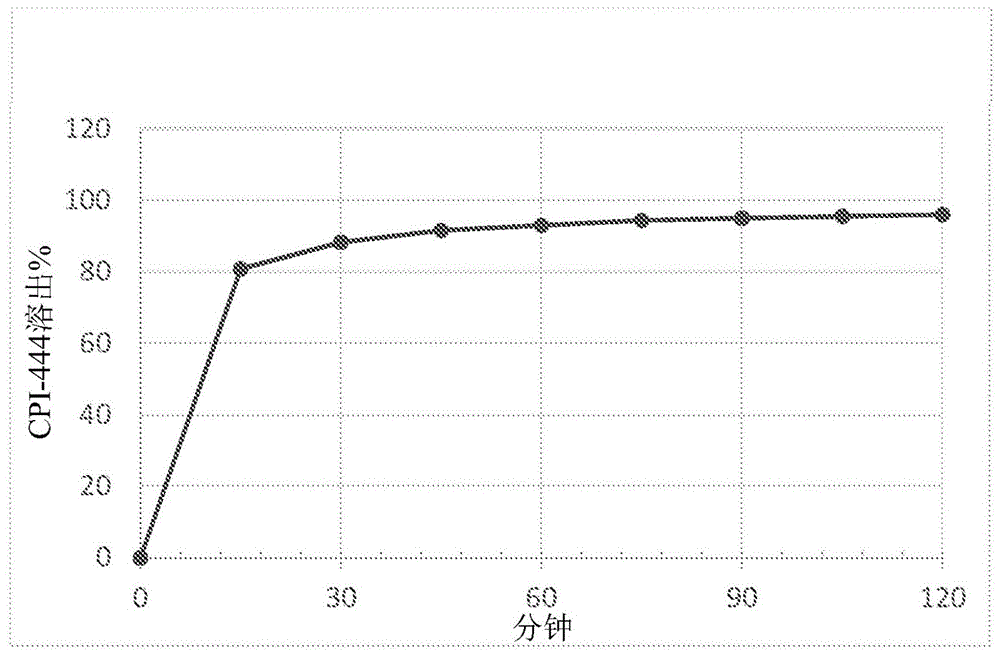
相关申请的交叉引用本申请要求于2018年2月1日提交的美国申请第62/625,163号的优先权,该美国申请的公开内容通过引用以其整体并入本文。
背景技术:
:免疫疗法的目标是驱动细胞毒性t细胞应答以根除癌症。为了防止对自身抗原的反应,存在多个抑制性检查点信号。细胞外腺苷是在急性炎性过程期间由三磷酸腺苷通过在多种组织类型的细胞表面上表达的外核苷酸酶cd73和cd39转化而产生的。腺苷通常响应于如感染或缺血等刺激,通过与其在靶细胞上的细胞外g蛋白偶联受体结合而被上调以保护宿主免受过度损伤,并开始愈合。然而,多种肿瘤类型可以主动地维持细胞外腺苷水平远远超过急性期反应,以通过多种机制抑制宿主的免疫应答。恶性细胞在微环境中对腺苷的增加将调节性t细胞募集到这一区域,并进一步提高腺苷水平。癌症细胞似乎直接利用腺苷。因为,腺苷导致肿瘤抗原向适应性系统的呈递效率较低,并且增强肿瘤生长。因此,已经设计了腺苷a2a受体拮抗剂,并且其正在临床开发中来治疗癌症。因此,本领域需要能够提供商业药物产品所必须的暴露、安全和/或稳定性的理想组合的腺苷a2a受体拮抗剂的调配物。为此,如本文所述,已经进行了开发例如生物利用度改善的、在室温下稳定并且将胃刺激的可能性降到最低的此类调配物的研究。本公开针对这些以及其它重要目的。技术实现要素:本文提供了包括微粉化药物颗粒和药学上可接受的赋形剂的药物组合物;其中所述微粉化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约20微米或更小的粒度分布。在一些方面,腺苷a2a受体拮抗剂是式(i)化合物、式(ii)化合物、式(iii)化合物、式(iiia)化合物、式(iiib)化合物或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结晶的。在一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所述药物组合物是片剂、胶囊或粉末的形式。在一些方面,所述药物组合物包括约10wt%到约40wt%的腺苷a2a受体拮抗剂、约40wt%到约80wt%的填料、约1wt%到约20wt%的崩解剂以及约1wt%到约20wt%的粘合剂。在一些方面,所述组合物包括约1mg到约1,000mg的腺苷a2a受体拮抗剂。在一些方面,所述组合物具有外包衣。本文提供了包括微粉化药物颗粒和药学上可接受的赋形剂的颗粒剂;其中所述微粉化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约20微米或更小的粒度分布。在一些方面,腺苷a2a受体拮抗剂是式(i)化合物、式(ii)化合物、式(iii)化合物、式(iiia)化合物、式(iiib)化合物或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结晶的。在一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所述颗粒剂包括约10wt%到约40wt%的腺苷a2a受体拮抗剂、约40wt%到约80wt%的填料、约1wt%到约20wt%的崩解剂以及约1wt%到约20wt%的粘合剂。在一些方面,可以在所述颗粒剂的内部或外部包含润滑剂、助流剂或表面活性剂。在一些方面,所述颗粒剂具有外包衣。在一些方面,任选地具有外包衣的所述颗粒剂被压制成片剂,被置于胶囊壳内或被置于小药囊或棒状包装内。本文提供了包括微粉化药物颗粒和药学上可接受的赋形剂的片剂;其中所述微粉化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约20微米或更小的粒度分布。在一些方面,腺苷a2a受体拮抗剂是式(i)化合物、式(ii)化合物、式(iii)化合物、式(iiia)化合物、式(iiib)化合物或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结晶的。在一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所述片剂包括约10wt%到约40wt%的腺苷a2a受体拮抗剂、约40wt%到约80wt%的填料、约1wt%到约20wt%的崩解剂以及约1wt%到约20wt%的粘合剂。在一些方面,所述片剂包括约1mg到约600mg的腺苷a2a受体拮抗剂。在一些方面,所述片剂包含表面活性剂、助流剂、润滑剂或其组合。在一些方面,所述片剂具有外包衣。本文提供了包括微粉化药物颗粒和药学上可接受的赋形剂的粉末;其中所述微粉化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约20微米或更小的粒度分布。在一些方面,腺苷a2a受体拮抗剂是式(i)化合物、式(ii)化合物、式(iii)化合物、式(iiia)化合物、式(iiib)化合物或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结晶的。在一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所述粉末包括约10wt%到约40wt%的腺苷a2a受体拮抗剂、约40wt%到约80wt%的填料、约1wt%到约20wt%的崩解剂以及约1wt%到约20wt%的粘合剂。在一些方面,所述粉末包括约1mg到约1,000mg的腺苷a2a受体拮抗剂。所述粉末可以以单剂量或多剂量使用,更常见地,其可以乘以预期数量的剂量或剂型。在一些方面,所述粉末进一步包括表面活性剂、助流剂、润滑剂或其中的两种或更多种的组合。在一些方面,所述粉末被压缩成片剂,置于胶囊壳内或置于小药囊或棒状包装内。在一些方面,所述粉末被测量出并被直接施用或与食物或液体混合。本文提供了包括微粉化药物颗粒和药学上可接受的赋形剂的口服调配物;其中所述微粉化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约20微米或更小的粒度分布。在一些方面,腺苷a2a受体拮抗剂是式(i)化合物、式(ii)化合物、式(iii)化合物、式(iiia)化合物、式(iiib)化合物或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结晶的。在一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所述口服调配物是片剂、胶囊或粉末的形式。在一些方面,所述口服调配物包括约10wt%到约40wt%的腺苷a2a受体拮抗剂、约40wt%到约80wt%的填料、约1wt%到约20wt%的崩解剂以及约1wt%到约20wt%的粘合剂。在一些方面,所述口服调配物包括约1mg到约1,000mg的腺苷a2a受体拮抗剂。在一些方面,所述口服调配物进一步包括表面活性剂、助流剂、润滑剂或其中的两种或更多种的组合。在一些方面,所述口服调配物具有外包衣。本文提供了包括惰性核和药物层的珠粒;其中所述外层包括微粉化药物颗粒和药学上可接受的赋形剂;其中所述微粉化药物颗粒包括腺苷受体拮抗剂。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述微粉化药物颗粒具有d90为约20微米或更小的粒度分布。在一些方面,腺苷a2a受体拮抗剂是式(i)化合物、式(ii)化合物、式(iii)化合物、式(iiia)化合物、式(iiib)化合物或前述化合物之一的药学上可接受的盐。在一些方面,所述微粉化的药物颗粒是结晶的。在一些方面,所述药学上可接受的赋形剂包括(i)填料,如多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)崩解剂,如羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)粘合剂,如羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合;或者(iv)填料、崩解剂和粘合剂中的两种或更多种的组合。在一些方面,所述珠粒包括约10wt%到约40wt%的腺苷a2a受体拮抗剂、约40wt%到约80wt%的填料、约1wt%到约20wt%的崩解剂以及约1wt%到约20wt%的粘合剂。在一些方面,所述珠粒进一步包括表面活性剂、助流剂、润滑剂或其中的两种或更多种的组合。在一些方面,所述珠粒具有外包衣。在一些方面,任选地具有外层包衣的所述珠粒被压制成片剂,被置于胶囊壳内或被置于小药囊或棒状包装内。本文提供的是在如羟丙甲纤维素胶囊壳等胶囊壳内包封有本文所述的药物组合物、颗粒剂、粉末或珠粒的胶囊。在一些方面,胶囊壳包括肠溶聚合物。在一些方面,所述胶囊具有外包衣。在一些方面,所述胶囊包括约1mg到约600mg的腺苷a2a受体拮抗剂。本文提供了包括腺苷a2a受体拮抗剂(例如式(iii)化合物)的药物组合物,其中,如按照《美国药典(uspharmacopeia(usp))》第<711>章的ii型(桨式)溶出设备测量的,所述组合物中的腺苷a2a受体拮抗剂的溶出度为在60分钟内至少70%。在一些方面,所述溶出度为在60分钟内至少75%。在一些方面,所述溶出度为在60分钟内至少80%。在一些方面,所述溶出度为在60分钟内至少85%。在一些方面,所述溶出度为在60分钟内至少90%。在一些方面,所述溶出度为在10分钟内至少70%。在一些方面,所述溶出度为在10分钟内至少60%。本文提供了包括腺苷a2a受体拮抗剂(例如式(iii)化合物)的药物组合物,如通过美国药典(usp)第<701>章崩解测试通过激光衍射光谱法测量的,所述药物组合物对的崩解时间为15分钟或更短。在一些方面,如通过激光衍射光谱法测量的,所述药物组合物具有约15分钟或更短的崩解时间。在一些方面,如通过激光衍射光谱法测量的,所述药物组合物具有约10分钟或更短的崩解时间。在一些方面,如通过激光衍射光谱法测量的,所述药物组合物具有约5分钟或更短的崩解时间。本文提供了通过施用治疗有效量的本文所述的用于治疗癌症的药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末或珠粒来治疗患者的癌症的方法。在一些方面,所述癌症是肺癌(例如,非小细胞肺癌)、黑色素瘤(例如,恶性黑色素瘤)、肾细胞癌、乳腺癌(例如,三阴性乳腺癌)、结肠直肠癌、膀胱癌、前列腺癌或头颈癌。在一些方面,将本文所述的药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末或珠粒每天向患者施用一次(qd)。在一些方面,每日一次施用可以包括施用1种、2种或3种口服调配物(例如,1种、2种或3种调配物或胶囊)。在一些方面,将本文所述的药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末或珠粒每天向患者施用两次(bid)。在一些方面,每日两次施用可以包括每日施用1种、2种或3种口服调配物(例如,1种、2种或3种片剂或胶囊)两次。在一些方面,癌症治疗的所述治疗有效量为每天约1mg到每天约1,000mg。在一些方面,用于成人癌症治疗的治疗有效量为每天约50mg到约600mg。在一些方面,用于人类儿科或兽医应用中的癌症治疗的治疗有效量可以是每天约5mg到约400mg。本公开提供了通过将所述微粉化腺苷a2a受体拮抗剂与至少一种药学上可接受的赋形剂混合形成颗粒剂来制备本文所述的药物组合物、口服调配物和颗粒剂的过程;将所述颗粒剂干燥并研磨或过筛;以及将所述颗粒剂装入胶囊或将所述颗粒剂压制成片剂;以及任选地将包衣涂覆到所述胶囊或片剂上。本文描述的药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具有出乎意料的优异性质。在一些方面,本文所述的药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具有出乎意料的优异生物利用度。在一些方面,本文所述的药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具有出乎意料的优异稳定性。在一些方面,本文所述的药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具有出乎意料的优异溶出曲线。在一些方面,本文所述的药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具有出乎意料的优异崩解曲线。在一些方面,本文所述的药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具有出乎意料的优异药代动力学性质。在一些方面,本文所述的药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末、珠粒)具有出乎意料的优异的cmin、cmax、cmax/cmin比、tmax或auc。本文阐述了本公开的这些方面和其它实施例和方面。附图说明图1示出了5号药物组合物《美国药典》(usp)<711>章溶出度测试中的溶出度,其中将所述组合物于900ml约37℃的0.1nhcl溶出介质中置于桨速度为50rpm的usp设备2中。图2是示出根据usp第<711>章溶出度测试1-3号药物组合物的溶出度的曲线图,其中将所述组合物于900ml约37℃的0.1nhcl溶出介质中置于桨速度为50rpm的usp设备2中。参考图2,p16k108003a是1号药物组合物;p16k108003b是2号药物组合物;并且p16k108003c是3号药物组合物。图3a-3c是曲线图,示出了根据usp第<711>章的溶出度测试,1-3号药物组合物在900ml约37℃的0.1nhcl溶出介质中的作为在40℃和75%相对湿度下的储存时间的函数的溶出度,在所述测试中,组合物置于桨速度为50rpm的usp设备2中。图3a示出了1号药物组合物(p16k108003a)的溶出曲线。图3b示出了2号药物组合物(p16k108003b)的溶出曲线。图3c示出了3号药物组合物(p16k108003c)的溶出曲线。图4示出了根据usp第<711>章溶出度测试1号药物组合物在900ml约37℃且ph为1.0的0.1nhcl溶出介质中的作为在加速条件(acc)或受控室温条件(crt)下的储存时间的函数的溶出度,在所述测试中,组合物置于桨速度为50rpm的usp设备2中。图5示出了根据usp第<711>章溶出度测试5号药物组合物在900ml约37℃且ph为1.0的0.1nhcl溶出介质中的作为在加速条件(acc)或受控室温条件(crt)下的储存时间的函数的溶出度,在所述测试中,组合物置于桨速度为50rpm的usp设备2中。具体实施方式定义如本文所用的术语“药物颗粒(drugparticle)”或“多种药物颗粒(drugparticles)”意指由a2a受体拮抗剂或其药学上可接受的盐构成的一种或多种颗粒。在一些方面,所述药物颗粒是固体。在一些方面,所述药物颗粒是半固体。在一些方面,除一种或多种a2a受体拮抗剂之外,所述药物颗粒不包含其它活性药物成分。在一些方面,所述药物颗粒仅包含单一类型的a2a受体拮抗剂。在一些方面,所述药物颗粒仅包含单一类型的a2a受体拮抗剂,并且不包含其它活性药物成分。在一些方面,所述药物颗粒仅包含单一类型的a2a受体拮抗剂,并且不包含药物赋形剂或其它活性药物成分。在一些方面,所述药物颗粒仅包含单一类型的a2a受体拮抗剂,任选地包含水分子,并且不包含药物赋形剂或其它活性药物成分。在一些方面,药物颗粒是结晶的。在一些方面,药物颗粒是无定形的。在一些方面,所述药物颗粒或所述多种药物颗粒是指组合物中的所有的药物颗粒。“微粉化药物颗粒”是指如通过激光衍射光谱法测量的,d90为约50微米或更小的粒度分布的药物颗粒。在一些方面,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约40微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约30微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约25微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约20微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约15微米或更小的粒度分布。在一些方面,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约10微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒是指组合物中的所有的药物颗粒。“粒度分布”或“psd”或“粒度分布”是指如通过激光衍射光谱法测量的,样品中以相对比例存在的颗粒的粒度。在一些方面,粒度分布是指组合物中所有药物颗粒的粒度分布。样品的粒度分布通过激光衍射光谱法测量。激光衍射分光计可以例如马尔文仪器有限公司(malverninstrumentsltd.)的3000和加利福尼亚州尔湾市horiba仪器公司(horibainstruments,inc.,irvineca)的la-950商购获得。对于激光衍射光谱,粒度分布通常以d值来描述,例如d90。在一些方面,激光衍射光谱可以用夫琅和费理论(fraunhofertheory)来分析。在一些方面,激光衍射光谱可以用米氏散射理论(miescatteringtheory)来分析。在一些方面,激光衍射光谱可以通过结合夫琅和费理论和米氏散射理论来分析。“d90”是如通过激光衍射光谱法测量的,样品中90%的材料(例如药物颗粒)的总体积低于指定粒度时的粒度分布点。也就是说,d90是指样品中药物颗粒材料总体积的90%低于指定粒度时的粒度分布。例如,如果d90为20微米,这意味着样品中90%的材料的粒度为20微米或更小。“d90”也称为dv(90)或d90。样品的粒度分布通过激光衍射光谱法测量。激光衍射分光计可以例如马尔文仪器有限公司的3000和加利福尼亚州尔湾市horiba仪器公司的la-950商购获得。“d50”是样品中材料的总体积的50%(如药物颗粒)低于指定粒度时的粒度分布点。即,d50是指样品中药物颗粒材料总体积的50%低于指定粒度的粒度分布。例如,如果d50为6微米,这意味着样品中50%的材料具有6微米或更小的粒度。“d50”也称为dv(50)或d50。样品的粒度分布通过激光衍射光谱法测量。激光衍射分光计可以例如马尔文仪器有限公司的3000和加利福尼亚州尔湾市horiba仪器公司的la-950商购获得。“d10”是样品中材料总体积的10%(如药物颗粒)低于指定粒度时的粒度分布点。即,d10是指样品中药物颗粒材料总体积的10%低于指定粒度时的粒度分布。例如,如果d10为1.8微米,这意味着样品中10%的材料具有1.8微米或更小的粒度。“d10”也称为dv(10)或d10。样品的粒度分布通过激光衍射光谱法测量。激光衍射分光计可以例如马尔文仪器有限公司的3000和加利福尼亚州尔湾市horiba仪器公司的la-950商购获得。“结晶”是指如通过本领域已知的方法确定的(如x射线粉末衍射、ir光谱法、拉曼光谱法、差示扫描量热法(dsc)、固态nmr、偏振光显微镜或通过其熔点)具有原子和/或分子的有序的三维晶格的化合物。参见例如《雷明顿:药学科学与实践(remington:thescienceandpracticeofpharmacy,第21版,利平科特·威廉斯·威尔金斯出版公司(lippincott,williamsandwilkins),巴尔的摩,马里兰州(2005);《美国药典(theunitedstatespharmacopeia)》,第23版(1995)。明确地说,当化合物在本文中被公开为结晶时,本领域普通技术人员将立即认识到所述化合物形成包含多种该化合物的结晶固体的一部分。“无定形”是指没有长程结晶有序的固体化合物(即包含多种化合物的固体)或固体组合物。在一些方面,无定形是指基本上不含结晶形式的化合物或组合物。也就是说,无定形是指包含化合物(例如,多种药物活性剂或药物)的固体,其中所述固体基本上不含结晶形式。在一些方面,无定形化合物(即包含多种化合物的固体)或组合物具有小于10%的结晶形式的化合物(即包含多种化合物的固体)或组合物;或低于5%;或小于2%的结晶形式的化合物(即包含多种化合物的固体)或组合物。在一些方面,无定形化合物或组合物具有小于1%的结晶形式的化合物(即,包含多种化合物的固体)或组合物。在一些方面,无定形化合物(即包含多种化合物的固体)或组合物通过x射线粉末衍射、ir光谱法、拉曼光谱法、差示扫描量热法(dsc)、固态nmr、偏振光显微镜或其熔点测定不具有结晶度。在一些方面,如本文所述的无定形化合物(即包含多种化合物的固体)、无定形固体分散体、无定形组合物(即包含多种组合物的固体)或无定形挤出物保持无定形状态超过18个月的时间段;超过2年;超过3年;超过4年;或者超过5年。明确地说,当化合物(例如药物或活性剂)在本文中被公开为无定形时,本领域普通技术人员将立即认识到所述化合物形成包含多种该化合物的无定形固体的一部分。同样,当化合物在本文中被公开为固体时(例如,“固体化合物”),本领域普通技术人员将立即认识到所述化合物形成包含多种该化合物的固体的一部分。“药学上可接受的赋形剂”是指有助于腺苷a2a受体拮抗剂向患者的施用和患者的吸收的物质,或有助于制造本文所述的颗粒剂、珠粒、粉末、片剂、组合物和调配物的物质。药学上可接受的赋形剂是惰性的。药学上可接受的赋形剂的非限制性实例包含药学上可接受的聚合物、水、nacl、生理盐水溶液、正常蔗糖、正常葡萄糖、粘合剂、填料、崩解剂、润滑剂、表面活性剂、包衣、甜味剂、调味剂、盐溶液、醇、油、明胶、碳水化合物、色素等。可以对这种进行灭菌,并且如果需要,可以将这种制剂与润滑剂、防腐剂、稳定剂、湿润剂、乳化剂、影响渗透压的盐、缓冲剂、着色剂和/或芳香物质等辅助剂混合。药学上可接受的赋形剂在药物出版社(pharmaceuticalpress)(2017)出版的《药物赋形剂手册(handbookofpharmaceuticalexcipients)》(第8版)和美国食品和药物管理局非活性成分数据库(unitedstatesfoodanddrugadministrationinactiveingredientdatabase)(2017年7月)中有所描述,所述文献的公开内容通过引用并入本文。本文所述的药物组合物(包含颗粒剂、珠粒、粉末、片剂、胶囊和口服调配物)可包括一种或多种药学上可接受的赋形剂。本领域技术人员将认识到,其它药学上可接受的赋形剂将可用于本文所述的组合物中。“填料”是用于药物组合物中的用于增加低剂量活性成分的体积的药学上可接受的赋形剂。示例性填料包含多元醇、麦芽糖糊精、微晶纤维素等。其它填料对本领域技术人员来说是已知的。“崩解剂”是一种暴露于使得药物组合物破裂(通常在消化道中,如胃、小肠或大肠)并释放活性成分的水或体液(例如胃酸、唾液)时膨胀和/或溶出的药学上可接受的赋形剂。在一些方面,崩解剂是一种超级崩解剂。示例性崩解剂包含羧烷基纤维素(例如羧甲基纤维素或交联羧甲基纤维素)、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物等。其它崩解剂和超级崩解剂是本领域技术人员已知的。“粘合剂”是将一种或多种其它化合物或活性成分结合在一起的药学上可接受的赋形剂。粘合剂能够向片剂、颗粒剂、珠粒或胶囊提供机械强度。示例性粘合剂包含羟烷基纤维素、烷基纤维素、玉米淀粉、明胶、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮等。其它粘合剂对本领域技术人员来说是已知的。“润滑剂”是一种防止其它化合物或活性成分聚集和/或防止化合物或活性成分在制造过程中粘附到装置或装备上的药学上可接受的赋形剂。示例性润滑剂包含硬脂酸镁、硬脂酸钙、硬脂酸钠、硬脂酸、滑石、硬脂酰醇富马酸钠、硼酸、苯甲酸钠、油酸钠、乙酸钠、十二烷基硫酸钠、十二烷基硫酸镁、山嵛酸甘油酯等。其它润滑剂是本领域技术人员已知的。“助流剂”是用于改善化合物或组合物流动性的药学上可接受的赋形剂。示例性助流剂包含磷酸钙、纤维素、胶体二氧化硅、疏水性胶体二氧化硅、氧化镁、硅酸镁、三硅酸镁、二氧化硅、滑石等。“多元醇”是具有两个或多个羟基的有机醇。在一些方面,多元醇是单体多元醇。示例性多元醇包含甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇等。“甘露醇”是指化合物ho-ch2-(ch(oh))4-ch2-oh。在一些方面,甘露醇是d-甘露醇。甘露醇是可商购获得的,例如,作为从法国罗盖特公司(roquettefrerescorporation)获得。“纤维素”或“纤维素化合物”或“纤维素聚合物”是指包含具有式(c6h10o5)n的β(1→4)连接的d-葡萄糖单元的链的有机多糖化合物。“微晶纤维素”是指符合usp标准的精制木浆。微晶纤维素可以是天然的,也可以是合成的,可以从很多供应商获得,如西格玛奥德里奇(sigma-aldrich)、milesscientific公司(milesscientific)、jrs制药公司(jrspharma)和fmc。“羟烷基纤维素”是指具有羟烷基的纤维素化合物的醚衍生物。羟烷基纤维素的实例包含羟丙基纤维素、羟乙基纤维素、羟乙基甲基纤维素、乙基羟乙基纤维素、羟丙基甲基纤维素等。“烷基纤维素”是指具有烷基的纤维素化合物的醚衍生物。烷基纤维素的实例包含甲基纤维素、乙基纤维素、乙基甲基纤维素等。“羧烷基纤维素”是指具有羧基烷基的纤维素化合物的醚衍生物。羧烷基纤维素的实例包含羧甲基纤维素、交联羧甲基纤维素等。“hpc”指羟丙基纤维素。hpc是一种重复葡萄糖单元中的一些羟基用环氧丙烷羟丙基化的纤维素醚。hpc是一种示例性的药学上可接受的聚合物。“hpmc”指羟丙基甲基纤维素或羟丙甲纤维素。hpmc是甲基纤维素、羟丙基和甲基的丙二醇醚,其通过醚键与无水葡萄糖环结合。每种组分的百分比(例如,甲氧基、羟丙基)和分子量可以变化。“药学上可接受的聚合物”是指本领域已知的可用作药学上可接受的赋形剂的任何聚合物。示例性的药学上可接受的聚合物包含:聚乙烯吡咯烷聚合物、聚乙烯吡咯烷共聚物、纤维素化合物、聚(丙交酯)、聚(乙交酯)、聚(丙交酯-共-乙交酯)共聚物、泊洛沙姆、聚山梨酸酯(例如,聚山梨酸酯80、聚山梨酸酯20)、肠溶衣材料、聚氧化乙烯、支链淀粉、聚乙烯醇、海藻酸钠、聚乙二醇、黄原胶、黄芪胶、瓜尔豆胶、阿拉伯树胶、阿拉伯胶、聚丙烯酸、甲基丙烯酸甲酯共聚物、羧乙烯基共聚物、淀粉、明胶、聚二恶烷、聚草酸酯、聚(α-酯)、聚酸酐、聚乙酸酯、聚己内酯、聚(原酸酯)、聚氨基酸、聚氨基碳酸酯、聚氨酯、聚碳酸酯、聚酰胺、聚(氰基丙烯酸烷基酯)等。“pvp”指聚乙烯吡咯烷酮或乙烯基吡咯烷酮的聚合物。pvp是一类平均分子量为约1,000道尔顿至约1,500,000道尔顿的聚合物。在一些方面,pvp可以是交联的pvp。在一些方面,聚乙烯吡咯烷酮聚合物的平均分子量为约1,000道尔顿到约1,000,000道尔顿;或约1,000道尔顿到约500,000道尔顿;或者约1,000道尔顿到约200,000道尔顿。在一些方面,聚乙烯吡咯烷酮聚合物的平均分子量为约1,000道尔顿到约150,000道尔顿。在一些方面,聚乙烯吡咯烷酮聚合物的平均分子量为约10,000道尔顿到约150,000道尔顿。在一些方面,聚乙烯吡咯烷酮聚合物的平均分子量为约50,000道尔顿到约150,000道尔顿。在一些方面,聚乙烯吡咯烷酮聚合物的平均分子量为约60,000道尔顿到约120,000道尔顿。pvp可从多种来源商购获得,如西格玛奥德里奇、basf和亚什兰公司(ashland)。“聚乙烯吡咯烷酮共聚物”或“乙烯基吡咯烷酮共聚物”是指包括乙烯基吡咯烷酮和一种或多种其它单体(如丙烯酸单体、苯乙烯、乙酸乙烯酯等)的共聚物。聚乙烯吡咯烷酮乙酸乙烯酯共聚物和pvp-va是示例性的聚乙烯吡咯烷酮共聚物。在一些方面,聚乙烯吡咯烷酮共聚物的平均分子量为约1,000道尔顿到约1,000,000道尔顿;或约1,000道尔顿到约500,000道尔顿;或者约1,000道尔顿到约200,000道尔顿。在一些方面,聚乙烯吡咯烷酮共聚物的平均分子量为约1,000道尔顿到约150,000道尔顿。在一些方面,聚乙烯吡咯烷酮共聚物的平均分子量为约10,000道尔顿到约150,000道尔顿。在一些方面,聚乙烯吡咯烷酮共聚物的平均分子量为约50,000道尔顿到约150,000道尔顿。“聚乙烯吡咯烷酮乙酸乙烯酯共聚物”或“聚乙烯吡咯烷酮和乙酸乙烯酯的共聚物”或“乙烯基吡咯烷酮和乙酸乙烯酯的共聚物”都指一类乙烯基吡咯烷酮和乙酸乙烯酯的共聚物,其具有不同的乙烯基吡咯烷酮与乙酸乙烯酯的wt%比,例如约30∶70到约70∶30,包含30∶70、35∶65、50∶50、60∶40和70∶30。乙烯基吡咯烷酮与乙酸乙烯酯的wt%比可以决定共聚物的不同性质,包含玻璃化转变温度。聚乙烯吡咯烷酮醋酸乙烯酯共聚物可从多种来源购得,如basf和亚什兰公司。“共聚维酮”是指1-乙烯基-2-吡咯烷酮与乙酸乙烯酯的重量比为约3∶2的1-乙烯基-2-吡咯烷酮和乙酸乙烯酯的共聚物。“共聚维酮”可以以va64从新泽西州弗洛勒姆公园的basf公司(basfcorporation)购得。“聚氧化乙烯”或“聚氧乙烯”或“聚乙二醇”或“peo”是指具有化学结构h-(och2ch2)n-oh的聚醚化合物。聚氧化乙烯的平均分子量可以为100道尔顿到约10,000,000道尔顿。在一些方面,聚氧化乙烯的平均分子量为约1,000道尔顿到约2,000,000道尔顿。在本文所述的组合物、颗粒剂和珠粒的一些方面,可以使用两种或多种具有不同平均分子量的聚氧化乙烯化合物。聚氧化乙烯可从例如陶氏化学公司(dowchemical)购得。“表面活性剂”是指降低两种液体之间的表面或界面张力的润湿剂。表面活性剂可以是阴离子型、阳离子型、非离子型或两性离子型。“阴离子表面活性剂”是指具有带负电荷的头部基团部分(如羧酸酯基团、硫酸酯基团、磺酸酯基团、磷酸酯基团或其中的两种或更多种的组合)的表面活性剂。在一些方面,阴离子表面活性剂包含烷基硫酸盐、酰基硫酸盐、胆汁酸盐和脂肪酸。在一些方面,阴离子表面活性剂包含十二烷基硫酸钠、十二烷基硫酸铵、十二烷基醚硫酸钠、肉豆蔻醇聚醚硫酸钠、硬脂酸钠、琥珀酸二异辛酯磺酸钠等。在一些方面,阴离子表面活性剂包含胆酸、脱氧胆酸、甘氨胆酸、牛磺胆酸、甘氨脱氧胆酸、牛磺脱氧胆酸、熊去氧胆酸、熊去氧胆酸、鹅去氧胆酸、甘氨脱氧胆酸、牛磺脱氧胆酸、油酸等。在一些方面,阴离子表面活性剂包含脂肪族磺酸盐、伯烷烃(例如,c5-c25)磺酸盐、伯烷烃(例如,c5-c25)二磺酸盐、(c5-c25)烯烃磺酸盐、c5-c25羟烷烃磺酸盐、烷基甘油醚磺酸盐、芳香族磺酸盐(例如烷基苯磺酸盐)、c10-c20烯烃磺酸钠(例如,c14-c16烯烃磺酸钠);膦酸(例如辛基膦酸、月桂基膦酸、辛基膦酸的盐、月桂基膦酸的盐)等。“阳离子表面活性剂”是指具有带正电荷的头部基团部分的表面活性剂。示例性阳离子表面活性剂包含氯化十六烷基吡啶鎓和溴化十六烷基三甲基铵。“非离子表面活性剂”是指具有共价键合的含氧亲水基团的表面活性剂。示例性非离子表面活性剂包含长链醇;脂肪酸酯(例如,单月桂酸酯、单油酸酯、单棕榈酸酯、单硬脂酸酯);脱水山梨醇(例如,聚氧乙烯(20)脱水山梨醇单油酸酯、单硬脂酸酯、单月桂酸酯);乙氧基化脂肪酸(例如,硬脂酸聚氧乙烯(40)酯、乙氧基化月桂酸);乙氧基化醇(例如,聚氧乙烯月桂基醚);乙氧基化烷基酚(例如壬基酚氧基聚(乙氧基)乙醇);和聚乙二醇化甘油酯。“两性离子表面活性剂”是指同时具有阳离子部分和阴离子部分的表面活性剂。通常,两性离子表面活性剂具有基于伯胺、仲胺、叔胺或季铵阳离子的阳离子部分。阴离子部分可以包括具有胺或铵(如磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰胆碱、鞘磷脂等)的磷酸根阴离子。“胶囊”是指包封组合物的壳。壳可以是硬壳或软壳,并且通常包括明胶、聚合物(如羟烷基纤维素、烷基纤维素、羧烷基纤维素或其中的两种或更多种的组合)或其组合。在一些方面,胶囊壳包括羟烷基纤维素。在一些方面,胶囊壳包括羟丙基甲基纤维素。在一些方面,胶囊壳包括肠溶聚合物。“外层”指完全包围组合物、片剂、胶囊、珠粒或颗粒剂的层。在一些方面,外层是聚合物,如羟烷基纤维素、烷基纤维素、羧烷基纤维素、聚乙烯醇或其中的两种或更多种的组合。在一些方面,外层是保护包衣或美学包衣。在一些方面,外层是肠溶包衣。在一些方面,外层是保护包衣、美学包衣、肠溶包衣或其中的两种或更多种的组合。“肠溶包衣”是指含有一种或多种在小肠中溶出或崩解但不在胃或胃环境中溶出或崩解的物质的包衣。示例性肠溶包衣材料包含肠溶聚合物。“肠溶聚合物”是指在约5到约7.4的ph下会溶出或崩解但在约1到约4.5的ph下不会溶出或崩解的聚合物。示例性肠溶聚合物包含:聚合明胶、紫胶、甲基丙烯酸共聚物、邻苯二甲酸丁酸纤维素、邻苯二甲酸氢纤维素、邻苯二甲酸丙酸纤维素、邻苯二甲酸聚醋酸酯、邻苯二甲酸醋酸纤维素、偏苯三酸醋酸纤维素、邻苯二甲酸羟丙基甲基纤维素、醋酸羟丙基甲基纤维素、琥珀酸二氧丙基甲基纤维素、羧甲基乙基纤维素、羟丙基甲基纤维素乙酸琥珀酸酯和丙烯酸聚合物和共聚物,其通常由丙烯酸甲酯、丙烯酸乙酯、甲基丙烯酸甲酯和/或甲基丙烯酸乙酯与丙烯酸酯和甲基丙烯酸酯的共聚物形成(例如,evonikroehmgmbh制造的ne、rl、rs)。“惰性核”是指任何形状的无药理活性的颗粒。惰性核可以是可溶的、不溶的或其组合。在一些方面,惰性核是球形的。在一些方面,惰性核包括糖、微晶纤维素、巴西棕榈蜡、甘露醇或其中的两种或更多种的组合。惰性核的粒度大于25微米;或为约50微米到约3mm;或者为约1mm到约2.5mm。惰性核是可商购获得,例如瑞士pharmatranssanaq股份公司(pharmatranssanaqag)。当用于提及珠粒时,“惰性核”被“药物层”包围,所述药物层是包括本文所述腺苷a2a受体拮抗剂和药学上可接受的赋形剂的任何厚度的层。药物层可以是单层或多层。“治疗有效量”或“有效量”是指足以治疗或预防疾病或症状(例如,以达到施用的效果、治疗疾病、降低酶活性、增加酶活性、降低蛋白质功能、降低疾病或病症的一种或多种症状)的量。在一些方面,治疗有效量是足来治疗癌症的量。确切的量将取决于治疗的目的,腺苷a2a受体拮抗剂是否被用作治疗癌症的唯一治疗剂,或者其是否与其它化疗或免疫调节化合物联合使用。如果腺苷a2a受体拮抗剂用作单独的治疗剂或用于联合治疗,其剂量可以不同,本领域技术人员将理解,腺苷a2a受体拮抗剂的量可以根据患者、所用的其它化疗或免疫调节化合物以及所治疗的癌症的类型而调整得更高或更低。“患者”或“受试者”是指患有或易患可通过施用化合物或药物组合物或通过本文提供的方法治疗的疾病(例如,癌症)的哺乳动物。患者的非限制性实例包含人、牛、大鼠、小鼠、狗、猫、猴子、山羊、绵羊等。在一些方面,患者是人。在一些方面,患者是狗或猫。在一些方面,患者是成年人。在一些方面,患者是人的孩子。“月”是指约28天到约31天的时间段。在一些方面,一个月是28天。在一些方面,一个月是29天。在一些方面,一个月是30天。在一些方面,一个月是31天。术语“快速崩解”是指本文所述的能够在较短的时间段内崩解的药物组合物(例如,口服调配物、颗粒剂、珠粒、片剂、胶囊)。崩解度是通过《美国药典(usp)》第<701>章崩解测试测量的。简单而言,将组合物以30次循环/分钟的速度在约37℃下置于篮-架组件中的1000ml去离子水中。在一些方面,所述较短的时间段约为30分钟或更短。术语“快速溶出”是指本文所述的药物组合物(例如,口服调配物、颗粒剂、珠粒、片剂、胶囊),其提供了腺苷a2a受体拮抗剂在较短的时间段内从药物组合物中的溶出。溶出度是通过《美国药典(usp)》第<701>章溶出度测试测量的。简单而言,将组合物于900ml约37℃的0.1nhcl溶出介质中置于桨速度为50rpm的usp设备2中。在一些方面,较短的时间段是在60分钟内至少50%的组合物溶出。在一些方面,较短的时间段是在30分钟内至少50%的组合物溶出。在一些方面,较短的时间段是在10分钟内至少50%的组合物溶出。“总杂质”在普通的药物命名法中是指药物中所有测量的杂质和降解产物的总和,也称为总相关物质。通过整合除溶剂之外的所有峰或与赋形剂相关的峰从指示稳定性的hplc法获得总杂质。以0.1%(v/v)甲磺酸水溶液为第一流动相并且乙腈为第二流动相使用梯度法。使用了c18色谱柱,uv检测为225nm。使用乙腈-水混合物稀释了样品。术语“生物等效”或“生物等效调配物”或“生物等效产品”是与其参考列出的药物(例如,5号药物组合物;6号药物组合物)在药学上等效的调配物,即在相同的使用条件下具有相同的活性成分、剂型、强度和施用途径。生物等效调配物在活性药物成分的吸收速率和程度上没有显著差异;并且,由于在活性药物成分的吸收速率和程度上没有显著差异,使其在治疗上等效,即可以替代参考上市药物,并期望生物等效产品具有与其参考列出的药物相同的安全性和功效(例如,5号药物组合物;6号药物组合物)。术语“疾病”或“病状”是指能够用本文提供的化合物、药物组合物或方法治疗的患者或受试者的状态或健康状况。在一些方面,所述疾病是癌症,如肺癌(例如,非小细胞肺癌)、黑色素瘤(例如,恶性黑色素瘤)、肾细胞癌、乳腺癌(例如,三阴性乳腺癌)、结肠直肠癌(例如,微卫星不稳定结肠直肠癌)、膀胱癌、前列腺癌(例如,转移性去势抵抗性前列腺癌、去势抵抗性前列腺癌)或头颈癌。在一些方面,这种疾病是一种转移性癌症。“qd”是指每天施用本文所述的化合物和组合物一次。“bid”指每天施用本文所述的化合物和组合物(bid)两次。在一些方面,每天两次施用是在患者醒来后和上床睡觉前。在一些方面,每天两次施用约隔8小时到约隔16小时。在一些方面,每天两次施用约隔9小时到约隔15小时。在一些方面,每天两次施用约隔10小时到约隔14小时。在一些方面,每天两次施用约为隔11小时到约隔13小时。在一些方面,每天两次施用约隔12小时。“癌症”是指在哺乳动物中发现的所有类型的癌症、肿瘤或恶性肿瘤,包含白血病、淋巴瘤、黑素瘤、神经内分泌肿瘤、癌和肉瘤。可以用本文提供的化合物、药物组合物或方法治疗的示例性癌症包含:淋巴瘤、肉瘤、膀胱癌、骨癌、脑瘤、宫颈癌、结肠癌、食道癌、胃癌、头颈癌、肾癌、骨髓瘤、甲状腺癌、白血病、前列腺癌、乳腺癌(例如三阴性、er阳性、er阴性、化疗抗性、赫赛汀抗性、her2阳性、阿霉素抗性、他莫苷芬抗性、导管癌、小叶癌、原发性、转移性)、卵巢癌、胰腺癌、肝癌(例如肝细胞癌)、肺癌(例如非小细胞肺癌、鳞状细胞肺癌、腺癌、大细胞肺癌、小细胞肺癌、类癌、肉瘤)、多形性胶质母细胞瘤、神经胶质瘤、黑色素瘤、前列腺癌、去势抵抗性前列腺癌、乳腺癌、三阴性乳腺癌、胶质母细胞瘤、卵巢癌、肺癌、鳞状细胞癌(例如头、颈或食管)、结肠直肠癌、白血病、急性髓性白血病、淋巴瘤、b细胞淋巴瘤或多发性骨髓瘤。另外的实例包含甲状腺癌、内分泌系统癌、脑癌、乳腺癌、宫颈癌、结肠癌、头颈癌、食道癌、肝癌、肾癌、肺癌、非小细胞肺癌、黑色素瘤、间皮瘤、卵巢癌、肉瘤、胃癌、子宫癌或髓母细胞瘤、霍奇金淋巴瘤(hodgkin′sdisease)、非霍奇金淋巴瘤(non-hodgkin′slymphoma)、多发性骨髓瘤、神经母细胞瘤、神经胶质瘤、多形性胶质母细胞瘤、卵巢癌、横纹肌肉瘤、原发性血小板增多症、原发性巨球蛋白血症、原发性脑肿瘤、癌症、恶性胰岛细胞瘤、恶性类癌、膀胱癌、癌前皮肤病变、睾丸癌、淋巴瘤、甲状腺癌、神经母细胞瘤、食道癌、泌尿生殖道癌、恶性高钙血症、子宫内膜癌、肾上腺皮质癌、内分泌或外分泌胰腺肿瘤、甲状腺髓样癌、甲状腺髓质癌、黑色素瘤、结肠直肠癌、甲状腺乳头状癌、肝细胞癌、乳头佩吉特病(paget′sdiseaseofthenipple)、叶状肿瘤、小叶癌、导管癌、胰腺星状细胞癌、肝星状细胞癌或前列腺癌。如本文所用,术语“转移”、“转移性”、“转移性肿瘤”和“转移性癌症”可以互换使用,并且指增殖性疾病或病症(例如癌症)从一个器官或另一个不相邻的器官或身体部分的扩散。癌症出现在起始部位(例如乳房),这一部位被称为原发性肿瘤,例如原发性乳腺癌。原发性肿瘤或起始部位的一些癌细胞获得了穿透和渗透局部区域周围正常组织的能力和/或穿透通过系统循环到体内的其它部位和组织的淋巴系统或血管系统壁的能力。由原发性肿瘤的癌细胞形成的第二种临床可检测肿瘤被称为转移性或继发性肿瘤。“腺苷a2a受体”或“a2a受体”是指并包含保持腺苷a2a受体活性(例如,与腺苷a2a受体相比,在至少50%、80%、90%、95%、96%、97%、98%、99%或100%的活性范围内)的任何重组或天然形式的腺苷a2a受体(也称为adora2a或其同工型或变体或同源物)。在一些方面,与天然存在的腺苷a2a受体相比,异构体、变体或同源物在整个序列或序列的一部分(例如,50、100、150或200个连续氨基酸部分)上具有至少90%、95%、96%、97%、98%、99%或100%的氨基酸序列同一性。在一些方面,腺苷a2a受体基本上与由uniprot参考号p29274识别的蛋白质或与所述蛋白质具有基本同一性的同种型、变体或同源物相同。在一些方面,腺苷a2a受体基本上与由uniprot参考号q60613识别的蛋白质或与所述蛋白质具有基本同一性的同种型、变体或同源物相同。“腺苷a2a受体拮抗剂”是一种例如通过结合、部分或完全阻断、降低、预防、延迟、失活、脱敏或下调腺苷a2a受体活性抑制腺苷a2a受体的化合物。关于腺苷a2a受体相互作用的“抑制(inhibition/inhibit/inhibiting)”等意思是相对于不存在抑制剂(例如,a2a受体拮抗剂)时蛋白质的活性或功能负面地影响(例如,降低)蛋白质的活性或功能产生(例如,降低a2a受体的活性)。在一些方面,抑制是指疾病或疾病症状(例如,癌症)的减少。因此,抑制至少部分包含部分或全部阻断腺苷a2a受体的刺激、减少、防止或延迟激活、或失活、脱敏或下调腺苷a2a受体的信号转导或酶活性。在一些方面,腺苷a2a受体拮抗剂是腺苷a2a受体拮抗剂的药学上可接受的盐。在实施例中,腺苷a2a受体拮抗剂是式(i)化合物或其药学上可接受的盐:在式(i)中:r1独立地是氢、卤素、-cxa3、-cn、-so2cl、-son1r9、-sov1nr9r10、-nhnh2、-onr9r10、-nhc=(o)nhnh2、-nhc=(o)nr9r10、-n(o)m1、-nr9r10、-nh-o-r9、-c(o)r9、-c(o)-or9、-c(o)nr9r10、-or9、经取代或未取代烷基、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基、或经取代或未取代杂芳基。在式(i)中:r2独立地是氢、卤素、-cxb3、-cn、-so2cl、-son2r11、-sov2nr11r12、-nhnh2、-onr11r12、-nhc=(o)nhnh2、-nhc=(o)nr11r12、-n(o)m2、-nr11r12、-nh-o-r11、-c(o)r11、-c(o)-or11、-c(o)nr11r12、-or11、经取代或未取代烷基、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基、或经取代或未取代杂芳基。在式(i)中:r3独立地是氢、卤素、-cxc3、-cn、-so2cl、-son3r13、-sov3nr13r14、-nhnh2、-onr13r14、-nhc=(o)nhnh2、-nhc=(o)nr13r14、-n(o)m3、-nr13r14、-nh-o-r13、-c(o)r13、-c(o)-or13、-c(o)nr13r14、-or13、经取代或未取代烷基、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基、或经取代或未取代杂芳基。在式(i)中:r9、r10、r11、r12、r13和r14独立地是氢、卤素、=o、=s、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、经取代或未取代烷基、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基、或经取代或未取代杂芳基。在一些方面,r9、r10、r11、r12、r13和r14独立地是氢、经取代或未取代烷基、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基、或经取代或未取代杂芳基。在式(i)中:xa、xb和xc独立地是f、cl、br或-i。在式(i)中:符号n1、n2和n3独立地是从0到4的整数。在一些方面,n1是0。在一些方面,n1是1。在一些方面,n1是3。在一些方面,n1是4。在一些方面,n2是0。在一些方面,n2是1。在一些方面,n2是3。在一些方面,n2是4。在一些方面,n3是0。在一些方面,n3是1。在一些方面,n3是3。在一些方面,n3是4。在式(i)中:符号m1、m2和m3独立地是从1到2的整数。在一些方面,m1是0。在一些方面,m1是1。在一些方面,m1是2。在一些方面,m2是0。在一些方面,m2是1。在一些方面,m2是2。在一些方面,m3是0。在一些方面,m3是1。在一些方面,m2是2。在式(i)中:符号v1、v2和v3独立地是从1到2的整数。在一些方面,v1是0。在一些方面,v1是1。在一些方面,v1是2。在一些方面,v2是0。在一些方面,v2是1。在一些方面,v2是2。在一些方面,v3是0。在一些方面,v3是1。在一些方面,v3是2。在实施例中,r1独立地是氢、卤素、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、r1a取代或未取代的烷基、r1a取代或未取代的杂烷基、r1a取代或未取代的环烷基、r1a取代或未取代的杂环烷基、r1a取代或未取代的芳基、或r1a取代或未取代的杂芳基。r1可以是r1a取代或未取代的(例如,c1-c20或c1-c6)烷基、r1a取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r1a取代或未取代的(例如,c3-c8或c5-c7)环烷基、r1a取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r1a取代或未取代的(例如,c5-c10或c5-c6)芳基或r1a取代或未取代的(例如5元到10元或5元到6元)的杂芳基。在实施例中,r1a独立地是氢、卤素、=o、=s、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、r1b取代或未取代的烷基、r1b取代或未取代的杂烷基、r1b取代或未取代的环烷基、r1b取代或未取代的杂环烷基、r1b取代或未取代的芳基或r1b取代或未取代的杂芳基。r1a可以是r1b取代或未取代的(例如,c1-c20或c1-c6)烷基、r1b取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r1b取代或未取代的(例如,c3-c8或c5-c7)环烷基、r1b取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r1b取代或未取代的(例如,c5-c10或c5-c6)芳基或r1b取代或未取代(例如5元到10元或5元到6元)的杂芳基。在实施例中,r1b独立地是氢、卤素、=o、=s、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、r1c取代或未取代的烷基、r1c取代或未取代的杂烷基、r1c取代或未取代的环烷基、r1c取代或未取代的杂环烷基、r1c取代或未取代的芳基、或r1c取代或未取代的杂芳基。r1b可以是r1c取代或未取代的(例如,c1-c20或c1-c6)烷基、r1c取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r1c取代或未取代的(例如,c3-c8或c5-c7)环烷基、r1c取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r1c取代或未取代的(例如,c5-c10或c5-c6)芳基或r1c取代或未取代(例如5元到10元或5元到6元)的杂芳基。在实施例中,r1c独立地是氢、卤素、=o、=s、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、未取代烷基、未取代杂烷基、未取代环烷基、未取代杂环烷基、未取代芳基或未取代杂芳基。r1c可以独立地是未取代(例如,c1-c20或c1-c6)烷基、未取代(例如,2元到20元或2元到6元)杂烷基、未取代(例如c3-c8或c5-c7)环烷基、未取代(例如,3元到8元或3元到6元)杂环烷基、未取代(例如,c5-c10或c5-c6)芳基或未取代(例如5元到10元或5元到6元)杂芳基。在实施例中,r1独立地是r1a取代或未取代的烷基、r1a取代或未取代的杂烷基、r1a取代或未取代的环烷基、r1a取代或未取代的杂环烷基、r1a取代或未取代的芳基、或r1a取代或未取代的杂芳基。在一些方面,r1是r1a取代或未取代的(例如,5元到10元或5元到6元)杂芳基。在一些方面,r1是未取代5元到6元杂芳基。在一些方面,r1是r1a取代的5元到6元杂芳基。在一些方面,r1是未取代5元杂芳基。在一些方面,r1是r1a取代的5元杂芳基。在一些方面,r1是r1a取代的呋喃基。在实施例中,r1a是r1b取代或未取代的(例如,c1-c20或c1-c6)烷基。在一些方面,r1a是r1b取代的c1-c6烷基。在一些方面,r1a是未取代c1-c6烷基。在一些方面,r1a是r1b取代的c1-c4烷基。在一些方面,r1a是未取代c1-c4烷基。在一些方面,r1a是r1b取代的c1-c3烷基。在一些方面,r1a是未取代c1-c3烷基。在一些方面,r1a是甲基。在实施例中,r2独立地是氢、卤素、-cxb3、-cn、-so2cl、-son2r11、-sov2nr11r12、-nhnh2、-onr11r12、-nhc=(o)nhnh2、-nhc=(o)nr11r12、-n(o)m2、-nr11r12、-nh-o-r11、-c(o)r11、-c(o)-or11、-c(o)nr11r12或-or11。在本文提供的方法的一些方面,r2独立地是氢、卤素、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、未取代烷基、未取代杂烷基、未取代环烷基、未取代杂环烷基、未取代芳基或未取代杂芳基。在一些方面,r2是-nr11r12。在一些方面,r11和r12独立地是氢或经取代或未取代(例如,c1-c20或c1-c6)烷基。在一些方面,r11和r12独立地是经取代或未取代c1-c6烷基。在一些方面,r11和r12独立地是经取代或未取代c1-c4烷基。在一些方面,r11和r12独立地是经取代或未取代c1-c3烷基。在一些方面,r11和r12独立地是未取代c1-c6烷基。在一些方面,r11和r12独立地是经取代或未取代c1-c4烷基。在一些方面,r11和r12独立地是未取代c1-c3烷基。在一些方面,r11和r12独立地是氢。在实施例中,r3独立地是氢、卤素、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、r4取代或未取代的烷基、r4取代或未取代的杂烷基、r4取代或未取代的环烷基、r4取代或未取代的杂环烷基、r4取代或未取代的芳基、或r4取代或未取代的杂芳基。r3可以是r4取代或未取代的(例如,c1-c20或c1-c6)烷基、r4取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r4取代或未取代的(例如,c3-c8或c5-c7)环烷基、r4取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r4取代或未取代的(例如,c5-c10或c5-c6)芳基或r4取代或未取代(例如5元到10元或5元到6元)的杂芳基。在实施例中,r4独立地是氢、卤素、=o、=s、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、r5取代或未取代的烷基、r5取代或未取代的杂烷基、r5取代或未取代的环烷基、r5取代或未取代的杂环烷基、r5取代或未取代的芳基、或r5取代或未取代的杂芳基。r4可以是r5取代或未取代的(例如,c1-c20或c1-c6)烷基、r5取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r5取代或未取代的(例如,c3-c8或c5-c7)环烷基、r5取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r5取代或未取代的(例如,c5-c10或c5-c6)芳基或r5取代或未取代(例如5元到10元或5元到6元)的杂芳基。在实施例中,r5独立地是氢、卤素、=o、=s、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、r6取代或未取代的烷基、r6取代或未取代的杂烷基、r6取代或未取代的环烷基、r6取代或未取代的杂环烷基、r6取代或未取代的芳基、或r6取代或未取代的杂芳基。r5可以是r6取代或未取代的(例如,c1-c20或c1-c6)烷基、r6取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r6取代或未取代的(例如,c3-c8或c5-c7)环烷基、r6取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r6取代或未取代的(例如,c5-c10或c5-c6)芳基或r6取代或未取代(例如5元到10元或5元到6元)的杂芳基。在实施例中,r6独立地是氢、卤素、=o、=s、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、r7取代或未取代的烷基、r7取代或未取代的杂烷基、r7取代或未取代的环烷基、r7取代或未取代的杂环烷基、r7取代或未取代的芳基、或r7取代或未取代的杂芳基。r6可以是r7取代或未取代的(例如,c1-c20或c1-c6)烷基、r7取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r7取代或未取代的(例如,c3-c8或c5-c7)环烷基、r7取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r7取代或未取代的(例如,c5-c10或c5-c6)芳基或r7取代或未取代(例如5元到10元或5元到6元)的杂芳基。在实施例中,r3独立地是氢、卤素、r4取代或未取代的烷基、r4取代或未取代的杂烷基、r4取代或未取代的环烷基、r4取代或未取代的杂环烷基、r4取代或未取代的芳基、或r4取代或未取代的杂芳基。在一些方面,r3独立地是r4取代或未取代的(例如,c1-c20或c1-c6)烷基。在一些方面,r3独立地是r4取代或未取代c1-c6烷基。在一些方面,r3独立地是r4取代或未取代c1-c5烷基。在一些方面,r3独立地是r4取代或未取代c1-c4烷基。在一些方面,r3独立地是r4取代或未取代c1-c3烷基。在一些方面,r3独立地是未取代c1-c6烷基。在一些方面,r3独立地是未取代c1-c5烷基。在一些方面,r3独立地是r4未取代c1-c4烷基。在一些方面,r3独立地是未取代c1-c3烷基。在一些方面,r3独立地是r4取代的c1-c6烷基。在一些方面,r3独立地是r4取代的c1-c5烷基。在一些方面,r3独立地是r4取代的c1-c4烷基。在一些方面,r3独立地是r4取代的c1-c3烷基。在一些方面,r3独立地是r4取代的c1烷基。在实施例中,r4可以是r5取代或未取代的(例如,c1-c20或c1-c6)烷基、r5取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r5取代或未取代的(例如,c3-c8或c5-c7)环烷基、r5取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r5取代或未取代的(例如,c5-c10或c5-c6)芳基或r5取代或未取代(例如5元到10元或5元到6元)的杂芳基。在一些方面,r4是r5取代或未取代的5元到6元杂芳基。在一些方面,r4是r5取代或未取代的6元杂芳基。在一些方面,r4是未取代6元杂芳基。在一些方面,r4是r5取代的6元杂芳基。在一些方面,r4是r5取代的吡啶基。在实施例中,r5可以是r6取代或未取代的(例如,c1-c20或c1-c6)烷基、r6取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r6取代或未取代的(例如,c3-c8或c5-c7)环烷基、r6取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r6取代或未取代的(例如,c5-c10或c5-c6)芳基或r6取代或未取代(例如5元到10元或5元到6元)的杂芳基。在一些方面,r5是r6取代或未取代的2元到6元杂烷基。在一些方面,r5是r6取代或未取代的2元到5元杂烷基。在一些方面,r5是r6取代或未取代的2元到4元杂烷基。在一些方面,r5是r6取代或未取代的2元到3元杂烷基。在一些方面,r5是r6取代或未取代的2元杂烷基。在一些方面,r5是未取代2元到6元杂烷基。在一些方面,r5是未取代2元到5元杂烷基。在一些方面,r5是未取代2元到4元杂烷基。在一些方面,r5是未取代2元到3元杂烷基。在一些方面,r5是未取代2元杂烷基。在一些方面,r5是r6取代的2元到6元杂烷基。在一些方面,r5是r6取代的2元到5元杂烷基。在一些方面,r5是r6取代的2元到4元杂烷基。在一些方面,r5是r6取代的2元到3元杂烷基。在一些方面,r5是r6取代的2元杂烷基。在实施例中,r6可以是r7取代或未取代的(例如,c1-c20或c1-c6)烷基、r7取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r7取代或未取代的(例如,c3-c8或c5-c7)环烷基、r7取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r7取代或未取代的(例如,c5-c10或c5-c6)芳基或r7取代或未取代(例如5元到10元或5元到6元)的杂芳基。在一些方面,r6是r7取代或未取代的3元到6元杂环烷基。在一些方面,r6是r7取代或未取代的5元杂环烷基。在一些方面,r6是r7取代的5元杂环烷基。在一些方面,r6是未取代5元杂环烷基。在一些方面,r6是未取代四氢呋喃基。在实施例中,r9、r10、r11、r12、r13和r14独立地是氢、卤素、=o、=s、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、未取代烷基、未取代杂烷基、未取代环烷基、未取代杂环烷基、未取代芳基或未取代杂芳基。在实施例中,r1是r1a取代的呋喃基。在一些方面,r1a是甲基。在一些方面,r2是-nr11r12。在一些方面,r11和r12独立地是氢。在一些方面,r3独立地是r4取代的c1烷基。在一些方面,r4是r5取代的吡啶基。在一些方面,r5是r6取代的2元杂烷基。在一些方面,r6是未取代四氢呋喃基。在实施例中,腺苷a2a受体拮抗剂是式(ii)化合物或其药学上可接受的盐:在式(ii)中:r6、r6.1和r6.2独立地是氢、卤素、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、经取代或未取代烷基、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基、或经取代或未取代杂芳基。在一些方面,r6、r6.1和r6.2独立地是氢、经取代或未取代烷基、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基、或经取代或未取代杂芳基。在一些方面,r6.1和r6.2是氢,并且r6是经取代或未取代烷基、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基、或经取代或未取代杂芳基。在一些方面,r6.1和r6.2是氢,并且r6是经取代或未取代杂环烷基。在一些方面,r6.1和r6.2是氢,并且r6是未取代杂环烷基。在一些方面,r1是经取代(例如被未取代c1-c5烷基取代)或未取代杂芳基。在一些方面,r1是经取代(例如被未取代c1-c5烷基取代)或未取代呋喃基。在一些方面,r1是甲基取代的呋喃基。在式(ii)中:r1和r6如上所述(例如,r6可以是r7取代或未取代的3元到6元杂环烷基,并且r1可以是r1a取代的5元到6元杂芳基)。在一些方面,r6是未取代四氢呋喃基,并且r1是r1a取代的呋喃基。在式(ii)中:r6.1可以独立地是氢、卤素、=o、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、r7.1取代或未取代的烷基、r7.1取代或未取代的杂烷基、r7.1取代或未取代的环烷基、r7.1取代或未取代的杂环烷基、r7.1取代或未取代的芳基、或r7.1取代或未取代的杂芳基。r6.1可以是r7.1取代或未取代的(例如,c1-c20或c1-c6)烷基、r7.1取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r7.1取代或未取代的(例如,c3-c8或c5-c7)环烷基、r7.1取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r7.1取代或未取代的(例如,c5-c10或c5-c6)芳基或r7.1取代或未取代(例如5元到10元或5元到6元)的杂芳基。在一些方面,r6.1是r7.1取代或未取代的c1-c6烷基。在一些方面,r6.1是r7.1取代或未取代的c1-c5烷基。在一些方面,r6.1是r7.1取代或未取代的c1-c4烷基。在一些方面,r6.1是r7.1取代或未取代的c1-c3烷基。在一些方面,r6.1独立地是r7.1取代的c1-c6烷基。在一些方面,r6.1是r7.1取代的c1-c5烷基。在一些方面,r6.1是r7.1取代的c1-c4烷基。在一些方面,r6.1是r7.1取代的c1-c3烷基。在一些方面,r6.1是未取代c1-c6烷基。在一些方面,r6.1是未取代c1-c5烷基。在一些方面,r6.1是未取代c1-c4烷基。在一些方面,r6.1是未取代c1-c3烷基。在一些方面,r6.1是未取代甲基。在式(ii)中:r6.2独立地是氢、卤素、=o、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、r7.2取代或未取代的烷基、r7.2取代或未取代的杂烷基、r7.2取代或未取代的环烷基、r7.2取代或未取代的杂环烷基、r7.2取代或未取代的芳基、或r7.2取代或未取代的杂芳基。r6.2可以是r7.2取代或未取代的(例如,c1-c20或c1-c6)烷基、r7.2取代或未取代的(例如,2元到20元或2元到6元)杂烷基、r7.2取代或未取代的(例如,c3-c8或c5-c7)环烷基、r7.2取代或未取代的(例如,3元到8元或3元到6元)杂环烷基、r7.2取代或未取代的(例如,c5-c10或c5-c6)芳基或r7.2取代或未取代(例如5元到10元或5元到6元)的杂芳基。在一些方面,r6.2是r7.2取代或未取代的c1-c6烷基。在一些方面,r6.2是r7.2取代或未取代的c1-c5烷基。在一些方面,r6.2是r7.2取代或未取代的c1-c4烷基。在一些方面,r6.2是r7.2取代或未取代的c1-c3烷基。在一些方面,r6.2是r7.2取代的c1-c6烷基。在一些方面,r6.2是r7.2取代的c1-c5烷基。在一些方面,r6.2是r7.2取代的c1-c4烷基。在一些方面,r6.2是r7.2取代的c1-c3烷基。在一些方面,r6.2是未取代c1-c6烷基。在一些方面,r6.2是未取代c1-c5烷基。在一些方面,r6.2是未取代c1-c4烷基。在一些方面,r6.2是未取代c1-c3烷基。在一些方面,r6.2是未取代甲基。在式(ii)中:r7、r7.1和r7.2独立地是氢、卤素、=o、=s、-cf3、-cn、-ccl3、-cooh、-ch2cooh、-conh2、-oh、-sh、-so2cl、-so3h、-so4h、-so2nh2、-no2、-nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、未取代烷基、未取代杂烷基、未取代环烷基、未取代杂环烷基、未取代芳基或未取代杂芳基。r7、r7.1和r7.2可以独立地是未取代(例如,c1-c20或c1-c6)烷基、未取代(例如,2元到20元或2元到6元)杂烷基、未取代(例如c3-c8或c5-c7)环烷基、未取代(例如,3元到8元或3元到6元)杂环烷基、未取代(例如,c5-c10或c5-c6)芳基或未取代(例如5元到10元或5元到6元)杂芳基。在实施例中,a2a受体拮抗剂是式(iii)化合物或其药学上可接受的盐:“式(iii)化合物”在本文中也可称为“式(iii)”或cpi-444。在一些方面,式(iii)化合物是式(iiia)化合物。在一些方面,式(iii)化合物是式(iiib)化合物。在一些方面,式(iii)化合物是式(iiia)和(iiib)化合物的混合物。在一些方面,式(iii)化合物是式(iiia)和式(iiib)化合物的外消旋混合物。在实施例中,式(iii)化合物是式(iiia)化合物或其药学上可接受的盐:在实施例中,式(iii)化合物是式(iiib)化合物或其药学上可接受的盐:用于制备腺苷a2a受体拮抗剂(包含式(i)、式(ii)、式(iii)、式(iiia)和式(iiib)的腺苷a2a受体拮抗剂)的方法在本领域中是已知的,并且例如在wo2017/112917、美国专利第8,450,328号、美国专利第8,987,279号、美国专利第9,376,443号和美国专利第9,765,080号中进行了描述,这些美国专利的公开内容通过引用以其整体并入本文。这里使用的缩写具有其化学和生物领域的常规含义。本文阐述的化学结构和化学式是根据化学领域中已知的化学价标准规则构建的。当用从左到右书写的常规化学式说明取代基时,所述取代基同等地涵盖由从右到左书写结构所得到的化学上一致的取代基,例如-ch2o-等同于-och2-。“烷基”本身或作为另一个取代基的一部分,是指直链(即无支链)或支链的非环状碳链(或碳)或其组合,其可以是完全饱和的、单不饱和的或多不饱和的,并且可以包含具有指定碳原子数的二价和多价自由基(即c1-c10是指一到十个碳)。饱和烃自由基的实例包含但不限于:甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、(环己基)甲基等基团;例如正戊基、正己基、正庚基、正辛基等的同系物和异构体。不饱和烷基是具有一个或多个双键或三键的基团。不饱和烷基的实例包含但不限于乙烯基、2-丙烯基、巴豆基、2-异戊烯基、2-(丁二烯基)、2,4-戊二烯基、3-(1,4-戊二烯基)、乙炔基、1-和3-丙炔基、3-丁炔基以及更高级的同系物和异构体。烷氧基是通过氧连接体(-o-)附接到分子其余部分的烷基。烷基部分可以是烯基部分。烷基部分可以是炔基部分。烷基部分可以完全饱和。除了一个或多个双键之外,烯基可以包含一个以上的双键和/或一个或多个三键。除了一个或多个三键之外,炔基可以包含一个以上的三键和/或一个或多个双键。“亚烷基”本身或作为另一个取代基的一部分,是指衍生自烷基的二价自由基,例如但不限于ch2ch2ch2ch2-。典型地,烷基(或亚烷基)具有1到24个碳原子,优选的是这些基团具有10个或更少碳原子,并且更优选的是具有6个或更少碳原子或4个或更少碳原子“低级烷基”或“低级亚烷基”是短链烷基或亚烷基,通常具有八个或更少的碳原子。除非另有说明,术语“亚烯基”本身或作为另一个取代基的一部分是指衍生自烯烃的二价自由基。“杂烷基”本身或与另一术语组合,是指稳定的直链或支链非环状链或其组合,包含至少一个碳原子和至少一个杂原子(例如,o、n、p、si和s),其中氮和硫原子可以任选地被氧化,并且氮杂原子可以任选地被季铵化。杂原子(例如,o、n、p、s和si)可以置于杂烷基的任何内部位置或烷基附接到分子其余部分的位置。实例包含但不限于:-ch2-ch2-o-ch3、-ch2-ch2-nh-ch3、-ch2-ch2-n(ch3)-ch3、-ch2-s-ch2-ch3、-ch2-ch2、-s(o)-ch3、-ch2-ch2-s(o)2-ch3、-ch=ch-o-ch3、-si(ch3)3、-ch2-ch=n-och3、-ch=ch-n(ch3)-ch3、-o-ch3、-o-ch2-ch3和-cn。至多两个或三个杂原子可以是连续的,如例如,-ch2-nh-och3和-ch2-o-si(ch3)3。杂烷基部分可以包含一个杂原子(例如,o、n、s、si或p)。杂烷基部分可以包含两个任选地不同的杂原子(例如,o、n、s、si或p)。杂烷基部分可以包含三个任选地不同的杂原子(例如,o、n、s、si或p)。杂烷基部分可以包含四个任选地不同的杂原子(例如,o、n、s、si或p)。杂烷基部分可以包含五个任选地不同的杂原子(例如,o、n、s、si或p)。杂烷基部分可以包含至多8个任选地不同的杂原子(例如,o、n、s、si或p)。除非另有说明,术语“杂链烯基”本身或与另一个术语组合表示包含至少一个双键的杂烷基。除了一个或多个双键之外,杂链烯基可以任选地包含一个以上的双键和/或一个或多个三键。除非另有说明,术语“杂烷基炔基”本身或与另一个术语组合表示包含至少一个三键的杂烷基。除了一个或多个三键之外,杂炔基可以任选地包含一个以上的三键和/或一个或多个双键。单独或作为另一个取代基的一部分,“杂亚烷基”是指衍生自杂烷基(例如但不限于-ch2-ch2-s-ch2-ch2-和-ch2-s-ch2-ch2-nh-ch2-)的二价自由基。对于杂亚烷基,杂原子也可以占据一个或两个链末端(例如亚烷氧基、亚烷二氧基、亚烷氨基、亚烷基二氨基等)。此外,对于亚烷基和杂亚烷基连接基团,连接基团的结构式的书写方向并不暗示连接基团的取向。例如,式-c(o)2r′表示-c(o)2r′和-r′c(o)2-两者。如上所述,本文所用的杂烷基包含通过杂原子附接到分子其余部分的那些基团,如-c(o)r′、-c(o)nr′、-nr′r″、-or′、-sr′和/或-so2r′。当在叙述“杂烷基”之后叙述特定的杂烷基(如“-nr′r′”等)时,应该理解术语“杂烷基”和“-nr′r′”不是多余的或互斥的。相反,叙述特定的杂烷基基团是为了增加清晰度。因此,术语“杂烷基”在本文中不应解释为排除特定的杂烷基,例如-nr′r″等。“环烷基”和“杂环烷基”本身或与其它术语组合分别表示“烷基”和“杂烷基”的非芳族环状形式,其中组成一个或多个环的碳不一定需要键合到氢上,因为所有的碳价都参与与非氢原子的键合。此外,对于杂环烷基,杂原子可以占据杂环附接到分子其余部分的位置。烷基的实例包含但不限于环丙基、环丁基、环戊基、环己基、1-环己烯基、3-环己烯基、环庚基、3-羟基-环丁-3-烯基-1,2、二酮、1h-1,2,4-三唑基-5(4h)-酮、4h-1,2,4-三唑基等。杂环烷基的实例包含但不限于1-(1,2,5,6-四氢吡啶基)、1-哌啶基、2-哌啶基、3-哌啶基、4-吗啉基、3-吗啉基、四氢呋喃-2-基、四氢呋喃-3-基、四氢噻吩-2-基、四氢噻吩-3-基、1-哌嗪基、2-哌嗪基等。“环亚烷基”和“杂环亚烷基”单独或作为另一个取代基的一部分分别是指衍生自环烷基和杂环烷基的二价自由基。杂环烷基部分可以包含一个环杂原子(例如,o、n、s、si或p)。杂环烷基部分可以包含两个任选地不同的环杂原子(例如,o、n、s、si或p)。杂环烷基部分可以包含三个任选地不同的环杂原子(例如,o、n、s、si或p)。杂环烷基部分可以包含四个任选地不同的环杂原子(例如,o、n、s、si或p)。杂环烷基部分可以包含五个任选地不同的杂原子(例如,o、n、s、si或p)。杂环烷基部分可以包含至多8个任选地不同的杂原子(例如,o、n、s、si或p)。“卤素(halo/halogen)”单独或作为另一个取代基的一部分是指氟、氯、溴或碘原子。此外,“卤代烷基”等术语旨在包含单卤代烷基和多卤代烷基。例如,术语“卤代(c1-c4)烷基”包含但不限于氟甲基、二氟甲基、三氟甲基、2,2,2-三氟乙基、4-氯丁基、3-溴丙基等。除非另外说明,否则“酰基”是指-c(o)r,其中r是经取代或未取代烷基、经取代或未取代环烷基、经取代或未取代杂烷基、经取代或未取代杂环烷基、经取代或未取代芳基、或经取代或未取代杂芳基。“芳基”是指多不饱和芳香族烃取代基,其可以是稠合在一起(即稠合的环芳基)或共价连接的单环或多环(优选1个到3个环)。稠环芳基是指稠合在一起的多个环,其中至少一个稠环是芳基环。术语“杂芳基”是指含有至少一个杂原子(如n、o或s)的芳基(或环),其中氮和硫原子任选地被氧化,并且一个或多个氮原子任选被地季铵化。因此,术语“杂芳基”包含稠环杂芳基(即稠合在一起的多个环,其中至少一个稠环是杂芳环)。5,6-稠环杂芳基是指稠合在一起的两个环,其中一个环具有5个成员并且另一个环具有6个成员,并且其中至少一个环是杂芳基环。同样,6,6-稠环杂芳基是指稠合在一起的两个环,其中一个环具有6个成员并且另一个环具有6个成员,并且其中至少一个环是杂芳基环。以及6,5-稠环杂芳基是指稠合在一起的两个环,其中一个环具有6个成员并且另一个环具有5个成员,并且其中至少一个环是杂芳基环。杂芳基可以通过碳或杂原子附接到分子的其余部分。芳基和杂芳基的非限制性实例包含:苯基、1-萘基、2-萘基、4-联苯基、1-吡咯基、2-吡咯基、3-吡咯基、3-吡唑基、2-咪唑基、4-咪唑基、吡嗪基、2-恶唑基、4-恶唑基、2-苯基-4-恶唑基、5-恶唑基、3-异恶唑基、4-异恶唑基、5-异恶唑基、2-噻唑基、4-噻唑基、5-噻唑基、2-呋喃基、3-呋喃基、2-噻吩基、3-噻吩基、2-吡啶基、3-吡啶基、4-吡啶基、2-嘧啶基、4-嘧啶基、5-苯并噻唑基、嘌呤基、2-苯并咪唑基、5-吲哚基、1-异喹啉基、5-异喹啉基、2-喹喏啉基、5-喹喏啉基、3-喹啉基和6-喹啉基。以上所指出的芳基和杂芳基环系统中的每一个的取代基选自下文所描述的可接受取代基的组。单独或作为另一取代基的一部分,“亚芳基”和“亚杂芳基”意指分别衍生于芳基和杂芳基的二价自由基。芳基和杂芳基的非限制性实例包含:吡啶基、嘧啶基、苯硫基、噻吩基、呋喃基、吲哚基、苯并二重氮基、苯并二恶唑基、苯并二恶烷基、噻吩甲酰基、吡咯并吡啶基、吲唑基、喹啉基、喹喔啉基、苯并吡唑基、喹唑啉基、苯并异恶唑基、咪唑并吡啶基、苯并呋喃基、苯并噻吩基(benzothienyl)、苯并噻吩基(benzothiophenyl)、苯基、萘基、联苯基、吡咯基、吡唑基、咪唑基、吡嗪基、恶唑基、异恶唑基、噻唑基、呋喃基噻吩基、吡啶基、嘧啶基、苯并噻唑基、嘌呤基、苯并咪唑基、异喹啉基、噻二唑基、恶二唑基、吡咯基、重氮基、三唑基、四唑基、苯并噻二唑基、异噻唑基、吡唑并嘧啶基、吡咯并嘧啶基、苯并三唑基、苯并唑基或喹啉基。上述实例可以是经取代的或未取代的,并且上述每个杂芳基实例的二价自由基是杂芳基的非限制性实例。杂芳基部分可以包含一个环杂原子(例如,o、n或s)。杂芳基部分可以包含两个任选地不同的环杂原子(例如,o、n或s)。杂芳基部分可以包含三个任选地不同的环杂原子(例如,o、n或s)。杂芳基部分可以包含四个任选地不同的环杂原子(例如,o、n或s)。杂芳基部分可以包含五个任选地不同的环杂原子(例如,o、n或s)。芳基部分可以有单个环。芳基部分可以具有两个任选地不同的环。芳基部分可以具有三个任选地不同的环。芳基部分可以具有四个任选地不同的环。杂芳基部分可以有一个环。杂芳基部分可以具有两个任选地不同的环。杂芳基部分可以具有三个任选地不同的环。杂芳基部分可以具有四个任选地不同的环。杂芳基部分可以具有五个任选地不同的环。稠环杂环烷基-芳基是稠合到杂环烷基上的芳基。稠环杂环烷基-杂芳基是稠合到杂环烷基上的杂芳基。稠环杂环烷基-环烷基是稠合到环烷基上的杂环烷基。稠环杂环烷基-杂环烷基是稠合到另一个杂环烷基上的杂环烷基。稠环杂环烷基-芳基、稠环杂环烷基-杂芳基、稠环杂环烷基-环烷基或稠环杂环烷基-杂环烷基可以各自独立地未被取代或被一个或多个本文所述的取代基取代。“氧代”是指与碳原子双键相连的氧。“烷基磺酰基”是指具有式-s(o2)-r′的部分,其中r′是如上定义的经取代或未取代的烷基。r′可以具有特定数量的碳(例如,“c1-c4烷基磺酰基”)。上述术语(例如,“烷基”、“杂烷基”、“环烷基”、“杂环烷基”、“芳基”和“杂芳基”)中的每一个包含所示自由基的经取代和未取代形式。各种类型的自由基的优选取代基如下。烷自由基和杂烷自由基(包含通常被称作亚烷基、烯基、亚杂烷基、杂烯基、炔基、环烷基、杂环烷基、环烯基和杂环烯基)的取代基可以是选自但不限于以下的多种基团中的一个或多个:-or′、=o、=nr′、=n-or′、-nr′r″、-sr′、-卤素、-sir′r″r″′、-oc(o)r′、-c(o)r′、-co2r′、-conr′r″、-oc(o)nr′r″、-nr″c(o)r′、-nr′-c(o)nr″r″′、-nr″c(o)2r′、-nr-c(nr′r″r″′)=nr″″、-nr-c(nr′r″)=nr″′、-s(o)r′、-s(o)2r′、-s(o)2nr′r″、-nrso2r′、-nr′nr″r″′、-onr′r″、-nr′c=(o)nr″nr″′r″″、-cn、-no2,数量在零到(2m′+1)范围内,其中m′是此类自由基中的碳原子总数。r、r′、r″、r″′和r″″各自优选独立地指氢、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基(例如,被1到3个卤素取代的芳基)、经取代或未取代杂芳基、经取代或未取代烷基、烷氧基或硫代烷氧基或芳基烷基。当化合物包含多于一个r基团时,例如,如当存在多于一个这些基团时独立地选择各r′、r″、r″′和r″″基团那样,独立地选择r基团中的每一个。当r′和r″附接在同一个氮原子上时,它们可以与氮原子结合形成4元、5元、6元或7元环。例如,-nr′r′’包含但不限于1-吡咯烷基和4-吗啉基。从以上对取代基的讨论中,本领域技术人员将理解术语“烷基”旨在包含含有与除氢基团以外的基团结合的碳原子的基团,如卤代烷基(例如,-cf3和-ch2cf3)和酰基(例如,-c(o)ch3、-c(o)cf3、-c(o)ch2och3等)。类似于所描述的烷自由基的取代基,芳基和杂芳基的取代基是变化的,并且选自例如以下:-or′、-nr′r″、-sr′、-卤素、-sir′r″r″′、-oc(o)r′、-c(o)r′、-co2r′、-conr′r″、-oc(o)nr′r″、-nr″c(o)r′、-nr′-c(o)nr″r″′、-nr″c(o)2r′、-nr-c(nr′r″r″′)=nr″″、-nr-c(nr′r″)=nr″′、-s(o)r′、-s(o)2r′、-s(o)2nr′r″、-nrso2r′、-nr′nr″r″′、-onr′r″、-nr′c(o)nr″nr″′r″″、-cn、-no2、-r′、-n3、-ch(ph)2、氟(c1-c4)烷氧基和氟(c1-c4)烷基,数量在零到芳环系统上的开放价总数的范围内并且其中r′、r″、r″′和r″″优选地独立地选自氢、经取代或未取代烷基、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基和经取代或未取代杂芳基。当化合物包含多于一个r基团时,例如,如当存在多于一个这些基团时独立地选择各r′基团、r″基团、r″′基团和r″″基团那样,独立地选择r基团中的每一个。两个或多个取代基可以被任选地连接形成芳基、杂芳基、环烷基或杂环烷基。这种所谓的成环取代基通常(尽管不是必须的)附接到环状碱基结构上。在一方面,成环取代基附接到基础结构的相邻成员上。例如,两个附接到环状碱基结构相邻成员上的成环取代基形成稠环结构。另一方面,成环取代基附接到基础结构的单个成员上。例如,两个附接到环状碱基结构的单个成员上的成环取代基形成螺环结构。在又另一方面,成环取代基附接到基础结构的非相邻成员上。芳基或杂芳基环的相邻原子上的两个取代基可以任选地形成通式为-t-c(o)-(crr′)q-u-的环,其中t和u独立地是-nr-、-o-、-crr′-或单键,并且q是0到3的整数。替代性地,芳基或杂芳基环的相邻原子上的取代基中的两个可以任选地被式-a-(ch2)r-b-的取代基取代,其中a和b独立地是-crr′-、-o-、-nr-、-s-、-s(o)-、-s(o)2-、-s(o)2nr′-或单键,并且r是1到4的整数。如此形成的新环的单键之一可以任选地被双键取代。替代性地,芳基或杂芳基环的相邻原子上的两个取代基可以任选地被式-(crr′)s-x′-(c″r″r″′)d-的取代基取代,其中s和d独立地是0到3的整数,并且x′是-o-、-nr′-、-s-、-s(o)-、-s(o)2-或-s(o)2nr′-。取代基r′、r″、r″′和r″″优选地独立地选自氢、经取代或未取代烷基、经取代或未取代杂烷基、经取代或未取代环烷基、经取代或未取代杂环烷基、经取代或未取代芳基和经取代或未取代杂芳基。“杂原子”或“环杂原子”旨在包含氧(o)、氮(n)、硫(s)、磷(p)和硅(si)。本文所用的“取代基”是指选自以下部分的基团:(a)氧代、卤素、-cf3、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、-nhc=(o)nh2、-nhso2h、-nhc=(o)h、-nhc(o)-oh、-nhoh、-ocf3、-ochf2、未取代烷基、未取代的杂烷基、未取代的环烷基、未取代杂环烷基、未取代的芳基、未取代的杂芳基,以及(b)被至少一个选自以下的取代基取代的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基:(i)氧代、卤素、-cf3、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、-nhc=(o)nh2、-nhso2h、-nhc=(o)h、-nhc(o)-oh、-nhoh、-ocf3、-ochf2、未取代烷基、未取代杂烷基、未取代环烷基、未取代杂环烷基、未取代芳基、未取代杂芳基,以及(ii)被至少一个选自以下的取代基取代的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基:(a)氧代、卤素、-cf3、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、-nhc=(o)nh2、-nhso2h、-nhc=(o)h、-nhc(o)-oh、-nhoh,-ocf3、-ochf2、未取代烷基、未取代杂烷基、未取代环烷基、未取代杂环烷基、未取代芳基、未取代杂芳基和(b)被至少一个选自以下的取代基取代的烷基,杂烷基,环烷基,杂环烷基,芳基,杂芳基:氧代、卤素、-cf3、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc=(o)nhnh2、-nhc=(o)nh2、-nhso2h、-nhc=(o)h、-nhc(o)-oh、-nhoh、-ocf3、-ochf2、未取代烷基、未取代杂烷基、未取代环烷基、未取代杂环烷基、未取代芳基、未取代杂芳基。如本文所用的,“大小受限的取代基(size-limitedsubstituent/size-limitedsubstituentgroup)”意指选自上文对于“取代基”所描述的所有取代基的基团,其中每个经取代或未取代烷基是经取代或未取代c1-c20烷基,每个经取代或未取代杂烷基是经取代或未取代2元到20元杂烷基,每个经取代或未取代环烷基是经取代或未取代c3-c8环烷基,每个经取代或未取代杂环烷基是经取代或未取代3元到8元杂环烷基,每个经取代或未取代芳基是经取代或未取代c6-c10芳基,并且每个经取代或未取代杂芳基是经取代或未取代5元到10元杂芳基。如本文所用的,“低级取代基(lowersubstituent/lowersubstituentgroup)”意指选自上文对于“取代基”所描述的所有取代基的基团,其中每个经取代或未取代烷基是经取代或未取代c1-c8烷基,每个经取代或未取代杂烷基是经取代或未取代2元到8元杂烷基,每个经取代或未取代环烷基是经取代或未取代c3-c7环烷基,每个经取代或未取代杂环烷基是经取代或未取代3元到7元杂环烷基,每个经取代或未取代芳基是经取代或未取代c6-c10芳基,并且每个经取代或未取代杂芳基是经取代或未取代5元到9元杂芳基。在实施例中,本文化合物中描述的每个经取代集团被至少一个取代基取代。更具体地,在一些方面,本文化合物中描述的每个经取代烷基、经取代杂烷基、经取代环烷基、经取代杂环烷基、经取代芳基、经取代杂芳基、经取代亚烷基、经取代杂亚烷基、经取代亚环烷基、经取代杂环亚烷基、经取代亚芳基和/或经取代杂亚芳基被至少一个取代基取代。在其它方面,这些基团中的至少一个或全部被至少一个尺寸受限的取代基取代。在其它方面,这些基团中的至少一个或全部被至少一个低级取代基取代。在本文化合物的实施例中,每个经取代或未取代烷基是经取代或未取代c1-c20烷基,每个经取代或未取代杂烷基是经取代或未取代2元到20元杂烷基,每个经取代或未取代环烷基是经取代或未取代c3-c8环烷基,每个经取代或未取代杂环烷基是经取代或未取代3元到8元杂环烷基,每个经取代或未取代芳基是经取代或未取代c6-c10芳基,并且每个经取代或未取代杂芳基是经取代或未取代5元到10元杂芳基。在一些方面,每个经取代或未取代亚烷基是经取代或未取代c1-c20亚烷基,每个经取代或未取代杂亚烷基是经取代或未取代2元到20元杂亚烷基,每个经取代或未取代环亚烷基是经取代或未取代c3-c8环亚烷基,每个经取代或未取代杂环亚烷基是经取代或未取代3元到8元杂环亚烷基,每个经取代或未取代亚芳基是经取代或未取代c6-c10亚芳基,和/或经取代或未取代杂亚芳基是经取代或未取代5元到10元杂亚芳基。在实施例中,每个经取代或未取代烷基是经取代或未取代c1-c8烷基,每个经取代或未取代杂烷基是经取代或未取代2元到8元杂烷基,每个经取代或未取代环烷基是经取代或未取代c3-c7环烷基,每个经取代或未取代杂环烷基是经取代或未取代3元到7元杂环烷基,每个经取代或未取代芳基是经取代或未取代c6-c10芳基,并且每个经取代或未取代杂芳基是经取代或未取代5元到9元杂芳基。在一些方面,每个经取代或未取代亚烷基是经取代或未取代c1-c8亚烷基,每个经取代或未取代杂亚烷基是经取代或未取代2元到8元杂亚烷基,每个经取代或未取代环亚烷基是经取代或未取代c3-c7环亚烷基,每个经取代或未取代杂环亚烷基是经取代或未取代3元到7元杂环亚烷基,每个经取代或未取代亚芳基是经取代或未取代c6-c10亚芳基,和/或每个经取代或未取代杂亚芳基是经取代或未取代5元到9元杂亚芳基。术语“药学上可接受的盐”旨在包含根据在本文所述化合物上发现的特定取代基用相对无毒的酸或碱制备的活性化合物的盐。当本文所述的化合物含有相对酸性的官能团时,碱加成盐可以通过将这些化合物的中性形式与足够量的所需碱(可以是纯的或在合适的惰性溶剂中)接触来获得。药学上可接受的碱加成盐的实例包含钠盐、钾盐、钙盐、铵盐、有机氨盐或镁盐或类似盐。当本文所述的化合物含有相对碱性的官能团时,酸加成盐可以通过将这些化合物的中性形式与足够量的所需酸(可以是纯的或在合适的惰性溶剂中)接触来获得。药学上可接受的酸加成盐的实例包含衍生自无机酸的酸加成盐,如盐酸、氢溴酸、硝酸、碳酸、一氢碳酸(monohydrogencarbonicacid)、磷酸、一氢磷酸(monohydrogenphosphoricacid)、二氢磷酸(dihydrogenphosphoricacid)、硫酸、一氢硫酸(monohydrogensulfuricacid)、氢碘酸、或亚磷酸等;连同衍生自相对无毒的有机酸的盐,这些有机酸像乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸、甲磺酸等。还包含氨基酸的盐(如精氨酸盐等),以及有机酸如葡萄糖醛酸或半乳糖醛酸等)的盐((参见例如,berge等,《药学科学杂志(journalofpharmaceuticalscience)》66:1-19(1977))。本文所述的某些化合物同时含有碱性和酸性官能团,使得可以将所述化合物转化为碱加成盐或酸加成盐。化合物的中性形式优选通过将盐与碱或酸接触并以常规方式分离母体化合物来再生。所述化合物的母体形式在某些物理性质上(如在极性溶剂中的溶出度)不同于各种盐形式。本文描述的化合物可以以未溶出形式和溶剂化形式存在,包含水合形式。一般来说,溶剂化形式相当于未溶剂化形式。本文描述的化合物具有不对称碳原子(光学中心或手性中心)或双键;根据绝对立体化学,可以定义为(r)-或(s)-或(d)-或(l)-的氨基酸的对映异构体、外消旋物、非对映异构体、互变异构体、几何异构体、立体等距形式以及单独的异构体都包括在本公开的范围内。本公开旨在包含外消旋形式和光学纯形式的化合物。光学活性(r)-和(s)-、或(d)-和(l)-异构体可使用手性合成子或手性试剂来制备,或使用常规技术来解析。除非另有说明,本文描述的结构也旨在包含所述结构的所有立体化学形式;即每个不对称中心的r构型和s构型。因此,本发明化合物的单一立体化学异构体以及对映体和非对映体混合物都在本公开的范围内。当本文所描述的化合物含有烯烃键或其它几何不对称中心时,且除非另外规定,否则希望化合物包含e几何异构体和z几何异构体两者。如本文所用的,“互变异构体”是指平衡存在并且容易从一种异构体形式转化为另一种异构体形式的两种或多种结构异构体之一。对本领域技术人员来说显而易见的是,某些化合物可以互变异构形式存在。除非另有说明,本文描述的结构也旨在包含仅在存在一个或多个同位素富集的原子时不同的化合物。例如,除了用氘或氚替代氢,或者用13c-或14c-富集的碳替代碳之外,化合物可以具有本发明的结构。本文所述的化合物还可以在构成这种化合物的一个或多个原子上含有非天然比例的原子同位素。例如,化合物可以用放射性同位素进行放射性标记,如例如氚(3h)、碘-125(125i)或碳-14(14c)。符号“-”表示化学部分与分子或化学式的剩余部分的附接点。在实施例中,本文描述的化合物可以包含r2和/或其它变量的多个实例。在一些方面,每个变量可以任选地是不同的,并且为了更清楚起见,可以对其进行适当的标记以区分每个组。例如,在每个r2不同的情况下,它们可以分别被称为例如r2.1、r2.2、r2.3和/或r2.4,其中r2的定义通过r2.1、r2.2、r2.3和/或r2.4假定。为了更清楚起见,在r2的定义中使用的变量和/或出现在多个实例中并且不同的其它变量可以类似地适当地标记以区分每个组。在一些方面,所述化合物是本文所述的化合物(例如,在一个方面、实施例、实例、权利要求、表格、方案、附图或图形中)。本文使用的术语“一个(a/an)”是指一个或多个。此外,本文所用的短语“被一个......取代”是指特定的基团可以被一个或多个任何或所有指定的取代基取代。例如,当烷基或杂芳基等基团被“未取代c1-c20烷基或未取代2元到20元杂烷基取代”时,所述基团可以包含一个或多个未取代c1-c20烷基和/或一个或多个未取代2元到20元杂烷基。在部分被r取代基取代的情况下,所述基团可称为“r取代的”。在部分是r取代的的情况下,所述部分被至少一个r取代基取代,并且每个r取代基任选地不同。例如,在本文的部分是r12取代或未取代的烷基的情况下,多个r12取代基可以附接到烷基部分,其中每个r12取代基任选地不同。当r取代的部分被多个r取代基取代时,每个r取代基在本文中可以用一个质数符号(′)来区分,如r′、r″,等等。例如,当一个部分是r12取代的或未取代烷基,并且所述部分被多个r12取代基取代时,所述多个r12取代基可以被区分为r12′、r12″、r12″等。在一些方面,多个r取代基是3。在一些方面,多个r取代基是2。在实施例中,本文所述的化合物可以包含r1、r2、r3、r4、r5、r6、r7、r9、r10、r11、r12、r13、r14和/或其它变量的多个实例。在这些方面,每个变量可以任选地是不同的,并且,为了更清楚起见,可以对其进行适当的标记以区分每个组。例如,在每个r1、r2、r3、r4、r5、r6、r7、r9、r10、r11、r12、r13和/或r14不同的情况下,它们可以分别被称为,例如,r1.1、r1.2、r1.3、r1.4、r2.1、r2.2、r2.3、r2.4、r3.1、r3.2、r3.3、r3.4、r4.1、r4.2、r4.3、r4.4、r5.1、r5.2、r5.3、r5.4、r6.1、r6.2、r6.3、r6.4、r7.1、r7.2、r7.3、r7.4、r9.1、r9.2、r9.3、r9.4、r10.1、r10.2、r10.3、r10.4、r11.1、r11.2、r11.3、r11.4、r12.1、r12.2、r12.3、r12.4、r13.1、r13.2、r13.3、r13.4、r14.1、r14.2、r14.3和/或r14.4,其中r1的定义通过r1.1、r1.2、r1.3和/或r1.4假定,r2的定义通过r2.1、r2.2、r2.3和/或r2.4假定,r3的定义通过r3.1、r3.2、r3.3和/或r3.4假定,r4的定义通过r4.1、r4.2、r4.3和/或r4.4假定,r5的定义通过r5.1、r5.2、r5.3和/或r5.4假定,r6的定义通过r6.1、r6.2、r6.3和/或r6.4假定,r7的定义通过r7.1、r7.2、r7.3和/或r7.4假定,r9的定义通过r9.1、r9.2、r9.3和/或r9.4假定,r10的定义通过r10.1、r10.2、r10.3和/或r10.4假定,r11的定义通过r11.1、r11.2、r11.3和/或r11.4假定,r12的定义通过r12.1、r12.2、r12.3和/或r12.4假定,r13的定义通过r13.1、r13.2、r13.3和/或r13.4假定,r14的定义通过r14.1、r14.2、r14.3和/或r14.4假定。为了更清楚起见,在r1、r2、r3、r4、r5、r6、r7、r9、r10、r11、r12、r13和/或r14的定义中使用的变量和/或出现在多个实例中并且不同的其它变量可以类似地适当标记以区分每个组。本文对化合物的描述受本领域技术人员已知的化学键合原理的限制。因此,当基团可被多个取代基中的一个或多个取代时,选择这类取代以便符合化学键合原理并且得到不是本质上不稳定的和/或本领域的普通技术人员应已知可能在环境条件(例如水性、中性和几种已知生理条件)下不稳定的化合物。例如,根据本领域技术人员已知的化学键原理,杂环烷基或杂芳基通过环杂原子附接到分子的其余部分,从而避免本质上不稳定的化合物。药物调配物在一些方面,本公开提供了包括微粉化药物颗粒和药学上可接受的赋形剂的药物组合物;其中所述微粉化药物颗粒包括a2a腺苷受体拮抗剂。在一些方面,腺苷a2a受体拮抗剂是结晶的。在一些方面,所述药学上可接受的赋形剂包括填料、崩解剂、粘合剂或其中的两种或更多种的组合。在一些方面,所述药学上可接受的赋形剂进一步包括表面活性剂、润滑剂、助流剂或其中的两种或更多种的组合。在一些方面,本公开提供了包括微粉化药物颗粒和药学上可接受的赋形剂的颗粒剂;其中所述微粉化药物颗粒包括a2a腺苷受体拮抗剂。在一些方面,所述腺苷a2a受体拮抗剂是结晶的。在一些方面,所述药学上可接受的赋形剂包括填料、崩解剂、粘合剂或其中的两种或更多种的组合。在一些方面,所述药学上可接受的赋形剂进一步包括表面活性剂、润滑剂、助流剂或其中的两种或更多种的组合。在一些方面,本公开提供了包括微粉化药物颗粒和药学上可接受的赋形剂的口服调配物;其中所述微粉化药物颗粒包括a2a腺苷受体拮抗剂。在一些方面,腺苷a2a受体拮抗剂是结晶的。在一些方面,所述药学上可接受的赋形剂包括填料、崩解剂、粘合剂或其中的两种或更多种的组合。在一些方面,所述药学上可接受的赋形剂进一步包括表面活性剂、润滑剂、助流剂或其中的两种或更多种的组合。在一些方面,本公开提供了包括微粉化药物颗粒和药学上可接受的赋形剂的片剂;其中所述微粉化药物颗粒包括a2a腺苷受体拮抗剂。在一些方面,腺苷a2a受体拮抗剂是结晶的。在一些方面,所述药学上可接受的赋形剂包括填料、崩解剂、粘合剂或其中的两种或更多种的组合。在一些方面,所述药学上可接受的赋形剂进一步包括表面活性剂、润滑剂、助流剂或其中的两种或更多种的组合。在一些方面,本公开提供了包括微粉化药物颗粒和药学上可接受的赋形剂的粉末;其中所述微粉化药物颗粒包括a2a腺苷受体拮抗剂。在一些方面,所述腺苷a2a受体拮抗剂是结晶的。在一些方面,所述药学上可接受的赋形剂包括填料、崩解剂、粘合剂或其中的两种或更多种的组合。在一些方面,所述药学上可接受的赋形剂进一步包括表面活性剂、润滑剂、助流剂或其中的两种或更多种的组合。在一些方面,本公开提供了包括惰性核和药物层的珠粒;其中所述药物层包括微粉化药物颗粒和药学上可接受的赋形剂;其中所述微粉化药物颗粒包括a2a腺苷受体拮抗剂。在一些方面,所述腺苷a2a受体拮抗剂是结晶的。在一些方面,所述药学上可接受的赋形剂包括填料、崩解剂、粘合剂或其中的两种或更多种的组合。在一些方面,所述药学上可接受的赋形剂进一步包括表面活性剂、润滑剂、助流剂或其中的两种或更多种的组合。所述药物层包围所述惰性核。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,腺苷a2a受体拮抗剂是式(i)化合物或其药学上可接受的盐。在一些方面,式(i)化合物是游离碱形式。在一些方面,式(i)化合物是药学上可接受的盐的形式。在一些方面,式(i)化合物是结晶的。在一些方面,腺苷a2a受体拮抗剂是式(ii)化合物或其药学上可接受的盐。在一些方面,式(ii)化合物是游离碱形式。在一些方面,式(ii)化合物是药学上可接受的盐的形式。在一些方面,式(ii)化合物是结晶的。在一些方面,腺苷a2a受体拮抗剂是式(iii)化合物或其药学上可接受的盐。在一些方面,式(iii)化合物是药学上可接受的盐的形式。在一些方面,式(iii)化合物是游离碱形式。在一些方面,式(iii)化合物是结晶的。在一些方面,腺苷a2a受体拮抗剂是式(iiia)化合物或其药学上可接受的盐。在一些方面,式(iiia)化合物是游离碱形式。在一些方面,式(iiia)化合物是药学上可接受的盐的形式。在一些方面,式(iiia)化合物是结晶的。在一些方面,腺苷a2a受体拮抗剂是式(iiib)化合物或其药学上可接受的盐。在一些方面,式(iiib)化合物是游离碱形式。在一些方面,式(iiib)化合物是药学上可接受的盐的形式。在一些方面,式(iiib)化合物是结晶的。在一些方面,腺苷a2a受体拮抗剂是式(iiia)化合物或其药学上可接受的盐和式(iiib)化合物或其药学上可接受的盐的混合物。在一些方面,腺苷a2a受体拮抗剂是式(iiia)化合物或其药学上可接受的盐和式(iiib)化合物或其药学上可接受的盐的外消旋混合物。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,腺苷a2a受体拮抗剂以有效量存在。在一些方面,腺苷a2a受体拮抗剂以约1wt%到约50wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约1wt%到约40wt%的量存在。在一些方面,腺苷a2a受体拮抗剂的量为约1wt%到约30wt%。在一些方面,腺苷a2a受体拮抗剂的量为约1wt%到约25wt%。在一些方面,腺苷a2a受体拮抗剂的量为约1wt%到约20wt%。在一些方面,腺苷a2a受体拮抗剂的量为约1wt%到约15wt%。在一些方面,腺苷a2a受体拮抗剂的量为约1wt%到约10wt%。在一些方面,腺苷a2a受体拮抗剂的量为约2wt%到约48wt%。在一些方面,腺苷a2a受体拮抗剂的量为约3wt%到约47wt%。在一些方面,腺苷a2a受体拮抗剂的量为约4wt%到约46wt%。在一些方面,腺苷a2a受体拮抗剂以约5wt%到约45wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约6wt%到约44wt%的量存在。在一些方面,腺苷a2a受体拮抗剂的量为约7wt%到约43wt%。在一些方面,腺苷a2a受体拮抗剂的量为约8wt%到约42wt%。在一些方面,腺苷a2a受体拮抗剂以约9wt%到约41wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约10wt%到约40wt%的量存在。在一些方面,腺苷a2a受体拮抗剂的量为约11wt%到约39wt%。在一些方面,腺苷a2a受体拮抗剂的量为约12wt%到约38wt%。在一些方面,腺苷a2a受体拮抗剂的量为约13wt%到约37wt%。在一些方面,腺苷a2a受体拮抗剂的量为约14wt%到约36wt%。在一些方面,腺苷a2a受体拮抗剂的量为约15wt%到约35wt%。在一些方面,腺苷a2a受体拮抗剂的量为约16wt%到约34wt%。在一些方面,腺苷a2a受体拮抗剂的量为约17wt%到约33wt%。在一些方面,腺苷a2a受体拮抗剂的量为约18wt%到约32wt%。在一些方面,腺苷a2a受体拮抗剂的量为约19wt%到约31wt%。在一些方面,腺苷a2a受体拮抗剂的量为约20wt%到约30wt%。在一些方面,腺苷a2a受体拮抗剂的量为约21wt%到约29wt%。在一些方面,腺苷a2a受体拮抗剂的量为约22wt%到约28wt%。在一些方面,腺苷a2a受体拮抗剂的量为约23wt%到约27wt%。在一些方面,腺苷a2a受体拮抗剂以约24wt%到约26wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约15wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约16wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约17wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约18wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约19wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约20wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约21wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约22wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约23wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约24wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约25wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约26wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约27wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约28wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约29wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约30wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约31wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约32wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约33wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约34wt%的量存在。在一些方面,腺苷a2a受体拮抗剂以约35wt%的量存在。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述微粉化药物颗粒具有d90为约50微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约45微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约40微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约35微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约30微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约29微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约28微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约27微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约26微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约25微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约24微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约23微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约22微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约21微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约20微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约19微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约18微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约17微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约16微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约15微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约14微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约13微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约12微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约11微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约10微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约9微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约8微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约7微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约6微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d90为约5微米或更小的粒度分布。本文描述的微粉化药物颗粒的粒度分布通过激光衍射光谱法测量。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述微粉化药物颗粒具有d50为约15微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约14微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约13微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约12微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约11微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约10微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约9.5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约9微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约8.5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约8微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约7.5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约7微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约6.5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约6微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约5.5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约4.5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约4微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约3.5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约3微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约2.5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d50为约2微米或更小的粒度分布。本文描述的微粉化药物颗粒的粒度分布通过激光衍射光谱法测量。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述微粉化药物颗粒具有d10为约10微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约9微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约8微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约7微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约6微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约4微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约3微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约2.9微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约2.8微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约2.7微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约2.6微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约2.5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约2.4微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约2.3微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约2.2微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约2.1微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约2微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约1.9微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约1.8微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约1.7微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约1.6微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约1.5微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约1.4微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约1.3微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约1.2微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约1.1微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约1微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约0.9微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约0.8微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约0.7微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约0.6微米或更小的粒度分布。在一些方面,所述微粉化药物颗粒具有d10为约0.5微米或更小的粒度分布。本文描述的微粉化药物颗粒的粒度分布通过激光衍射光谱法测量。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述微粉化药物颗粒具有d90小于20微米;d50小于10微米;和d10小于5微米的粒度分布。在一些方面,所述微粉化药物颗粒具有d90小于20微米;d50小于6微米;和d10小于2微米的粒度分布。在一些方面,所述微粉化药物颗粒具有d90小于15微米;d50小于8微米;和d10小于3微米的粒度分布。在一些方面,所述微粉化药物颗粒具有d90小于12微米;d50小于5微米;和d10小于1.5微米的粒度分布。在一些方面,所述微粉化药物颗粒具有d90小于11微米;d50小于4.5微米;和d10小于1.2微米的粒度分布。在一些方面,所述微粉化药物颗粒具有d90小于10微米;d50小于4微米;和d10小于1.1微米的粒度分布。在一些方面,所述微粉化药物颗粒具有d90小于9微米;d50小于3.5微米;和d10小于1微米的粒度分布。本文描述的微粉化药物颗粒的粒度分布通过激光衍射光谱法测量。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,可以使用本领域已知的任何药学上可接受的赋形剂。在一些方面,所述药学上可接受的赋形剂包括填料。在一些方面,所述药学上可接受的赋形剂包括崩解剂。在一些方面,所述药学上可接受的赋形剂包括粘合剂。在一些方面,所述药学上可接受的赋形剂包括填料和崩解剂。在一些方面,所述药学上可接受的赋形剂包括填料和粘合剂。在一些方面,所述药学上可接受的赋形剂包括崩解剂和粘合剂。在一些方面,所述药学上可接受的赋形剂包括填料、崩解剂和粘合剂。在一些方面,所述药学上可接受的赋形剂包括填料和润滑剂。在一些方面,所述药学上可接受的赋形剂包括崩解剂和润滑剂。在一些方面,所述药学上可接受的赋形剂包括粘合剂和润滑剂。在一些方面,所述药学上可接受的赋形剂包括填料、崩解剂和润滑剂。在一些方面,所述药学上可接受的赋形剂包括填料、粘合剂和润滑剂。在一些方面,所述药学上可接受的赋形剂包括崩解剂、粘合剂和润滑剂。在一些方面,所述药学上可接受的赋形剂包括填料、崩解剂、粘合剂和润滑剂。在一些方面,所述药学上可接受的赋形剂进一步包括表面活性剂、助流剂或其组合。在一些方面,所述药学上可接受的赋形剂可进一步包括一种或多种另外的用于增强本文所述的药物组合物、颗粒剂、片剂、胶囊、粉末和珠粒的制造、粉末流动性、化学性质(例如稳定性)或生物性质(例如吸收)的化合物。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述填料可以是本领域已知的任何填料。在一些方面,所述填料包括多元醇、麦芽糖糊精、微晶纤维素或其中的两种或更多种的组合。在一些方面,所述填料是多元醇。在一些方面,所述填料是甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。在一些方面,所述填料是甘露醇。在一些方面,所述填料是麦芽糖醇。在一些方面,所述填料是乳糖。在一些方面,所述填料是麦芽糖糊精。在一些方面,所述填料是微晶纤维素。在一些方面,所述填料是多元醇和麦芽糖糊精。在一些方面,所述填料包括:(i)麦芽糖糊精和(ii)甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。在一些方面,所述填料包括:(i)麦芽糖糊精和(ii)甘露醇。在一些方面,所述填料包括:(i)麦芽糖糊精和(ii)乳糖。在一些方面,所述填料是多元醇和微晶纤维素。在一些方面,所述填料包括:(i)微晶纤维素和(ii)甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。在一些方面,所述填料包括:(i)微晶纤维素和(ii)甘露醇。在一些方面,所述填料包括:(i)微晶纤维素和(ii)乳糖。在一些方面,所述填料是麦芽糖糊精和微晶纤维素。在一些方面,填料是多元醇、麦芽糖糊精和微晶纤维素。在一些方面,所述填料包括:(i)麦芽糖糊精,(ii)微晶纤维素,和(iii)甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。在一些方面,所述填料包括:(i)麦芽糖糊精,(ii)微晶纤维素,和(iii)甘露醇。在一些方面,所述填料包括:(i)麦芽糖糊精,(ii)微晶纤维素,和(iii)乳糖。当本文所述的组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒中的填料包括甘露醇时,所述甘露醇是结晶甘露醇、喷雾干燥甘露醇或其组合。在一些方面,所述甘露醇是结晶甘露醇。在一些方面,所述甘露醇是喷雾干燥的甘露醇。在一些方面,所述甘露醇包括结晶甘露醇和喷雾干燥甘露醇,其中结晶甘露醇与喷雾干燥甘露醇的比例为约25∶1到约1∶25;或约20∶1到约1∶20;或约15∶1到约1∶15;或约10∶1到约1∶10;或约8∶1到约1∶8。在一些方面,结晶甘露醇与喷雾干燥甘露醇的比例为约5∶1到约1∶5。在一些方面,结晶甘露醇与喷雾干燥甘露醇的比例为约3∶1到约1∶3。在一些方面,结晶甘露醇与喷雾干燥甘露醇的比例为约3∶1到约1∶1。在一些方面,结晶甘露醇与喷雾干燥甘露醇的比例为约2.5∶1到约1.5∶1。在一些方面,结晶甘露醇与喷雾干燥甘露醇的比例为约2∶1。在一些方面,甘露醇的粒度(平均直径,通过激光衍射测量)为约10微米到约600微米。在一些方面,甘露醇的粒度(平均直径,通过激光衍射测量)为约25微米到约250微米。在一些方面,甘露醇是粒度(平均直径,通过激光衍射测量)为约25微米到约160微米的结晶甘露醇。在一些方面,甘露醇是粒度(平均直径,通过激光衍射测量)为约40微米到约60微米的结晶甘露醇。在一些方面,甘露醇是粒度(平均直径,通过激光衍射测量)为约50微米的结晶甘露醇(可以50c商购获得)。在一些方面,甘露醇是粒度为约100微米到约500微米的喷雾干燥甘露醇。在一些方面,甘露醇是粒度为约100微米到约200微米的喷雾干燥甘露醇。在一些方面,甘露醇是粒度约为180微米的喷雾干燥的甘露醇(可以200sd商购获得)。在一些方面,甘露醇包括粒度为约25微米到约160微米的结晶甘露醇和粒度为约80微米到约200微米的喷雾干燥甘露醇,其中结晶甘露醇与喷雾干燥甘露醇的比例为约10∶1至约1∶10;或约5∶1到约1∶5;或者比例为约3∶1到约1∶3,或者比例为约3∶1到约1∶1;或者比例为约2.5∶1到约1.5∶1;或者比例为约2∶1;或者比例为约1.9∶1;或者比例为约2∶1到约1.9∶1。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述填料以合适的量存在于所述药物组合物、颗粒剂、片剂、胶囊、粉末和珠粒中。在一些方面,所述填料以约10wt%到约95wt%;或约15wt%到约90wt%;或约20wt%到约80wt%;或约20wt%到约75wt%;或约20wt%到约70wt%的量存在。在一些方面,所述填料以约30wt%到约80wt%的量存在。在一些方面,所述填料以约30wt%到约75wt%的量存在。在一些方面,所述填料的量为约30wt%到约70wt%。在一些方面,所述填料的量为约30wt%到约65wt%。在一些方面,所述填料的量为约40wt%到约80wt%。在一些方面,所述填料的量为约40wt%到约75wt%。在一些方面,所述填料的量为约40wt%到约70wt%。在一些方面,所述填料的量为约40wt%到约65wt%。在一些方面,所述填料的量为约50wt%到约80wt%。在一些方面,所述填料的量为约50wt%到约75wt%。在一些方面,所述填料的量为约50wt%到约70wt%。在一些方面,所述填料的量为约50wt%到约65wt%。在一些方面,所述填料的量为约55wt%到约80wt%。在一些方面,所述填料的量为约55wt%到约75wt%。在一些方面,所述填料的量为约55wt%到约70wt%。在一些方面,所述填料的量为约51wt%到约69wt%。在一些方面,所述填料的量为约52wt%到约68wt%。在一些方面,所述填料的量为约53wt%到约67wt%。在一些方面,所述填料的量为约54wt%到约66wt%。在一些方面,所述填料的量为约55wt%到约65wt%。在一些方面,所述填料的量为约56wt%到约64wt%。在一些方面,所述填料的量为约57wt%到约63wt%。在一些方面,所述填料的量为约58wt%到约62wt%。在一些方面,所述填料的量为约59wt%到约61wt%。在一些方面,所述填料的量为约60wt%到约61wt%。在一些方面,所述填料的量为约60wt%到约62wt%。在一些方面,所述填料的量为约50wt%。在一些方面,所述填料的量为约51wt%。在一些方面,所述填料的量为约52wt%。在一些方面,所述填料的量为约53wt%。在一些方面,所述填料的量为约54wt%。在一些方面,所述填料的量为约55wt%。在一些方面,所述填料的量为约56wt%。在一些方面,所述填料的量为约57wt%。在一些方面,所述填料的量为约58wt%。在一些方面,所述填料的量为约59wt%。在一些方面,所述填料的量为约60wt%。在一些方面,所述填料的量为约60.25wt%。在一些方面,所述填料的量为约60.5wt%。在一些方面,所述填料的量为约60.75wt%。在一些方面,所述填料的量为约61wt%。在一些方面,所述填料的量为约61.25wt%。在一些方面,所述填料的量为约61.5wt%。在一些方面,所述填料的量为约61.75wt%。在一些方面,所述填料的量为约62wt%。在一些方面,所述填料的量为约62.25wt%。在一些方面,所述填料的量为约62.5wt%。在一些方面,所述填料的量为约62.75wt%。在一些方面,所述填料的量为约63wt%。在一些方面,所述填料的量为约64wt%。在一些方面,所述填料的量为约65wt%。在一些方面,所述填料的量为约66wt%。在一些方面,所述填料的量为约67wt%。在一些方面,所述填料的量为约68wt%。在一些方面,所述填料的量为约69wt%。在一些方面,所述填料的量为约70wt%。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述崩解剂可以是本领域已知的任何崩解剂。在一些方面,所述崩解剂是一种超级崩解剂。在一些方面,所述崩解剂是药学上可接受的聚合物。在一些方面,所述崩解剂包括羧烷基纤维素(例如羧甲基纤维素或交联羧甲基纤维素)、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合。在一些方面,所述崩解剂包括羧烷基纤维素。在一些方面,所述崩解剂包括羧甲基纤维素。在一些方面,所述崩解剂包括交联羧甲基纤维素。在一些方面,所述崩解剂包括羟基乙酸淀粉钠。在一些方面,所述崩解剂包括交联聚乙烯吡咯烷酮聚合物。在一些方面,所述崩解剂包括羧烷基纤维素和羟基乙酸淀粉钠。在一些方面,所述崩解剂包括交联羧烷基纤维素和羟基乙酸淀粉钠。在一些方面,所述崩解剂包括羧烷基纤维素和交联聚乙烯吡咯烷酮聚合物。在一些方面,所述崩解剂包括交联的羧烷基纤维素和交联的聚乙烯吡咯烷酮聚合物。在一些方面,所述崩解剂包括羧烷基纤维素、羟基乙酸淀粉钠和交联聚乙烯吡咯烷酮聚合物。在一些方面,所述崩解剂包括交联羧烷基纤维素、羟基乙酸淀粉钠和交联聚乙烯吡咯烷酮聚合物。在一些方面,所述崩解剂包括羟基乙酸淀粉钠和交联聚乙烯吡咯烷酮聚合物。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述崩解剂以合适的量存在于所述药物组合物、颗粒剂、片剂、胶囊、粉末和珠粒中。在一些方面,所述崩解剂以约0.5wt%到约30wt%的量存在。在一些方面,所述崩解剂的量为约1wt%到约25wt%。在一些方面,所述崩解剂的量为约1wt%到约20wt%。在一些方面,所述崩解剂的量为约1wt%到约15wt%。在一些方面,所述崩解剂的量为约1wt%到约14wt%。在一些方面,所述崩解剂的量为约1wt%到约13wt%。在一些方面,所述崩解剂的量为约1wt%到约12wt%。在一些方面,所述崩解剂的量为约1wt%到约11wt%。在一些方面,所述崩解剂的量为约1wt%到约10wt%。在一些方面,所述崩解剂的量为约2wt%到约15wt%。在一些方面,所述崩解剂的量为约2wt%到约14wt%。在一些方面,所述崩解剂的量为约2wt%到约13wt%。在一些方面,所述崩解剂的量为约2wt%到约12wt%。在一些方面,所述崩解剂的量为约2wt%到约11wt%。在一些方面,所述崩解剂的量为约2wt%到约10wt%。在一些方面,所述崩解剂的量为约3wt%到约11wt%。在一些方面,所述崩解剂的量为约4wt%到约10wt%。在一些方面,所述崩解剂的量为约5wt%到约9wt%。在一些方面,所述崩解剂的量为约6wt%到约8wt%。在一些方面,所述崩解剂的量为约7wt%。在一些方面,所述崩解剂的量为约5wt%。在一些方面,所述崩解剂的量为约6wt%。在一些方面,所述崩解剂的量为约4wt%到约12wt%。在一些方面,所述崩解剂的量为约5wt%到约11wt%。在一些方面,所述崩解剂的量为约6wt%到约10wt%。在一些方面,所述崩解剂的量为约7wt%到约9wt%。在一些方面,所述崩解剂的量为约8wt%。在一些方面,所述崩解剂的量为约5wt%到约13wt%。在一些方面,所述崩解剂的量为约6wt%到约12wt%。在一些方面,所述崩解剂的量为约7wt%到约11wt%。在一些方面,所述崩解剂的量为约8wt%到约10wt%。在一些方面,所述崩解剂的量为约9wt%。在一些方面,所述崩解剂的量为约10wt%。在一些方面,所述崩解剂的量为约11wt%。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述粘合剂可以是本领域已知的任何粘合剂。在一些方面,所述粘合剂是药学上可接受的聚合物。在一些方面,所述粘合剂包括羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合。在一些方面,所述粘合剂包括羟烷基纤维素。在一些方面,所述粘合剂包括烷基纤维素。在一些方面,所述粘合剂包括玉米淀粉。在一些方面,所述粘合剂包括聚乙二醇。在一些方面,所述粘合剂包括聚氧化乙烯。在一些方面,所述粘合剂包括聚乙烯吡咯烷酮。在一些方面,所述粘合剂包括羟烷基纤维素和烷基纤维素。在一些方面,所述粘合剂包括羟烷基纤维素、烷基纤维素和聚乙二醇。在一些方面,所述粘合剂包括羟烷基纤维素和聚乙二醇。在一些方面,所述粘合剂包括烷基纤维素和聚乙二醇。在一些方面,所述粘合剂包括羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素或其中的两种或更多种的组合。在一些方面,所述羟烷基纤维素是羟丙基纤维素。在一些方面,所述粘合剂包括羟乙基纤维素。在一些方面,所述粘合剂包括羟丙基甲基纤维素。在一些方面,所述粘合剂包括羟丙基纤维素和羟乙基纤维素。在一些方面,所述粘合剂包括羟丙基纤维素和羟丙基甲基纤维素。在一些方面,所述粘合剂包括羟乙基纤维素和羟丙基甲基纤维素。在一些方面,所述粘合剂包括羟丙基纤维素、羟乙基纤维素和羟丙基甲基纤维素。在一些方面,所述粘合剂包括甲基纤维素、乙基纤维素、乙基甲基纤维素或其中的两种或更多种的组合。在一些方面,所述烷基纤维素是甲基纤维素。在一些方面,所述粘合剂包括乙基纤维素。在一些方面,所述粘合剂包括乙基甲基纤维素。在一些方面,所述粘合剂包括甲基纤维素、乙基纤维素和乙基甲基纤维素。在一些方面,所述粘合剂包括甲基纤维素和乙基甲基纤维素。在一些方面,所述粘合剂包括乙基纤维素和乙基甲基纤维素。在一些方面,所述粘合剂包括甲基纤维素和乙基纤维素。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述粘合剂以合适的量存在于所述药物组合物、颗粒剂、片剂、胶囊、粉末和珠粒中。在一些方面,所述粘合剂以约0.1wt%到约50wt%;或约0.1wt%到约45wt%;或约0.1wt%到约40wt%;或约0.1wt%到约35wt%;或约0.1wt%到约30wt%的量存在。在一些方面,所述粘合剂的量为约0.5wt%到约25wt%。在一些方面,所述粘合剂的量为约0.5wt%到约20wt%。在一些方面,所述粘合剂的量为约0.5wt%到约15wt%。在一些方面,所述粘合剂的量为约0.5wt%到约10wt%。在一些方面,所述粘合剂的量为约1wt%到约10wt%。在一些方面,所述粘合剂的量为约2wt%到约10wt%。在一些方面,所述粘合剂的量为约0.1wt%到约8wt%。在一些方面,所述粘合剂的量为约0.5wt%到约7wt%。在一些方面,所述粘合剂的量为约1wt%到约6wt%。在一些方面,所述粘合剂的量为约2wt%到约5wt%。在一些方面,所述粘合剂的量为约1wt%到约9wt%。在一些方面,所述粘合剂的量为约2wt%到约8wt%。在一些方面,所述粘合剂的量为约3wt%到约7wt%。在一些方面,所述粘合剂的量为约4wt%到约6wt%。在一些方面,所述粘合剂的量为约0.5wt%到约8wt%。在一些方面,所述粘合剂的量为约1wt%到约7wt%。在一些方面,所述粘合剂的量为约2wt%到约6wt%。在一些方面,所述粘合剂的量为约3wt%到约5wt%。在一些方面,所述粘合剂的量为约1wt%。在一些方面,所述粘合剂的量为约2wt%。在一些方面,所述粘合剂的量为约3wt%。在一些方面,所述粘合剂的量为约4wt%。在一些方面,所述粘合剂的量为约5wt%。在一些方面,所述粘合剂的量为约6wt%。在一些方面,所述粘合剂的量为约7wt%。在一些方面,所述粘合剂的量为约8wt%。在一些方面,本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒进一步包括润滑剂。所述润滑剂可以是本领域已知的任何润滑剂。在一些方面,所述润滑剂是硬脂酸镁、硬脂酸、硬脂酸钙、硬脂酸钠、滑石、硬脂酰醇富马酸钠、山嵛酸甘油酯、硼酸、苯甲酸钠、油酸钠、乙酸钠、十二烷基硫酸钠、十二烷基硫酸镁或其中的两种或更多种的组合。在一些方面,所述润滑剂包括硬脂酸镁。在一些方面,所述润滑剂包括硬脂酸。在一些方面,所述润滑剂包括硬脂酸镁和硬脂酸。在一些方面,所述润滑剂包括硬脂酸镁、硬脂酸钙、硬脂酸钠、硬脂酸或其中的两种或更多种的组合。在一些方面,所述润滑剂包括硬脂酸镁、硬脂酸钙、硬脂酸钠或其中的两种或更多种的组合。在本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒的一些方面,所述润滑剂以合适的量存在于所述药物组合物、颗粒剂、片剂、胶囊、粉末和珠粒中。在一些方面,所述润滑剂的量为约0.1wt%到约5wt%。在一些方面,所述润滑剂的量为约1wt%到约4wt%。在一些方面,所述润滑剂的量为约1.5wt%到约3.5wt%。在一些方面,所述润滑剂的量为约2wt%到约3wt%。在一些方面,所述润滑剂的量为约2wt%到约2.5wt%。在一些方面,所述润滑剂的量为约0.5wt%。在一些方面,所述润滑剂的量为约1wt%。在一些方面,所述润滑剂的量为约1.25wt%。在一些方面,所述润滑剂的量为约1.5wt%。在一些方面,所述润滑剂的量为约1.75wt%。在一些方面,所述润滑剂的量为约2wt%。在一些方面,所述润滑剂的量为约2.25wt%。在一些方面,所述润滑剂的量为约2.5wt%。在一些方面,所述润滑剂的量为约2.75wt%。在一些方面,所述润滑剂的量为约3wt%。在一些方面,所述润滑剂的量为约4wt%。在一些方面,所述润滑剂的量为约5wt%。在一些方面,本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒进一步包括表面活性剂。在一些方面,所述表面活性剂是阴离子型的,如十二烷基硫酸铵、十二烷基硫酸钠、十二烷基醚硫酸钠、肉豆蔻醇聚醚硫酸钠、琥珀酸二异辛酯磺酸钠等。在一些方面,所述表面活性剂是两性离子型的,如磷脂、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰胆碱等。在一些方面,所述表面活性剂是阳离子型的,如季铵和吡啶鎓阳离子表面活性剂。在一些方面,所述表面活性剂是非离子型的,如脱水山梨醇酯、聚山梨醇酯、泊洛沙姆等。在一些方面,本文所述的药物组合物、口服调配物、颗粒剂、片剂、胶囊、粉末和珠粒进一步包括表面助流剂。在一些方面,所述助流剂是胶态二氧化硅、二氧化硅、滑石或其组合。在一些方面,所述助流剂是硅胶。在一些方面,所述助流剂是滑石。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)式(iii)化合物或其药学上可接受的盐,所述式(iii)化合物或其药学上可接受的盐具有d90为约10微米或更小的粒度分布;和(ii)多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合。在一些方面,(ii)是多元醇。在一些方面,(ii)是麦芽糖糊精。在一些方面,(ii)是微晶纤维素。在一些方面,(ii)是多元醇和麦芽糖糊精。在一些方面,(ii)是多元醇和微晶纤维素。在一些方面,(ii)是麦芽糖糊精和微晶纤维素。在一些方面,(ii)是多元醇、麦芽糖糊精和微晶纤维素。在一些方面,所述多元醇是甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。在一些方面,(ii)是甘露醇。在一些方面,(ii)是甘露醇和麦芽糖糊精。在一些方面,(ii)是甘露醇和微晶纤维素。在一些方面,(ii)包括甘露醇、麦芽糖糊精和微晶纤维素。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)式(iii)化合物或其药学上可接受的盐,所述式(iii)化合物或其药学上可接受的盐具有d90为约10微米或更小的粒度分布,和(ii)羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合。在一些方面,(ii)是羧甲基纤维素。在一些方面,所述羧甲基纤维素是交联羧甲基纤维素。在一些方面,所述羧甲基纤维素是交联羧甲基纤维素钠。在一些方面,(ii)是聚乙烯吡咯烷酮聚合物。在一些方面,(ii)包括羧甲基纤维素和聚乙烯吡咯烷酮聚合物。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)式(iii)化合物或其药学上可接受的盐,所述式(iii)化合物或其药学上可接受的盐具有d90为约10微米或更小的粒度分布,和(ii)羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合。在一些方面,(ii)是羟烷基纤维素。在一些方面,(ii)是羟丙基纤维素。在一些方面,(ii)是烷基纤维素。在一些方面,(ii)包括羟烷基纤维素和烷基纤维素。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)式(iii)化合物或其药学上可接受的盐,所述式(iii)化合物或其药学上可接受的盐具有d90为约10微米或更小的粒度分布;(ii)多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;和(iii)羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合。在一些方面,(ii)是多元醇,并且(iii)是羧甲基纤维素。在一些方面,(ii)是麦芽糖糊精,并且(iii)是羧甲基纤维素。在一些方面,(ii)是微晶纤维素,并且(iii)是羧甲基纤维素。在一些方面,(ii)包括多元醇和麦芽糖糊精,并且(iii)是羧甲基纤维素。在一些方面,(ii)包括多元醇和微晶纤维素,并且(iii)是羧甲基纤维素。在一些方面,(ii)包括麦芽糖糊精和微晶纤维素,并且(iii)是羧甲基纤维素。在一些方面,(ii)包括多元醇、麦芽糖糊精和微晶纤维素,以及(iii)是羧甲基纤维素。在一些方面,所述多元醇是甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。在一些方面,(ii)是甘露醇,并且(iii)是羧甲基纤维素。在一些方面,(ii)包括甘露醇和麦芽糖糊精,并且(iii)是羧甲基纤维素。在一些方面,(ii)包括甘露醇和微晶纤维素,并且(iii)是羧甲基纤维素。在一些方面,(ii)包括甘露醇、麦芽糖糊精和微晶纤维素,并且(iii)是羧甲基纤维素。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)式(iii)化合物或其药学上可接受的盐,所述式(iii)化合物或其药学上可接受的盐具有d90为约10微米或更小的粒度分布;(ii)多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;和(iii)羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合。在一些方面,(ii)是多元醇,并且(iii)是羟烷基纤维素。在一些方面,(ii)是麦芽糖糊精,并且(iii)是羟烷基纤维素。在一些方面,(ii)包含微晶纤维素,并且(iii)是羟烷基纤维素。在一些方面,(ii)包含多元醇和麦芽糖糊精,并且(iii)是羟烷基纤维素。在一些方面,(ii)包含多元醇和微晶纤维素,并且(iii)是羟烷基纤维素。在一些方面,(ii)包含麦芽糖糊精和微晶纤维素,并且(iii)是羟烷基纤维素。在一些方面,(ii)包括多元醇、麦芽糖糊精和微晶纤维素,并且(iii)是羟烷基纤维素。在一些方面,所述多元醇是甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。在一些方面,(ii)是甘露醇,并且(iii)是羟烷基纤维素。在一些方面,(ii)包括甘露醇和麦芽糖糊精,并且(iii)是羟烷基纤维素。在一些方面,(ii)包括甘露醇和微晶纤维素,并且(iii)是羟烷基纤维素。在一些方面,(ii)包括甘露醇、麦芽糖糊精和微晶纤维素,并且(iii)是羟烷基纤维素。在一些方面,所述羟烷基纤维素是羟丙基纤维素。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)式(iii)化合物或其药学上可接受的盐,所述式(iii)化合物或其药学上可接受的盐具有d90为约10微米或更小的粒度分布,(ii)羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其两种或更多种的组合;以及(iii)羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合。在一些方面,(ii)是羧甲基纤维素,并且(iii)是羟烷基纤维素。在一些方面,所述羧甲基纤维素是交联羧甲基纤维素。在一些方面,所述羧甲基纤维素是交联羧甲基纤维素钠。在一些方面,(ii)是聚乙烯吡咯烷酮聚合物,并且(iii)是羟烷基纤维素。在一些方面,(ii)包括羧甲基纤维素和聚乙烯吡咯烷酮聚合物,并且(iii)是羟烷基纤维素。在一些方面,所述羟烷基纤维素是羟丙基纤维素。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)式(iii)化合物或其药学上可接受的盐,所述式(iii)化合物或其药学上可接受的盐具有d90为约10微米或更小的粒度分布;(ii)多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(iii)羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;和(iv)羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合。在一些方面,(ii)是多元醇,(iii)是羧甲基纤维素,并且(iv)是羟烷基纤维素。在一些方面,(ii)是麦芽糖糊精,(iii)是羧甲基纤维素,并且(iv)是羟烷基纤维素。在一些方面,(ii)是微晶纤维素,(iii)是羧甲基纤维素,并且(iv)是羟烷基纤维素。在一些方面,(ii)包括多元醇和麦芽糖糊精,(iii)是羧甲基纤维素,并且(iv)是羟烷基纤维素。在一些方面,(ii)包括多元醇和微晶纤维素,(iii)是羧甲基纤维素,并且(iv)是羟烷基纤维素。在一些方面,(ii)包括麦芽糖糊精和微晶纤维素,(iii)是羧甲基纤维素,并且(iv)是羟烷基纤维素。在一些方面,(ii)包括多元醇、麦芽糖糊精和微晶纤维素,(iii)是羧甲基纤维素,并且(iv)是羟烷基纤维素。在一些方面,所述多元醇是甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。在一些方面,所述羟烷基纤维素是羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素或其中的两种或更多种的组合。在一些方面,(ii)是甘露醇,(iii)是交联羧甲基纤维素,并且(iv)是羟丙基纤维素。在一些方面,(ii)包括甘露醇和麦芽糖糊精,(iii)是交联的羧甲基纤维素,并且(iv)是羟丙基纤维素。在一些方面,(ii)包括甘露醇和微晶纤维素,(iii)是交联的羧甲基纤维素,并且(iv)是羟丙基纤维素。在一些方面,(ii)包括甘露醇、麦芽糖糊精和微晶纤维素,(iii)是交联的羧甲基纤维素,并且(iv)是羟丙基纤维素。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)约25wt%到约35wt%的腺苷a2a受体拮抗剂或其药学上可接受的盐;(ii)约50wt%到约70wt%的填料;以及(iii)约1wt%到约10wt%的崩解剂。在一些方面,所述药物组合物进一步包括约1wt%到约10wt%的粘合剂。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)约25wt%到约35wt%的式(iii)化合物或其药学上可接受的盐;(ii)约40wt%到约60wt%的甘露醇;(iii)约5wt%到约20wt%的微晶纤维素;以及(iv)约1wt%到约10wt%的交联羧甲基纤维素钠。在一些方面,所述药物组合物进一步包括约1wt%到约10wt%的羟丙基纤维素。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)约25wt%到约35wt%的式(iii)化合物或其药学上可接受的盐;(ii)约45wt%到约55wt%的甘露醇;(iii)约10wt%到约15wt%的微晶纤维素;以及(iv)约4wt%到约8wt%的交联羧甲基纤维素钠。在一些方面,所述药物组合物进一步包括约1wt%到约8wt%的羟丙基纤维素。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)约20wt%到约30wt%的式(iii)化合物或其药学上可接受的盐;(ii)约30wt%到约50wt%的甘露醇;(iii)约15wt%到约30wt%的微晶纤维素;以及(iv)约1wt%到约15wt%的交联羧甲基纤维素钠。在一些方面,所述药物组合物进一步包括约1wt%到约10wt%的羟丙基纤维素。在一些方面,所述甘露醇包括重量比为约1∶1.5到约1∶2.5的喷雾干燥的甘露醇和结晶甘露醇。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)约23wt%到约27wt%的式(iii)化合物或其药学上可接受的盐;(ii)约37wt%到约40wt%的甘露醇;(iii)约21wt%到约24wt%的微晶纤维素;以及(iv)约5wt%到约10wt%的交联羧甲基纤维素钠。在一些方面,所述药物组合物进一步包括约2wt%到约6wt%的羟丙基纤维素。在一些方面,所述甘露醇包括重量比为约1∶1.5到约1∶2.5的喷雾干燥的甘露醇和结晶甘露醇。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)约24wt%到约26wt%的式(iii)化合物或其药学上可接受的盐;(ii)约38wt%到约39wt%的甘露醇;(iii)约22wt%到约23wt%的微晶纤维素;以及(iv)约7wt%到约9wt%的交联羧甲基纤维素钠。在一些方面,所述药物组合物进一步包括约3wt%到约5wt%的羟丙基纤维素。在一些方面,所述甘露醇包括重量比为约1∶1.5到约1∶2.5的喷雾干燥的甘露醇和结晶甘露醇。在一些方面,本公开提供了药物组合物、口服调配物、片剂、胶囊、颗粒剂、粉末和珠粒,其包括:(i)约25wt%的式(iii)化合物或其药学上可接受的盐;(ii)约38.25wt%的甘露醇;(iii)约22.5wt%的微晶纤维素;以及(iv)约8wt%的交联羧甲基纤维素钠。在一些方面,所述药物组合物进一步包括约4wt%的羟丙基纤维素。在一些方面,所述甘露醇包括重量比为约1∶1.5到约1∶2.5的喷雾干燥的甘露醇和结晶甘露醇。在一些方面,本公开提供了本文所述的药物组合物、口服调配物、颗粒剂、片剂、粉末、口服调配物和珠粒的生物等效调配物。在一些方面,本公开提供了6号药物组合物。在一些方面,本公开提供了如表11a所示的6号药物组合物或其生物等效调配物。在一些方面,本公开提供了如表11b所示的6号药物组合物或其生物等效调配物。在一些方面,本公开提供了5号药物组合物。在一些方面,本公开提供了如表9a所示的5号药物组合物或其生物等效调配物。在一些方面,本公开提供了如表9b所示的5号药物组合物或其生物等效调配物。在一些方面,本公开提供了4号药物组合物。在一些方面,本公开提供了3号药物组合物或其生物等效调配物。在一些方面,本公开提供了2号药物组合物或其生物等效调配物。在一些方面,本公开提供了1号药物组合物或其生物等效调配物。在本文提供的组合物的实施例中(包含药物组合物和口服调配物(例如,片剂、胶囊、颗粒剂、粉末和珠粒)),所述组合物不包含除一种或多种a2a受体拮抗剂以外的其它活性药物成分。在本文提供的组合物(包含药物组合物、口服调配物(例如,片剂、胶囊、颗粒剂、粉末和珠粒))的一些方面,所述组合物仅包含单一类型的a2a受体拮抗剂。在本文提供的组合物(包含药物组合物、口服调配物(例如,片剂、胶囊、颗粒剂、粉末和珠粒))的一些方面,所述组合物仅包含单一类型的a2a受体拮抗剂,不包含其它活性药物成分。在本文提供的组合物(包含药物组合物、口服调配物(例如,片剂、胶囊、颗粒剂、粉末和珠粒))的一些方面,所述组合物仅包含单一类型的a2a受体拮抗剂,不包含药物赋形剂或其它活性药物成分。口服调配物在一些方面,本文所述的药物组合物是口服调配物。口服调配物包含适合患者摄入的片剂、丸剂、粉末、小药囊、棒状包装、糖衣丸、胶囊、薄片(wafer)、膜剂、液体、锭剂、凝胶、糖浆、浆液、悬浮液等。固体口服调配物包含粉末、片剂、颗粒剂、珠粒、胶囊、膜剂、薄片、可咀嚼调配物和可分散颗粒剂。液体口服调配物包含溶液、悬浮液和乳剂。其它口服剂量调配物包含口腔粘膜调配物,如舌下或口腔调配物(如片剂、薄膜或薄饼)。在一些方面,所述口服调配物是本文所述的片剂。在一些方面,所述片剂是压缩片剂。在一些方面,所述片剂被包封在外层内。在一些方面,所述片剂被包封在外肠溶层内。在一些方面,所述片剂是一种快速崩解的片剂。在一些方面,所述片剂是舌下片剂。在一些方面,所述片剂是口含片剂。在一些方面,所述片剂是一种快速崩解的舌下片剂。在一些方面,所述片剂是一种快速崩解的口含片剂。在一些方面,所述片剂是通过压制本文所述的药物组合物形成的。在一些方面,所述片剂是通过压制本文所述的颗粒剂形成的。在一些方面,所述片剂是通过压制本文所述的颗粒剂形成的,其中所述颗粒剂具有外包衣层,并且其中所述片剂任选地进一步包括外包衣层。在一些方面,所述片剂是通过压制本文所述的药物组合物形成的。在一些方面,所述片剂是通过压制本文所述的粉末形成的。在一些方面,所述片剂是通过压制本文所述的珠粒形成的。在一些方面,所述片剂是通过压制本文所述的珠粒形成的,其中所述珠粒具有外包衣层,并且其中所述片剂任选地进一步包括外包衣层。在一些方面,所述外包衣层包括肠溶包衣。在一些方面,所述口服调配物是胶囊。在一些方面,所述胶囊包括包封在胶囊壳内的本文所述的药物组合物,其中所述胶囊壳任选地进一步包封在外包衣层内。在一些方面,所述胶囊包括包封在胶囊壳内的本文所述的颗粒剂,其中所述胶囊壳任选地进一步包封在外包衣层内。在一些方面,所述胶囊包括包封在胶囊壳内的本文所述的颗粒剂,其中所述颗粒剂包括外包衣层,并且其中所述胶囊壳任选地进一步包封在外包衣层内。在一些方面,所述胶囊包括包封在胶囊壳内的本文所述的珠粒,其中所述珠粒包括外包衣层,并且其中所述胶囊壳任选地进一步包封在外包衣层内。在一些方面,所述胶囊包括包封在胶囊壳内的本文所述的粉末,其中所述胶囊壳任选地进一步包封在外包衣层内。在一些方面,所述口服调配物是固体胶囊。在一些方面,所述胶囊是一种快速崩解的胶囊。在一些方面,所述外包衣层包括肠溶包衣。在一些方面,胶囊壳包括肠溶聚合物。在一些方面,所述口服调配物是颗粒剂,其中所述颗粒剂包含包括所述的药物组合物。在一些方面,所述颗粒剂包括包衣层。在一些方面,多种颗粒剂包括包衣层,并且多种颗粒剂不包括包衣层。在一些方面,所述颗粒剂被撒在食物或液体上或之中,或者直接用于口服施用。在一些方面,所述口服调配物是粉末,其中所述粉末包含本文所述的药物组合物。在一些方面,所述口服调配物是可复水粉末。可重构粉末可以被添加到液体中以供摄取,其中粉末溶出在液体中或者粉末在液体中形成悬浮液。在一些方面,所述粉末被撒在食物上或食物中用于口服施用。在一些方面,本公开提供了含有本文所述药物组合物的小药囊。在一些方面,本公开提供了包含本文所述颗粒剂的小药囊。在一些方面,本公开提供了包含本文所述粉末的小药囊。在一些方面,本公开提供了包含本文所述珠粒的小药囊。小药囊是一种有用的包装材料,其中内容物意在被撒在食物中或添加到液体中。在一些方面,本公开提供了含有本文所述药物组合物的棒状包装。在一些方面,本公开提供了含有本文所述颗粒剂的棒状包装。在一些方面,本公开提供了含有本文所述粉末的棒状包装。在一些方面,本公开提供了含有本文所述珠粒的棒状包装。棒状包装是一种有用的包装材料,其中内容物意在被撒在食物中或添加到液体中。在实施例中,本文所述的口服调配物(包含片剂、胶囊、颗粒剂和珠粒)包括包衣。在一些方面,所述包衣包围调配物,即所述包衣形成一个层,其中调配物被包围在所述层内(被所述层包围)。在一些方面,所述包衣部分包围所述调配物。在一些方面,所述口服调配物是包括包衣的片剂。在一些方面,所述口服调配物是包括包衣的压制片剂。在一些方面,所述口服调配物是包括包衣的胶囊。在一些方面,所述口服调配物包括被包衣包围的颗粒剂。在一些方面,所述口服调配物包括被包衣包围的珠粒。在一些方面,所述包衣是肠溶衣。在一些方面,本文所述的口服调配物(包含片剂、胶囊、颗粒剂、粉末和珠粒)包括约1mg到约1,000mg的腺苷a2a受体拮抗剂剂量。在一些方面,腺苷a2a受体拮抗剂的剂量为约1mg到约900mg。在一些方面,腺苷a2a受体拮抗剂的剂量为约1mg到约800mg。在一些方面,腺苷a2a受体拮抗剂的剂量为约1mg到约700mg。在一些方面,腺苷a2a受体拮抗剂的剂量为约1mg到约600mg。在一些方面,腺苷a2a受体拮抗剂的剂量为约1mg到约500mg。在一些方面,腺苷a2a受体拮抗剂的剂量为约1mg到约400mg。在一些方面,所述口服调配物(如片剂和胶囊)包括约1mg到约50mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约5mg到约40mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约5mg到约30mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约5mg到约20mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约5mg到约10mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约5mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约10mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物如片剂和胶囊包括约20mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约25mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约20mg到约100mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约25mg到约75mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约30mg到约70mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约40mg到约60mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约45mg到约55mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约50mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约50mg到约150mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约75mg到约125mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约80mg到约120mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约85mg到约115mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约90mg到约110mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约95mg到105mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约100mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约100mg到约200mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约110mg到约190mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约120mg到约180mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约130mg到约170mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约140mg到约160mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约150mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约150mg到约250mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约170mg到约230mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约180mg到约220mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约185mg到约215mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约190mg到约210mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约195mg到205mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约200mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约200mg到约300mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约210mg到约290mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约220mg到约280mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约230mg到约270mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约240mg到约260mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约250mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约250mg到约350mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约270mg到约330mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约280mg到约320mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约285mg到约315mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约290mg到约310mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约295mg到305mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约300mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约300mg到约400mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约310mg到约390mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约320mg到约380mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约330mg到约370mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约340mg到约360mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约350mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约350mg到约450mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约370mg到约430mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约380mg到约420mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约385mg到约415mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约390mg到约410mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约395mg到405mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约400mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约400mg到约500mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约410mg到约490mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约420mg到约480mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约430mg到约470mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约440mg到约460mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约450mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约450mg到约550mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约470mg到约530mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约480mg到约520mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约485mg到约515mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约490mg到约510mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约495mg到505mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约500mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约500mg到约600mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约510mg到约590mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约520mg到约580mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约530mg到约570mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约540mg到约560mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约550mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约550mg到约650mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约570mg到约630mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约580mg到约620mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约585mg到约615mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约590mg到约610mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约595mg到605mg的腺苷a2a受体拮抗剂剂量。在一些方面,所述口服调配物(如片剂和胶囊)包括约600mg的腺苷a2a受体拮抗剂剂量。性质本文所述的药物组合物(例如,口服调配物、片剂、胶囊、珠粒、颗粒剂、粉末)具有优异的化学性质(例如,稳定性、溶出度、崩解)和生物性质(例如,药代动力学性质)。在实施例中,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备测量的,所述药物组合物(例如,口服调配物、片剂、珠粒、胶囊、颗粒剂)是快速溶出的。在一些方面,所述溶出度为在60分钟内至少55%。在一些方面,所述溶出度为在60分钟内至少60%。在一些方面,所述溶出度为在60分钟内至少65%。在一些方面,所述溶出度为在60分钟内至少70%。在一些方面,所述溶出度为在60分钟内至少75%。在一些方面,所述溶出度为在60分钟内至少80%。在一些方面,所述溶出度为在60分钟内至少81%。在一些方面,所述溶出度为在60分钟内至少82%。在一些方面,所述溶出度为在60分钟内至少83%。在一些方面,所述溶出度为在60分钟内至少84%。在一些方面,所述溶出度为在60分钟内至少85%。在一些方面,所述溶出度为在60分钟内至少86%。在一些方面,所述溶出度为在60分钟内至少87%。在一些方面,所述溶出度为在60分钟内至少88%。在一些方面,所述溶出度为在60分钟内至少90%。在一些方面,所述溶出度为在60分钟内至少95%。本文所述的“溶出度”或“溶出速率”是通过《美国药典(usp)》第<711>章ii型(桨式)溶出设备测量的。在实施例中,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备测量的,所述溶出度为在30分钟内至少55%。在一些方面,所述溶出度为在30分钟内至少60%。在一些方面,所述溶出度为在30分钟内至少65%。在一些方面,所述溶出度为在30分钟内至少70%。在一些方面,所述溶出度为在30分钟内至少75%。在一些方面,所述溶出度为在30分钟内至少80%。在一些方面,所述溶出度为在30分钟内至少85%。在一些方面,所述溶出度为在30分钟内至少90%。在一些方面,所述溶出度为在30分钟内至少95%。本文所述的“溶出度”或“溶出速率”是通过《美国药典(usp)》第<711>章ii型(桨式)溶出设备测量的。在实施例中,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备测量的,所述溶出度为在10分钟内至少50%。在一些方面,所述溶出度为在10分钟内至少55%。在一些方面,所述溶出度为在10分钟内至少60%。在一些方面,所述溶出度为在10分钟内至少65%。在一些方面,所述溶出度为在10分钟内至少70%。在一些方面,所述溶出度为在10分钟内至少75%。在一些方面,所述溶出度为在10分钟内至少80%。在一些方面,所述溶出度为在10分钟内至少85%。在一些方面,所述溶出度为在10分钟内至少90%。本文所述的“溶出度”或“溶出速率”是通过《美国药典(usp)》第<711>章ii型(桨式)溶出设备测量的。在实施例中,如通过《美国药典(usp)》第<701>章的崩解测试测量的,所述药物组合物(例如,口服调配物、片剂、珠粒、胶囊、颗粒剂)是快速崩解的。在一些方面,所述药物组合物具有约30分钟或更短的崩解时间。在一些方面,所述药物组合物具有约25分钟或更短的崩解时间。在一些方面,所述药物组合物具有约20分钟或更短的崩解时间。在一些方面,所述药物组合物具有约19分钟或更短的崩解时间。在一些方面,所述崩解时间为约18分钟或更短。在一些方面,所述崩解时间为约17分钟或更短。在一些方面,所述崩解时间为约16分钟或更短。在一些方面,所述崩解时间为约15分钟或更短。在一些方面,所述崩解时间为约14分钟或更短。在一些方面,所述崩解时间为约13分钟或更短。在一些方面,所述崩解时间为约12分钟或更短。在一些方面,所述崩解时间为约11分钟或更短。在一些方面,所述崩解时间为约10分钟或更短。在一些方面,所述崩解时间为约9分钟或更短。在一些方面,所述崩解时间为约8分钟或更短。在一些方面,所述崩解时间为约7分钟或更短。在一些方面,所述崩解时间为约6分钟或更短。在一些方面,所述崩解时间为约5分钟或更短。在一些方面,所述崩解时间为约4分钟或更短。在一些方面,所述崩解时间为约3分钟或更短。在一些方面,所述崩解时间为约2分钟或更短。在一些方面,所述崩解时间为约1分钟或更短。“崩解”或“崩解时间”或“崩解速率”是通过《美国药典(usp)》第<701>章崩解测试测量的。在实施例中,本文所述的药物组合物(例如,口服调配物、片剂、珠粒、胶囊、颗粒剂)在以下条件下总杂质水平小于3%:在40℃、75%相对湿度下密闭储存4周,如通过高效液相色谱法和随后的紫外分光光度法(hplc-uv)测量的。在一些方面,所述杂质水平低于2.5%。在一些方面,所述杂质水平低于2%。在一些方面,所述杂质水平低于1.9%。在一些方面,所述杂质水平低于1.8%。在一些方面,所述杂质水平低于1.7%。在一些方面,所述杂质水平低于1.6%。在一些方面,所述杂质水平低于1.5%。在一些方面,所述杂质水平低于1.4%。在一些方面,所述杂质水平低于1.3%。在一些方面,所述杂质水平低于1.2%。在一些方面,所述杂质水平低于1.1%。在一些方面,所述杂质水平低于1%。在一些方面,所述杂质水平低于0.9%。在一些方面,所述杂质水平低于0.8%。在一些方面,所述杂质水平低于0.7%。在一些方面,所述杂质水平低于0.6%。在一些方面,所述杂质水平低于0.5%。在一些方面,所述杂质水平低于0.4%。在一些方面,所述总杂质水平为约0.5%到小于2.0%。在一些方面,所述总杂质水平为约0.5%到小于1.5%。在一些方面,所述总杂质水平为约0.5%到小于1.4%。在一些方面,所述总杂质水平为约0.5%到小于1.3%。在一些方面,所述总杂质水平为约0.5%到小于1.2%。在一些方面,所述总杂质水平为约0.5%到小于1.1%。在一些方面,所述总杂质水平为约0.5%到小于1.0%。在一些方面,所述总杂质水平为约0.5%到小于0.9%。在实施例中,本文所述的药物组合物(例如,口服调配物、片剂、珠粒、胶囊、颗粒剂)在以下任一条件下总杂质水平小于3%:(i)在40℃、75%相对湿度、有或没有干燥剂的条件下密闭储存6个月,如通过高效液相色谱和随后的紫外分光光度法(hplc-uv)测量的;(ii)在25℃、60%相对湿度、有或没有干燥剂的条件下密闭储存6个月,如通过hplc-uv测量的;(iii)在40℃、75%相对湿度、有或没有干燥剂的条件下密闭储存3个月,如通过hplc-uv测量的;或(iv)在25℃、60%相对湿度有或没有干燥剂的条件下密闭储存3个月,如通过hplc-uv测量的。在一些方面,所述杂质水平低于2.5%。在一些方面,所述杂质水平低于2%。在一些方面,所述杂质水平低于1.9%。在一些方面,所述杂质水平低于1.8%。在一些方面,所述杂质水平低于1.7%。在一些方面,所述杂质水平低于1.6%。在一些方面,所述杂质水平低于1.5%。在一些方面,所述杂质水平低于1.4%。在一些方面,所述杂质水平低于1.3%。在一些方面,所述杂质水平低于1.2%。在一些方面,所述杂质水平低于1.1%。在一些方面,所述杂质水平低于1%。在一些方面,所述杂质水平低于0.9%。在一些方面,所述杂质水平低于0.8%。在一些方面,所述杂质水平低于0.7%。在一些方面,所述杂质水平低于0.6%。在一些方面,所述杂质水平低于0.5%。在一些方面,所述杂质水平低于0.4%。在一些方面,所述总杂质水平为约0.5%到小于2.0%。在一些方面,所述总杂质水平为约0.5%到小于1.5%。在一些方面,所述总杂质水平为约0.5%到小于1.4%。在一些方面,所述总杂质水平为约0.5%到小于1.3%。在一些方面,所述总杂质水平为约0.5%到小于1.2%。在一些方面,所述总杂质水平为约0.5%到小于1.1%。在一些方面,所述总杂质水平为约0.5%到小于1.0%。在一些方面,所述总杂质水平为约0.5%到小于0.9%。在实施例中,本文所述的药物组合物(例如,口服调配物、片剂、珠粒、胶囊、颗粒剂)具有约90%到约110%的测定标示量%(lc)。在一些方面,所述lc%为约91%到约109%。在一些方面,所述lc%为约92%到约108%。在一些方面,所述lc%为约93%到约107%。在一些方面,所述lc%为约94%到约106%。在一些方面,所述lc%为约95%到约105%。在一些方面,所述lc%为约96%到约104%。在一些方面,所述lc%为约97%到约103%。在一些方面,所述lc%为约97%到约103%。在一些方面,所述lc%为约98%到约102%。在一些方面,所述lc%为约99%到约101%。治疗方法在实施例中,本公开提供了通过向患者施用治疗有效量的本文所述的药物组合物、口服调配物、颗粒剂、珠粒、片剂、胶囊、粉末或口服调配物来治疗患者癌症的方法。所述方法可有效治疗任何癌症,尤其是受腺苷a2a受体调节的癌症。在一些方面,所述药物组合物、颗粒剂、珠粒或口服调配物用于治疗转移性癌症。在一些方面,所述方法用于治疗肺癌、黑色素瘤、肾细胞癌、乳腺癌、结肠直肠癌、膀胱癌、前列腺癌或头颈癌。在一些方面,所述方法用于治疗非小细胞肺癌、恶性黑色素瘤、肾细胞癌、三阴性乳腺癌、结肠直肠癌或膀胱癌。在一些方面,所述方法用于治疗肺癌。在一些方面,所述方法用于治疗非小细胞肺癌。在一些方面,所述方法用于治疗黑素瘤。在一些方面,所述方法用于治疗恶性黑色素瘤。在一些方面,所述方法用于治疗肾细胞癌。在一些方面,所述方法用于治疗乳腺癌。在一些方面,所述方法用于治疗三阴性乳腺癌。在一些方面,所述方法用于治疗结肠直肠癌。在一些方面,所述方法用于治疗微卫星不稳定结肠直肠癌。在一些方面,所述方法用于治疗膀胱癌。在一些方面,所述方法用于治疗头颈癌。在一些方面,所述方法用于治疗前列腺癌。在一些方面,所述方法用于治疗去势抵抗性前列腺癌。在一些方面,所述方法用于治疗转移性去势抵抗性前列腺癌。所述治疗癌症的方法包括治疗转移性癌症的方法、治疗癌症肿瘤的方法和治疗转移性癌症肿瘤的方法。本文所述的药物组合物、口服调配物、颗粒剂、珠粒、片剂、胶囊、粉末和口服调配物含有治疗有效量(即有效治疗癌症的量)的腺苷a2a受体拮抗剂。当施用于治疗癌症的方法时,这种组合物将含有有效达到所需结果的活性成分的量,所述所需结果包含以下一个或多个:(i)减缓癌症的进展;(ii)增强抗肿瘤免疫记忆;(iii)使cd8+细胞浸润、t细胞活化、干扰素-γ途径基因表达和t细胞克隆扩增中的一个或多个超过基线;(iv)防止肿瘤的大小或体积随时间增长;(v)随着时间推移减小癌性肿瘤的大小或体积;以及(vi)防止癌性肿瘤转移。腺苷a2a受体拮抗剂的治疗有效量的确定在本领域技术人员的能力范围内,特别是根据本文的详细公开。在用本文所述的药物组合物和口服调配物(例如,颗粒剂、珠粒、片剂、胶囊、粉末)治疗癌症的方法的实施例中,所述腺苷a2a受体拮抗剂的所述治疗有效量为约1mg到约1,000mg。在一些方面,所述治疗有效量为约1mg到约900mg。在一些方面,所述治疗有效量为约1mg到约800mg。在一些方面,所述治疗有效量为约1mg到约700mg。在一些方面,所述治疗有效量为约1mg到约600mg。在一些方面,所述治疗有效量为约1mg到约500mg。在一些方面,所述治疗有效量为约1mg到约400mg。在用本文所述的药物组合物和口服调配物(例如,颗粒剂、珠粒、片剂、胶囊、粉末)治疗癌症的方法的实施例中,所述腺苷a2a受体拮抗剂的所述治疗有效量为约100mg到约1,000mgmg。在一些方面,所述治疗有效量为约100mg到约900mg。在一些方面,所述治疗有效量为约100mg到约850mg。在一些方面,所述治疗有效量为约100mg到约800mg。在一些方面,所述治疗有效量为约100mg到约700mg。在一些方面,所述治疗有效量为约100mg到约600mg。在一些方面,所述治疗有效量为约100mg到约500mg。在一些方面,所述治疗有效量为约100mg到约450mg。在一些方面,所述治疗有效量为约100mg到约400mg。在一些方面,所述治疗有效量为约100mg到约300mg。在一些方面,所述治疗有效量为约150mg到约250mg。在一些方面,所述治疗有效量为约200mg到约400mg。在一些方面,所述治疗有效量为约250mg到约350mg。在一些方面,所述治疗有效量为约300mg到约500mg。在一些方面,所述治疗有效量为约350mg到约450mg。在一些方面,这一治疗有效量的施用为qd。在一些方面,这一治疗有效量的施用为bid。在用本文所述的药物组合物和口服调配物(例如,颗粒剂、珠粒、片剂、胶囊、粉末)治疗癌症的方法的实施例中,所述腺苷a2a受体拮抗剂的所述治疗有效量为约100mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为125mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为150mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为175mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为200mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为225mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为250mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为275mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为300mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为325mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为350mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为375mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为400mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为425mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为450mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为475mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为500mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为525mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为550mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为575mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为600mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为625mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为650mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为675mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为700mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为725mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为750mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为775mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为800mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为825mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为850mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为875mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为900mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为950mg。在一些方面,所述腺苷a2a受体拮抗剂的所述治疗有效量约为1,000mg。在一些方面,这一治疗有效量的施用是qd。在一些方面,这一治疗有效量的施用为bid。本文所述药物组合物的施用频率(例如,每天一次、每天两次、每天三次)和持续时间(例如,一周、两周、一个月、两个月、六个月、1年、5到10年,或直到疾病进展)可以根据多种因素而变化,例如,患者是否患有另一种疾病,以及施用途径;身材大小、年龄、性别、健康状况、体重;所治疗疾病症状的性质和程度;是否存在同时治疗(例如,用化疗剂、放疗或免疫调节化合物)、正在治疗的癌症的并发症或其它健康相关问题。对治疗的频率和持续时间的调整和操纵在本领域技术人员的能力范围内。在一些方面,本文所述的药物组合物每天向患者施用一次(qd)。在一些方面,所述药物组合物每天施用两次(bid)。在一些方面,所述药物组合物每天施用三次。在一些方面,所述药物组合物每天施用一次,持续约7天。在一些方面,所述药物组合物每天施用一次,持续约14天。在一些方面,所述药物组合物每天施用一次,持续约21天。在一些方面,所述药物组合物每天施用一次,持续约一个月。在一些方面,所述药物组合物每天施用一次,直到疾病进展。在一些方面,所述药物组合物每天施用两次,持续约7天。在一些方面,所述药物组合物每天施用两次,持续约14天。在一些方面,所述药物组合物每天施用两次,持续约21天。在一些方面,所述药物组合物每天施用两次,持续一个月。在一些方面,所述药物组合物每天施用两次,直到疾病进展。在施用14天后,可以立即开始另一个施用周期,或者可以停止治疗14天或一个月,然后进行另一个施用周期。在施用一个月后,可以立即开始另一个施用周期,或者可以停止治疗14天或一个月,然后进行另一个施用周期。因此,在施用一个周期(例如,每天一次/两次/三次,持续7天、14天、21天、1个月)后,可以立即开始另一个施用周期,或者可以停止治疗一段时间(例如,7天、14天、21天、1个月),随后进行另一个施用周期。施用和/或停用的周期可以是相同的时间段(例如,14天)或不同的时间段(例如,一个周期是14天,另一个周期是21天)。制造过程在实施例中,腺苷a2a受体拮抗剂(例如,式(iii)化合物)被微粉化。腺苷a2a受体拮抗剂可以通过本领域已知的任何方法微粉化。在一些方面,腺苷a2a受体拮抗剂可以单独或与一种或多种药学上可接受的赋形剂一起通过干磨微粉化。示例性干磨装置是喷射式磨机。在一些方面,腺苷a2a受体拮抗剂通过单独或与一种或多种药学上可接受的赋形剂一起通过湿磨微粉化。示例性湿磨装置包含行星式球磨机、球磨机、搅拌珠磨机(agitatorbeadmill)和喷雾干燥机。在腺苷a2a受体拮抗剂被微粉化后,将其过筛并与本文所述的药学上可接受的赋形剂共混。过筛步骤可以用本领域已知的任何研磨装置或过筛装置来进行,例如回转筛分机、滚筒筛分机、振动筛分机、滚筒振动筛分机或comil。在所述过程的这一步骤中,可以使用任何合适的筛目尺寸。在一些方面,筛目尺寸是#16目美国标准筛;或#18目美国标准筛;或者#20目美国标准筛。在一些方面,筛目尺寸是#20目美国标准筛;或#30目美国标准筛;或#35目美国标准筛。在过筛和共混腺苷a2a受体拮抗剂和药学上可接受的赋形剂之后,将共混的调配物制粒以形成腺苷a2a受体拮抗剂和药学上可接受的赋形剂的附聚物。制粒技术包含湿法制粒(如低剪切、高剪切、流化床);干法制粒(例如,辊压)等。然后,如果颗粒剂不是通过干燥过程产生的,对颗粒剂进行干燥(例如,烘箱托盘干燥、流化床干燥)以除去任何水分。在制粒之后或与制粒串联,用本领域已知的任何研磨装置研磨调配物,如用回转筛分机、滚筒筛分机、振动筛分机或滚筒振动筛分机。在一些方面,可以使用粉碎机(菲茨帕特里克公司(thefitzpatrickcompany))。对于某些干法制粒过程,研磨步骤可以连接到制粒过程并紧随制粒过程之后。然后,可进一步将这种调配物与药学上可接受的赋形剂共混、压制成片剂,并且任选地选用包衣层()包衣。在实例中更详细地描述了形成本文所述的组合物的这些方法。实施例实施例1.一种药物组合物,其包括药物颗粒和药学上可接受的赋形剂;其中所述药物颗粒包括腺苷a2a受体拮抗剂或其药学上可接受的盐,所述a2a受体拮抗剂或其药学上可接受的盐通过激光衍射光谱法测量具有d90为约30微米或更小的粒度分布。实施例2.根据实施例1所述的药物组合物,其中所述腺苷a2a受体拮抗剂是式(i)化合物。实施例3.根据实施例1所述的药物组合物,其中所述腺苷a2a受体拮抗剂是式(ii)化合物。实施例4.根据实施例1所述的药物组合物,其中所述腺苷a2a受体拮抗剂是式(iii)化合物。实施例5.根据实施例1所述的药物组合物,其中所述腺苷a2a受体拮抗剂是式(iiia)化合物。实施例6.根据实施例1所述的药物组合物,其中所述腺苷a2a受体拮抗剂是式(iiib)化合物。实施例7.根据实施例1到6中任一项所述的组合物,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约25微米或更小的粒度分布。实施例8.根据实施例7所述的组合物,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约20微米或更小的粒度分布。实施例9.根据实施例8所述的组合物,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约15微米或更小的粒度分布。实施例10.根据实施例9所述的组合物,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约10微米或更小的粒度分布。实施例11.根据实施例1到10中任一项所述的组合物,所述药学上可接受的赋形剂包括填料、崩解剂、粘合剂、表面活性剂、助流剂或其中的两种或更多种的组合。实施例12.根据实施例1到10中任一项所述的组合物,其中所述药学上可接受的赋形剂包括:(i)多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合;(iv)来自(i)的化合物和来自(ii)的化合物;(v)来自(i)的化合物和来自(iii)的化合物;(vi)来自(ii)的化合物和来自(iii)的化合物;或(vii)来自(i)的化合物、来自(ii)的化合物和来自(iii)的化合物。实施例13.根据实施例12所述的组合物,其包括来自(i)的化合物、来自(ii)的化合物和来自(iii)的化合物。实施例14.根据实施例13所述的组合物,其包括约40wt%到约80wt%的来自(i)的化合物、约1wt%到约20wt%的来自(ii)的化合物和约1wt%到约20wt%的来自(iii)的化合物。实施例15.根据实施例14所述的组合物,其包括约50wt%到约70wt%的来自(i)的化合物、约1wt%到约15wt%的来自(ii)的化合物和约1wt%到约10wt%的来自(iii)的化合物。实施例16.根据实施例15所述的组合物,其包括约55wt%到约65wt%的来自(i)的化合物、约2wt%到约12wt%的来自(ii)的化合物和约1wt%到约8wt%的来自(iii)的化合物。实施例17.根据实施例16所述的组合物,其包括约58wt%到约63wt%的来自(i)的化合物、约2wt%到约10wt%的来自(ii)的化合物和约2wt%到约8wt%的来自(iii)的化合物。实施例18.根据实施例17所述的组合物,其包括约61wt%的来自(i)的化合物;约8wt%的来自(ii)的化合物;以及约4wt%的来自(iii)的化合物。实施例19.根据实施例1到10中任一项所述的组合物,其中所述药学上可接受的赋形剂包括:(i)多元醇;(ii)微晶纤维素;(ii)羧甲基纤维素;以及(iii)羟烷基纤维素。实施例20.根据实施例1到10中任一项所述的组合物,其中所述药学上可接受的赋形剂包括(i)多元醇,(ii)微晶纤维素,(iii)麦芽糖糊精,(iv)羧甲基纤维素,(v)羟烷基纤维素,(vi)烷基纤维素,或(vii)其中的两种或更多种的组合。实施例21.根据实施例7、19或20所述的组合物,其中所述羟烷基纤维素是羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素或其中的两种或更多种的组合。实施例22.根据实施例21所述的组合物,其中所述羟烷基纤维素是羟丙基纤维素。实施例23.根据实施例12、19、20、21或22所述的组合物,其中所述多元醇是甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。实施例24.根据实施例23所述的组合物,其中所述多元醇是甘露醇。实施例25.根据实施例1到24中任一项所述的组合物,其包括约1wt%到约50wt%的腺苷a2a受体拮抗剂。实施例26.根据实施例25所述的组合物,其包括约5wt%到约45wt%的腺苷a2a受体拮抗剂。实施例27.根据实施例26所述的组合物,其包括约10wt%到约40wt%的腺苷a2a受体拮抗剂。实施例28.根据实施例27所述的组合物,其包括约15wt%到约35wt%的腺苷a2a受体拮抗剂。实施例29.根据实施例28所述的组合物,其包括约20wt%到约30wt%的腺苷a2a受体拮抗剂。实施例30.根据实施例29所述的组合物,其包括约24wt%到约26wt%的腺苷a2a受体拮抗剂。实施例31.根据实施例30所述的组合物,其包括约25wt%的腺苷a2a受体拮抗剂。实施例32.根据实施例1到31中任一项所述的组合物,其进一步包括约0.5wt%到约4wt%的润滑剂。实施例33.根据实施例32所述的组合物,其包括约0.5wt%到约2.3wt%的润滑剂。实施例34.根据实施例33所述的组合物,其包括约2.25wt%的润滑剂。实施例35.根据实施例1到34中任一项所述的组合物,其包括约1mg到约1,000mg的腺苷a2a受体拮抗剂。实施例36.根据实施例35所述的组合物,其包括约50mg到约600mg的腺苷a2a受体拮抗剂。实施例37.根据实施例36所述的组合物,其包括约50mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg或约600mg的腺苷a2a受体拮抗剂。实施例38.根据实施例1到37中任一项所述的组合物,如通过《美国药典(usp)》第<701>章的崩解测试方法测量的,其崩解时间为约15分钟或更短。实施例39.根据实施例38所述的组合物,如通过《美国药典(usp)》第<701>章的崩解测试方法测量的,其溶出度为约10分钟或更短。实施例40.根据实施例1到39中任一项所述的组合物,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,其溶出度为在60分钟内至少75%。实施例41.根据实施例40所述的组合物,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,其溶出度为在60分钟内至少90%。实施例42.根据实施例40所述的组合物,物如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,其溶出度为在10分钟内至少70%。实施例43.根据实施例1到42中任一项所述的组合物,其中所述组合物是口服调配物。实施例44.根据实施例43所述的组合物,其中所述组合物是片剂。实施例45.根据实施例43所述的组合物,其中所述组合物是粉末。实施例46.根据实施例43所述的组合物,其中所述组合物是胶囊。实施例47.一种治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用治疗有效量的根据实施例1到46中任一项所述的组合物以治疗所述癌症。实施例48.根据实施例47所述的方法,其中所述癌症是非小细胞肺癌、黑色素瘤、肾细胞癌、乳腺癌、结肠直肠癌、膀胱癌、前列腺癌或头颈癌。实施例49.根据实施例47或48所述的方法,其中所述治疗有效量为每天约1mg到约1,000mg。实施例50.根据实施例49所述的方法,其中所述治疗有效量为每天约10mg到约600mg。实施例51.根据实施例50所述的方法,其中所述治疗有效量为每天约100mg到约400mg。实施例52.一种颗粒剂,其包括药物颗粒和药学上可接受的赋形剂;其中所述药物颗粒包括腺苷a2a受体拮抗剂或其药学上可接受的盐,如通过激光衍射光谱法测量的,所述a2a受体拮抗剂或其药学上可接受的盐具有d90为约30微米或更小的粒度分布。实施例53.根据实施例52所述的颗粒剂,其中所述腺苷a2a受体拮抗剂是式(i)化合物。实施例54.根据实施例52所述的颗粒剂,其中所述腺苷a2a受体拮抗剂是式(ii)化合物。实施例55.根据实施例52所述的颗粒剂,其中所述腺苷a2a受体拮抗剂是式(iii)化合物。实施例56.根据实施例52所述的颗粒剂,其中所述腺苷a2a受体拮抗剂是式(iiia)化合物。实施例57.根据实施例52所述的颗粒剂,其中所述腺苷a2a受体拮抗剂是式(iiib)化合物。实施例58.根据实施例52到57中任一项所述的颗粒剂,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约25微米或更小的粒度分布。实施例59.根据实施例58所述的颗粒剂,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约20微米或更小的粒度分布。实施例60.根据实施例58所述的颗粒剂,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约15微米或更小的粒度分布。实施例61.根据实施例58所述的颗粒剂,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约10微米或更小的粒度分布。实施例62.根据实施例52到61中任一项所述的颗粒剂,所述药学上可接受的赋形剂包括填料、崩解剂、粘合剂、润滑剂、表面活性剂、助流剂或其中的两种或更多种的组合。实施例63.根据实施例52到61所述的颗粒剂,其中所述药学上可接受的赋形剂包括:(i)多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合;(iv)来自(i)的化合物和来自(ii)的化合物;(v)来自(i)的化合物和来自(iii)的化合物;(vi)来自(ii)的化合物和来自(iii)的化合物;或(vii)来自(i)的化合物、来自(ii)的化合物和来自(iii)的化合物。实施例64.根据实施例63所述的颗粒剂,其包括来自(i)的化合物、来自(ii)的化合物和来自(iii)的化合物。实施例65.根据实施例64所述的颗粒剂,其包括约40wt%到约80wt%的来自(i)的化合物、约1wt%到约20wt%的来自(ii)的化合物和约1wt%到约20wt%的来自(iii)的化合物。实施例66.根据实施例65所述的颗粒剂,其包括约50wt%到约70wt%的来自(i)的化合物、约1wt%到约15wt%的来自(ii)的化合物和约1wt%到约10wt%的来自(iii)的化合物。实施例67.根据实施例66所述的颗粒剂,其包括约55wt%到约65wt%的来自(i)的化合物、约2wt%到约12wt%的来自(ii)的化合物和约1wt%到约8wt%的来自(iii)的化合物。实施例68.根据实施例67所述的颗粒剂,其包括约58wt%到约63wt%的来自(i)的化合物、约2wt%到约10wt%的来自(ii)的化合物和约2wt%到约8wt%的来自(iii)的化合物。实施例69.根据实施例68所述的颗粒剂,其包括约61wt%的来自(i)的化合物;约8wt%的来自(ii)的化合物;以及约4wt%的来自(iii)的化合物。实施例70.根据实施例52到61中任一项所述的颗粒剂,其中所述药学上可接受的赋形剂包括:(i)多元醇;(ii)微晶纤维素;(ii)羧甲基纤维素;以及(iii)羟烷基纤维素。实施例71.根据实施例52到61中任一项所述的颗粒剂,其中所述药学上可接受的赋形剂包括(i)多元醇,(ii)微晶纤维素,(iii)麦芽糖糊精,(iv)羧甲基纤维素,(v)羟烷基纤维素,(vi)烷基纤维素,或(vii)其中的两种或更多种的组合。实施例72.根据实施例63、70或71所述的颗粒剂,其中所述羟烷基纤维素是羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素或其中的两种或更多种的组合。实施例73.根据实施例72所述的颗粒剂,其中所述羟烷基纤维素是羟丙基纤维素。实施例74.根据实施例63、70、71、72或73所述的颗粒剂,其中所述多元醇是甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。实施例75.根据实施例74所述的颗粒剂,其中所述多元醇是甘露醇。实施例76.根据实施例52到75中任一项所述的颗粒剂,其包括约1wt%到约50wt%的腺苷a2a受体拮抗剂。实施例77.根据实施例76所述的颗粒剂,其包括约5wt%到约45wt%的腺苷a2a受体拮抗剂。实施例78.根据实施例77所述的颗粒剂,其包括约10wt%到约40wt%的腺苷a2a受体拮抗剂。实施例79.根据实施例78所述的颗粒剂,其包括约15wt%到约35wt%的腺苷a2a受体拮抗剂。实施例80.根据实施例79所述的颗粒剂,其包括约20wt%到约30wt%的腺苷a2a受体拮抗剂。实施例81.根据实施例80所述的颗粒剂,其包括约24wt%到约26wt%的腺苷a2a受体拮抗剂。实施例82.根据实施例81所述的颗粒剂,其包括约25wt%的腺苷a2a受体拮抗剂。实施例83.根据实施例52到82中任一项所述的颗粒剂,其进一步包括约0.5wt%到约4wt%的润滑剂。实施例84.根据实施例83所述的颗粒剂,其包括约0.5wt%到约2.3wt%的润滑剂。实施例85.根据实施例84所述的颗粒剂,其包括约2.25wt%的润滑剂。实施例86.一种药物组合物,其包括根据实施例52到85中任一项所述的颗粒剂。实施例87.一种片剂,其包括根据实施例52到85中任一项所述的颗粒剂。实施例88.一种胶囊,其包括包封在胶囊壳内的根据实施例52到85中任一项所述的颗粒剂。实施例89.一种小药囊或棒状包装,其包括根据实施例52到85中任一项所述的颗粒剂。实施例90.根据实施例86所述的药物组合物、实施例87所述的片剂、实施例88所述的胶囊或实施例89所述的小药囊或棒状包装,所述药物组合物、片剂、胶囊或小药囊或棒状包装包括约1mg到约1,000mg腺苷a2a受体拮抗剂。实施例91.根据实施例86所述的药物组合物、实施例87所述的片剂、实施例88所述的胶囊或实施例89所述的小药囊或棒状包装,所述药物组合物、片剂、胶囊或小药囊或棒状包装包括约50mg到约500mg腺苷a2a受体拮抗剂。实施例92.根据实施例86所述的药物组合物、实施例87所述的片剂、实施例88所述的胶囊或实施例89所述的小药囊或棒状包装,所述药物组合物、片剂、胶囊、小药囊或棒状包装包括约50mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg或约600mg的腺苷a2a受体拮抗剂。实施例93.根据实施例86所述的药物组合物、实施例87所述的片剂、实施例88所述的胶囊,如通过《美国药典(usp)》第<701>章的崩解测试方法测量的,所述药物组合物、片剂、胶囊的崩解时间为约15分钟或更短。实施例94.根据实施例86所述的药物组合物、实施例87所述的片剂、实施例88所述的胶囊,如通过《美国药典(usp)》第<701>章的崩解测试方法测量的,所述药物组合物、片剂、胶囊的崩解时间为约10分钟或更短。实施例95.根据实施例86所述的药物组合物、实施例87所述的片剂、实施例88胶囊所述的胶囊,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,所述药物组合物、片剂、胶囊的溶出度为在60分钟内至少75%。实施例96.根据实施例86所述的药物组合物、实施例87所述的片剂、实施例88胶囊所述的胶囊,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,所述药物组合物、片剂、胶囊的溶出度为在60分钟内至少90%。实施例97.根据实施例86所述的药物组合物、实施例87所述的片剂、实施例88胶囊所述的胶囊,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,所述药物组合物、片剂、胶囊的溶出度为在10分钟内至少70%。实施例98.一种治疗有需要的受试者的癌症的方法,所述方法包括向受试者施用治疗有效量的根据实施例52到85中任一项所述的颗粒剂、根据实施例86和90到97中任一项所述的组合物、根据实施例87和90到97中任一项所述的片剂、根据实施例88和90到97中任一项所述的胶囊或实施例89所述的棒状包装或小药囊来治疗癌症。实施例99.根据实施例98所述的方法,其中所述癌症是肺癌、黑素瘤、肾细胞癌、乳腺癌、结肠直肠癌、膀胱癌、前列腺癌或头颈癌。实施例100.根据实施例98或99所述的方法,其中所述治疗有效量为每天约1mg到约1,000mg。实施例101.根据实施例100所述的方法,其中所述治疗有效量为每天约10mg到约600mg。实施例102.根据实施例101所述的方法,其中所述治疗有效量为每天约100mg到约400mg。实施例103.一种珠粒,其包括惰性核和药物层;其中所述药物层包括药物颗粒和药学上可接受的赋形剂;其中所述药物颗粒包括腺苷a2a受体拮抗剂或其药学上可接受的盐,如通过激光衍射光谱法测量的,所述a2a受体拮抗剂或其药学上可接受的盐具有d90为约30微米或更小的粒度分布。实施例104.根据实施例103所述的珠粒,其中所述腺苷a2a受体拮抗剂是式(i)化合物。实施例105.根据实施例103所述的珠粒,其中所述腺苷a2a受体拮抗剂是式(ii)化合物。实施例106.根据实施例103所述的珠粒,其中所述腺苷a2a受体拮抗剂是式(iii)化合物。实施例107.根据实施例103所述的珠粒,其中所述腺苷a2a受体拮抗剂是式(iiia)化合物。实施例108.根据实施例103所述的珠粒,其中所述腺苷a2a受体拮抗剂是式(iiib)化合物。实施例109.根据实施例103到108中任一项所述的珠粒,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约25微米或更小的粒度分布。实施例110.根据实施例109所述的珠粒,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约20微米或更小的粒度分布。实施例111.根据实施例110所述的珠粒,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约15微米或更小的粒度分布。实施例112.根据实施例111所述的珠粒,其中,如通过激光衍射光谱法测量的,所述药物颗粒具有d90为约10微米或更小的粒度分布。实施例113.根据实施例103到112中任一项所述的珠粒,其中所述核的粒度大于50微米。实施例114.根据实施例113所述的珠粒,其中所述核的粒度为约100微米到约2.5mm。实施例115.根据实施例103到114中任一项所述的珠粒,其中所述药学上可接受的赋形剂包括填料、崩解剂、粘合剂、润滑剂、表面活性剂、助流剂或其中的两种或更多种的组合。实施例116.根据实施例103到114中任一项所述的珠粒,其中所述药学上可接受的赋形剂包括:(i)多元醇、麦芽糖糊精、微晶纤维素、磷酸二钙或其中的两种或更多种的组合;(ii)羧甲基纤维素、羟基乙酸淀粉钠、交联聚乙烯吡咯烷酮聚合物或其中的两种或更多种的组合;(iii)羟烷基纤维素、烷基纤维素、玉米淀粉、聚乙二醇、聚氧化乙烯、聚乙烯吡咯烷酮或其中的两种或更多种的组合;(iv)来自(i)的化合物和来自(ii)的化合物;(v)来自(i)的化合物和来自(iii)的化合物;(vi)来自(ii)的化合物和来自(iii)的化合物;或者(vii)来自(i)的化合物、来自(ii)的化合物和来自(iii)的化合物。实施例117.根据实施例116所述的珠粒,其包括来自(i)的化合物、来自(ii)的化合物和来自(iii)的化合物。实施例118.根据实施例117所述的珠粒,其包括约40wt%到约80wt%的来自(i)的化合物、约1wt%到约20wt%的来自(ii)的化合物和约1wt%到约20wt%的来自(iii)的化合物。实施例119.根据实施例118所述的珠粒,其包括约50wt%到约70wt%的来自(i)的化合物、约1wt%到约15wt%的来自(ii)的化合物和约1wt%到约10wt%的来自(iii)的化合物。实施例120.根据实施例119所述的珠粒,其包括约55wt%到约65wt%的来自(i)的化合物、约2wt%到约12wt%的来自(ii)的化合物和约1wt%到约8wt%的来自(iii)的化合物。实施例121.根据实施例120所述的珠粒,其包括约58wt%到约63wt%的来自(i)的化合物、约2wt%到约10wt%的来自(ii)的化合物和约2wt%到约8wt%的来自(iii)的化合物。实施例122.根据实施例121所述的珠粒,其包括约61wt%的来自(i)的化合物;约8wt%的来自(ii)的化合物;以及约4wt%的来自(iii)的化合物。实施例123.根据实施例103到114中任一项所述的珠粒,其中所述药学上可接受的赋形剂包括:(i)多元醇;(ii)微晶纤维素;(ii)羧甲基纤维素;以及(iii)羟烷基纤维素。实施例124.根据实施例103到114中任一项所述的珠粒,其中所述药学上可接受的赋形剂包括(i)多元醇,(ii)微晶纤维素,(iii)麦芽糖糊精,(iv)羧甲基纤维素,(v)羟烷基纤维素,(vi)烷基纤维素,或(vii)其中的两种或更多种的组合。实施例125.根据实施例116、123或124所述的珠粒,其中所述羟烷基纤维素是羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素或其中的两种或更多种的组合。实施例126.根据实施例125所述的珠粒,其中所述羟烷基纤维素是羟丙基纤维素。实施例127.根据实施例116、123、124、125、126或127所述的珠粒,其中所述多元醇是甘露醇、山梨醇、异麦芽糖、麦芽糖醇、乳糖、蔗糖、直链淀粉、葡萄糖、右旋糖、乳糖醇、赤藓糖醇、阿拉伯糖醇、木糖醇、海藻糖、核糖醇、肌醇或其中的两种或更多种的组合。实施例128.根据实施例127所述的珠粒,其中所述多元醇是甘露醇。实施例129.根据实施例103到128中任一项所述的珠粒,其包括约1wt%到约50wt%的腺苷a2a受体拮抗剂。实施例130.根据实施例129所述的珠粒,其包括约5wt%到约45wt%的腺苷a2a受体拮抗剂。实施例131.根据实施例130所述的珠粒,其包括约10wt%到约40wt%的腺苷a2a受体拮抗剂。实施例132.根据实施例131所述的珠粒,其包括约15wt%到约35wt%的腺苷a2a受体拮抗剂。实施例133.根据实施例132所述的珠粒,其包括约20wt%到约30wt%的腺苷a2a受体拮抗剂。实施例134.根据实施例133所述的珠粒,其包括约24wt%到约26wt%的腺苷a2a受体拮抗剂。实施例135.根据实施例134所述的珠粒,其包括约25wt%的腺苷a2a受体拮抗剂。实施例136.一种药物组合物,其包括根据实施例103到135中任一项所述的珠粒。实施例137.一种片剂,其包括根据实施例103到135中任一项所述的珠粒。实施例138.一种胶囊,其包括根据实施例103到135中任一项所述的珠粒。实施例139.一种棒状包装或小药囊,其包括根据实施例103到135中任一项所述的珠粒。实施例140.根据实施例136所述的药物组合物、实施例137所述的片剂、实施例138所述的胶囊或实施例139所述的棒状包装或小药囊,所述药物组合物、片剂、胶囊或棒状包装或小药囊包装包括约1mg到约1,000mg腺苷a2a受体拮抗剂。实施例141.根据实施例136所述的药物组合物、实施例137所述的片剂、实施例138所述的胶囊或实施例139所述的棒状包装或小药囊,所述药物组合物、片剂、胶囊或棒状包装或小药囊包装包括约50mg到约600mg腺苷a2a受体拮抗剂。实施例142.根据实施例136所述的药物组合物、实施例137所述的片剂、实施例138所述的胶囊或实施例139所述的棒状包装或小药囊,所述药物组合物、片剂、胶囊、棒状包装或小药囊包括约50mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg或约600mg的腺苷a2a受体拮抗剂。实施例143.根据实施例136所述的药物组合物、实施例137所述的片剂或实施例138所述的胶囊,如通过《美国药典(usp)》第<701>章的崩解测试方法测量的,所述药物组合物、片剂、胶囊的崩解时间为约15分钟或更短。实施例144.根据实施例136所述的药物组合物、实施例137所述的片剂或实施例138所述的胶囊,如通过《美国药典(usp)》第<701>章的崩解测试方法测量的,所述药物组合物、片剂、胶囊的崩解时间为约10分钟或更短。实施例145.根据实施例136所述的药物组合物、实施例137所述的片剂或实施例138胶囊所述的胶囊,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,所述药物组合物、片剂、胶囊的溶出度为在60分钟内至少75%。实施例146.根据实施例136所述的药物组合物、实施例137所述的片剂或实施例138胶囊所述的胶囊,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,所述药物组合物、片剂、胶囊的溶出度为在60分钟内至少90%。实施例147.根据实施例136所述的药物组合物、实施例137所述的片剂或实施例138胶囊所述的胶囊,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,所述药物组合物、片剂、胶囊的溶出度为在10分钟内至少70%。实施例148.一种治疗有需要的受试者的癌症的方法,所述方法包括向受试者施用治疗有效量的根据实施例103到135中任一项所述的珠粒、根据实施例136所述的药物组合物、根据实施例137所述的片剂、根据实施例138所述的胶囊或根据实施例139所述的棒状包装或小药囊来治疗癌症。实施例149.根据实施例148所述的方法,其中所述癌症是非小细胞肺癌、黑色素瘤、肾细胞癌、乳腺癌、结肠直肠癌、膀胱癌、前列腺癌或头颈癌。实施例150.根据实施例148或149所述的方法,其中所述腺苷a2a受体拮抗剂的所述治疗有效量为每天约1mg到约1,000mg。实施例151.根据实施例150所述的方法,其中所述腺苷a2a受体拮抗剂的所述治疗有效量为每天约50mg到约600mg。实施例152.根据实施例151所述的方法,其中所述腺苷a2a受体拮抗剂的所述治疗有效量为约50mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg或约600mg。实施例153.一种组合物或其生物等效调配物,所述组合物或其生物等效调配物包括:(i)约20wt%到约30wt%的式(iii)化合物或其药学上可接受的盐,如通过激光衍射光谱法测量的,所述式(iii)化合物或其药学上可接受的盐具有d90为约10微米或更小的粒度分布;(ii)约35wt%到约40wt%的甘露醇;(iii)约15wt%到约30wt%的微晶纤维素;(iv)约4wt%到约12wt%的交联羧甲基纤维素钠;以及(v)约1wt%到约8wt%的羟丙基纤维素。实施例154.根据实施例153所述的组合物,其中所述甘露醇包括重量比为约1∶1到约1∶3的喷雾干燥的甘露醇和结晶甘露醇。实施例155.一种组合物或其生物等效调配物,所述组合物或其生物等效调配物包括:(i)约24wt%到约26wt%的式(iii)化合物或其药学上可接受的盐,如通过激光衍射光谱法测量的,所述式(iii)化合物或其药学上可接受的盐具有d90为约10微米或更小的粒度分布;(ii)约37wt%到约40wt%的甘露醇;(iii)约20wt%到约25wt%的微晶纤维素;(iv)约4wt%到约12wt%的交联羧甲基纤维素钠;以及(v)约2wt%到约6wt%的羟丙基纤维素。实施例156.根据实施例155所述的组合物,其中所述甘露醇包括重量比为约1∶1.5到约1∶2.5的喷雾干燥的甘露醇和结晶甘露醇。实施例157.一种1号药物组合物或其生物等效调配物。实施例158.一种2号药物组合物或其生物等效调配物。实施例159.一种3号药物组合物或其生物等效调配物。实施例160.一种4号药物组合物或其生物等效调配物。实施例161.一种5号药物组合物或其生物等效调配物。实施例162.一种6号药物组合物或其生物等效调配物。实施例163.根据实施例153到162中任一项所述的组合物,其包括约1mg到约1,000mg的所述式(iii)化合物。实施例164.根据实施例163所述的组合物,其包括约50mg到约600mg的所述式(iii)化合物。实施例165.根据实施例164所述的组合物,其包括约100mg到约400mg的所述式(iii)化合物。实施例166.根据实施例163所述的组合物,其包括约50mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg或约600mg的所述式(iii)化合物。实施例167.根据实施例153到166中任一项所述的组合物,如通过《美国药典(usp)》第<701>章的崩解测试方法测量的,其崩解时间为约15分钟或更短。实施例168.根据实施例167所述的组合物,如通过《美国药典(usp)》第<701>章的崩解测试方法测量的,其崩解时间为约10分钟或更短。实施例169.根据实施例153到168中任一项所述的组合物,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,其溶出度为在60分钟内至少75%。实施例170.根据实施例169所述的组合物,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,其溶出度为在60分钟内至少75%。实施例171.根据实施例169所述的组合物,如通过《美国药典(usp)》第<711>章的ii型(桨式)溶出设备方法测量的,其溶出度为在10分钟内至少70%。实施例172.一种片剂,其包括实施例153到171中任一项所述的组合物。实施例173.一种胶囊,其包括根据实施例153到171中任一项所述的组合物。实施例174.一种粉末,其包括根据实施例153到171中任一项所述的组合物。实施例175.一种小药囊或棒状包装,其包括根据实施例153到171中任一项所述的组合物。实施例176.一种治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用治疗有效量的根据实施例153到171中任一项所述的组合物、根据实施例172所述的片剂、根据实施例173所述的胶囊、根据实施例174所述的粉末或根据实施例175所述的小药囊或棒状包装来治疗癌症。实施例177.根据实施例176所述的方法,其中所述癌症是非小细胞肺癌、黑色素瘤、肾细胞癌、乳腺癌、结肠直肠癌、膀胱癌、前列腺癌或头颈癌。实施例178.根据实施例176或177所述的方法,其中所述治疗有效量为每天约1mg到约1,000mg。实施例179.根据实施例178所述的方法,其中所述治疗有效量为每天约50mg到约600mg。实施例48.根据实施例179所述的方法,其中所述治疗有效量为每天约100mg到约400mg。实施例49.根据实施例178所述的方法,其中所述治疗有效量为每天约50mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg或约600mg。实例缩写:api:活性药物成分(式(iii));asd:无定形固体分散体;rh:相对湿度;rt:室温;rrt:相对保留时间(hplc);xrpd:x光粉末衍射;ytz:钇稳定氧化锆。实例1使用具有2英寸直径环的sturtevantsdm喷射式磨机将式(iii)微粉化。工艺参数为:进气压力120psi;研磨室100psi;喷嘴气压80psi;人工费率。微粉化前后的式(iii)的粒度示于表1a。表1ad10d50d90微粉化前2.3微米8.6微米31.1微米微粉化1遍0.9微米3.3微米8.2微米使用具有4英寸直径环的sturtevantsdm喷射式磨机将式(iii)微粉化。工艺参数为:进气压力120psi;研磨室100psi;喷嘴气压80psi;人工费率。微粉化前后的式(iii)的粒度示于表1b。表1bd10d50d90微粉化前2.3微米8.6微米31.1微米微粉化1遍1.1微米4.3微米20.2微米微粉化2遍0.9微米3.1微米8.3微米实例2表2a和表2b所示的1号药物组合物(调配物003a)通过以下过程制备。在喷射式磨机中将式(iii)微粉化,直到通过激光衍射光谱法测量粒度分布为d90为10微米。然后,使用表2b所示的颗粒部分的比例将式(iii)与(i)喷雾干燥的乳糖、(ii)微晶纤维素(mcc102)、(iii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司(fmccorporation,philadelphia,pa))和(iv)羟丙基纤维素(ef,肯塔基州科温顿的亚什兰公司(ashland,covington,ky)共混。通过美国标准#30筛网(600微米)将共混物过筛,然后再次将共混物混合。将共混物湿法制粒(研钵和研杵;形成20%w/v的颗粒),然后在60℃下干燥,并且然后通过美国标准#30筛网过筛。然后使用表2b中的颗粒外部分的合适的比例将颗粒剂与(i)微晶纤维素(mcc102)、(ii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)和(iii)硬脂酰醇富马酸钠共混以形成1号药物组合物,然后用单级卡弗(carver)压片机(圆凹0.3150″直径(8mm),8kp硬度)压制。表2a-1号药物细合物组分功能mg/片wt%式(iii)活性成分2514.7乳糖填料7544.1微晶纤维素填料5331.2羧甲基纤维素钠崩解剂105.9羟丙基纤维素粘合剂52.9硬脂酰醇富马酸钠滑润剂21.2表2b-1号药物组合物实例3表3a和表3b所示的2号药物组合物(调配物003b)通过以下过程制备。在喷射式磨机中将式(iii)微粉化,直到通过激光衍射光谱法测量粒度分布为d90为10微米。然后,使用表3b中的颗粒部分的比例将式(iii)与(i)喷雾干燥的乳糖、(ii)微晶纤维素(mcc102)、(iii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)、(iv)多库酯钠颗粒和(v)羟丙基纤维素(ef,肯塔基州科温顿的亚什兰公司)共混。通过美国标准#30筛网(600微米)将共混物过筛,然后再次将共混物混合。将共混物湿法制粒(研钵和研杵;形成20%w/v的颗粒),然后在60℃下干燥,并且然后通过美国标准#30筛网过筛。然后,使用表3b所示的颗粒外部分的合适的比例将颗粒剂与(i)微晶纤维素(mcc102)、(ii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)和(iii)硬脂酰醇富马酸钠共混以形成2号药物组合物,然后用单级卡弗压榨机(圆凹0.3150”直径(8mm),8kp硬度)压制。表3a-2号药物细合物表3b-2号药物组合物实例4表4a和表4b所示的3号药物组合物(调配物003c)通过以下过程制备。在喷射式磨机中将式(iii)微粉化,直到通过激光衍射光谱法测量粒度分布为d90为10微米。然后,使用表4b所示的颗粒部分的比例将式(iii)与(i)甘露醇(parteckm100)、(ii)1泊洛沙姆f68、(iii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)和(iv)羟丙基纤维素(ef,肯塔基州科温顿的亚什兰公司)共混。通过美国标准#30筛网(600微米)将共混物过筛,然后再次将共混物混合。将共混物湿法制粒(研钵和研杵;形成20%w/v的颗粒),然后在60℃下干燥,并且然后通过美国标准#30筛网过筛。然后,使用表4b所示的颗粒外部分的合适的比例将颗粒剂与(i)微晶纤维素(mcc102)、(ii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)和(iii)硬脂酰醇富马酸钠共混以形成3号药物组合物,然后用单级卡弗压榨机(圆凹0.3150”直径(8mm),8kp硬度)压制。表4a-3号药物细合物组分功能mg/片wt%式(iii)活性成分2514.7甘露醇(parteckm100)填料8047.1泊洛沙姆f68填料158.8羧甲基纤维素钠崩解剂105.9羟丙基纤维素粘合剂52.9微晶纤维素(mcc102)填料3319.4硬脂酰醇富马酸钠滑润剂21.2表4b-3号药物组合物实例5也对1-3号药物组合物进行了《美国药典(usp)》第<701>章的溶出度测试,其中将组合物于900ml约37℃的0.1nhcl溶出介质中置于桨速度为50rpm的usp设备2中。结果示于表2中。从结果中可以看出,1号组合物和2号组合物显示出在10分钟内至少80%的溶出,而3号组合物显示出在30分钟后约80%的溶出。实例6在40℃和75%相对湿度的加速稳定性条件下测试了1-3号药物组合物的储存稳定性,并使用hplc-uv对其进行了监测。稳定时间点为2周闭盖和开盖条件,以及4周闭盖条件。将组合物储存在45cc的瓶子里,没有干燥剂。稳定条件下的杂质的量示于表6a-6c中。表6a:1号药物组合物式(iii)初始打开2周密闭2周密闭4周测定,lc%--99.598.799.2101.1总杂质(%)0.80%0.83%0.52%0.45%1.18%表6b:2号药物组合物式(iii)初始打开2周密闭2周密闭4周测定,lc%--106.3104.8104.9107.2总杂质(%)0.80%0.65%0.88%0.88%1.21%表6c:3号药物组合物式(iii)初始打开2周密闭2周密闭4周测定,lc%--105.4101.2101.6104.8总杂质(%)0.80%0.75%0.75%0.56%1.14%还对1-3号药物组合物进行了美国药典(usp)第<711>章的溶出度测试,其中将所述组合物于900ml约37℃的0.1nhcl溶出介质中置于桨速度为50rpm的usp设备2中。1-3号药物组合物的结果分别示于图3a-3c中。实例7表2a和表2b中所示的1号药物组合物是通过稍微改进的方法(生产调配物029c)制备的,如下所述。在喷射式磨机中将式(iii)微粉化,直到通过激光衍射光谱法测量粒度分布为d90为10微米。然后,使用表2b所示的颗粒部分的比例将式(iii)与(i)喷雾干燥的乳糖、(ii)微晶纤维素(mcc102)、(iii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)和(iv)羟丙基纤维素(ef,宾夕法尼亚州费城的fmc公司)共混。通过美国标准#30筛网(600微米)将共混物过筛,然后再次将共混物混合。将共混物用2升kitchenaid混合机制粒(速度4,最大10速度),在50℃下干燥一小时,并且然后通过美国标准#30筛网过筛。然后使用表2b所示的颗粒外部分的合适的比例将颗粒剂与(i)微晶纤维素(mcc102)、(ii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)和(iii)硬脂酰醇富马酸钠共混以形成1号药物组合物,然后用单级压片机(f-press)(8.00mm直径平圆冲头)压制。10个样品片剂的重量、厚度、硬度和崩解时间示于下表7a。表7a将片剂储存在装有1克干燥剂或无干燥剂的75cchdpe瓶中40℃和75%相对湿度的加速条件(acc)下和25℃和60%相对湿度的受控室温条件(crt)下,并且对其进行监测。结果示于表7b(无干燥剂储存)和表7c(有干燥剂储存)中。在每个时间点和每个储存条件下,通过两种储存条件下的溶出度测试来表征片剂(图4)。按照《美国药典(usp)》第<701>章的溶出度测试进行了溶出度测试,将组合物于900ml约37℃的0.1nhcl溶出介质中置于桨速度为50rpm的usp设备2中。表7b表7c实例8表8a和表8b所示的4号药物组合物通过以下过程制备。在喷射式磨机中将式(iii)微粉化,直到通过激光衍射光谱法测量粒度分布为d90为10微米。然后,将式(iii)过筛,并使用表8b所示的颗粒部分的比例将其与(i)甘露醇(usp)、(ii)微晶纤维素(mcc102)和(iii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)共混以形成共混物。将共混物用溶于水中的羟丙基纤维素(klucelef,ashland,covington,ky)流化床制粒,然后将其干燥。将成粒和经过干燥的共混物在粉碎锤磨机(fitzmill,)中进行研磨以形成颗粒剂。使用表8b所示的颗粒外部分的合适的比例将颗粒剂与(i)微晶纤维素(mcc102)、(ii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)、(iii)胶体二氧化硅和(iv)硬脂酰醇富马酸钠共混以形成4号药物组合物,随后将其压制成片剂,每片片剂用目标量为16mg的白色包衣。表8a-4号药物组合物组分功能mg/片wt%式(iii)活性成分10025.00甘露醇,usp填料15739.25微晶纤维素,nf填料9022.50交联羧甲基纤维素钠,nf崩解剂328.00羟丙基纤维素,nf粘合剂123.00胶体二氧化硅,nf滑润剂41.00硬脂酰醇富马酸钠滑润剂51.25总400100.00表8b-4号药物组合物实例9表9a和表9b中所示的5号药物组合物通过以下过程制备。在喷射式磨机中将式(iii)微粉化,直到通过激光衍射光谱法测量粒度分布为d90为10微米。然后,将式(iii)过筛,然后使用表9b中所示的颗粒部分的比例将其与(i)甘露醇、(ii)微晶纤维素(nf)和(iii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)共混以形成共混物。所述甘露醇包括重量比为约1.9∶1的50c和200sd。用5%w/w的羟丙基纤维素(ef,肯塔基州科温顿的亚什兰公司)水性溶液将共混物流化床制粒,并且然后干燥(由此将水从调配物中除去)。将成粒和经过干燥的共混物在粉碎锤磨机(fitzmill,)中进行研磨以形成颗粒剂。然后使用表9b所示的颗粒外部分的比例将颗粒剂与(i)二氧化硅和(ii)硬脂酰醇富马酸钠共混以形成5号药物组合物。然后,将组合物压制成片剂,并且每片片剂用目标量为12mg的橙色包衣。表9a-5号药物组合物组分功能mg/片wt%式(iii)活性剂10025.00甘露醇填料15338.25微晶纤维素,nf填料9022.50交联羧甲基纤维素钠,nf超级崩解剂328.00羟丙基纤维素,nf粘合剂164.00二氧化硅助流剂(flowaid/glidant)41.00硬脂酰醇富马酸钠滑润剂51.25总400100.00表9b-5号药物组合物将片剂储存在75cchdpe瓶中40℃和75%相对湿度的加速条件(acc)下和25℃和60%相对湿度的受控室温条件(crt)下,并且对其进行监测。结果示于表9c中。在每个时间点和每个储存条件下,通过两种储存条件下的溶出度测试来表征片剂(图5)。按照《美国药典(usp)》第<701>章的溶出度测试进行了溶出度测试,将组合物于900ml约37℃的0.1nhcl溶出介质中置于桨速度为50rpm的usp设备2中。表9c实例10根据《美国药典(usp)》第<701>章的崩解测试方法对5号药物组合物进行了崩解测试:篮-架组合件,1000ml去离子水,30次循环/分钟。所述组合物的崩解时间小于5分钟。使用《美国药典(usp)》第<711>章的ii型(桨式)溶出设备2以50转/分的桨速在900ml的0.1nhcl介质(37℃)中对5号药物组合物进行了溶出度测试。如图1所示,组合物中80%以上的药物在30分钟内溶出。实例11表11a和表11b所示的6号药物组合物通过以下过程制备。在喷射式磨机中将式(iii)微粉化,直到通过激光衍射光谱法测量粒度分布为d90为10微米。然后,将式(iii)过筛,然后使用表11b中所示的颗粒部分的比例将其与(i)甘露醇、(ii)微晶纤维素(nf)和(iii)内部交联的羧甲基纤维素钠(ac-di-宾夕法尼亚州费城的fmc公司)共混以形成共混物。请注意,所述甘露醇包括重量比为约1.94∶1的50c和200sd。用5%w/w的羟丙基纤维素(ef,肯塔基州科温顿的亚什兰公司)水性溶液将共混物流化床制粒,并且然后干燥(由此将水从调配物中除去)。将成粒和经过干燥的共混物在粉碎锤磨机(fitzmill,)中进行研磨以形成颗粒剂。然后使用表11b所示的颗粒外部分的比例将颗粒剂与(i)二氧化硅和(ii)硬脂酰醇富马酸钠共混以形成6号药物组合物。然后将所述组合物压制成片剂,并且每片片剂用目标量为6mg的米色包衣。表11a-6号药物组合物组分功能mg/片wt%式(iii)活性剂5025.00甘露醇填料76.538.25微晶纤维素,nf填料4522.50交联羧甲基纤维素钠,nf超级崩解剂168.00羟丙基纤维素,nf粘合剂84.00二氧化硅助流剂(flowaid/glidant)21.00硬脂酰醇富马酸钠滑润剂2.51.25总400100.00表11b-6号药物组合物实例12珠粒将通过以下过程制备。将通过干磨或湿磨将式(iii)微粉化,直到通过激光衍射光谱法测量粒度分布为d90为10微米。然后,将式(iii)与本文所述的赋形剂一起置于悬浮液中,以形成药物悬浮液。药物/赋形剂悬浮液将被喷洒到惰性核(例如糖球、纤维素球)上,以在惰性核上形成药物层。在一些方面,惰性核将是#30-35糖球(500-600微米)。将任选地使用保护性包衣对珠粒进行包衣。在一些方面,保护性包衣将包含hpc(ef)和滑石。可选择地添加润滑剂以防止珠粒相互粘附。在一些方面,经过包衣的珠粒将被填充到胶囊壳中。在填充到胶囊中之前,可以任选地将另外的赋形剂与珠粒共混。在一些方面,可以将珠粒与其它赋形剂混合并将其压制成片剂。在一些方面,工艺条件如表12所示。表12本文使用的章节标题仅用于组织目的,并且不应被解释为限制所描述的主题。本申请中引用的所有文件或文件的一部分出于任何目的通过引用将其整体并入本文。尽管在此示出并描述了各种实施例和方面,但是对于本领域技术人员来说,显然这些实施例和方面仅作为实例提供。本领域技术人员现在将会想到许多变化、改变和取代。应当理解,可以采用本文描述的实施例的各种替代方案。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1