工艺和疫苗的制作方法
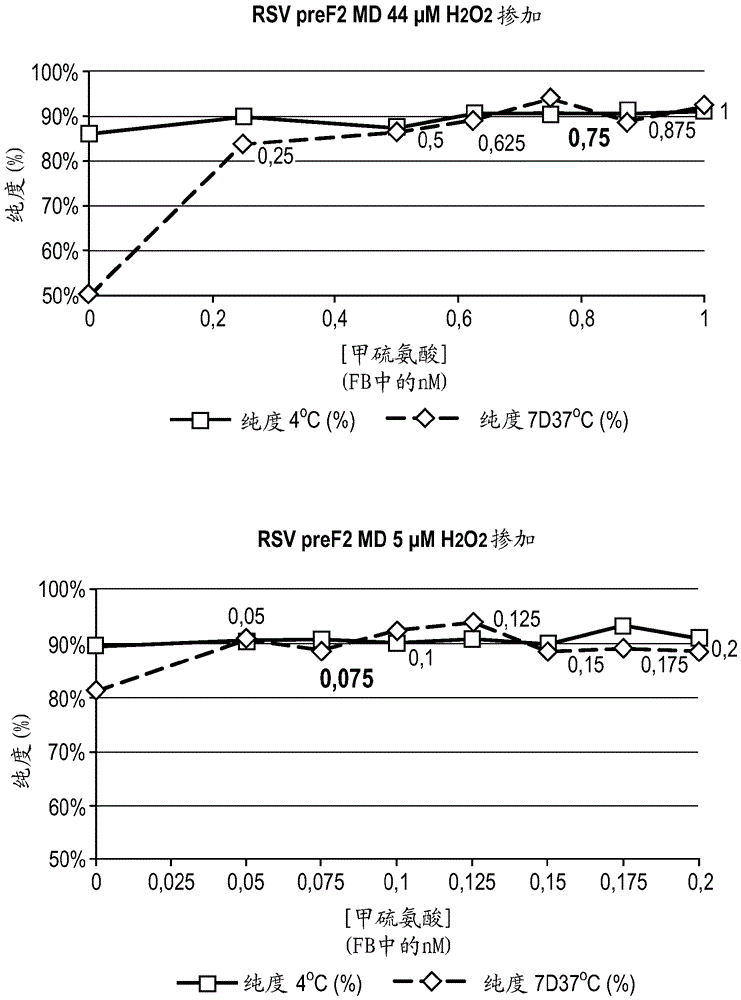
本发明涉及用于制造生物药物的方法,其包括添加抗氧化剂以防止或减少氧化,并且涉及含有抗氧化剂的生物药物,并且涉及相关方面。更具体地,本发明涉及用于制造生物药物的方法,在此期间在制造设备的表面灭菌中使用过氧化氢。发明背景生物药物的稠度和保质期可以在制造工艺期间或在长期储存期间或者从工艺步骤、诸如冷冻、干燥和冷冻干燥或者从这些因素的组合受到氧化的影响。氧化可以由暴露于空气或光或化学品、诸如过氧化氢导致。这尤其适用于多肽,例如疫苗抗原,但是也可能适用于可能易于氧化的任何生物分子,并且此外还适用于载体,诸如重组病毒载体。大多数高反应性氧化剂,包括自由基,可以与生物材料、诸如蛋白、dna、rna、脂质和碳水化合物反应。并非所有氧化都是完全随机的,通常氧化剂的反应性越低,氧化位点的选择性越高。例如,h2o2的反应性与例如自由基相比不是非常高的事实,意味着其在其氧化目标中更有选择性。蛋白和肽可以是生物系统中的氧化剂的目标。它们可以被靶向在蛋白主链(其可以导致主链的片段化)和氨基酸侧链上的氧化。侧链的氧化可以导致构象变化和二聚化或聚集。因此,氧化可以导致蛋白损坏,并且可以对于蛋白的结构和功能具有严重后果。半胱氨酸、甲硫氨酸、色氨酸、组氨酸和酪氨酸的侧链是氧化的主要目标,以该顺序排列(ji等人,2009,参见下文)。硫中心易于氧化,使半胱氨酸和甲硫氨酸残基成为蛋白内的氧化的优选位点。蒸汽过氧化氢(vhp)技术已经使用超过十年,以对药物加工设备和洁净室进行灭菌。vhp是针对许多微生物(包括细菌孢子)有效的强氧化剂,并且显示细菌负荷的显著降低(通过嗜热脂肪土芽孢杆菌(geobacillusstearothermophillus)的最低6-log减少表示)。疫苗和其他含有生物剂的药物产品、尤其是意欲用于注射的生物药物产品的制造在无菌条件下实施。具体而言,最终步骤、诸如配制、填充和冷冻干燥可以涉及容器、诸如含有赋形剂的容器和/或用疫苗制剂或其他药物产品填充的小瓶通过称为隔离体的无菌围隔体的运输,所述隔离体将设备与外部环境分开,同时进行某些操作。为了防止任何不期望的污染,使用vhp技术对隔离体内表面进行定期灭菌。在灭菌步骤后,然后通过应用一个或多个通气循环从隔离体清除vhp。在通气循环期间,清洁空气置换围隔体中的空气,并且任选地通过催化转化器携带它,其在催化转化器中被转化为水和氧气。清洁空气继续更新,直至残留的vhp浓度达到可接受的水平。甲硫氨酸的氧化是许多蛋白药物中的主要降解途径之一,且因此其已被广泛研究。过氧化物(诸如过氧化氢)已广泛用于研究蛋白中的甲硫氨酸氧化的动力学和机理。yin等人2004,pharmaceuticalresearchvol21,no.12,2377-2383描述了使用过氧化氢来查看治疗性蛋白粒细胞集落刺激因子(g-csf)和人甲状旁腺激素(hpth)片段的非位点特异性氧化以及各种抗氧化剂的作用。ji等人2009,jpharmaceuticalsciences,vol98,no12,4485-4500描述了使用甲状旁腺激素pth作为模型蛋白和使用过氧化氢作为氧化剂来筛选防止氧化的稳定剂。lam等人1997,jpharmaceuticalsciences,vol86,no11,1250-1255描述了使用抗氧化剂来防止温度诱导的重组人源化单克隆抗体her2的甲硫氨酸氧化。cheng等人2016,jpharmaceuticalsciences,vol105,1837-1842使用模型蛋白查看过氧化氢(其可以从许多来源(包括vhp)存在)对在冻干期间的蛋白的氧化和聚集的影响。li等人2003us2003/0104996描述了含有在白蛋白不存在的情况下稳定的促红细胞生成素和用抗氧化剂、诸如甲硫氨酸作为稳定剂的制剂。osterberg等人1999us5,962,650描述了具有氨基酸、诸如甲硫氨酸的因子viii的制剂。hubbard等人2018,jpharmaceuticalscienceandtechnology,doi:10.5731/pdajpst.2017.008326“vaporphasehydrogenperoxidesanitizationofanisolatorforasepticfillingofmonoclonalantibodydrugproduct-hydrogenperoxideuptakeandimpactonproteinquality”查看残留vhp对单克隆抗体药物产品的质量的影响,并且提供关于可以控制以降低药物产品摄取过氧化氢的风险的工艺参数的建议。hambly&gross2009,analyticalchemistry,81,7235-7242描述了在当存在h2o2时冷冻干燥后固态的蛋白脱铁卟啉肌红蛋白的氧化。luo&anderson2006和2008,pharmresearch23,2239-2253以及jpharmsciences97,3907-3925研究了冷冻干燥的产品(聚乙烯吡咯烷)中的半胱氨酸氧化,并观察了分子运动和氧化。发明概述我们已经发现,生物药物,尤其是某些免疫原性组合物和疫苗,可能遭受氧化,所述氧化可能进而影响稠度和/或效力和/或保质期。由暴露于空气或制造中使用的试剂或条件(例如,用于对设备进行灭菌的过氧化氢)引起的氧化可能是有责任的。用于冷冻干燥许多疫苗或其他生物药物的冻干过程也可能是有责任的或可能加剧该问题,例如,通过冷冻浓缩药物的组分。此外,已经发现,在疫苗生产中的隔离体单元的灭菌中使用的过氧化氢可能对疫苗产品具有影响。尽管过氧化氢灭菌后用干净空气大量清洗隔离体,但痕量过氧化氢仍存在,并且可以在经过隔离体的小瓶中发现,并且也可以吸附至免疫原性组合物或疫苗产品中。这种残留的过氧化氢可能引起与其接触的生物药物的组分的氧化。因此,提供了制造包含至少一种生物分子或载体的生物药物的方法,所述方法包括以下步骤,所述步骤中的一个或多个在已使用过氧化氢进行表面灭菌的无菌围隔体(asepticenclosure)中进行:(a)将所述生物分子或载体与一种或多种赋形剂(包括抗氧化剂)一起配制,以产生包含抗氧化剂的生物药物;(b)用所述生物药物填充容器;和(c)密封或部分密封所述容器。还提供了通过本文所述的制造方法生产的生物药物。还提供了免疫原性组合物或疫苗,其包含至少一种抗原或编码至少一种抗原的载体,所述抗原或载体与一种或多种赋形剂(包括甲硫氨酸)一起配制。进一步提供了免疫原性组合物或疫苗,其包含至少一种抗原或编码至少一种抗原的载体,所述抗原或载体与一种或多种赋形剂(包括抗氧化剂)一起配制,其中所述免疫原性组合物是冷冻干燥的。附图简述图1a和图1b:在不同的储存条件下且在有和没有抗氧化剂的情况下的rsvpref的rp-hplc色谱图。图1a是对于0µm掺加、在4℃储存和在37℃14天(14d37℃,通篇使用该约定)获得的,其显示,这些储存条件在未暴露于过氧化氢的样品中不引起概况改变。图1b是对于0µm掺加、13.4µm掺加、26.8µm掺加、83.8µm掺加、167.6µm掺加和1676µm掺加、在7d4℃下储存后的fclyo获得的,其显示概况改变,这取决于过氧化氢的掺加浓度。在y-轴的垂直顺序(上至下)为:1676;167.6;83.8;26.8;13.4;和0。图2:在不同抗氧化剂存在和不存在的情况下,掺加后液体和冻干rsvpref制剂中的h2o2浓度的演变。在每个系列中,条代表(左至右)掺加;掺加后4小时;冻干(冻干饼再水化后校正以考虑1.25倍稀释因子)4℃。图3:用h2o2掺加后的模型蛋白(物质p)氧化比率,在每个系列中,条代表(左至右)0;27;和168µm掺加。图4:用h2o2掺加后的rsvpref的氧化比率,在每个系列中,条代表(左至右)0和27µm掺加。图5:rp-hplc色谱图,其显示n-乙酰半胱氨酸对用h2o2掺加的rsvpref的影响,氧化的杂质在“无氧化剂”中最突出(灰色线)。图6:rp-hplc色谱图,其显示谷胱甘肽对用h2o2掺加的rsvpref的影响,“无氧化剂”(灰色线)。图7:rp-hplc色谱图,其显示l-半胱氨酸对用h2o2掺加的rsvpref的影响,“无氧化剂”(灰色线)。图8:rp-hplc色谱图,其显示抗坏血酸对用h2o2掺加的rsvpref的影响,“无氧化剂”(灰色线)。图9a和图9b:rp-hplc色谱图,其显示l-甲硫氨酸对用h2o2掺加的rsvpref的影响,“无氧化剂”(灰色线)。图10:对于先前测试的各种抗氧化剂,在先前的图中给出作为色谱图中主峰积分面积与所有峰面积的比率的rsvpref的纯度的分析。在每个系列中(左至右):0和27µm掺加。图11:通过rp-hplc分析的含有rsvpref的样品的sds-page-还原条件。图12:通过rp-hplc分析的含有rsvpref的样品的sds-page–非还原条件。图13:在5µm掺加的情况下,甲硫氨酸添加对含有rsvpref的冻干组合物中的h2o2含量的影响的图形表示。图14:在44µm掺加的情况下,甲硫氨酸添加对含有rsvpref的冻干组合物中的h2o2含量的影响的图形表示。图15:色谱图,其显示实施例2中使用的rsvpref的通过rp-hplc的纯度,以给出基础氧化水平。图16:在递增浓度的甲硫氨酸存在的情况下和h2o2掺加后,在4℃和7d37℃下储存的冻干组合物中的rsvpref纯度的演变。图17:在rsvpref的h2o2掺加后,met343ox比率相对于甲硫氨酸浓度的演变。图18:数学预测的含有rsvpref的组合物中met343ox比率相对于递增甲硫氨酸浓度的演变。图19:蛋白d、met192随时间氧化的质谱结果。图20:氧化蛋白d的rp-hplc色谱图。图21:在非还原条件下通过sds-page获得的蛋白d、uspa2和pe-pila的抗原概况。图22:在有或没有甲硫氨酸或半胱氨酸的情况下蛋白d、met192随时间氧化的质谱结果。图23:在有或没有甲硫氨酸或半胱氨酸的情况下的氧化蛋白d的rp-hplc色谱图。图24:h2o2掺加后和在有或没有甲硫氨酸或半胱氨酸的情况下,在非还原条件下通过sds-page获得的蛋白d的抗原概况。图25:在有和没有h2o2和5mm甲硫氨酸的情况下,含有蛋白d、pepila和uspa2的组合物的疏水性变体hplc。图26:在有h2o2和10mm甲硫氨酸的情况下,含有蛋白d、pepila和uspa2的组合物的疏水性变体hplc,其显示蛋白d峰。图27:在含有蛋白d、pepila和uspa2的组合物中的蛋白d的疏水性变体rp-hplc%峰3;在左小图中,没有抗氧化剂的非h2o2氧化样品;在右小图中,具有不同浓度的甲硫氨酸的h2o2氧化样品。图28:对于含有蛋白d、pepila和uspa2、h2o2氧化的样品与不同浓度的甲硫氨酸的组合物中的蛋白d的疏水性变体rp-hplc%峰3。图29:从rp-hplc,峰1、2和3的面积总和。图30:在37℃下1个月后以%计的蛋白dm192氧化的液相色谱联用质谱。左小图没有h2o2,右小图在冷冻干燥前具有1300ngh2o2/ml,其有或没有甲硫氨酸。图31:如图30,蛋白dm192氧化的液相色谱联用质谱,其在左侧显示没有h2o2或甲硫氨酸的样品,并且在右侧显示含有甲硫氨酸加上在冷冻干燥前添加的1300ngh2o2/ml的样品。图32:通过facs分析的腺病毒感染性,用不同浓度的h2o2掺加的载体。图33:通过picogreen测定的腺病毒完整性(dna释放),用不同浓度的h2o2掺加的载体。图34:通过facs分析的腺病毒感染性,具有不同浓度存在的甲硫氨酸的用h2o2掺加的载体。图35:通过picogreen测定的腺病毒完整性(dna释放),具有以不同浓度存在的甲硫氨酸的用h2o2掺加的载体。图36:在有和没有h2o2以及有递增浓度的甲硫氨酸的情况下,通过lc-ms测量的腺病毒六邻体甲硫氨酸氧化。序列标识符的描述seqidno:1代表如本文的实施例中所用的rsvpref抗原的构象约束的rsvpref抗原多肽序列。seqidno:2seqidno:1的pref序列的一部分,其显示甲硫氨酸的编号。seqidno:3另外的rsvpref序列。seqidno:4另外的rsvpref序列。seqidno:5另外的rsvpref序列。seqidno:6可以用作三聚化序列(例如如seqidno:1、4和5中)的示例性卷曲-螺旋(异亮氨酸拉链)序列。seqidno:7由seqidno:3中所示的前体序列产生的成熟多肽的f1链。seqidno:8由seqidno:3中所示的前体序列产生的成熟多肽的f2链。seqidno:9物质p(实施例中使用的模型肽)。seqidno:10流感嗜血杆菌蛋白d序列。seqidno:11蛋白d的变体。seqidno:12蛋白d片段。seqidno:13流感嗜血杆菌蛋白e片段。seqidno:14蛋白e片段。seqidno:15流感嗜血杆菌pila序列。seqidno:16pila片段。seqidno:17pe-pila融合蛋白。seqidno:18减去信号肽的pe-pila融合蛋白。seqidno:19卡他莫拉氏菌uspa2蛋白。seqidno:20uspa2的片段。seqidno:21chad155腺病毒六邻体蛋白ii主要衣壳蛋白。详述我们已经发现,残留的h2o2扩散至在用过氧化氢灭菌的商业配制/填充/转移隔离体中配制和填充的免疫原性组合物和疫苗中,尤其是在已经使用蒸气过氧化氢(vhp)技术对隔离体进行灭菌的情况下。我们已经发现这些痕量可以引起蛋白氧化,尤其是蛋白上的甲硫氨酸残基的氧化。我们已经通过质谱显示,rsvpref已经自然地容易被空气氧化,氧化还与冷冻干燥工艺相关(导致示例性pref蛋白中的met343ox(即氧化的甲硫氨酸343)的水平增加最高达2倍),以及涉及将定义量的液态过氧化氢引入制剂的h2o2掺加(经设计以模拟残留vhp)进一步增加氧化水平(导致相同pref中的met343ox水平增加最高达10倍)。此外,我们已经显示,其他生物药物也类似于易于氧化。额外的实例是通过甲硫氨酸192氧化(其中甲硫氨酸192对应于seqidno.14中的甲硫氨酸192)测量的含有蛋白d、pepila和uspa2的组合物中来自无法分型的流感嗜血杆菌(nthi)的蛋白d和通过六邻体蛋白上的甲硫氨酸(五个甲硫氨酸,被命名为met270、299、383、468和512,其对应于seqidno.21中的来自chad155六邻体蛋白ii主要衣壳蛋白的甲硫氨酸270、299、383、468和512)的氧化和通过测量活病毒载体的完整性和感染性的技术测量的活腺病毒载体。无菌围隔体和隔离体技术医药产品(包括生物药物)的药物制造在无菌环境中进行。这可以采用无菌围隔体、诸如洁净室或洁净室内的工作站(其具有在围隔体和周围空间之间提供分隔、限制工作站和洁净室之间的接触的屏障(有时称为限制进入屏障系统或rabs))或隔离体的形式。如本文所述的无菌围隔体可以是提供没有或基本上没有污染(例如,有害细菌、病毒或其他微生物的污染)的微生物受控环境的任何围隔体。无菌围隔体为生产标记为无菌的医药产品的无菌处理提供了微生物受控环境。在本上下文中,术语“隔离体”通常涉及已被开发为更可靠地控制环境的无菌围隔体使用。洁净室内可能存在隔离体。隔离体是通常具有单个腔室的单元,其提供受控环境,所述受控环境在一个或多个设备部件和/或一个或多个工艺周围维持屏障或围隔,使得可以维持无菌环境一定时间段或同时在隔离体内实施工艺或一系列工艺。因此,隔离体提供了其内部与外部环境的分隔,所述外部环境可以是例如周围的洁净室和人员。隔离体有时被称为封闭或开放系统。封闭系统在整个操作中保持密封。开放隔离体系统被设计为允许材料在操作期间通过一个或多个开口连续或半连续运输进出系统。工程改造开口(例如在隔离体内使用连续的正压)以排除外部污染物进入隔离体腔室。可以提供手套端口,以使操作员在隔离体内部进行工艺步骤,同时仍维持与外界的屏障,且因此无需与内部设备和制造中的产品直接接触。在一个实施方案中,所述无菌围隔体是洁净室,其能够根据用于无菌产品制造的欧盟良好生产规范指南提供b级内部环境。在一个进一步实施方案中,所述无菌围隔体是在洁净室内的工作站,所述工作站能够根据用于无菌产品制造的欧盟良好生产规范指南提供a级内部环境。在另一个实施方案中,所述无菌围隔体是隔离体,所述隔离体能够根据用于无菌产品制造的欧盟良好生产规范指南提供a级内部环境。药物生产的无菌操作的受控环境主要由含有a级的工作站的b级的常规洁净室提供,其符合pic/s(药品检验合作计划)和ecgmp(良好生产规范)指南。较少数的受控环境由含有提供a级环境的隔离体的d级或更好的清洁室提供。气闸可用于将材料引入隔离体。在将容器引入隔离体之前,可以在气闸内实施灭菌以对其中存在材料的容器的表面进行灭菌。无菌围隔体(诸如隔离体)可用于在生产生物药物期间进行各种操作。一种这种操作是填充产品的小瓶,其中将小瓶用药物填充并用塞子塞住或部分用塞子塞住,以准备用于最终步骤、诸如冻干。另一种这种操作是简单转移至另一设备部件,例如将部分用塞子塞住的小瓶转移至冻干机,在所述冻干机中将药物冷冻干燥。对于疫苗生产,在无菌围隔体(诸如隔离体)内进行的操作可以包括,例如,将一种或多种疫苗抗原与额外抗原或与载体偶联以产生缀合的疫苗,将疫苗抗原与赋形剂一起配制,用散装最终疫苗制剂填充容器,或用一个或多个疫苗剂量填充个别小瓶,并将填充的小瓶运输至进一步的步骤,诸如冻干(冷冻干燥)。将理解的是,与本文的描述相关的操作不受限制,并且可以是在生物药物的生产中进行的任何操作或操作的组合,所述生物药物的生产在无菌环境中进行,所述无菌环境可能含有来自过氧化氢灭菌工艺的残留h2o2。无菌围隔体需要定期去污染,例如在对不同材料进行的操作之间,以确保用于在围隔体中进行下一操作的无菌条件。药物生产中常用的去污剂是过氧化氢,并且这可以以各种形式使用。蒸气或汽化的过氧化氢(vhp)在一个实施方案中,本文所述的工艺中的过氧化氢以气态过氧化氢的形式使用,所述气态过氧化氢是蒸气形式的过氧化氢。这与气溶胶过氧化氢不同,所述气溶胶过氧化氢呈过氧化氢于水中的小滴的形式,经常称为干雾。为了达到所需的去污染水平,采用定义的浓度和暴露于vhp的时间。如全球安全标准所要求,用于无菌围隔体的灭菌的vhp水平通常以ppmv/v(百万分之一)或mg/m3表示。vhp被评级为对人有害,且因此许多国家已施加职业暴露限值。工人可以暴露的过氧化氢的最大量可能根据在国家间不同的规定而不同,或者可以在国家间以不同的术语表示。例如,在比利时,8-小时工作班次平均的允许暴露限值为1.0ppmv/v或1.4mg/m3,而在英国,15分钟的限值为2.0ppmv/v。在使用vhp的灭菌周期结束时,房间或围隔体用新鲜空气通气,并且在允许工作人员进入房间之前或可以将另外的材料引入隔离体以用于另一生产阶段之前,必需进行空气分析。过氧化氢的浓度必须降低至非危险水平,通常小于1ppmv/v或更低,例如,0.1ppmv/v,或0.1和1.0ppmv/v之间。过氧化氢完全溶于水。vhp通过主动汽化h2o2和水的水溶液来生产,并且可以通过专门为此目的设计的发生器来生产。合适的发生器包括汽化板。用于生产vhp的h2o2溶液的浓度通常可以在20-70%之间或在30-50%之间,或更具体地在30-35%之间,例如约35%w/w。所述发生器通过使过氧化氢水溶液通过汽化器来产生vhp,且然后使蒸汽在程序化的空气浓度下循环,通常为140ppm至1400ppm(75ppm的浓度被认为在人中“对生命或健康直接危害”),这取决于使用无菌围隔体的目的。在发生器内,空气/h2o2/h2o混合物的温度足够高,使其处于气态。气体从发生器携带进入隔离体围隔体,以对其表面进行灭菌并使其无菌。vhp在密闭空间中已循环预定的时间段后,其例如通过经由发生器循环回去而去除,其中其可以通过催化转化器分解为水和氧气。或者,可以将vhp排至外部。围隔体中的vhp水平通常通过通风而降低,直至vhp的浓度降至安全水平,例如特定国家(诸如比利时或英国)中的安全标准所需的水平。或者可以将其降低至对于特定目的所需的较低水平,其可以根据生产中的生物药物而不同。在一个实施方案中,在灭菌之后,降低围隔体中的vhp水平,直至其达到小于或等于1ppmv/v,或小于或等于0.5ppmv/v,或小于或等于0.1ppmv/v,或0.05ppmv/v和1.0ppmv/v之间,或0.1ppmv/v和1.0ppmv/v之间。例如,可以通过使用由设备提供的定义的工作设定点,实现围隔体(诸如隔离体)中的目标降低的vhp水平。在一个实施方案中,对于vhp,所述隔离体具有在0.1和1.0ppmv/v之间的工作设定点,意味着一旦vhp在低于或等于在0.1至1.0ppmv/vvhp的范围内的设定点的水平,就可以使用所述隔离体。在另一个实施方案中,所述隔离体具有1.0ppmv/vvhp的工作设定点,意味着一旦vhp在1.0ppmv/vvhp或以下的水平,就可以使用所述隔离体。在一个实施方案中,通过视觉比色管、诸如draeger管的方式来测量围隔体中的残留vhp水平。使用vhp的典型灭菌周期可以由以下阶段组成:阶段1-预调节:在预调节阶段(设置溶液,准备蒸发板,任选地调节湿度)期间在系统中创建表面灭菌的必要开始条件。阶段2–调节:在围隔体中生成实现期望的去污效果所需的气态h2o2的剂量。阶段3–灭菌:经定义的时间引入应用剂量的vhp。阶段4–通气:达到围隔体中所需的残留h2o2浓度(ppmv/v)。在灭菌(阶段3)后,实施通气(阶段4)以从隔离体除去或消除vhp。通气阶段后允许的残留vhp的最大浓度通常为1ppm,如通过目视比色管(draeger管)所测量。vhp浓度继续降低,而围隔体的加热、通风和空气调节继续。气溶胶过氧化氢(ahp)在另一个实施方案中,过氧化氢以气溶胶(也称为干雾)(其由水中的过氧化氢溶液的小滴组成)的形式使用。通过将h2o2溶液经由喷嘴喷入围隔体,可以将ahp引入围隔体。ahp是比vhp更老的技术,但是显然,这种和其他过氧化氢灭菌技术也可以用于本文所述的工艺中。测量残留的过氧化氢为了理解由于在处理期间使用h2o2而在本文所述的产品或药物制剂中存在的残留h2o2的量,可以进行模拟生产工艺。可以在用于工艺的设备上模拟最坏情况的生产工艺,其中用水或代表性的安慰剂溶液替换产品。在h2o2摄取的方面,生产工艺在最不利的条件(即在高残留h2o2浓度下且持续长处理时间)进行。随后,例如使用辣根过氧化物酶amplexred测定法测定产物(水或安慰剂)中h2o2的量。然后,在通过这种方法的产物中发现的h2o2的量可以用作h2o2掺加实验(其中将h2o2以定义的浓度添加至产物中)的基础,以评价产物对氧化的敏感性。替代地或另外地,由于过氧化氢(例如灭菌周期中采用和来自与其接触的设备的vhp或ahp)而在药物制剂中可能存在的潜在的残留h2o2可以根据最坏的情况数学计算。实际上,如果已经进行初步实验以数学定量和描述对药物制剂中的最终h2o2含量的不同贡献,则这些数学算法可用于估算产物中的h2o2量。来自vhp工艺的残留h2o2最初以蒸气形式存在于围隔体中,并扩散至药物制剂中,在那里存在与制剂的空气接触,并且一旦被吸收,它就变成h2o2溶液。残留的h2o2也可以以液体形式存在于药物生产中使用的材料和设备上,并且从此处可以经由当空气在围隔体中循环时的气态或通过直接接触转移至制剂中。例如,已知一些材料、诸如硅对于h2o2是多孔的。初步实验和所得的数学计算应当考虑可变因素,诸如容器在围隔体中的停留时间,设备的组分材料,所暴露制剂的表面积,填充体积,气相中残留的h2o2量,小瓶的用塞子塞住或部分用塞子塞住。可以针对这些对药物制剂中的最终h2o2量的贡献开发数学算法,以提供对于各种制剂和工艺进行计算的基础。参见例如vuylsteke等人2019,j.pharmaceuticalsciences,1-7:“thediffusionofhydrogenperoxideintotheliquidproductduringfillingoperationsinsidevaporoushydrogenperoxidesterilizedisolatorscanbepredictedbyamechanisticmodel”。抗氧化剂用于本文所述的工艺或组合物中的抗氧化剂是药学上可接受的试剂,其可以添加至制剂中,以防止或减少所述工艺或组合物中的生物分子或生物载体的氧化。在一个实施方案中,所述抗氧化剂防止或减少多肽、诸如疫苗抗原的氧化。多肽、诸如疫苗抗原上的甲硫氨酸残基可能易于氧化,例如由于过氧化氢的存在导致的氧化,或通过与环境空气接触或在工艺、诸如冻干期间简单地氧化。过氧化氢可能已经从生物药物的生产中使用的设备的灭菌留下(残留的过氧化氢),并且已吸附或扩散至制剂中。所述制剂可以例如在工艺、诸如冻干(其中将制剂冷冻干燥以产生固体产物(冻干饼))期间与空气接触和/或更易于氧化。在一个实施方案中,所述抗氧化剂减少多肽上的甲硫氨酸基团的氧化。在一个具体实施方案中,所述抗氧化剂将甲硫氨酸基团的氧化降低至不超过在过氧化氢不存在的情况下的氧化的水平。在本文所述的实施方案中,可以通过本领域中已知的方法,诸如本文在实施例中所述的那些,观察或测量多肽的氧化。可以例如通过质谱、rp-hplc和sds-page的方式观察或测量蛋白的氧化。在一个实施方案中,这三种方法中的两种用于观察或测量氧化的水平,例如质谱法和rp-hplc。在另一个实施方案中,使用所有三种方法。在本文所述的进一步实施方案中,可以例如通过质谱法观察或测量病毒载体的表面上的蛋白的氧化。用于工艺和组合物(诸如本文所述的免疫原性组合物)中的药学上可接受的抗氧化剂的实例,包括含有硫醇的赋形剂,诸如n-乙酰基半胱氨酸、l-半胱氨酸、谷胱甘肽、单硫代甘油;l-甲硫氨酸或d-甲硫氨酸的形式的含有硫醚的赋形剂,诸如甲硫氨酸;和抗坏血酸。氨基酸抗氧化剂、诸如甲硫氨酸包括甲硫氨酸或其他一种或多种氨基酸的单体或二聚体或三聚体或另外的多聚体形式。多聚体氨基酸可以总共含有例如最多达三个或四个或五个或六个或七个或八个氨基酸,其可以是全部相同的,例如全部是甲硫氨酸或全部是半胱氨酸,或者可以是氨基酸包括例如至少一种甲硫氨酸或半胱氨酸的混合物,或主要例如甲硫氨酸或半胱氨酸,或主要甲硫氨酸和半胱氨酸的混合物。包括甲硫氨酸或半胱氨酸的短肽或甲硫氨酸的混合物的短肽。此类氨基酸抗氧化剂是用于防止或减少多肽的氧化的目的的添加剂。在某些制剂中,甲硫氨酸作为抗氧化剂特别有效。在某些制剂中,甲硫氨酸作为抗氧化剂更有效,因为其并不不利地影响抗原的纯度,如通过rp-hplc或lc-ms所测量。在一个实施方案中,所述抗氧化剂是l-甲硫氨酸。在一个实施方案中,所述抗氧化剂是这样的抗氧化剂,其针对生物分子或载体的氧化进行保护,而不会不利地影响生物分子或载体的纯度,例如其不产生可通过rp-hplc和/或lc-ms检测到的分解产物。在一个实施方案中,所述抗氧化剂是这样的抗氧化剂,其针对活载体、诸如病毒载体、例如腺病毒载体、诸如chad155或chad157的氧化进行保护,如通过载体感染性和/或完整性所显示或测量。在一个具体实施方案中,所述抗氧化剂针对载体的氧化或氧化对载体的完整性或感染性的影响进行保护,例如通过测量由载体引入宿主细胞的转基因的表达的facs分析和/或通过测量从载体的dna释放的dna定量测定、例如picogreen测定所观察或测量。在一个实施方案中,所述抗氧化剂以0.05mm至50mm、或0.1至20mm或0.1至15mm或0.5至15mm或0.5至12mm、例如约10mm或约5mm或0.1mm至10mm、或0.1至5mm或0.5mm至5mm或约1mm的浓度存在于最终液体制剂中。最终的液体制剂是指准备使用的液体制剂(因此含有所有所需组分),或准备冷冻干燥、随后在使用前用水溶液重构的液体制剂(在这种情况下,可以在重构期间添加额外组分、诸如佐剂)。不排除最终液体制剂可以在施用前与一种或多种另外的制剂组合。在一个实施方案中,所述抗氧化剂以最高达20mm的浓度存在于最终液体制剂中,或以最高达15mm或最高达12mm或最高达10mm或最高达8mm或最高达7mm或最高达6mm或最高达5mm的浓度存在于最终液体制剂中。在一个实施方案中,所述抗氧化剂以0.1mm或以上或0.5mm或以上的浓度存在。在一个实施方案中,所述抗氧化剂是天然存在的氨基酸或天然存在的抗氧化剂。在一个具体实施方案中,所述氨基酸或天然存在的抗氧化剂是天然存在的氨基酸或天然存在的抗氧化剂,其选自l-甲硫氨酸、l-半胱氨酸和谷胱甘肽。在另一个实施方案中,所述抗氧化剂是l-甲硫氨酸或l-半胱氨酸。在一个实施方案中,所述抗氧化剂是甲硫氨酸(例如l-甲硫氨酸)。在一个具体实施方案中,所述抗氧化剂是甲硫氨酸(例如l-甲硫氨酸),其以0.05mm至50mm、或0.1至20mm或0.1至15mm或0.5至15mm或0.5至12mm、例如约10mm或约5mm、或0.1mm至10mm或0.1至5mm或0.5mm至5mm或约1mm的浓度存在于最终液体制剂中。在一个实施方案中,甲硫氨酸(例如l-甲硫氨酸)以最高达20mm的浓度存在于最终液体制剂中,或以最高达15mm或最高达12mm或最高达10mm或最高达8mm或最高达7mm或最高达6mm或最高达5mm的浓度存在于最终液体制剂中。在一个实施方案中,甲硫氨酸(例如l-甲硫氨酸)以0.1mm或以上或0.5mm或以上的浓度存在。所需的抗氧化剂的量将取决于各种参数。对每种生物分子或载体进行剂量范围研究,以确定在一定范围的剂量的特定抗氧化剂的效力,且由此选择最佳剂量。相关参数包括例如:-将与设备配置、自灭菌和使用设备以来经过的时间相关的残留h2o2的量,h2o2阈值,例如1ppm或不同(这将帮助确定测试抗氧化剂所需的掺加水平)-特定生物分子或载体对通过h2o2或空气/工艺步骤的氧化的敏感性-生物分子或载体的基础氧化的水平-特定生物分子或载体的最大可接受氧化的水平。生物药物所述生物药物是含有生物组分的药物制剂。其可以是任何药物制剂,包括疫苗和免疫原性组合物,其需要在无菌条件下生产,并且具有在生产工艺期间可能易于氧化的生物组分。所述生物组分通常是,但不是必须是,生物药物的活性成分。在一个实施方案中,所述生物药物意欲通过注射施用。在一个实施方案中,本文所述的工艺用于生产无菌可注射制剂,例如用于人中的可注射制剂,诸如用于通过注射施用的免疫原性组合物或疫苗。显然,所述生物药物也可以被称为制剂,并且其可以采取单个容器中的一剂或多剂或散装产品的形式。最终药物可以是液体或固体(例如冻干的),并且可以包含除了抗氧化剂以外的额外药学上可接受的赋形剂。所述药物可以进一步包含佐剂。冻干本文所述的药物和制剂可以呈液体或固体形式。在一个实施方案中,所述生物药物呈液体形式。在另一个实施方案中,所述生物药物呈固体形式,例如可以将其冷冻干燥,例如用于重构用于疫苗施用。冷冻干燥是一种低温脱水工艺,其涉及将制剂冷冻至低于三相点(triplepoint)(材料的固相、液相和气相可以共存的最低温度),降低压力并通过初步干燥步骤中的升华来除去冰和在第二干燥步骤中除去剩余的水。可以任选地在干燥之前使用退火以通过升高和降低温度来增加冰晶的大小。退火通过如下实施:将温度维持高于制剂的玻璃化转变温度(tg’),将其维持特定时间量,然后将其降低至低于tg’。受控成核也可用于增加冰晶的大小,其对基质的作用相同。冻干通常用于疫苗制造中。在一个实施方案中,冻干使用以下步骤实施:-冷冻步骤(低于三相点)-任选地,退火步骤或受控成核步骤-初级干燥步骤-次级干燥步骤。冻干在称为冷冻浓缩的工艺中增加制剂的组分的浓度。本文所述的残留过氧化氢的浓度的所得增加可以引起或加重过氧化氢的有害作用,诸如制剂中的生物组分、例如多肽的氧化。通常将相对于冻干之前的液体制剂来表示或指定本文所述的冻干制剂中的组分、诸如抗氧化剂的浓度(量)。生物分子和载体生物分子包括核酸、蛋白、多肽、肽、碳水化合物、脂质和生物体的任何其他组分或产物,诸如抗体、激素等。这些生物分子可以源自生物来源,在生物来源中合成或从生物来源提取,或者它们可以化学合成以代表生物产物,例如肽。生物分子进一步包括包含来自一种或多种不同病毒的一种或多种多肽的病毒样颗粒,以及细菌孢子。生物载体包括细菌、酵母和病毒载体,诸如慢病毒、逆转录病毒、腺病毒和腺相关病毒。载体可以进一步包括复制子,诸如质粒、噬菌粒、粘粒、杆状病毒、杆粒、细菌人工染色体(bac)、酵母人工染色体(yac)。载体可以是重组载体,其包含与待在宿主细胞中表达的一个或多个重组核苷酸序列可操作连接的一个或多个表达控制序列,其中一个或多个重组核苷酸序列编码一种或多种抗原。对于本领域技术人员显而易见的是,可以对其应用本教导的生物分子和载体是广泛范围的。本文描述的工艺可以潜在地应用于任何生物活性成分,诸如生物分子或载体,由于氧化,特别是由于过氧化氢的存在而导致的氧化,其可以易于降低效力或降低纯度或降低保质期。在一个实施方案中,所述生物分子或载体是抗原。在一个实施方案中,所述抗原是rsv抗原,诸如rsv融合前f。在一个实施方案中,所述抗原来自水痘带状疱疹病毒,诸如ge。在一个实施方案中,所述抗原来自流感嗜血杆菌。在一个具体实施方案中,所述抗原是蛋白d,包括蛋白d的变体,例如seqidno.11。在一个实施方案中,所述抗原是腺病毒载体。在一个具体实施方案中,所述腺病毒载体是黑猩猩腺病毒载体,诸如chad155或chad157,例如chad155-rsv,例如如本文在实施例中所述。主要但非排他地,本发明涉及免疫原性组合物和疫苗。具体而言,本发明涉及用于通过注射施用的药物。在一个实施方案中,所述生物分子或载体源自感染人或动物的微生物。在另一个实施方案中,所述生物分子或载体是源自感染人或动物的微生物的蛋白或糖蛋白抗原。在一个实施方案中,所述生物分子或载体不是抗体或衍生自抗体。在一个实施方案中,所述生物分子或载体不是细胞因子。在一个实施方案中,所述生物分子或载体不是激素。在一个实施方案中,所述生物分子或载体不是人来源的。疫苗和免疫原性组分本文提供的免疫原性组合物包括免疫原性组合物,其包含与一种或多种赋形剂(包括甲硫氨酸)一起配制的至少一种抗原,所述组合物可以冷冻干燥或可以不冷冻干燥。进一步提供了免疫原性组合物,其包含与一种或多种赋形剂(包括抗氧化剂,例如甲硫氨酸)一起配制的至少一种抗原,其中所述免疫原性组合物是冷冻干燥的。在一个实施方案中,甲硫氨酸(例如l-甲硫氨酸)存在于此类免疫原性组合物中,以0.05至50mm或0.1至5mm或约1.0mm存在于液体制剂中。在一个具体实施方案中,甲硫氨酸(例如l-甲硫氨酸)以0.05mm至50mm、或0.1至20mm或0.1至15mm或0.5至15mm或0.5至12mm、例如约10mm或约5mm、或0.1mm至10mm或0.1至5mm或0.5mm至5mm或约1mm的浓度存在于最终液体制剂中。在一个实施方案中,甲硫氨酸(例如l-甲硫氨酸)以最高达20mm的浓度存在于最终液体制剂中,或以最高达15mm或最高达12mm或最高达10mm或最高达8mm或最高达7mm或最高达6mm或最高达5mm的浓度存在于最终液体制剂中。在一个实施方案中,甲硫氨酸(例如l-甲硫氨酸)以0.1mm或以上或0.5mm或以上的浓度存在。在一个实施方案中,所述免疫原性组合物包含如本文所述的rsv融合前f蛋白。在一个实施方案中,所述免疫原性组合物包含来自水痘带状疱疹病毒的抗原,诸如ge。在一个实施方案中,所述免疫原性组合物包含来自流感嗜血杆菌的抗原。在一个具体实施方案中,所述抗原是蛋白d,包括蛋白d的变体,诸如seqidno.11。在一个实施方案中,所述免疫原性组合物包含腺病毒载体。在一个具体实施方案中,所述腺病毒载体是黑猩猩腺病毒载体,诸如chad155或chad157,例如chad155-rsv,例如如本文在实施例中所述。免疫原性组合物是能够在递送至哺乳动物(合适地人)后诱导针对抗原的免疫应答、例如体液(例如,抗体)和/或细胞介导的(例如,细胞毒性的t细胞)应答的组合物。疫苗包括预防性和治疗性疫苗。疫苗包括包含任选地具有佐剂的一种或多种抗原的亚单位疫苗,活疫苗,例如活病毒疫苗,以及通过载体、诸如病毒载体的方式递送的疫苗抗原。本文涉及本发明的“疫苗”或“疫苗组合物”或“疫苗制剂”的实施方案也适用于本发明的涉及“免疫原性组合物”的实施方案,且反之亦然。疫苗和免疫原性组合物可以进一步包含佐剂。如本文所用的“佐剂”是指增强对免疫原的免疫应答的组合物。此类佐剂的实例包括、但不限于:无机佐剂(例如无机金属盐诸如磷酸铝或氢氧化铝)、有机佐剂(例如皂苷,诸如qs21或角鲨烯)、水包油乳剂(例如,mf59或as03,两者均含有角鲨烯,或类似的含有角鲨烯的水包油乳剂),基于皂苷油的佐剂(例如,弗氏完全佐剂和弗氏不完全佐剂)、细胞因子(例如il-1β、il-2、il-7、il-12、il-18、gm-cfs和inf-γ)、微粒佐剂(例如免疫刺激性复合物(iscoms)、脂质体或可生物降解的微球)、病毒体、细菌佐剂(例如单磷酰脂质a,诸如3-脱-o-酰化的单磷酰脂质a(3d-mpl)或胞壁酰基肽)、合成的佐剂(例如非离子的嵌段共聚物、胞壁酰基肽类似物或合成的脂质a)、合成的多核苷酸佐剂(例如聚精氨酸或聚赖氨酸)和含有未甲基化的cpg二核苷酸(“cpg”)的免疫刺激性寡核苷酸。一种合适的佐剂是单磷酰脂质a(mpl),尤其是3-脱-o-酰化的单磷酰脂质a(3d-mpl)。在化学上,它经常作为具有4、5或6个酰化链的3-脱-o-酰化的单磷酰脂质a的混合物供应。它可以通过在gb2122204b中教导的方法纯化和制备,该参考文献也公开了二磷酰脂质a及其3-o-脱酰化变体的制备。已经描述了其他纯化的和合成的脂多糖(美国专利号6,005,099和ep0729473b1;hilgers等人,1986,int.arch.allergy.lmmunol.,79(4):392-6;hilgers等人,1987,immunology,60(1):141-6;和ep0549074b1i)。皂苷也是合适的佐剂(参见lacaille-dubois,m和wagnerh,areviewofthebiologicalandpharmacologicalactivitiesofsaponins.phytomedicine第2卷第363-386页(1996))。例如,皂苷quila(源自南美洲皂树molina的树皮)及其级分描述于美国专利号5,057,540和kensil,crit.rev.ther.drugcarriersyst,1996,12:1-55;和ep0362279b1中。quila的纯化级分也被称为免疫刺激剂,诸如qs21和qs17;它们的生产方法公开在美国专利号5,057,540和ep0362279b1中。在这些参考文献中也描述了qs7(quil-a的非溶血级分)。qs21的使用进一步描述于kensil等人(1991,j.immunology,146:431-437)中。qs21和聚山梨酯或环糊精的组合也是已知的(wo99/10008)。包含quila的级分(诸如qs21和qs7)的微粒佐剂系统描述于wo96/33739和wo96/11711中。另一种佐剂是含有未甲基化的cpg二核苷酸(“cpg”)的免疫刺激性的寡核苷酸(krieg,nature374:546(1995))。cpg是存在于dna中的胞嘧啶-鸟苷二核苷酸基序的缩写。当通过全身和粘膜途径施用时,cpg被称为佐剂(wo96/02555,ep468520,davis等人,j.immunol,1998,160:870-876;mccluskie和davis,j.immunol.,1998,161:4463-6)。当配制在疫苗中时,cpg可以与游离抗原一起在游离溶液中施用(wo96/02555),或共价地缀合至抗原(wo98/16247),或与载体诸如氢氧化铝一起配制(brazolot-millan等人,proc.natl.acad.sci.,usa,1998,95:15553-8)。佐剂诸如上述的那些可以与载体诸如脂质体、水包油乳剂(诸如mf59或as03或含有角鲨烯的水包油乳剂)和/或金属性盐(包括铝盐诸如氢氧化铝)一起配制。例如,可以将3d-mpl与氢氧化铝(ep0689454)或水包油乳剂(wo95/17210)一起配制;可以将qs21与含有胆固醇的脂质体(wo96/33739)、水包油乳剂(wo95/17210)或明矾(wo98/15287)一起配制;可以将cpg与明矾一起(brazolot-millan,同上)或与其他阳离子载体一起配制。可以在本发明中利用佐剂的组合,尤其是单磷酰脂质a和皂苷衍生物的组合(参见,例如,wo94/00153;wo95/17210;wo96/33739;wo98/56414;wo99/12565;wo99/11241),更特别是在wo94/00153中公开的qs21和3d-mpl的组合,或其中将qs21在含有胆固醇的脂质体(dq)中淬灭的组合物(如在wo96/33739中公开的)。或者,cpg+皂苷(诸如qs21)的组合是适合用在本发明中的佐剂。包含在水包油乳剂中的qs21、3d-mpl和生育酚的有效佐剂制剂描述于wo95/17210中,且是用于用在本发明中的另一种制剂。可以将皂苷佐剂配制在脂质体中,并与免疫刺激性的寡核苷酸组合。因此,合适的佐剂系统包括,例如,单磷酰脂质a(优选3d-mpl)与铝盐一起的组合(例如如在wo00/23105中所述)。另一种示例性的佐剂包含qs21和/或mpl和/或cpg。可以将qs21在含有胆固醇的脂质体中淬灭,如在wo96/33739中公开的。as01是含有mpl(3-o-去酰基-4’-单磷酰脂质a)、qs21(皂树molina(quillajasaponariamolina),级分21),antigenics,newyork,ny,usa)和脂质体的佐剂系统。as01b是含有mpl、qs21和脂质体(50μgmpl和50μgqs21)的佐剂系统。as01e是含有mpl、qs21和脂质体(25μgmpl和25μgqs21)的佐剂系统。在一个实施方案中,免疫原性组合物或疫苗包含as01。在另一个实施方案中,免疫原性组合物或疫苗包含as01b或as01e。在一个具体实施方案中,免疫原性组合物或疫苗包含as01e。抗原术语‘抗原’是技术人员众所周知的。抗原可以是能够在人或动物中产生免疫应答的蛋白、多糖、肽、核酸、蛋白-多糖缀合物、分子或半抗原。抗原可以衍生自来自病毒、细菌、寄生虫、原生动物或真菌的分子,与来自病毒、细菌、寄生虫、原生动物或真菌的分子同源,或合成以模拟来自病毒、细菌、寄生虫、原生动物或真菌的分子。在一个替代实施方案中,所述抗原衍生自来自肿瘤细胞或赘生物的分子,与来自肿瘤细胞或赘生物的分子同源或合成以模拟来自肿瘤细胞或赘生物的分子。在一个进一步实施方案中,所述抗原衍生自与过敏、阿尔茨海默氏病、动脉粥样硬化、肥胖症和尼古丁依赖性相关的物质,和与过敏、阿尔茨海默氏病、动脉粥样硬化、肥胖症和尼古丁依赖性相关的物质同源,或合成以模拟与过敏、阿尔茨海默氏病、动脉粥样硬化、肥胖症和尼古丁依赖性相关的物质。所述抗原可以是对氧化敏感的任何抗原,特别是在氧化可能导致效力或纯度或保质期降低的情况下。在一个实施方案中,所述抗原是生物分子,诸如含有易于氧化的氨基酸残基、例如甲硫氨酸残基的多肽。在一个实施方案中,所述抗原是蛋白或糖蛋白。所述抗原可以源自人或非人病原体,包括例如感染人和非人脊椎动物的病毒、细菌、真菌、寄生微生物或多细胞寄生虫,或来自癌细胞或肿瘤细胞。rsv抗原在一个实施方案中,所述抗原是人呼吸道合胞病毒(rsv)多肽抗原。在某些实施方案中,所述多肽抗原是来自rsv的f蛋白多肽抗原,例如构象约束的f多肽抗原。已描述了呈融合前(pref)和融合后(postf)构象的构象约束的f蛋白。此类构象约束的f蛋白通常包含工程改造的rsvf蛋白胞外域。f蛋白胞外域多肽是rsvf蛋白的一部分,其包括rsvf蛋白的细胞外结构域的全部或部分,并且缺乏功能性(例如,通过缺失或取代)跨膜结构域,其可以表达,例如,在细胞培养物中以可溶性(不附着于膜)的形式表达。在融合前构象中构象约束的示例性f蛋白抗原在本领域已经描述并且详细公开于例如美国专利号8,563002(wo2009079796);美国公开专利申请号us2012/0093847(wo2010/149745);us2011/0305727(wo2011/008974);us2014/0141037、wo2012/158613、wo2014/160463(含有pref,被称为ds-cav1)、wo2017/109629和wo2018/109220,其各自通过引用并入本文,用于举例说明融合前f多肽(和核酸)及其产生方法的目的。通常,所述抗原呈多肽的三聚体的形式。提供融合前构象的f蛋白的实例的额外出版物包括:mclellan等人,science,vol.340:1113-1117;mclellan等人,science,vol342:592-598,rigter等人,plosone,vol.8:e71072,和krarup等人nat.commun.6:8143doi:10.1038/ncomms9143,其各自也可以在本文公开的疫苗制剂的背景下使用。例如,在融合前构象中稳定的f蛋白多肽通常包括f蛋白(例如,可溶性f蛋白多肽)的胞外域,其包含至少一个稳定f蛋白的融合前构象的修饰。例如,所述修饰可以选自三聚化结构域的添加(通常至c末端),弗林蛋白酶切割位点中的一个或多个的缺失(在氨基酸~105-109和~133-136),pep27结构域的缺失,疏水结构域(例如,hra和/或hrb)中的亲水性氨基酸的取代或添加。在一个实施方案中,构象约束的pref抗原包含rsvf蛋白多肽的f2结构域(例如氨基酸1-105)和f1结构域(例如氨基酸137-516),其没有间插的弗林蛋白酶切割位点,其中所述多肽进一步包含位于f1结构域的c-末端的异源三聚化结构域。任选地,pref抗原还包含改变糖基化(例如,增加糖基化)的修饰,诸如在对应于rsvf蛋白的氨基酸~500-502的位置处取代一个或多个氨基酸。当存在寡聚化序列时,其优选为三聚化序列。合适的寡聚化序列是本领域中众所周知的,并且包括,例如,酵母gcn4亮氨酸拉链蛋白的卷曲螺旋,来自噬菌体t4纤维蛋白的三聚化序列(“折叠子”),和流感ha的三聚体结构域。另外或可替代地,在融合前构象中构象约束的f多肽可以包括至少两个引入的半胱氨酸残基,其彼此非常接近并形成稳定融合前rsvf多肽的二硫键。例如,两个半胱氨酸可以在彼此的约10å之内。例如,半胱氨酸可以在位置165和296或在位置155和290处引入。示例性pref抗原由seqidno:1代表。已知本文在实施例中描述和根据seqidno:1的pref具有优先氧化的7个甲硫氨酸中的3个(met317、met343、met74)。甲硫氨酸的编号根据seqidno:2,并且包括met317、met343和met74的甲硫氨酸的位置显示于seqidno:2(其为seqidno:1的一部分)中。在这3个甲硫氨酸中,按以下顺序观察到氧化的程度:met317>met343>met74。在本文的实施例中,met343已被选为最简单的一者用于定量,因为在胰蛋白酶消化后,其分布在仅一种肽(imtsk肽)上。在用h2o2掺加的包含该pref的疫苗中,在3个甲硫氨酸氧化比率之间观察到相关性,显示met343vs.met317的氧化比率之间的关系和met343vs.met74的氧化比率之间的关系分别为±3倍和±0.5倍。在本文中可以使用的另外的rsvpref分子具有以下seqidno:3的前体序列。加工的蛋白的f1和f2链如下面的seqidno:7和8中所述。seqidno:3的粗体、加下划线的部分是添加至rsvf胞外域以实现三聚化的噬菌体t4纤维蛋白(“折叠子”)结构域。可以使用的另一种rsvpref序列具有下面的seqidno:4。这可以在wo2010/149745中作为seqidno:6找到。可以使用的另外的rsvpref序列具有下面的seqidno:5。在seqidno:1、4和5中发现的示例性卷曲-螺旋(异亮氨酸拉链)序列在下面作为seqidno:6给出seqidno:7(由seqidno:3中显示的前体序列产生的成熟多肽的f1链)seqidno:8(由seqidno:3中显示的前体序列产生的成熟多肽的f2链)vzv抗原和其他来源的抗原在另一个实施方案中,所述抗原源自疟原虫属物种(诸如恶性疟原虫(plasmodiumfalciparum)),分枝杆菌属物种(诸如结核分枝杆菌(mycobacteriumtuberculosis)(tb)),水痘带状疱疹病毒(vzv),人免疫缺陷病毒(hiv),莫拉氏菌属物种(诸如卡他莫拉氏菌(moraxellacatarrhalis))或无法分型的流感嗜血杆菌(haemophilusinfluenzae)(nthi)。在一个实施方案中,所述抗原源自水痘带状疱疹病毒(vzv)。用于本发明中的vzv抗原可以是任何合适的vzv抗原或其免疫原性衍生物,合适地是纯化的vzv抗原,诸如vzv糖蛋白ge(也称为gp1)或其免疫原性衍生物。在一个实施方案中,所述vzv抗原是vzv糖蛋白ge(也称为gp1)或其免疫原性衍生物。野生型或全长ge蛋白由623个氨基酸组成,所述623个氨基酸包含信号肽、所述蛋白的主要部分、疏水锚定区域(残基546-558)和c-末端尾巴。在一个方面,使用gec-末端截短体(也被称为截短的ge或ge截短体),由此所述截短在羧基末端除去总氨基酸残基的4-20%。在一个进一步方面,所述截短的ge缺乏羧基末端锚定区域(合适地是野生型序列的近似氨基酸547-623)。在ep0405867和其中的参考文献中描述了ge抗原,其无锚衍生物(其也是免疫原性衍生物)及其生产[也参见vafaia.,antibodybindingsitesontruncatedformsofvaricalla-zostervirusgpi(ge)glycoprotein,vaccine199412:1265-9]。ep192902也描述了ge及其生产。haumont等人virusresearch(1996)vol40,p199-204(通过引用完整地并入本文)也描述了截短的ge。在wo2006/094756中描述了适合用于根据本发明的用途的佐剂化的vzvge组合物,即与佐剂组合的羧基末端截短的vzvge,所述佐剂包含qs-21、3d-mpl和脂质体(进一步含有胆固醇)。leroux-roelsi.等人(j.infect.dis.2012,206:1280-1290)报道了评估佐剂化的vzv截短的ge亚单位疫苗的i/ii期临床试验。hiv抗原在另一个实施方案中,所述抗原来自hiv。所述抗原可以是hiv蛋白,诸如hiv包膜蛋白。例如,所述抗原可以是hiv包膜gp120多肽或其免疫原性片段,或者两种或更多种不同hiv包膜gp120多肽抗原或免疫原性片段(例如来自hiv的不同的进化枝或毒株)的组合。其他合适的hiv抗原包括nef、gag和polhiv蛋白及其免疫原性片段。可能存在hiv抗原的组合。流感嗜血杆菌抗原在另一个实施方案中,所述抗原来自无法分型的流感嗜血杆菌抗原,其例如选自:fimbrin蛋白[(us5766608-ohiostateresearchfoundation)]和包含来自其的肽的融合体[例如,lb1(f)肽融合体;us5843464(osu)或wo99/64067];omp26[wo97/01638(cortecs)];p6[ep281673(stateuniversityofnewyork)];tbpa和/或tbpb;hia;hsf;hin47;hif;hmw1;hmw2;hmw3;hmw4;hap;d15(wo94/12641);蛋白d(ep594610);p2;和p5(wo94/26304);蛋白e(wo07/084053)和/或pila(wo05/063802)。所述组合物可以包含卡他莫拉氏菌蛋白抗原,其例如选自:omp106[wo97/41731(antex)&wo96/34960(pmc)];omp21;lbpa和/或lbpb[wo98/55606(pmc)];tbpa和/或tbpb[wo97/13785&wo97/32980(pmc)];copb[helminenme,等人(1993)infect.immun.61:2003-2010];uspa1和/或uspa2[wo93/03761(universityoftexas)];ompcd;hasr(pct/ep99/03824);pilq(pct/ep99/03823);omp85(pct/ep00/01468);lipo06(gb9917977.2);lipo10(gb9918208.1);lipo11(gb9918302.2);lipo18(gb9918038.2);p6(pct/ep99/03038);d15(pct/ep99/03822);ompla1(pct/ep99/06781);hly3(pct/ep99/03257);和ompe。在一个实施方案中,药物或制剂包含无法分型的流感嗜血杆菌(nthi)蛋白抗原和/或卡他莫拉氏菌蛋白抗原。所述组合物可以包含来自流感嗜血杆菌的蛋白d(pd)。蛋白d可以如wo91/18926中所述。所述组合物可以进一步包含来自流感嗜血杆菌的蛋白e(pe)和/或pilina(pila)。蛋白e和pilina可以如wo2012/139225中所述。蛋白e和pilina可以作为融合蛋白呈现;例如,如wo2012/139225中所述的lvl735。例如,所述组合物可以包含三种nthi抗原(pd、pe和pila,其中最后两种组合为pepila融合蛋白)。所述组合物可以进一步包含来自卡他莫拉氏菌的uspa2。uspa2可以如wo2015125118中所述,例如wo2015125118中描述的mc-009((m)(uspa231-564)(hh))。例如,所述组合物可以包含三种nthi抗原(pd、pe和pila,其中最后两种组合为pepila融合蛋白)和一种卡他莫拉氏菌抗原(uspa2)。此类抗原的组合可用于预防或治疗疾病、诸如慢性阻塞性肺病(copd),其为一种肺病,其特征在于肺气流的慢性阻塞,其干扰正常呼吸且不是完全可逆转的;和/或预防或治疗copd的急性恶化(aecopd)。aecopd是一种急性事件,其特征在于患者的呼吸道症状的恶化,其超出正常的日与日变化。通常,aecopd导致药物改变。在一个实施方案中,所述抗原是nthi蛋白d或其免疫原性片段,合适地与蛋白d序列具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽。蛋白d可以如wo91/18926中所述。在一个实施方案中,蛋白d具有来自ep0594610的图9的序列(图9a和9b一起为364个氨基酸)(本文为seqidno:10)。该蛋白可以提供针对流感嗜血杆菌相关的中耳炎的保护水平(pyrmula等人lancet367;740-748(2006))。蛋白d可以用作全长蛋白或片段(例如,蛋白d可以如wo0056360中所述)。例如,蛋白d序列可以包含ep0594610中描述的蛋白d片段或由其组成,其开始于序列sshssnmant(serserhisserserasnmetalaasnthr)(seqidno.12),并且缺乏来自ep0594610的图9的19个n-末端氨基酸,其任选地具有与所述蛋白d片段的n-末端融合的来自ns1的三肽mdp(348个氨基酸)(其中的seqidno:11)。在一个实施方案中,蛋白d多肽不缀合至多糖,例如来自肺炎链球菌的多糖。在一个实施方案中,蛋白d多肽是游离蛋白(例如未缀合的)。在一个方面,蛋白d或蛋白d的片段是未脂化的。seqidno10:蛋白d(364个氨基酸)seqidno.11:具有来自ns1的mdp三肽的d蛋白片段(348个氨基酸)在一个实施方案中,所述抗原是蛋白d或其免疫原性片段,合适地是与seqidno.10具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽。蛋白d的免疫原性片段可以包含seqidno.10的至少7、10、15、20、25、30或50个连续氨基酸的免疫原性片段。所述免疫原性片段可以引发可以结合seqidno.10的抗体。在另一个实施方案中,所述抗原是蛋白d或其免疫原性片段,合适地与seqidno.11具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽。蛋白d的免疫原性片段可以包含seqidno.11的至少7、10、15、20、25、30或50个连续氨基酸的免疫原性片段。包含蛋白d抗原的免疫原性组合物可以进一步包含来自nthi的蛋白e或其免疫原性片段,合适地与蛋白e序列具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽。蛋白e(pe)是具有粘附特性的外膜脂蛋白。其在无法分型的流感嗜血杆菌(nthi)粘附至/侵袭上皮细胞中发挥作用。(j.immunology183:2593-2601(2009);thejournalofinfectiousdiseases199:522-531(2009),microbesandinfection10:87-96(2008))。其在有荚膜的流感嗜血杆菌和无法分型的流感嗜血杆菌二者中高度保守,且具有保守的上皮结合结构域。(thejournalofinfectiousdiseases201:414-419(2010))。当与作为参考菌株的流感嗜血杆菌rd比较时,已在不同嗜血杆菌物种中描述了13种不同点突变。在对数生长期和静止期细菌中都观察到其表达。(wo2007/084053)。蛋白e也通过结合玻连蛋白而参与人补体抗性。(immunology183:2593-2601(2009))。pe通过结合结构域pkryarsvrqykilncanyhltqvr(对应于seqidno.13的氨基酸84-108)结合玻连蛋白,所述玻连蛋白是末端补体途径的重要抑制剂(j.immunology183:2593-2601(2009))。如本文所用,“蛋白e(proteine)”、“蛋白e(proteine)”、“prote”和“pe”意指来自流感嗜血杆菌的蛋白e。蛋白e可由以下氨基酸序列组成或包含以下氨基酸序列:seqidno.13(对应于wo2012/139225a1的seqidno.4):以及在整个长度上与seqidno.13具有至少或确切地75%、77%、80%、85%、90%、95%、97%、99%或100%同一性的序列。在一个实施方案中,蛋白e或其免疫原性片段合适地是分离的免疫原性多肽,其与seqidno.13具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性。蛋白e的免疫原性片段可以包含seqidno.13的至少7、10、15、20、25、30或50个连续氨基酸的免疫原性片段。所述免疫原性片段可以引发可以结合seqidno.13的抗体。在另一个实施方案中,蛋白e或免疫原性片段合适地是分离的免疫原性多肽,其与seqidno.14(对应于wo2012/139225a1的seqidno.125)具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性:seqidno.14:蛋白e的氨基酸20-160包含蛋白d抗原的免疫原性组合物可以进一步包含pila或其免疫原性片段,合适地与pila序列具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽。在另一个实施方案中,所述免疫原性组合物可以包含pila的免疫原性片段,合适地与pila序列具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽。菌毛蛋白a(pila)可能是参与颤动的流感嗜血杆菌iv型菌毛(tfp)的主要菌毛蛋白亚基(infectionandimmunity,73:1635-1643(2005))。nthipila是在体内表达的保守粘附素。它已显示参与nthi粘附、定殖(colonization)和生物膜形成。(molecularmicrobiology65:1288-1299(2007))。如本文所用,“pila”意指来自流感嗜血杆菌的菌毛蛋白a。pila可以由以下蛋白序列组成或包含以下蛋白序列:seqidno.15(对应于wo2012/139225a1的seqidno.58),以及与seqidno.15具有80%-100%同一性的序列。例如,pila可以与seqidno.15具有至少80%、85%、90%、95%、97%或100%同一性。在一个实施方案中,所述免疫原性组合物可以包含pila或其免疫原性片段,合适地与seqidno.15具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽。pila的免疫原性片段可以包含seqidno.15的至少7、10、15、20、25、30或50个连续氨基酸的免疫原性片段。所述免疫原性片段可以引发可以结合seqidno.15的抗体。在另一个实施方案中,所述免疫原性组合物包含pila的免疫原性片段,合适地与seqidno.16(对应于wo2012/139225a1的seqidno.127)具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽:seqidno.16来自流感嗜血杆菌菌株86-028np的pila的氨基酸40-149:蛋白e和菌毛蛋白a可以作为融合蛋白(pe-pila)呈现。在另一个实施方案中,所述免疫原性组合物包含蛋白e和pila,其中蛋白e和pila作为融合蛋白、合适地与lvl-735seqidno.17(对应于wo2012/139225a1的seqidno.194)具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽存在。seqidno.17:lvl735(蛋白):(pelbsp)(proteaa20-160)(gg)(pilaaa40-149):在另一个实施方案中,所述免疫原性组合物包含蛋白e和pila,其中蛋白e和pila作为融合蛋白、合适地与lvl-735(其中已除去信号肽)seqidno.18(对应于wo2012/139225a1的seqidno.219)具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽存在。seqidno.18:没有信号肽的pe-pila融合蛋白:可以如wo2012/139225a1(其内容通过引用并入本文)中所述测量蛋白e(pe)和菌毛蛋白a(pila)多肽的免疫原性。包含蛋白d抗原的免疫原性组合物可以进一步包含来自卡他莫拉氏菌的免疫原性多肽或其免疫原性片段。在一个实施方案中,所述免疫原性组合物包含uspa2或其免疫原性片段。遍在表面蛋白a2(uspa2)是三聚体自转运蛋白,其在电子显微照片中表现为棒棒糖共有的结构(hoiczyk等人.emboj.19:5989-5999(2000))。其由n-末端头部、随后以两亲性螺旋结束的茎和c-末端膜结构域构成(hoiczyk等人.emboj.19:5989-5999(2000))。uspa2含有非常好地保守的结构域(aebi等人,infection&immunity65(11)4367-4377(1997)),其被单克隆抗体识别,所述单克隆抗体在小鼠卡他莫拉氏菌攻击模型中被动转移后显示保护性(helminnen等人jinfectdis.170(4):867-72(1994))。已显示uspa2与宿主结构和细胞外基质蛋白如纤连蛋白(tan等人,jinfectdis.192(6):1029-38(2005))和层粘连蛋白(tan等人,jinfectdis.194(4):493-7(2006))相互作用,表明其可以在卡他莫拉氏菌感染的早期阶段中发挥作用。uspa2似乎也参与卡他莫拉氏菌抵抗正常人血清的杀细菌活性的能力(attiaas等人.infectimmun73(4):2400-2410(2005))。其(i)结合补体抑制剂c4bp,使得卡他莫拉氏菌能够抑制经典补体系统,(ii)通过从血清吸附c3来防止替代补体途径的活化,且(iii)通过结合补体调节蛋白玻连蛋白来干扰补体系统的终末阶段,膜攻击复合物(mac)。(devries等人,microbiolmolbiolrev.73(3):389-406(2009))。如本文所用,“uspa2”意指来自卡他莫拉氏菌的遍在表面蛋白a2。uspa2可以由以下氨基酸序列组成或包含以下氨基酸序列:seqidno:19(来自atcc25238)(对应于wo2015/125118a1的seqidno.1):以及在整个长度上与seqidno:19具有至少或确切63%、66%、70%、72%、74%、75%、77%、80%、84%、85%、90%、95%、96%、97%、98%、99%或100%同一性的序列。如seqidno:19中所述的uspa2含有信号肽(例如,seqidno:19的氨基酸1至29),层粘连蛋白结合结构域(例如,seqidno:19的氨基酸30至177),纤连蛋白结合结构域(例如,seqidno:19的氨基酸165至318)(tan等人.jid192:1029-38(2005)),c3结合结构域(例如,seqidno:19的氨基酸30至539(wo2007/018463),或seqidno:19的氨基酸30至539的片段,例如seqidno:19的氨基酸165至318(hallströmt等人.j.immunol.186:3120-3129(2011)),两亲性螺旋(例如,使用不同的预测方法鉴定的seqidno:19的氨基酸519至564或seqidno:19的氨基酸520-559)和c末端锚定结构域(例如,seqidno:19的氨基酸576至630氨基酸(brooks等人,infection&immunity,76(11),5330-5340(2008))。在一个实施方案中,uspa2的免疫原性片段含有层粘连蛋白结合结构域和纤连蛋白结合结构域。在一个额外实施方案中,uspa2的免疫原性片段含有层粘连蛋白结合结构域、纤连蛋白结合结构域和c3结合结构域。在一个进一步实施方案中,uspa2的免疫原性片段含有层粘连蛋白结合结构域、纤连蛋白结合结构域、c3结合结构域和两亲性螺旋。已经描述了各种卡他莫拉氏菌物种的uspa2氨基酸差异。参见,例如,jbacteriology181(13):4026-34(1999),infectionandimmunity76(11):5330-40(2008)和plosone7(9):e45452(2012)。来自卡他莫拉氏菌的38种菌株的uspa2氨基酸序列在wo2018/178264和wo2018/178265(其通过引用并入本文)中给出。uspa2的免疫原性片段可以包含seqidno:19的至少450、490、511、534或535个连续氨基酸的免疫原性片段。uspa2的免疫原性片段可以包含下述或由下述组成:例如如通过引用并入本文的wo2015/125118a1中所述的任何uspa2构建体mc-001、mc-002、mc-003、mc-004、mc-005、mc-006、mc-007、mc-008、mc-009、mc-010或mc-011,例如本文的mc-009seqidno.20。所述免疫原性片段可以引发抗体,所述抗体可以结合该片段所衍生的全长序列。在另一个实施方案中,所述免疫原性组合物可以包含uspa2的免疫原性片段,合适地与选自以下的多肽具有至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的分离的免疫原性多肽:mc-001、mc-002、mc-003、mc-004、mc-005、mc-006、mc-007、mc-008、mc-009(seqidno.20)、mc-010或mc-011,例如mc009seqidno.20(对应于wo2015/125118a1的seqidno.69)。seqidno.20mc-009(蛋白)–(m)(uspa231-564)(hh)uspa2多肽的免疫原性可以如wo2015/125118a1(其内容通过引用并入本文)中所述进行测量。本文所述的免疫原性组合物可以包含来自nthi和卡他莫拉氏菌的多种抗原,包括蛋白d、pe、pila(其可能呈pe-pila融合体的形式)和uspa2,例如:-pd10µg/pe-pila(lvl735构建体,如wo2012/139225中所述)10µg/uspa2(mc009构建体,如wo2015125118中所述)10µg/as01e-pd10µg/pe-pila(lvl735构建体,如wo2012/139225中所述)10µg/uspa2(mc009构建体,如wo2015125118中所述)3.3µg/as01e在wo2015125118(实施例14)中,在小鼠卡他莫拉氏菌肺部炎症模型中评估以上两种特异性免疫原性组合物。因此,在一个实施方案中,所述免疫原性组合物包含10μg蛋白d(例如seqidno.11),10μgpe-pila融合蛋白(例如seqidno.17或18)和10μguspa2(例如seqidno.20),其具有或没有佐剂(例如as01e)。在另一个实施方案中,所述免疫原性组合物包含10μg蛋白d(例如seqidno.11),10μgpe-pila融合蛋白(例如seqidno.17或18)和3.3μguspa2(例如seqidno.20),其具有或没有佐剂(例如as01e)。抗原的组合显而易见的是,可以提供多种抗原。例如,可以提供多种抗原以强化引发的免疫应答(例如以确保强烈的保护),可以提供多种抗原以拓宽免疫应答(例如以确保针对一系列病原体菌株或在大部分受试者群体中的保护)或可以提供多种抗原以同时引发针对许多病症的免疫应答(由此简化施用方案)。在提供多种抗原的情况下,这些可以是不同的蛋白,或者可以呈一种或多种融合蛋白的形式。抗原剂量抗原可以以每人剂量每抗原0.1至200µg、例如每人剂量每抗原0.1至100µg的量提供。人剂量可以是固定剂量,例如0.5ml。可以在小瓶中提供个别剂量的疫苗,或者可以在单个小瓶中提供多剂量的疫苗,例如多个0.5ml剂量。因此,在一个实施方案中,本文所述的制剂或组合物作为小瓶中的单剂量(例如0.5ml剂量)或作为单个小瓶中的多剂量(例如0.5ml的倍数)提供。小瓶的内容物可以是液体,或准备在施用前用水溶液重构的固体(例如,其中液体制剂已经冷冻干燥)。载体合适地,术语“载体”是指相对于野生型序列已经实质上改变(例如,已经缺失和/或失活基因或功能区域)和/或并入异源序列、即获得自不同来源的核酸(也称为“插入物”)且在引入细胞(例如,宿主细胞)中时复制和/或表达插入的多核苷酸序列的核酸。载体可以包括任何基因元件或合适的核酸分子,包括裸露dna、质粒、病毒、粘粒、噬菌体载体诸如λ载体、人工染色体诸如bac(细菌人工染色体)或附加体。本文特别感兴趣的是病毒载体。本文中特别讨论了可用于递送疫苗抗原的载体,但显而易见的是,载体不受限制并且可用于将任何蛋白(通常为异源蛋白)递送至细胞,用于治疗或疫苗目的,并且或者可用于递送反义核酸和用于基因疗法中。在一个实施方案中,所述载体是病毒载体,其将蛋白,合适地异源蛋白,递送至细胞,以用于治疗或疫苗目的。此类载体含有表达盒,其为选择的异源基因(转基因)和驱动宿主细胞中的基因产物的翻译、转录和/或表达所必需的其他调节元件的组合。此类病毒载体可以基于任何合适的病毒,诸如痘病毒,例如牛痘病毒(例如,修饰病毒安卡拉(mva)),nyvac(源自牛痘的哥本哈根毒株),禽痘,金丝雀痘(alvac)和鸡痘(fpv),腺病毒,腺相关病毒(aav)诸如aav5型,甲型病毒(例如委内瑞拉马脑炎病毒(vee),辛迪比斯病毒(sin),塞姆利基森林病毒(sfv)和vee-sin嵌合体),疱疹病毒,麻疹病毒,水疱性口炎病毒载体,逆转录病毒,例如慢病毒,疱疹病毒,例如cmv,副粘病毒。载体还包括表达载体,克隆载体和可用于在宿主细胞中生成重组病毒、诸如腺病毒的载体。腺病毒载体在一个实施方案中,所述载体是腺病毒载体,例如编码源自rsv、hcv、hpv或hsv的抗原的腺病毒载体。腺病毒是物种特异性的,并且作为不同的血清型(即没有被抗体交叉中和的类型)出现。腺病毒已经从人和非人猿猴(诸如黑猩猩、倭黑猩猩、猕猴和大猩猩)分离。特别感兴趣的是猿猴腺病毒载体,诸如黑猩猩腺病毒载体。示例性腺病毒载体描述于wo2010/085984、wo2014/139587、wo2016/198621、wo2018/104911和wo2016/198599中。示例性腺病毒载体包括chad155和chad157。例如,所述腺病毒载体可以是黑猩猩腺病毒载体,其包含病毒基因、诸如e1或其他病毒基因或功能区的一个或多个缺失或灭活。这种病毒载体可以被描述为“骨架”,其可以原样使用或用作对载体进行额外修饰(包括添加一个或多个编码抗原或抗原的序列)的起点。术语“能够复制的”腺病毒是指在没有宿主细胞中包含的任何重组辅助蛋白存在下可以在所述宿主细胞中复制的腺病毒。合适地,“能够复制的”腺病毒包含下述完整的或功能性的必需早期基因:e1a、e1b、e2a、e2b、e3和e4。从特定动物分离的野生型腺病毒将是在该动物中能够复制的。术语“不能复制的”或“复制缺陷的”腺病毒是指这样的腺病毒,其不能复制,因为其已经被工程改造以至少包含功能缺失(或“功能丧失”突变),即在不将基因完全除去的情况下损害该基因的功能的缺失或突变,例如人工终止密码子的引入,活性位点或相互作用结构域的缺失或突变,基因的调节序列的突变或缺失等,或编码对于病毒复制必需的基因产物的基因的完全除去,诸如选自e1a、e1b、e2a、e2b、e3和e4(诸如e3orf1、e3orf2、e3orf3、e3orf4、e3orf5、e3orf6、e3orf7、e3orf8、e3orf9、e4orf7、e4orf6、e4orf4、e4orf3、e4orf2和/或e4orf1)的腺病毒基因中的一个或多个的完全除去。尤其合适地,e1和任选地e3和/或e4被缺失。腺病毒载体(ad)载体包括例如非复制性ad5、adil、ad26、ad35、ad49、chad3、chad4、chad5、chad7、chad8、chad9、chadio、chadil、chadlό、chadl7、chadl9、chad20、chad22、chad24、chad26、chad30、chad31、chad37、chad38、chad44、chad63、chad82和chad155、chad157、chadox1和chadox2载体或能够复制的ad4和ad7载体。在一个实施方案中,所述腺病毒载体是黑猩猩腺病毒载体,诸如chad155,其编码rsv抗原,诸如rsvf抗原,和任选地一种或多种另外的rsv抗原,诸如rsvn抗原和rsvm2抗原。在一个实施方案中,所述腺病毒载体是编码rsvf、rsvn和rsvm2抗原的chad155-rsv载体。由载体表达的抗原由本文所述的腺病毒载体或其他载体表达的免疫原可用于针对病原体或针对癌细胞或肿瘤细胞免疫人或非人动物,所述病原体包括,例如,感染人和非人脊椎动物的细菌、真菌、寄生微生物或多细胞寄生物。由本文描述的载体表达的免疫原可以是已经描述的任何抗原。例如,由载体表达的免疫原可以选自多种病毒科。病毒科(针对其的免疫应答将是期望的)的实例包括狂犬病毒属诸如狂犬病毒、呼吸道病毒诸如呼吸道合胞病毒(rsv)和其他副粘病毒诸如人偏肺病毒、hmpv和副流感病毒(piv)。合适的抗原的另外实例是来自hcv、hpv和hsv的抗原。可用作免疫原以免疫人或非人动物的狂犬病抗原可选自狂犬病病毒糖蛋白(g)、rna聚合酶(l)、基质蛋白(m)、核蛋白(n)和磷蛋白(p)。术语“g蛋白”或“糖蛋白”或“g蛋白多肽”或“糖蛋白多肽”是指具有狂犬病糖蛋白多肽的氨基酸序列的全部或部分的多肽或蛋白。术语“l蛋白”或“rna聚合酶蛋白”或“l蛋白多肽”或“rna聚合酶蛋白多肽”是指具有狂犬病rna聚合酶蛋白多肽的氨基酸序列的全部或部分的多肽或蛋白。术语“m蛋白”或“基质蛋白”或“m蛋白多肽”或“基质蛋白多肽”是指具有狂犬病基质蛋白多肽的氨基酸序列的全部或部分的多肽或蛋白。术语“n蛋白”或“核蛋白”或“n蛋白多肽”或“核蛋白多肽”是指具有狂犬病核蛋白多肽的氨基酸序列的全部或部分的多肽或蛋白。术语“p蛋白”或“磷蛋白”或“p蛋白多肽”或“磷蛋白多肽”是指具有狂犬病磷蛋白多肽的氨基酸序列的全部或部分的多肽或蛋白。可用作由载体表达的免疫原以免疫人或非人动物的rsv的合适的抗原可以选自:融合蛋白(f)、附着蛋白(g)、基质蛋白(m2)和核蛋白(n)。术语“f蛋白”或“融合蛋白”或“f蛋白多肽”或“融合蛋白多肽”是指具有rsv融合蛋白多肽的氨基酸序列的全部或部分的多肽或蛋白。类似地,术语“g蛋白”或“g蛋白多肽”是指具有rsv附着蛋白多肽的氨基酸序列的全部或部分的多肽或蛋白。术语“m蛋白”或“基质蛋白”或“m蛋白多肽”是指具有rsv基质蛋白的氨基酸序列的全部或部分的多肽或蛋白,且可以包括m2-1(其可以在本文中书写为m2.1)和m2-2基因产物中的任一种或两种。同样地,术语“n蛋白”或“核衣壳蛋白”或“n蛋白多肽”是指具有rsv核蛋白的氨基酸序列的全部或部分的多肽或蛋白。在一个实施方案中,在病毒载体(尤其是腺病毒、例如chad155)中编码的rsv的抗原包含rsvf抗原和rsvm和n抗原。更具体地,所述抗原是rsvfatm抗原(缺失跨膜和细胞质区域的融合(f)蛋白)和rsvm2-1(转录抗终止)和n(核衣壳)抗原。在一个实施方案中,所述免疫原可以来自逆转录病毒,例如慢病毒诸如人免疫缺陷病毒(hiv)。在这样的一个实施方案中,免疫原可以源自hiv-1或hiv-2。hiv基因组编码许多不同的蛋白,其中每一种当由本发明的载体表达时可以以其整体或作为片段是免疫原性的。包膜蛋白包括例如gp120、gp41和env前体gp160。hiv的非包膜蛋白包括例如内部结构蛋白诸如gag和pol基因的产物和其他非结构蛋白诸如rev、nef、vif和tat。在一个实施方案中,本发明的载体编码一种或多种包含hivgag的多肽。gag基因被翻译为前体多蛋白,其被蛋白酶切割以产生包括基质蛋白(p17)、衣壳(p24)、核衣壳(p9)、p6和两种间隔肽p2和p1(它们都是gag的片段的实例)的产物。gag基因产生55-千道尔顿(kd)gag前体蛋白(也称为p55),其从未剪接的病毒mrna表达。在翻译期间,p55的n末端被肉豆蔻酰化,触发其与细胞膜的细胞质方面的缔合。膜缔合的gag多蛋白与其他病毒蛋白和细胞蛋白一起募集病毒基因组rna的两个拷贝,其触发病毒颗粒从被感染的细胞的表面出芽。出芽后,在病毒成熟为四种较小蛋白(命名为ma(基质[p17])、ca(衣壳[p24])、nc(核衣壳[p9])和p6,它们都是gag的片段的实例)的过程期间,p55被病毒编码的蛋白酶(pol基因的产物)切割。用于评估生物分子或载体的氧化水平的方法可以使用各种方法来评估与h2o2接触的影响以及潜在抗氧化剂的影响,包括例如以下方法:间接方法的实例:amplexred比色方法可用于在不同阶段定量h2o2,例如在最终散装(fb)疫苗中,在其中容器已经用一个或多个疫苗剂量填充的最终容器(fc)中,或在重构冻干产品后(如果适用)。直接方法:•具有高分辨率的反相高压液相色谱(rp-hplc)可用于评价抗原的纯度。这种高分辨率色谱方法用于分离由不同氧化形式产生的抗原的变体。当抗原被氧化时,可以生成亲水性变体并在色谱图上更早地洗脱。未氧化色谱图每种抗原仅显示一个峰(纯峰),而当已发生氧化时,纯峰的大小减小,并且新峰显示为氧化形式,其在非氧化抗原(纯峰)之前洗脱。这既是通过观察峰进行的定性测量,又是通过计算纯峰的面积相比于所有其他峰的面积的百分比进行的定量方法。因此,对于纯产物,获得的值接近于100%,并且随着氧化产物的存在降低。•质谱联用液相色谱(lc-ms)可用于定量甲硫氨酸残基的氧化比率,例如在抗原中。例如,对于seqidno:1的pref,在7个甲硫氨酸残基中,3个容易被氧化(met317>met343>met74)。显示met343,因为其最容易被追踪(分布在单个消化肽上),尽管不是最氧化的肽。在腺病毒载体中,六邻体蛋白中的一个或多个甲硫氨酸可用于指示载体的氧化,例如在chad155中,针对氧化研究六邻体甲硫氨酸中的五个:met270、299、383、468和512。在包含来自流感嗜血杆菌的蛋白d抗原(例如seqidno:11)的组合物中,m192用作氧化的探针,因为可以在m192氧化和蛋白d的其他甲硫氨酸的氧化水平之间建立关联。•其他能够检测氧化是否影响产品的潜在的关键质量属性(pcqa)的方法o抗原性(elisa,表面等离振子共振(spr),gyros)o构象(傅立叶变换红外共振(ftir),圆二色性(cd))。与活载体一起使用以查看h2o2和抗氧化剂的影响的另外的方法包括:•dna释放测定法(诸如picogreen测定法)可用于测量dna释放,并且因此指示病毒衣壳完整性。•可以通过查看感染宿主细胞中的转基因表达来测量病毒感染性,例如使用facs分析。在随后编号的段落中进一步描述了本发明的实施方案:1.制造包含至少一种生物分子或载体的生物药物的方法,所述方法包括以下步骤,所述步骤中的一个或多个在已使用过氧化氢进行表面灭菌的无菌围隔体中进行:(a)将所述生物分子或载体与一种或多种赋形剂(包括抗氧化剂)一起配制,以产生包含抗氧化剂的生物药物;(b)用所述生物药物填充容器;和(c)密封或部分密封所述容器。2.根据段落1所述的方法,其中用于灭菌的过氧化氢呈蒸气形式(vhp)或气溶胶化形式(ahp)。3.根据段落1或段落2所述的方法,其中所述生物分子或载体包含多肽。4.根据段落1至3所述的方法,其中所述生物分子是重组蛋白。5.根据段落1至4所述的方法,其中所述生物分子或载体易于氧化。6.根据段落3至5所述的方法,其中所述生物分子或载体包含一个或多个甲硫氨酸基团,且其中所述抗氧化剂减少由所述过氧化氢引起的所述生物分子上的一个或多个甲硫氨酸基团的氧化。7.根据段落6所述的方法,其中所述抗氧化剂将甲硫氨酸基团的氧化降低至不超过在过氧化氢不存在的情况下的氧化的水平。8.根据段落1至7所述的方法,其中所述抗氧化剂是氨基酸。9.根据段落1至8所述的方法,其中所述抗氧化剂是含有硫醚的分子。10.根据段落9所述的方法,其中所述抗氧化剂是甲硫氨酸。11.根据段落10所述的方法,其中所述抗氧化剂是l-甲硫氨酸。12.根据段落1至11所述的方法,其中所述抗氧化剂在所述制剂中以高于0.05mm存在。13.根据段落1至12所述的方法,其中所述抗氧化剂在所述制剂中以低于50mm存在。14.根据段落1至13所述的方法,其中所述无菌围隔体是隔离体。15.根据段落14所述的方法,其中,对于vhp,所述隔离体具有0.1和1.0ppm之间的工作设定点。16.根据段落15所述的方法,其中所述隔离体具有1.0ppmvhp的工作设定点。17.根据段落1至16所述的方法,其中所述生物药物是免疫原性组合物或疫苗,且所述生物分子或载体是抗原或编码抗原的载体。18.根据段落17所述的方法,其中所述抗原是rsv抗原。19.根据段落18所述的方法,其中所述抗原是rsv融合前f抗原。20.根据段落17所述的方法,其中所述抗原来自水痘带状疱疹病毒。21.根据段落20所述的方法,其中所述抗原是vzvge抗原。22.根据段落17所述的方法,其中所述抗原来自流感嗜血杆菌。23.根据段落22所述的方法,其中所述抗原是流感嗜血杆菌蛋白d抗原(例如seqidno.11)。24.根据段落17所述的方法,其中编码抗原的载体是腺病毒载体,诸如chad155。25.根据段落24所述的方法,其中所述腺病毒载体编码rsv抗原。26.根据段落24所述的方法,其中所述腺病毒载体编码来自卡他莫拉氏菌的抗原。27.根据段落1至26所述的方法,其包括将制剂冻干(冷冻干燥)的另外的步骤。28.根据段落27所述的方法,其中所述冻干包括以下步骤:-冷冻步骤(低于三相点)-任选地,退火步骤和/或受控成核步骤-初级干燥步骤-次级干燥步骤。29.根据段落1至28所述的方法,其中所述生物药物是无菌可注射制剂(当呈液体形式时)。30.通过根据段落1-29所述的方法生产的生物药物。31.免疫原性组合物或疫苗,其包含至少一种抗原或编码至少一种抗原的载体,所述抗原或载体与一种或多种包括甲硫氨酸的赋形剂一起配制。32.段落31的免疫原性组合物或疫苗,其包含rsv融合前f抗原。33.段落31的免疫原性组合物或疫苗,其包含流感嗜血杆菌蛋白d抗原(例如seqidno.11)。34.段落33的免疫原性组合物或疫苗,其进一步包含pe-pila融合蛋白(例如seqidno.17或18)和卡他莫拉氏菌uspa2抗原(例如seqidno.20)。35.段落31的免疫原性组合物或疫苗,其包含腺病毒载体,诸如chad155。36.段落31至35的免疫原性组合物或疫苗,其中甲硫氨酸以0.05至50mm存在。37.段落36的免疫原性组合物或疫苗,其中甲硫氨酸以0.1至20mm存在。38.段落37的免疫原性组合物或疫苗,其中所述甲硫氨酸以0.1至15mm存在。39.段落38的免疫原性组合物或疫苗,其中所述甲硫氨酸以0.5至15mm存在。40.段落38的免疫原性组合物或疫苗,其中所述甲硫氨酸以0.1至5mm存在。41.段落31至40的免疫原性组合物或疫苗,其中所述组合物呈冷冻干燥形式。42.段落41的免疫原性组合物或疫苗,其适合于重构于水溶液、例如包含佐剂的水溶液中。43.免疫原性组合物或疫苗,其包含至少一种抗原或编码至少一种抗原的载体,所述抗原或载体与一种或多种包括抗氧化剂的赋形剂一起配制,其中所述免疫原性组合物是冷冻干燥的。44.段落43的免疫原性组合物或疫苗,其中所述抗氧化剂是天然存在的抗氧化剂。45.段落44的免疫原性组合物或疫苗,其中所述抗氧化剂是氨基酸。46.段落45的免疫原性组合物或疫苗,其中所述抗氧化剂是甲硫氨酸。47.段落46的免疫原性组合物或疫苗,其中在冷冻干燥之前,所述甲硫氨酸以0.05至50mm存在于所述液体制剂中。48.段落47的免疫原性组合物或疫苗,其中在冷冻干燥之前,所述甲硫氨酸以0.1至20mm存在于所述液体制剂中。49.段落48的免疫原性组合物或疫苗,其中在冷冻干燥之前,所述甲硫氨酸以0.1至15mm存在。50.段落49的免疫原性组合物或疫苗,其中在冷冻干燥之前,所述甲硫氨酸以0.5至15mm存在。51.段落49的免疫原性组合物或疫苗,其中在冷冻干燥之前,所述甲硫氨酸以0.1至5mm存在。52.段落43至51的免疫原性组合物或疫苗,其适合于用水溶液、诸如包含佐剂的水溶液重构。53.段落52的免疫原性组合物或疫苗,其用水溶液、诸如包含佐剂的水溶液重构。54.段落43至53的免疫原性组合物或疫苗,其包含rsv融合前f抗原。55.段落43至53的免疫原性组合物或疫苗,其包含流感嗜血杆菌蛋白d抗原(例如seqidno.11)。56.段落55的免疫原性组合物或疫苗,其进一步包含pe-pila融合蛋白(例如seqidno.17或18)和卡他莫拉氏菌uspa2抗原(例如seqidno.20)。57.段落56的免疫原性组合物或疫苗,其用佐剂、例如aso1e重构。58.段落43至53的免疫原性组合物或疫苗,其包含腺病毒载体,诸如chad155。本公开将通过参考以下实施例进一步阐述。实施例实施例中使用的术语表:aox抗氧化剂cysl-半胱氨酸dp药物产品ds药物物质edta乙二胺四乙酸钠/二钠eic萃取离子色谱fb最终散装:填充前未填充的最终制剂fcliq最终容器液体:含有填充的最终散装的小瓶fclyo最终容器冻干产物:含有冷冻干燥后的冻干饼的小瓶gsh谷胱甘肽hisl-组氨酸hp过氧化氢[h2o2]过氧化氢浓度hrp用于定量h2o2的辣根过氧化物酶反应metl-甲硫氨酸(这是这些实施例中使用的物质)met343ox定量pref蛋白上氧化的met343vs.总met343的比率的lc-ms方法。不合格的分析方法。msg谷氨酸钠nacn-乙酰半胱氨酸rp-hplc反相高压液相色谱,其用于评价药物产品中的rsvpref2的纯度。rv重构的疫苗sp物质pvhp蒸气过氧化氢实施例1:评价残留hp对rsvpref2抗原的影响并选择抗氧化剂以保护抗原免于氧化引言:设计了一种策略来评价残留hp对疫苗的影响,其包括通过在疫苗生产工艺期间配制最终散装(fb)后引入代表性量的液态hp(掺加)来模拟hp暴露。这然后随后为小瓶填充步骤、小瓶用塞子塞住步骤(液体疫苗的完全用塞子塞住或冻干疫苗的部分用塞子塞住),冻干过程(如果必要)和小瓶加盖步骤。在冻干疫苗的情况下,暴露于残留hp后存在初始的冷冻步骤。该步骤冷冻浓缩溶解的hp和疫苗内容物(即抗原和其他制剂组分),并且可以被认为是最坏的情况,其可以加强来自hp的氧化。为了理解该现象并评价hp对配制的抗原的影响,因此同样需要模拟全过程。为了包括其中残留的hp可能影响疫苗的疫苗制造工艺的所有可能要素,可以使用以下步骤:(i)用h2o2掺加–其中填充步骤后,即在最终容器液体(fc液体)中,而且还在较高浓度下(以研究氧化行为),可能发现一定量的过氧化氢,所述填充步骤后是o刚好在液体疫苗的完全用塞子塞住步骤之前,和o刚好在装载入冻干疫苗的冷冻干燥机之前(ii)维持hp掺加和装载至冷冻干燥机架子之间的保持时间,代表生产程序(iii)进行标准的冻干循环(以使产品暴露于代表性的冷冻浓缩步骤)(iv)在分析之前模拟最终的容器冻干产物(fclyo)的老化(以强制氧化反应)。在同时,在抗氧化剂存在和不存在的情况下筛选疫苗制剂,以理解抗氧化剂的添加是否可以有效地防止残留hp对rsvpref2抗原的影响。在这种情况下,抗氧化剂的添加在最终散装生产期间进行,这是最接近于rsvpref2首次可能暴露于商业生产设施中的过氧化氢的点。如果预期暴露于氧化源、诸如hp,则也可以在此之前(例如在抗原生产期间)进行抗氧化剂添加。基于在1ppmvhp的残留vhp浓度下操作的隔离体中的制造工艺之后发现的h2o2的预期量,定义用于掺加的h2o2的浓度。该代表性浓度会通常根据制造工厂设计特点以及为确保进行模拟最坏情况条件的研究而应用的安全边际而不同。在这种情况下,还使用高于最大vhp代表性值的h2o2的量来帮助表征抗原的氧化行为(即168.0µm掺加)。表1.本实施例中使用的关键vhp浓度(ppm)和对应的h2o2(µm)[vhp]隔离体限值(ppm)对应的代表性[h2o2]掺加(µm)1.026.8不代表vhp隔离体限值的更高浓度168.0方法评价rsvpref2抗原的氧化rsvpref2抗原的氧化通过两种直接分析方法和一种间接分析方法测量:质谱联用液相色谱(lc-ms),其用于定量氧化的甲硫氨酸343(met343ox)相比于rsvpref2蛋白上的相同甲硫氨酸残基的总量的比率。该方法显示[h2o2]对rsvpref2氧化的非线性影响(高浓度下的饱和现象)。已知rsvpref2具有的7个甲硫氨酸中的3个(met317、met343、met74)优先按以下顺序被氧化:met317>met343>met74。在这里,met343被选为最容易定量的甲硫氨酸,因为用胰蛋白酶消化样品后,其分布在仅一种肽(imtsk肽)上。注意:在用h2o2掺加的药物物质上,在3个甲硫氨酸氧化比率之间观察到相关性,显示met343vs.met317的氧化比率之间的关系和met343vs.met74的氧化比率之间的关系分别为±3倍和±0.5倍。在还原条件下进行的反相高压液相色谱评价抗原的纯度,这是因为其能够分离蛋白的亲水性变体(通常由氧化产生)。其还可以提供关于抗氧化剂添加对抗原结构的影响的一些信息。amplexred–辣根过氧化物酶(hrp)测定–通过amplexred–hrp测定法确定h2o2的命运,作为一种间接方法来定量不同工艺步骤(例如,在fc液体中,在fclyo中,在模拟老化后)存在的h2o2。在还原和非还原条件下进行的sds-page用于测定残留hp和抗氧化剂添加对rsvpref2抗原结构的影响。在特定的子实验中,物质p的lc-eic-ms还用于测定物质p的氧化比率,所述物质p作为添加至rsvpref2制剂中并共同冻干的模型蛋白。其被用作评估抗氧化剂功效的筛选工具。选择初始抗氧化剂用于实验筛选(和初始剂量)基于文献确立10种抗氧化剂及可以施用它们的最大浓度。然后,实验筛选目的在于确立在rsvpref2疫苗组合物中添加这些赋形剂对ph的影响,以进一步选择可以将它们添加至疫苗制剂中的最大浓度。样品生产和管理实验中的样品生产和管理的一般示意图如下流程图中所示:•将fcliq(500µl)直接配制于3ml硅化小瓶中。•筛选12种不同的抗氧化剂条件(包括1种无抗氧化剂和2种不同的met浓度)(表2)。•然后在配制步骤后在fcliq中进行3种不同的[h2o2]掺加(10µl)(0、27、168µm)。•在将小瓶装载于冷冻干燥机中之前,维持fcliq的4小时暴露,其被认为是商业设施中最坏的情况。在保持时间期间,将样品保持在黑暗中。•将冷冻干燥机架子预冷却。进行的循环包括冷冻步骤、初级干燥步骤和次级干燥步骤,并且总共持续45h。o然后将样品在黑暗中在4℃下储存。•1组专门用于h2o2定量,首先在fcliq中,然后在fclyo中(组#1,每种抗氧化剂条件,每次掺加和每个时间点,1个小瓶)。•1组专用于lc-ms以用于met343氧化比率测定,rp-hplc和sds-page操作(组#2,每种抗氧化剂条件,每次掺加和每个时间点,2个小瓶)。•在特定的子实验中,将1组与作为模型蛋白的物质p一起配制于制剂中,并共同冻干(组#3,每种抗氧化剂条件,每次掺加和每个时间点,1个小瓶)。•在[h2o2]定量之前,将组#1的fclyo在4℃下储存。•在分析之前,将组#2和#3的fclyo在7d37℃下储存(强制老化条件)。表2.实施例1的最终散装疫苗中测试的抗氧化剂列表和选择的浓度抗氧化剂粗体的对于fb中的制剂选择的浓度(mm)抗坏血酸30柠檬酸3na30cys50edta5gsh5his50l-胱氨酸2.5met5和50msg50nac5fc液体vs.fclyo中的通过hrp的h2o2消耗(组#1)如上所示,在配制期间的不同步骤定量剩余的h2o2,首先在h2o2掺加后的fcliq步骤4h和fclyo中(在4℃下储存10d后),使用150mmnacl作为重构介质。在7d37℃储存后没有进行定量,因为在这些储存条件下在先前的实验中没有发现h2o2(数据未显示)。通过lc-eic-ms的作为模型蛋白的物质p的氧化比率(组#3)物质p(sp)是速激肽肽家族的11个氨基酸(十一肽)的小神经肽。物质p的序列为:arg-pro-lys-pro-gln-gln-phe-phe-gly-leu-met,在本文中显示为:。在该子实验中,使用物质p作为具有单一met氨基酸的模型可氧化蛋白。met残基由于肽的大小小且由于其位于肽的n-末端区域而可自由接近。使用定量sp的氧化比率的直接方法,即使用lc/uv-ms检测的萃取离子色谱法(eic)。对于该组,样品配制在小瓶中直接进行,其中不同的制剂每个小瓶含有选定的抗氧化剂、rsvpref2抗原和6.25µgsp。这确保来自sp的总met的量与来自rsvpref2相等(在两种情况下均为3.5nmol)。然后将样品进行上述的掺加/冻干,并在分析之前储存在7d37℃下。通过lc-ms的met343氧化比率(组#2)基于组#1和组#3的结果,通过对选择的样品的lc-ms评价fclyo中的rsvpref2的met343残基的氧化比率。在分析之前,将组#2的fclyo储存在7d37℃的强制老化条件下。未掺加样品用作对照。通过rp-hplc对纯度的影响(组#2’)然后选择显示最佳结果(最低的met343氧化比率)的抗氧化剂用于通过rp-hplc进行fclyo分析。这用经受以0µmvs.27µm掺加h2o2的样品进行,以评价:•对色谱图的视觉影响•对纯度值的影响(主峰积分vs.所有峰的总和的比率)这与sds-page表征平行进行(相同组,相同样品)。通过sds-page对构象的影响(组#2’)如所述,基于lc-ms结果仅包括最有效抗氧化剂的fclyo在非还原和还原条件下通过sds-page分析,以确立向制剂中添加抗氧化剂是否对rsvpref2构象具有影响。这用1µg沉积蛋白和银染程序进行。结果:过氧化氢对rsvpref2抗原的影响:图1显示代表性rp-hplc色谱图,如下:图1a:对于在4℃和14d37℃下储存之间的0µm掺加获得的,其显示这些储存条件不在未暴露于过氧化氢的样品中引起概况改变。图1b:对于0µm掺加、13.4µm掺加、26.8µm掺加、83.8µm掺加、167.6µm掺加和1676µm掺加、在7d4℃下储存后的fclyo获得的,其显示概况改变,这取决于过氧化氢的掺加浓度。抗氧化剂功效和对构象的影响在抗氧化剂存在的情况下的h2o2消耗(组#1)图2显示在掺加168和27µm的h2o2后,在不同抗氧化剂不存在和存在的情况下4℃储存后,掺加后4h的fc液体中和fclyo中的[h2o2]的演变。如图2中所示,产生fclyo以比较该步骤的不同选择的赋形剂的抗氧化功效。向包含rsvpref2抗原的fb制剂中添加12种不同的抗氧化剂条件(包括1种无抗氧化剂和2种不同浓度的met),然后向所述fb制剂中分别掺加0、27和168µmh2o2。如图2中所示,在制剂中不存在抗氧化剂的情况下:•掺加后4h发现的h2o2的量与最初掺加的量相同,考虑到分析可变性。•对于较低(27µm)和较高(168µm)h2o2掺加进行相同的观察。•在冻干后(在10d4℃储存fclyo后评价),在重构疫苗(rv)中观察到h2o2含量降低~75%。•对于较低和较高的h2o2掺加观察到相当的比率。•注意:我们从先前的实验知道(结果未显示),在37℃下储存7天后,在fclyo中发现接近没有剩余的h2o2。在一些抗氧化剂(met、nac、gsh、抗坏血酸、l-胱氨酸)存在的情况下,冻干后发现的h2o2量(经调整以考虑1.25倍稀释倍数的fclyo条)低于无抗氧化剂对照组中。在最高50mm浓度的met和nac5mm的情况下,在冻干步骤之前已经观察到完全h2o2消耗。在最低5mm浓度的met和l-胱氨酸2.5mm的情况下,在冻干步骤之前已经观察到部分h2o2消耗。这表明在进行冻干之前,met、nac和l-胱氨酸足够有效足以在短的4h时间范围内在fc液体中消耗h2o2,已知所述冻干诱导关键的冷冻浓缩步骤。一些样品(即cys)在掺加后显示比掺加量更高的h2o2含量,这可以通过分析测试的干扰来解释(此步骤未考虑结果)。此外,使用含有抗氧化剂且未用h2o2掺加的空白的吸光度的分析(数据未显示)显示,fcliq中存在一些抗氧化剂可能导致非常高的空白吸光度。这显示这些样品的分析是不可靠的,尤其是考虑到校准曲线都获得自在没有抗氧化剂的rsvpref2缓冲液中稀释的h2o2标准品。具体而言,在该步骤丢弃对于柠檬酸盐3na和l-胱氨酸获得的结果。结论:•基于其保护rsvpref2免于通过h2o2的氧化的功效选择5种候选物,并且分类如下:nac5mm=met50mm=gsh5mm>met5mm≌抗坏血酸。•在这些实验条件下,对于his和msg未看到从阴性对照的改善。•由于分析干扰(高空白吸光度),结果被认为对于cys、柠檬酸3na和l-胱氨酸不可靠。如通过lc/uv-ms所评价的作为模型蛋白的物质p的氧化比率将物质p和12种抗氧化剂条件(包括1种无抗氧化剂和2种不同浓度的met)添加至fb制剂中,与rsvpref2共同冻干,且然后分别用0、27和168µmh2o2掺加,然后在4h保持时间后使用标准的45h冻干周期冻干。然后将fclyo储存在7d37℃的强制老化条件下,并通过lc/uv-ms分析以定量sp氧化比率。该实验的结果(图3)显示:•在没有抗氧化剂的情况下,在fb制剂中,sp具有以下的氧化比率:o5.4%sp氧化,其中掺加0µm。o48.6%sp氧化,其中掺加27µm。o86.9%sp氧化,其中掺加168µm。•his50mm和msg50mm在针对来自掺加的h2o2的氧化保护sp方面是无效的。•edta5mm、柠檬酸3na30mm、抗坏血酸30mm和l-胱氨酸2.5mm显示针对来自掺加的h2o2的氧化的部分抗氧化功效。•met5和50mm、nac5mm、gsh5mm和cys50mm表现出针对来自掺加的h2o2的氧化的非常高的保护。•对于0µm掺加(无h2o2):配制/填充/冻干工艺似乎引起未掺加样品中的sp的基线氧化(5.4%氧化),可通过在fb制剂中添加最有效的抗氧化剂来预防:omet5和50mm:1.08和1.24%sp氧化onac5mm:1.73%sp氧化ogsh5mm:2.12%sp氧化ocys50mm:1.24%sp氧化ol-胱氨酸2.5mm:1.58%sp氧化。•对于27µmh2o2掺加,从48.6%sp氧化的阴性对照,最有效抗氧化剂的添加防止sp氧化:omet5和50mm:3.08和1.73%sp氧化onac5mm:2.69%sp氧化ogsh5mm:2.49%sp氧化ocys50mm:1.29%sp氧化ol-cys2.5mm:6.53%sp氧化。•对于168µmh2o2掺加,从86.9%sp氧化的阴性对照,最有效抗氧化剂的添加防止sp氧化:omet5和50mm:7.37和3.42%sp氧化onac5mm:5.11%sp氧化ogsh5mm:2.98%sp氧化ocys50mm:1.26%sp氧化。在该掺加下,l-胱氨酸不能充分防止sp氧化(56%sp氧化)抗坏血酸30mm给出混合结果,在0µm掺加下sp氧化的增加(17.8%),和在27和168µm掺加下相当的水平(19.4和19.1%sp氧化),这可能由分析干扰或由平衡下的可逆氧化过程引起,其显示该赋形剂的抗氧化剂和促氧化剂特性两者。综上所述,可以基于抗氧化剂针对sp氧化的功效进行以下抗氧化剂的选择:cys50mm>met50mm>gsh5mm>nac5mm>met5mm。该分类证实先前关于h2o2含量的演变获得的结果,除了cys,其先前因为其干扰hrp分析测定而被省略。由于用两种方法观察到的结果可能是分析干扰的结果,因此在筛选中也进一步维持抗坏血酸。如通过lc-ms所评价的氧化(met343ox比率)基于先前的观察,仅针对0µm掺加分析在27µmh2o2的更代表性条件下掺加的met50mm、met5mm、nac5mm、gsh5mm、抗坏血酸30mm。fclyo在7d37℃的强制老化条件下储存。图4中显示的筛选显示:•对于0µm掺加(无h2o2):配制/填充/冻干工艺似乎引起未掺加样品中的rsvpref2的基线氧化(1.99%氧化),可通过在fb制剂中添加最有效的抗氧化剂来防止:omet5和50mm:1.01和1.06%met343oxonac5mm:1.02%sp氧化ogsh5mm:1.04%sp氧化ocys50mm:1.12%sp氧化。•对于27µmh2o2掺加,从27.17%met343氧化的阴性对照,最有效抗氧化剂的添加防止rsvpref2氧化:omet5和50mm:1.37和1.16%sp氧化onac5mm:1.2%sp氧化ogsh5mm:1.01%sp氧化ocys50mm:1.16%sp氧化。•met50和5mm、nac5mm、gsh5mm和cys50mm保护rsvpref2免于h2o2的27µm掺加的氧化。•实验证实,抗坏血酸30mm具有抗氧化剂和促氧化剂特性两者,因为其显示:o针对0µmh2o2掺加,met343ox比率比阴性对照更高(3.54%met343ox)o针对27µmh2o2掺加,met343ox比率比阴性对照更低(3.54%met343ox)。•还证实通过添加抗氧化剂可防止与制剂/填充/冻干工艺相关的氧化(例如,通过空气的氧化)(没有抗氧化剂的0µm掺加:1.99%met343ox比率vs.具有最有效抗氧化剂的0µm掺加后为±1.0%)。应当指出,该测定是破坏性的,并且因此仅能够定量由酶促消化产生的特定肽(即imtsk肽)的氧化甲硫氨酸比率。因此,其没有提供关于氧化或添加抗氧化剂对总体rsvpref2结构的影响的信息。氧化和对rp-hplc色谱图的影响为了通过高分辨率rp-hplc确定rsvpref2氧化是否影响纯度读出值并确定这是否可以通过使用抗氧化剂来避免,通过rp-hplc分析与通过lc-ms分析的那些(met343ox比率)相同的条件。fclyo储存在7d37℃的强制老化条件下。色谱图显示于图5-9中,并在下面进行讨论。比较该读出值的不同潜在抗氧化剂的结果显示于图10中。具有基础、非掺加概况(呈黑色)和27µm掺加概况(浅灰色)的色谱图的定性分析显示于图5-9中。该分析显示,与0µm掺加阴性对照相比,27µm掺加概况具有显著影响。抗氧化剂条件显示:•nac5mm(图5)和gsh5mm(图6)显示,当用0µmh2o2掺加时,抗氧化剂添加对rsvpref2没有影响,并且当用27µmh2o2掺加时抗氧化剂添加对rsvpref2具有非常好的保护作用。•cys50mm(图7)显示出现在13和15分钟之间洗脱的新的小的亲水峰,但当用0µmh2o2掺加时,抗氧化剂添加对rsvpref2的影响总共很小,并且在27µmh2o2掺加后对主峰中具有非常好的保护能力。•30mm抗坏血酸(图8)显示混合结果,其中在0µmh2o2掺加的情况下影响非常高,并且在存在27µmh2o2掺加的情况下得到改善。这证实该抗氧化剂的矛盾行为。•met5和50mm(图9a和9b)显示,当用0µmh2o2掺加时,抗氧化剂添加对rsvpref2没有影响,并且当用27µmh2o2掺加时,保护作用非常好。作为色谱图中的主峰积分与所有峰积分的比率的纯度的分析在图10中给出,其具有关于所选抗氧化剂,在fb步骤中用0或27µmh2o2掺加的fclyo中通过rp-hplc的rsvpref2纯度的演变。其显示,在27µmh2o2掺加的影响下,将纯度从89.4%降低至73.1%,在制剂中添加最有效的抗氧化剂(nac5mm,gsh5mm,cys50mm,met5mm和50mm)能够维持rsvpref2抗原的高纯度(>88.0%)。30mm抗坏血酸再一次显示混合结果,在h2o2不存在的情况下具有促氧化剂活性,并且在27µmh2o2掺加下具有保护作用。应当注意的是,该测定是在变性和还原条件(十二烷基硫酸钠sds1%,二硫苏糖醇dtt32mm)下制备样品后进行的,并且因此不能检测到对蛋白的四级或三级结构的改变。通过sds-page的对构象的影响在还原条件下和非还原条件下,使用β-巯基乙醇作为还原剂和银染色用于检测,通过sds-page分析与选择用于rp-hplc的那些相同的样品。此外,使用内部对照(ds,在fb步骤以0、27和168µmh2o2掺加的fc,孔#1至#4和#11至#14)评价氧化的影响。除了ds(孔#1),所有fclyo样品都已经在分析前进行在7d37℃的强制老化。如图11和图12中所示,27和168µmh2o2掺加对fclyo中rsvpref2的氧化没有可见的影响。作为结果,在非还原和还原条件下对sds-page的进一步影响只可以与添加抗氧化剂后的蛋白结构的修饰关联,而对rsvpref2氧化不是如此。nac5mm(孔#5和#6)、gsh5mm(孔#7和#8)和cys50mm(孔#9和#10)在还原条件下没有可见的影响(图11)。然而,在非还原条件下(图12),可以清楚地观察到更高阶结构的分子量从~150kda降低至~120kda区域。关于蛋白亚单位,可见清楚的修饰,其中主要原始峰在~70kda,如对照中所见,分成在~50kda和~40kda之间的两个峰,而与h2o2暴露无关。筛选的所有基于硫醇的(r-s-h)抗氧化剂(nac、gsh、cys)都显示在非还原条件下获得的天然sds-page概况的非常清楚的修饰,其概况与在非还原条件下观察到的那些相当。通过定义,抗氧化剂是还原性物质,且因此制剂中具有强还原特性的硫醇的存在可能导致天然rsvpref2蛋白中的二硫键的改变。去质子化的硫醇(硫醇盐)是已知的亲核试剂,并且取决于条件(pka,亲核性),经常导致现有二硫键的攻击。30mm抗坏血酸(孔#15和#16)在还原和未还原条件下显示相当的修饰。在两种情况下,在~150kda的更高阶结构相关的峰均显示比对照中更强的峰。关于迁移峰的分子量,看不到任何改变。在暴露于和未暴露于h2o2条件的制剂之间没有观察到影响。5和50mm甲硫氨酸(分别为孔#17和#18以及#19和#20)是评价的显示迁移峰的分子量和峰强度都没有改变的唯一抗氧化剂。也没有观察到氧化的影响。总之,通过sds-page分析的rsvpref2结构受基于巯基的抗氧化剂(nac、gsh、cys)(其为强还原剂)的影响。因此,它们的使用在rsvpref2制剂中是不可接受的,因为它们会改变构象,并可能改变抗原的免疫原性概况。甲硫氨酸(一种反应性较低的硫醚抗氧化剂)是最好的方法。结论:甲硫氨酸是针对通过残留的vhp和通过冻干期间的空气的氧化的rsvpref2的最合适的抗氧化剂。其具有以下进一步优点:•其被fda批准为非活性成分•其在销售的可注射产品中以最高达15mm的浓度存在•其毒性被非常好地表征o其固有地毒性低,因为其为氨基酸o其显示非常低的急性(高ld50)和慢性毒性(高的无观察到的不良反应水平(noobservedadverseeffectlevel))•其针对代表在fb中浓度为5和50mm(在rv中浓度为4和40µm)的残留vhp的h2o2掺加显示有效的抗氧化活性。o通过直接h2o2消耗(在fb中和fclyo中)o通过对以下直接测量•对模型蛋白(sp)•对rsvpref2,通过甲硫氨酸氧化•对rsvpref2,通过经由rp-hplc观察到的色谱图概况的保护•其显示,与筛选的所有其他抗氧化剂不同,对通过sds-page评价的蛋白构象没有影响。使用不同浓度的h2o2掺加并最终使用vhp实施剂量-定义研究,以选择rsvpref2制剂中抗氧化剂的理想浓度(参见实施例2)。实施例2–剂量范围研究以确定甲硫氨酸用于针对氧化保护rsvpref2的最佳浓度引言在其中确定最合适的抗氧化剂为met的实施例1后,本实验聚焦于通过剂量-范围研究、随后为包括hp掺加以模拟残留vhp暴露的代表性工艺,确定添加至rsvpref2的fb制剂的最佳浓度。方法配制测试的rsvpref2量为:•低抗原剂量ld(与实施例1中相同)•中抗原剂量md(是低剂量的2倍)•高抗原剂量hd(是低剂量的5倍)制剂中的赋形剂的组成和比例与实施例1中相同。在本实施例中测试的最终散装疫苗中的met量范围为:•对于最终用5µmh2o2掺加的样品的生产,0/0.05/0.075/0.1/0.125/0.150/0.175/0.2mm。•对于最终用44µmh2o2掺加的样品的生产,0/0.25/0.5/0.625/0.75/0.875/1mm。•对于用0µmh2o2掺加的样品(空白生产),0/0.125/0.875mm。进行与实施例1相同的生产和评估过程(有/没有抗氧化剂的rsvpref2fb的制剂,掺加,4h的保持时间,与实施例1中相同的45h的冻干周期,在7d37℃的强制老化下储存fc)。关于在该剂量-范围研究中掺加的h2o2,增加用于掺加的h2o2浓度以包括更宽的边际,如下表3中所示,但h2o2浓度更低,代表更低的0.1ppm残留vhp。表3.本实施例中使用的关键vhp浓度(ppm)和对应的h2o2(µm)。[vhp]隔离体限值(ppm)对应的代表性[h2o2]掺加(µm)0.15.01.044.0不代表vhp隔离体限值的更高浓度168.0储存冻干后,将fc在4℃或37℃下储存7天用于加速稳定性研究。通过met343ox和rp-hplc,证明该持续时间足以达到氧化平稳期。分析学对产生的fclyo进行的分析仅限于与氧化关联的那些。考虑到在实施例1中,从氧化或从met添加未观察到对蛋白结构的影响,来进行这一点。进行的分析是:•h2o2定量:fc4℃,仅在rsvpref2中剂量下•rp-hplc(纯度):所有样品,作为筛选工具•lc-ms(met343ox):基于rp-hplc结果的样品选择(lc-ms通量限制)。在该实验期间进行额外的测量(药物物质的基本纯度和氧化),以增加基本氧化水平上的对照数目。结果在4℃下储存的fclyo中的hp含量图13显示在5µm掺加的情况下met添加对fclyo中的h2o2含量的影响的图示表示。在代表暴露于0.1ppmvhp的用5µmh2o2掺加的样品的情况下:•仅在不含游离met的样品中检测到h2o2,并且以非常低的水平进行定量。•在以0.05mm开始的met水平上,未发现剩余的h2o2,而在含有0mmmet的fc中定量20%平均剩余的h2o2(在fb中掺加的h2o2vs.在fclyo中测量的h2o2之间)。图14显示在44µm掺加的情况下met添加对fclyo中的h2o2含量的影响的图示表示。在代表暴露于1.0ppmvhp的用44µmh2o2掺加的样品的情况下:•仅在44µmh2o2掺加后存在0.25mmmet的情况下可检测到h2o2,其中在fclyo步骤检测到0.29µmh2o2。这等于h2o2含量从掺加浓度降低99.3%(相比之下,在met不存在的情况下,同一步骤的更低的73,6%降低)。•对于测试的较高met浓度(0.5mm和以上),在fclyo中未发现h2o2(h2o2含量从掺加浓度降低100%)。结论:在met存在的情况下,甚至在以下最低浓度下,也从fclyo完全消除h2o2:•当fb已经用5µmh2o2掺加时为0.05mm•当fb已经用44µmh2o2掺加时,从0.5mmmet开始。通过rp-hplc的纯度遵循与实施例1中相同的方法,本实施例中使用的药物物质批次的纯度用于建立具有基本氧化水平的参考。ds的纯度被确定为91.77%的值(n=1)。对于参考,获得的色谱图呈现于图15中。这随后为在4℃和7d37℃储存后通过rp-hplc分析fclyo中的rsvpref2的纯度。其显示:•rsvpref2剂量(低剂量vs.中剂量vs.高剂量)不影响在met不存在的情况下在44或5µmh2o2掺加后在fclyo步骤测量的纯度,主要值为:o在44µmh2o2掺加后,在7d37℃下的纯度水平在50%和60%之间o在5µmh2o2掺加后,在7d37℃下的纯度水平在80%和85%之间ovs.在ds和非掺加的fc中的92%值。•在4℃下非常短时间储存(<10d)后的纯度水平没有受到很大影响,因为在正常储存条件下,fclyo中的氧化是相对缓慢的过程。•在44µmh2o2掺加的情况下,纯度在0.625mm和0.75mm之间包含的met水平下恢复,并且所需的met水平与rsvpref2剂量无关。•在5µmh2o2掺加的情况下,纯度在0.075mm的met水平下恢复,并且所需的met水平与rsvpref2剂量无关。•这表现出h2o2掺加浓度和fb中控制rsvpref2纯度所需的met浓度之间的潜在的线性关系。图16显示在递增浓度的met存在的情况下和在fb步骤实现的5和44µmh2o2掺加后,在4℃和7d37℃下储存的fclyo中的rsvpref2纯度的演变。总之,在本实施例中,对于44µmh2o2掺加,至少0.625mm的met的水平(与抗原剂量无关)似乎适合于控制纯度。在本实施例中,对于5µmh2o2掺加,至少0.075mm的met的水平似乎适合于控制纯度(通过rp-hplc)。通过lc-ms的met343ox比率图17显示h2o2掺加后(在fb步骤)fc的met343ox比率相对于甲硫氨酸浓度的演变。通过lc-ms进行的测定rsvpref2抗原的met343ox比率的分析(如实施例1中所示)显示:•在本实施例中使用的ds批次表现出2.4%rsvpref2met343ox的天然氧化比率。•基于ld的rsvpref2的相同ds、但用0µm水掺加的参考fc表现出4.6%met343ox的氧化比率(相比于ds批次参考增加1.9倍)。•用44µmh2o2掺加且含有0mmmet的样品表现出基本的40.2%rsvpref2met343ox(相比于未掺加参考fc增加8.7倍)。•在h2o2暴露之前在fb制剂中添加0.75mmmet(显示足以控制对纯度的影响的量)后,rsvpref2met343ox降低至6.1%rsvpref2met343ox(相比于未掺加参考fc增加1.3倍)。•进一步增加met浓度(0.875和1.0mm)后,rsvpref2met343ox比率分别进一步降低至5.7和5.7%(相比于未掺加参考fc增加1.2倍)。•通过添加0.875µm的met,完全控制仅与冻干工艺相关的抗原的氧化(ds批次和未掺加的fc之间的met343ox水平增加)–显示在h2o2不存在的情况下添加抗氧化剂也是有效的。同时,用从先前实验获得的数据,我们显示:•在44µm掺加和较高met浓度(2.0mm)下,met343ox比率继续降低(3.6%),并且可达到未掺加fc值的氧化值(在这种情况下为3.3%)。然而,使用这些met水平没有达到用于配制的ds的met343ox水平(2.4%),但剂量-范围的数学预测(图18)显示6mmmet足以将met343ox水平控制至1.5%,回到ds批次氧化水平。一般结论通过lc-ms评价的氧化表明,需要比对于rp-hplc可测定的met浓度更高的met浓度。尽管后者表明线性关系似乎可适用于控制纯度,但通过lc-ms评价的氧化情况并非如此,因为该方法对氧化的灵敏度和特异性大得多。在这种情况下,对于met添加的效力存在饱和现象,并且图形预测似乎遵循功率衰减,推断出在2和13mm之间包含的更高的met添加,这取决于所需的氧化控制水平。最终容器疫苗的氧化比率与原始药物物质的氧化比率直接相关。此外,数据显示甚至在没有h2o2的情况下,在冻干期间也发生氧化,并且这种现象可通过添加met来控制。实施例3–用于含有蛋白d、pepila和uspa2的组合物的抗氧化剂评价含有蛋白d、pepila和uspa2的组合物中存在的抗原对通过vhp的氧化的敏感性。在以下实验中表明,蛋白d中的甲硫氨酸对氧化敏感,并且在蛋白d中,甲硫氨酸192特别敏感。第一项实验由用以下浓度范围内的液态h2o2掺加组成:0、150、800、1300和5000ng/ml。未用h2o2掺加(0ng/ml)的疫苗批次对应于参考样品,以生成未应激、未氧化的参考样品。以150和1300ng/ml掺加的样品分别代表用于在隔离体中以0.1和1ppmv/vvhp进行制造的暴露。然后将生成的样品冷冻干燥并进行在25℃、37℃和45℃的加速稳定性计划以及在4℃的实时稳定性。通过在不同的加速稳定性之后进行分析测试来评价h2o2掺加的影响。通过质谱表明,发现蛋白d是对氧化最敏感的抗原。我们观察到高百分比的氧化甲硫氨酸,并且通过sdspage和在rp-hplc色谱图中观察到分子量偏移。观察到h2o2水平对氧化的met192的水平的明显影响;h2o2的量越高,met192的氧化越多。基于m192氧化,可以建立相关性以确定蛋白d的其他甲硫氨酸的氧化水平,因此m192被用作氧化的探针。此外,表明甚至对于制造中的0.1ppmv/v的当量应激,也发生m192的氧化。结果如下显示于图19至21中。图19显示在不同温度下,对于0和1300ng/mlh2o2,蛋白dmet192随着时间氧化的质谱结果。在45℃下7天后,达到+/-55%氧化。图20显示在45℃下储存3天的具有1300ng/mlh2o2的氧化的蛋白d和在4℃下储存的未掺加的蛋白d的rp-hplc色谱图。图21显示在4℃下储存、在37℃下储存15天和在45℃下储存7天的氧化或未氧化的样品通过在未还原条件下的sds-page获得的抗原概况。泳道4、6和8显示氧化应激对蛋白d概况的影响。抗氧化剂的评价设计实验以发现使用抗氧化剂是否可以防止由于在生产规模上遇到的vhp氧化应激导致的蛋白d氧化,并且如果如此,确定哪种抗氧化剂是最合适的。再一次,将三价疫苗用h2o2掺加(或不掺加),且然后冷冻干燥。测试有和没有l-甲硫氨酸或半胱氨酸的制剂。在冷冻干燥之前,制剂含有50mm的l-甲硫氨酸或30mm的半胱氨酸。在37℃下2个月后,对含有50mm甲硫氨酸或30mm半胱氨酸作为抗氧化剂或根本没有抗氧化剂的氧化和未氧化样品进行sds-page,疏水性变体rp-hplc(其也可以称为通过rp-hplc的纯度)和质谱法。结果显示于图22、23和24中。在非还原条件下通过sds-page获得的抗原概况显示于图24中。当样品用h2o2掺加时,半胱氨酸和甲硫氨酸两者均阻止蛋白d的分子量偏移。在30mm半胱氨酸存在的情况下观察到pe-pila的概况改变。对于用h2o2掺加的样品和未用h2o2掺加的样品都是这种情况。对于3种抗原,在甲硫氨酸存在的情况下未观察到概况改变。对于疏水性变体rp-hplc,与未氧化的参考样品相比,对于3种抗原,在甲硫氨酸存在的情况下没有观察到概况改变。对于半胱氨酸,没有观察到氧化峰,尽管蛋白d主峰面积减少,如同h2o2掺加的对照样品。蛋白d的rp-hplc色谱图显示于图23中。对于通过质谱法的%甲硫氨酸氧化,添加抗氧化剂具有明显的防止蛋白d氧化的效力。甲硫氨酸存在的情况下的氧化水平略低于半胱氨酸存在的情况下的氧化水平。在h2o2、半胱氨酸或甲硫氨酸存在的情况下,对于pe-pila或uspa2没有观察到氧化的显著增加。仅蛋白d的结果显示于图22中。注意,在图22中,在代表具有30mm半胱氨酸的样品的60天结果的点后面看不到具有50mm甲硫氨酸的样品的60天结果。基于这些结果,甲硫氨酸被鉴定为针对包含蛋白d、uspa2和pe-pila的该疫苗中的h2o2介导的氧化进行保护的最合适的抗氧化剂。因此,进行甲硫氨酸剂量范围实验,以确定足以防止氧化的确切甲硫氨酸浓度。实施例4–剂量范围研究以确定甲硫氨酸用于针对氧化保护蛋白d的最佳浓度本实施例显示为了定义避免蛋白d氧化的最佳l-甲硫氨酸浓度而生成的rp-hplc和质谱数据。通过向含有不同浓度的l-met的含有蛋白d、pepila和uspa2的组合物中掺加1300ngh2o2/ml而测定l-甲硫氨酸作为抗氧化剂的最佳浓度(下表4)。随后将药物产品冷冻干燥并进行稳定性计划(表5)。表4id制剂掺加[h2o2]ng/ml[met]mm18cop14010018cop14071300018cop14021300518cop140313001018cop140413001518cop140513002518cop1406130050表5时间/温度t0天t7天t14天t30天t2月t3月t6月t9月t12月t18月t24月4℃xn/an/axn/axxxxxx37℃n/axxxxxn/an/an/an/an/a45℃n/axxn/an/an/an/an/an/an/an/a选择以下测试:•通过rp-hplc的疏水性变体:每个条件/时间点3个小瓶;对于所有样品都应用54min的运行(对于蛋白d特异性的),除了在45℃下15天后的批次18cop1401、18cop1402和18cop1407,对其应用154min的运行(对于3种抗原);将样品随机化于样品集合中;•通过质谱法的甲硫氨酸氧化(蛋白d的met192):对于在37℃下1个月后的批次18cop1401(参考样品)、18cop1403(具有10mmmet的氧化样品)和18cop1407(氧化的参考样品),6个小瓶。对于在37℃和45℃下7天和14天后的所有样品,基于rp-hplc数据选择含有10mml-met的样品用于质谱分析。该实验的关键目标是选择l-met作为保护药物产品免于氧化的抗氧化剂的最佳浓度。甲硫氨酸的最佳浓度确保掺加h2o2的样品的氧化水平至少与未掺加h2o2的对照样品一样好。为了确定此范围,第一步是找到可以证明其与对照样品相比不逊色的最低l-met浓度。这从最高剂量开始降至最低剂量进行评估。选择该剂量的接受标准基于通过质谱法的6%差异边际(即我们通过质谱法寻找m192氧化与参考的偏差不超过6%)或在疏水性变体rp-hplc的氧化峰表面积的方面等效的标准。除了不仅通过质谱法直接测量甲硫氨酸氧化,其还通过rp-hplc进行估算。发现rp-hplc氧化峰1、2和3的总和(参见下文)与m192氧化的质谱测量值良好地相关。此外,发现单独的峰3的%面积对于与质谱相关性远远可接受。rp-hplc方法具有在低氧化值下更快速且变化较小的优点。结果和讨论通过rp-hplc的疏水性变体rp-hplc用于观察纯度。图25显示对于样品18cop1407(0mml-met+h2o2)、18cop1402(5mml-met+h2o2)和18cop1401(0mmmet+无h2o2),在45℃2周后疏水性变体hplc154分钟色谱图。图26显示对于样品18cop1403(10mml-met+h2o2),在45℃2周后的疏水性变体hplc分钟色谱图。图27显示疏水性变体rp-hplc%峰3,在左小图中为没有抗氧化剂的未氧化的样品;右小图中为具有不同浓度的甲硫氨酸的氧化的样品。图28显示具有不同浓度的甲硫氨酸的氧化样品的疏水性变体rp-hplc%峰3。图29显示通过rp-hplc的峰1、2和3的面积总和。对于含有5mml-met和h2o2的样品以及对于不含甲硫氨酸和不含h2o2的参考样品,在45℃下2周后,在约60-62分钟没有观察到峰(图25)。对于这两种样品,在67分钟后,观察到轻微的氧化峰。然而,所述峰显示相似的强度。另一方面,对于含有h2o2、但不含甲硫氨酸的样品,在约60、62和67分钟观察到清晰的峰,分别命名为峰1、2和3。在45℃下1周后,进行相同的观察,用于与对其进行聚焦于蛋白d的色谱运行的10mm甲硫氨酸重叠。由于甲硫氨酸的存在,未观察到pe-pila和uspa2的概况变化(图25)。在色谱图上,可以分别在约38分钟和108分钟看到pe-pila和uspa2。当pe-pila用h2o2掺加时,在pe-pila分析性应激测试运动期间,也观察到含有h2o2、但不含甲硫氨酸的样品在约32分钟的小峰。在45℃下2周后,对于含有h2o2和10mm甲硫氨酸的样品,在主要蛋白d峰之前未观察到氧化峰(图26),含有h2o2和5mm的甲硫氨酸的样品也是如此(图25)。在45℃下1周后的含有h2o2和5、10和15mm甲硫氨酸的样品的覆盖图良好重叠,并且在这些样品中的任一者的主要蛋白d峰之前均未观察到有意义的氧化峰(未显示)。疏水性变体rp-hplc%峰3面积是峰3面积,其表示为所有峰总面积的百分比。%峰3面积显示从未掺加的参考样品(0mmmet)的约2%直至无甲硫氨酸且用1300ngh2o2/ml掺加的样品的约27%的明显的增加(参见图27)。对于用h2o2掺加的含有5mm或更多的甲硫氨酸的样品,未观察到疏水性变体rp-hplc%峰3面积的这种增加。rp-hplc%峰3面积在0和5mml-甲硫氨酸之间的演变是未知的,尽管注意到%峰3的增加在某个点处必须是急剧的,因为对于不含甲硫氨酸的用h2o2掺加的样品观察到约27%。此外,观察到,含有甲硫氨酸和h2o2的样品的%峰3面积低于不含甲硫氨酸和没有掺加的h2o2的参考样品(参见图28)。假设这是由于在配制、填充和冷冻干燥过程期间参考样品的一些轻微氧化,而在制剂中不存在甲硫氨酸来保护免于这种氧化。由于甲硫氨酸的存在,在此处理期间,含有甲硫氨酸(且用h2o2掺加)的样品被保护免于氧化。这可以解释为什么与未掺加的无甲硫氨酸参考样品相比,对于用h2o2掺加且含有甲硫氨酸的样品观察到更低的%峰3面积。此后,给出对峰3面积进行的统计分析的概述。发现峰3比峰2更适合用于分析,因为对于峰2观察到的信号弱。在用1300ngh2o2/ml掺加的样品中,在第7天和第14天,37℃或45℃观察到峰3。对于含有至少5mm甲硫氨酸的样品,面积峰3的结果达到非劣效性标准,因为组差异(处理的减去对照)的2侧标准化渐近线90%ci的上限分别低于387000和260000[非劣效性的限值])。这对应于通过质谱法测量的分别为9%和6%的可接受差异。对于不存在甲硫氨酸的用1300ngh2o2/ml掺加的样品,不符合非劣效性标准。通过液相色谱联用质谱的甲硫氨酸氧化蛋白d图30显示在37℃下1个月后以%计的蛋白dm192氧化的液相色谱联用质谱。左小图含有未用h2o2掺加的样品,在右小图中为在冷冻干燥前接受1300ngh2o2/ml的样品。误差条指示95%置信区间。图31显示在37℃下1个月后以%计的蛋白dm192氧化的液相色谱联用质谱。左小图含有未用h2o2掺加的样品,在右小图中为在冷冻干燥前接受1300ngh2o2/ml且含有10mm甲硫氨酸的样品。误差条指示95%置信区间。蛋白d甲硫氨酸192(m192)的质谱数据描绘于图30中。未用h2o2掺加且不含甲硫氨酸的样品显示非常有限水平的m192氧化,而用h2o2掺加且不含甲硫氨酸的样品清楚地显示高水平的m192氧化-约50%,并且不符合统计学的非劣效性标准。含有10mml-met且用h2o2掺加的样品的氧化水平低于或等于未掺加的参考。该样品符合统计学的非劣效性标准,因为组差异(处理的减去对照)的2侧标准化渐近线90%ci的上限低于6%[非劣效性的限值]。至于疏水性变体rp-hplc,与未掺加的不含甲硫氨酸的样品相比,含有甲硫氨酸的样品的氧化似乎略少(图31)。上面在rp-hplc结果的讨论中给出了这种观察的可能解释。pe-pila对于pe-pilam215氧化,在37℃下30天后观察到的氧化水平与所有测试样品在相同范围内(数据未显示)。在未掺加h2o2的参考和含有10mm甲硫氨酸的掺加h2o2的样品之间没有发现差异。uspa2对于uspa2m530氧化,未用h2o2掺加且不含甲硫氨酸的样品显示非常有限水平的m530氧化(约2%)。用h2o2掺加且不含甲硫氨酸的样品清楚地显示较高水平的m530氧化;约8%,并且确实符合统计学的非劣效性标准。含有10mml-met且用h2o2掺加的样品的氧化水平低于未掺加的参考(数据未显示)。摩尔考量由于氧化是一种化学反应,因此有趣的是以摩尔数表示氧化剂和抗氧化剂的量,以理解摩尔比的理念。以摩尔计,反应物和试剂的量如下:量摩尔量掺加1300ng/mlh2o20.038mm蛋白d浓度(药物产品中25μg/ml,每个蛋白d分子40kda)0.0006mm可以看出,与蛋白d相比,h2o2分子有63倍过剩。然而,如果将10mm的甲硫氨酸添加至药物产品中,则对于以1300ng/ml掺加的h2o2的每个分子,存在263个甲硫氨酸分子。因此,添加甲硫氨酸大大降低h2o2与蛋白d反应的机会。结论我们显示,对于在气相中以0.1ppmv/v或1ppmv/vh2o2暴露执行的等效制造工艺,观察到蛋白d的氧化。我们证明添加抗氧化剂、特别是l-甲硫氨酸或半胱氨酸可以防止这种氧化。当决定待添加至药物产品中的甲硫氨酸浓度时,考虑以下几点;-[met]应当在隔离体中保护1ppmv/vh2o2工艺,以确保制造灵活性。-10mmmet给出足够的安全边际和在较低浓度(5mm)的数据点,为此rp-hplc峰3面积保持低于未氧化的参考(未掺加h2o2)。-基于含有蛋白d、pepila和uspa2的组合物中存在的3种抗原上的敏感甲硫氨酸的质谱结果,10mm甲硫氨酸已经证明良好保护免于氧化。-由于这些原因,在本实施例中为该疫苗选择10mml-met的浓度。实施例5–用于活载体疫苗的抗氧化剂针对通过用于商业填充/传输线的灭菌的残留vhp的潜在氧化评价chad155-rsv腺病毒载体。本文使用的chad155-rsv载体含有编码来自呼吸道合胞病毒的f、n、m2结构蛋白的rsv转基因。在缺失chad155e1和大部分e4区域后,将转基因插入腺病毒载体。此外,为了提高表达ad5e1区的人包装细胞系中的chad155载体的生产力,用ad5e4orf6取代天然黑猩猩e4区。将活载体疫苗以0、150和1300ng/mlh2o2(代表商业设施中的0ppm、0.1ppm和1ppmvhp的条件)用h2o2掺加。在有和没有甲硫氨酸的情况下和不同剂量的甲硫氨酸下进行实验。然后将疫苗剂量填充并冷冻干燥并进行加速稳定性研究。使用以下方法来评价h2o2/抗氧化剂对活载体疫苗的影响。通过facs分析测量病毒感染性。通过hplc测量病毒颗粒含量。病毒dna含量通过qpcr(定量pcr)测量。使用picogreen测定法通过dna释放测量病毒衣壳完整性。细节在下面给出。表6.picogreen测定实验条件对新鲜和降解的ds对照(其对于将对于样品获得的标准化值归一化是必需的)进行picogreen测定。从dna试剂试剂盒的标准曲线获得标准化值。然后,通过将样品的值与在新鲜对照和降解的对照之间计算的标准直线关联,从新鲜对照(考虑为基质中的dna释放的0%)和降解的对照(考虑为基质中dna释放的100%)的标准化值进行归一化的计算。通过将稀释至制剂浓度的ds在60℃下放置30分钟来获得降解的对照。表7.通过facs实验条件的感染性hplc和qpcr的结果显示,用h2o2掺加没有明显的影响。这显示氧化没有完全改变病毒颗粒或dna的完整性,因此在h2o2掺加后,颗粒-内容物和整个dna保持稳定。然而,通过facs分析的感染性和通过picogreen测定的dna释放受到影响,并且显示于图32和33中。这些测试(平均值±sd,n=2)显示,代表0.1和1ppm残留vhp的条件在25℃下一个月(1m25℃)后显著影响两种cqa。这显示氧化既改变衣壳完整性,又降低病毒感染细胞的能力。在1m25℃下,使用0和25mm之间的甲硫氨酸浓度进行剂量范围研究。对于剂量范围研究,通过facs的感染性显示于图34中。结果与先前的研究一致(在1ppmvhp下,在t0和t1m25℃之间损失0.4log)。在vhp不存在的情况下,在t1m25℃和t1m4℃之间的感染性差异在甲硫氨酸浓度间相对稳定。在vhp存在的情况下,增加甲硫氨酸浓度显著改善t1m25℃和t1m4℃之间的感染性差异,并且似乎在约5mm甲硫氨酸达到平稳期。通过picogreen的衣壳完整性显示于图35中。picrogreen%是样品和降解的对照的测量的荧光之间的比率。降解的对照是在60℃下放置30分钟的稀释至制剂浓度的组合物的样品。chad155六邻体甲硫氨酸氧化通过lc-ms测量,并且其中所述甲硫氨酸中的五个(met270、299、383、468和512)的结果显示于图36中。六邻体蛋白是腺病毒主要衣壳蛋白,并且含有大量甲硫氨酸。基于其位置、敏感性和氧化速率选择met270、299、383、468和512。chad155六邻体蛋白ii主要衣壳蛋白序列在seqidno:21中给出。结果显示,5mm或更高的甲硫氨酸阻止1ppmvhp对活载体疫苗的作用,并且甚至在h2o2不存在的情况下,甲硫氨酸也保护疫苗免于冻干的影响。在图36中,每个甲硫氨酸的前五个条显示在h2o2不存在的情况下添加的渐增量的甲硫氨酸(从零开始)。第二的五个条显示在存在1ppmvhp的当量的情况下递增的甲硫氨酸。当计算图36中显示的五个甲硫氨酸的平均值时,也可以清楚地看到甲硫氨酸的保护作用。因此,确立5mm和以上的甲硫氨酸能够控制vhp对t1m25后的cqa和metox比率的影响。本实施例显示,甲硫氨酸添加再次是抵消与工艺应激(冷冻干燥和h2o2暴露)相关的氧化(这次是对活病毒疫苗)的影响的有效解决方案。序列seqidno:1rsvpref序列seqidno:2作为seqidno:1的部分的rsvpref序列seqidno:3另外的rsvpref序列seqidno:4另外的rsvpref序列seqidno:5另外的rsvpref序列seqidno:6卷曲-螺旋(异亮氨酸拉链)序列seqidno:7从seqidno:3中显示的前体序列产生的成熟多肽的f1链seqidno:8从seqidno:3中显示的前体序列产生的成熟多肽的f2链seqidno:9物质p(实施例中使用的模型肽)seqidno:10蛋白d(364个氨基酸)seqidno:11具有来自ns1的mdp三肽的蛋白d片段(348个氨基酸)seqidno:12ep0594610中描述的蛋白d片段的开始seqidno:13来自流感嗜血杆菌的蛋白eseqidno:14来自流感嗜血杆菌的蛋白e的氨基酸20-160seqidno:15来自流感嗜血杆菌的pilaseqidno:16来自流感嗜血杆菌菌株86-028np的氨基酸40-149seqidno:18没有信号肽的pe-pila融合蛋白seqidno:19来自卡他莫拉氏菌(来自atcc25238)的uspa2a2seqidno:20uspa2的免疫原性片段(31-564)seqidno:21chad155六邻体蛋白ii主要衣壳蛋白当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1