杀病毒纳米颗粒及其对流感病毒的用途
本发明涉及包含三糖部分的杀病毒纳米颗粒及抗流感病毒的用途。
背景技术:
流感病毒是最具传染性的病毒。每年,不同的流感病毒株感染动物和人类的很大一部分,危及婴儿、老年人和免疫功能低下的人,所有这些人都有因流感相关并发症而住院和死亡的风险。因此,季节性流感对社会经济产生了显著影响。实际上,在发达国家以及主要在发展中国家,呼吸道疾病会花费卫生总费用的很大一部分。由于流感突变如此迅速,开发疫苗仍然是一项重大挑战。若只关注偶发性大流行而不是每年的爆发,则疫苗的开发会面临更大的挑战。这种情况对新疫苗的开发时间(平均为6个月)构成严重风险。此外,即使在存在疫苗的情况下,也远未能达到合理的疫苗接种覆盖率。因此,仍然存在新的大流行(如西班牙流感)风险,其被认为是对全球健康的最大威胁之一。
自然,疫苗之后的第二道防线是抗病毒药物。目前已批准了多种抗流感药物:神经氨酸酶抑制剂如扎那米韦(zanamivir)和奥司他韦(oseltamivir),离子通道抑制剂如金刚烷胺(amantadine),融合抑制剂如阿比朵尔(umifenovir)(仅在俄罗斯和中国)和聚合酶抑制剂如baloxavirmarboxil(最近在美国和日本批准)。然而,已经认识到当前药物的功效远非理想。对这些药物的关注范围从明显的副作用到短时间使用后出现药物抗性病毒。考虑到这个问题的重要性,许多其他药物正在临床试验中。这些药物大多数是抑制病毒与宿主细胞融合的单克隆抗体。尽管它们很有前途,但它们的成本很可能会因制造工艺而很高。
在靶向病毒的保守部分的分子开发方面有相当多的研究路线。此外,寻找毒性有限的杀病毒(即不可逆)药物非常具有挑战性。最近,尽管发现从蛙皮分离的肽具有这种特性,但是它们的ec50仅微摩尔,并且其毒性是有争议的。
病毒血球凝集素(ha)与在宿主细胞上携带唾液酸(sa)的糖蛋白之间的相互作用是流感传染的主要步骤。sa和ha之间的结合亲和力低,并且通过多价结合来补偿。受这种自然现象的启发,已经多次尝试使用sa包被的多价材料(例如聚合物、树状聚合物和纳米颗粒)以抑制流感病毒。
reuter等人合成了具有各种结构的经唾液酸装饰的聚合材料,例如线性聚合物、梳状支化聚合物和树状结构;对它们进行了针对不同株的甲型流感病毒的测试。发现只有高分子量(>100kda)的支化结构以微摩尔浓度的唾液酸抑制一种流感病毒x-31株。papp等人测试了唾液酸官能化的金纳米颗粒(np)对x-31流感病毒株的抑制活性,并报道了核直径为14nm的np具有比2nm的np更好的抑制活性。但是,在这项研究中,他们没有提及抑制病毒的np浓度。该小组也合成了不同尺寸的经唾液酸装饰的糖结构,并以毫摩尔浓度抑制x-31株。
已知人流感病毒优先结合糖蛋白上的α2,6-连接的sa。最近,事实证明,携带有α2,6-唾液酸乳糖(sialylactose)的多价材料以低微摩尔浓度抑制流感病毒。tang等人合成了携带有α2,6-唾液酸乳糖的刷状聚合物,其以微摩尔浓度的唾液酸单元抑制甲型流感pr8株。kwon等人用α2,6-唾液酸乳糖装饰的pamam树状聚合物,并抑制了数种流感病毒株,例如甲型流感pr8、cal09和nws33。
体外(invitro)抑制流感病毒的微摩尔材料浓度仍然过高,体内(invivo)浓度甚至更高。另外,大多数进入抑制剂是抑病毒的;病毒经病毒-材料复合物的体外稀释后又再次具有感染力。
在没有广谱有效的疫苗的情况下,针对流感的药物的需求尚未得到满足。理想的抗流感药物应该是广谱的,靶向病毒的高度保守的部分,具有不可逆的作用,即在低浓度下具有杀病毒作用(以避免因在体液中稀释而失去功效),以及显然是无毒的。
技术实现要素:
为了解决这个问题,本发明提供了一种与ha强烈相互作用、以低浓度不可逆地抑制流感病毒的感染性并且显示出极低毒性的纳米颗粒。
本发明的一个方面提供了一种杀病毒纳米颗粒,其包含核和与所述核共价连接的多个配体,其中所述配体的至少一部分包含三糖部分,并且其中:
-所述核是环糊精,
-所述配体是相同的或不同的,并且是基于任选取代的烷基的配体,以及
-每个三糖部分选自3-唾液酸-n-乙酰基乳糖胺(3’sln)和6-唾液酸-n-乙酰基乳糖胺(6’sln)。
本发明的另一方面提供了由式(i)表示的杀病毒纳米颗粒
其中,
m是2至8,以及
n是2至28、或4至13。
本发明的另一方面提供了一种由式(ii)表示的杀病毒纳米颗粒或其药学上可接受的盐:
其中,
每个r独立地是基于任选取代的烷基的配体,其中,所述配体中的至少两个具有选自包括3-唾液酸-n-乙酰基乳糖胺(3’sln)和6-唾液酸-n-乙酰基乳糖胺(6’sln)的组的三糖部分,或其中所述配体中的至少一个具有3’sln,且另一个具有6’sln;
每个r’独立地是h、-(ch2)y-cooh、-(ch2)y-so3-、聚合物或水溶性部分;
x是6、7或8;和
y是4到20的整数。
本发明的另一方面提供了一种药物组合物,其包含有效量的一种或多种本发明的杀病毒纳米颗粒和至少一种药学上可接受的赋形剂、载剂和/或稀释剂。
本发明的另一方面提供了本发明的杀病毒纳米颗粒,其用于治疗和/或预防流感病毒感染和/或与流感病毒有关的疾病。
本发明的另一方面提供了杀病毒组合物,其包含有效量的一种或多种本发明的杀病毒纳米颗粒和任选的至少一种合适的气溶胶载剂。
本发明的另一方面提供了一种消毒和/或灭菌的方法,其包括使用本发明的杀病毒组合物或本发明的杀病毒纳米颗粒。
本发明的另一方面提供了一种设备,其包括:本发明的杀病毒组合物或一种或多种本发明的杀病毒纳米颗粒,以及用于施用或分配所述杀病毒组合物或所述杀病毒纳米颗粒的装置。
本发明的另一方面提供了本发明的杀病毒纳米颗粒或本发明的杀病毒组合物用于灭菌和/或消毒的用途。
附图说明
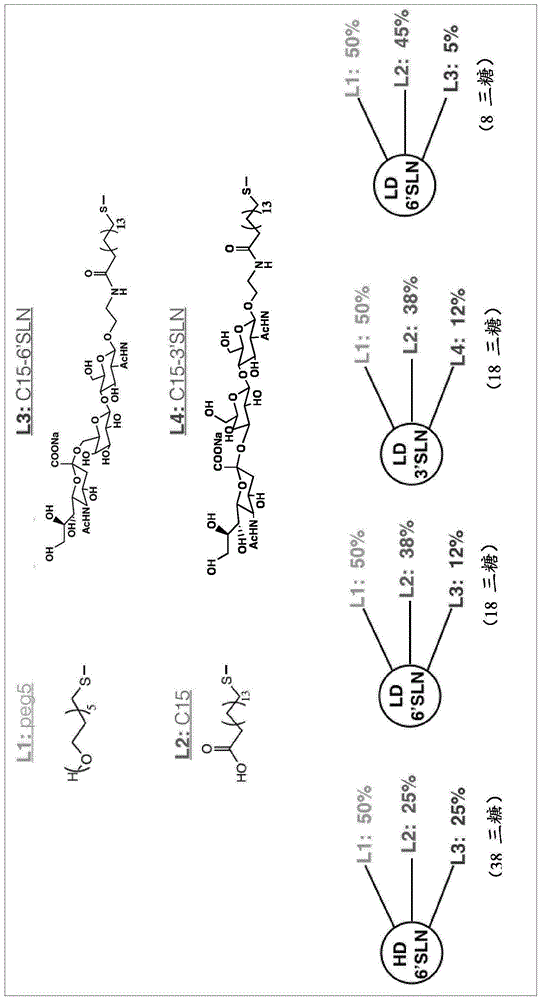
图1显示了具有不同配体组成的纳米颗粒的化学结构。平均纳米颗粒直径:2.9±0.9nm。
图2显示了h3n2病毒vic/11株的tem图像:没有纳米颗粒(a),与ld6’sln纳米颗粒孵育1小时后的病毒(b),和与peg(5)纳米颗粒孵育1小时后的病毒(c)。
图3示出了c15-6’sln改性的β-cd的化学结构(a)。该经改性的cd对不同流感株的ec50浓度(b)。对neth/09株的杀病毒活力(c)在mucilair上的离体(exvivo)实验(d)。该经改性的cd与ha球状头相互作用的图示(e)。
图4显示了示例性的经改性的环糊精。每个β-cd的6’sln或3’sln的数目是通过1hnmr计算得出的平均值。基于nmr结果构建了经改性的环糊精的代表性化学结构。ec50代表在24hpi的mdck细胞上抗甲型/荷兰/2009(h1n1)的半数抑制浓度(图7)。n/a:不可评估。为了易于参考,在这些3d结构中未显示一些在背面的环糊精糖、配体和三糖。
图5显示了进行1hnmr研究以表征图4中所示的经改性的环糊精。每个β-环糊精的6’sln或3’sln的平均值是通过比较来自三糖(◆)的独特峰和β-环糊精(·)的独特峰来计算的。两个峰均对应于单个氢。
图6显示了剂量-反应曲线,表明c6-6’(a)、c14-6’(b)、c11-3’(c)和c1-6’(d)抗甲型/荷兰/2009h1n1的抗病毒活性。结果是一式两份进行的两次独立实验的平均值。
图7显示了剂量-反应曲线,表明c11-6’抗乙型/威斯康星州/2010(a)、甲型/临床/2018h1n1(b)、甲型/新加坡/2004h3n2(c)和乙型/临床/2018(d)的抗病毒活性。结果是一式两份进行的两次独立实验的平均值。
图8显示了剂量-反应曲线,表明c11-3’抗禽病毒株甲型/土耳其/土耳其/2005h5n1(以及c11-6’对照)(a)和甲型/土耳其/意大利/977/1999h7n1(b)的抗病毒活性。在图a的情况下,用facs和icc两者方法定量感染。结果是一式两份进行的两次独立实验的平均值。
图9显示了c11-6’和p8-6’在体外的抗病毒活性比较。小图(a)和(b)在左图上显示了每种化合物抗甲型/nl/09的抑制活性,并与细胞活力测定的结果叠放。所有化合物均表现出非常相似的行为。这些小图的右图显示了杀病毒(即稀释)测试的结果。请注意,在图的轴上,ffu代表病灶形成单位,nt代表未处理组。在(c)中,测试了c11-6’抗以下病毒株:甲型/新加坡/2004(h3n2)、乙型/威斯康星州/2010和甲型/临床/2018(h1n1)。结果是一式两份进行的两次独立实验的平均值和sem。
图10显示了c14-6’(a)、c6-6’(b)和c11-3’(c)抗甲型/荷兰/2009(h1n1)的杀病毒活性。实验是在100μg/ml的化合物浓度下进行的。结果是两次独立实验的平均值和sem。
图11显示了c11-6’和p8-6’的离体抑制活性比较。c11-6’在共同处理条件下提供了抗临床大流行h1n109株的全面保护,而p8-6’仅在感染开始时提供了较小的保护(a)。在图11(b)中,感染后7天(共同处理条件)的免疫荧光证实了c11-6’提供的保护作用。红色:单克隆抗体甲型流感,蓝色:dapi,绿色:β-iv-微管蛋白(纤毛细胞的标记)。在相应图像的底部显示了每个组织的厚度(b)。c11-6’在治疗后条件下也显示出很高的功效(c)。(a)和(c)的结果为一式两份进行的2至4个独立实验的平均值和sem。(b)的图像代表每个条件下拍摄的10张图像。
图12显示了ldh从感染组织中的释放。组织被感染,并在感染时用c11-6’(50μg)或p8-6’处理。使在96hpi和24hpi进行的顶端洗涤物经历ldh测量。结果是针对h1n1和h1n1c11-6’的两个独立实验的平均值和sem,以及针对p8-6’的一式两份进行的单个实验的平均值和sem。
图13显示了长期共同处理实验。组织被感染,并在感染时用c11-6’(50μg)处理。在前5天,然后在第9、17和23天,每日收集顶端洗涤物,在前一天进行清洗以评估每日的病毒产量。结果是一式两份进行的单个实验的平均值。
图14显示了离体毒性。每天添加不同剂量的c11-6’或等体积的培养基或5%triton来处理组织。处理后96小时,对组织进行以下处理:a)mtt分析,b)评估组织活力的ldh分析,c)经上皮抗性评估和d)elisa分析以评估促炎性细胞因子的释放。ldh和elisa对收集的基础培养基进行。实验是两个独立实验的平均值和sem。
图15显示了c11-6’的体内抗病毒活性。(a)至(c)小鼠在感染甲型/nl/09的同时和感染后48小时用pbs或c11-6’鼻内处理。在感染后48小时和96小时定量病毒载量(a),并每天监测感染小鼠的发病率(温度(b)和体重(c)降低)。(d)至(f)小鼠在感染后6小时用pbs或c11-6’鼻内处理,并且每天处理,共处理3天(每只小鼠14μg)。每天监测感染小鼠的发病率(d)-(e)和存活率(f)。结果表示为平均值±sem。箭头指示治疗时间。
图16显示了β-环糊精、6’sln-β-乙胺和c11-6’的1hnmr叠加光谱。
图17显示了c11-6’的dosy光谱,表明所得化合物不含未结合的三糖。
图18显示了针对facs执行的门控策略。
具体实施方式
本文所提及的所有公开、专利申请、专利和其它参考文献都通过引用整体并入。提供本文所讨论的公开和申请仅因其公开先于本申请的提交日期。本文并无内容将被解释为承认本发明由于在先的发明而无权提前于所述公布。另外,材料、方法和实例仅为说明性的,并不旨在限制。
在冲突的情况下,以包括定义的本说明书为准。
除非另外限定,本文所使用的全部技术和科学术语都具有与本发明所属技术领域的技术人员通常理解的含义相同的含义。如本文所使用的,提供以下定义以促进对本发明的理解。
术语“包含”通常在包括的意义上使用,也就是说,允许存在一个或多个特征或成分。此外,正如在说明书和权利要求书中所使用的,术语“包含”可以包括以“由……组成”和/或“基本由……组成”描述的类似实施方案。
如说明书和权利要求书中所使用的,在短语例如本文的“a和/或b”中使用的术语“和/或”旨在包括“a和b”、“a或b”、“a”、和“b”。
如本说明书和附随的权利要求书中所用,单数形式的不定冠词“a”,“an”和定冠词”the”包括复数的引用,除非上下文另有明确指示。
如说明书和权利要求书中所使用的,在短语例如“至少一个c原子”中使用的术语“至少一个”可以意指“一个c原子”、或“两个c原子”、或更多的c原子。
如本文所用,术语“抑病毒”是指通过证明病毒在与抗病毒组合物相互作用后可逆地抑制其感染性的体外测试确定的抗病毒功效的特征。例如,这种相互作用通过与病毒结合或以其他方式干扰病毒的表面配体来抑制感染性。但是,一旦相互作用终止(例如,通过稀释),并且在没有促进病毒重构的任何添加材料或条件的情况下,病毒则有可能恢复感染性。
如本文所用,术语“杀病毒”是指通过证明病毒在与抗病毒化合物或组合物相互作用后不可逆地抑制其感染性的体外测试确定的抗病毒功效的特征。例如,这种相互作用通过与病毒结合或以其他方式干扰病毒的表面配体来抑制感染性。但是,即使在相互作用终止后(例如,通过稀释),并且在没有促进病毒重构的任何添加材料或条件的情况下,病毒也基本上无法恢复感染性。
如本文所用,术语“生物相容性”是指与活细胞、组织、器官或系统的相容性,并且没有显著的损伤、毒性或被免疫系统排斥的风险。
如本文所用,“纳米”(例如,在“纳米颗粒”中使用的)是指纳米尺寸,例如具有纳米尺寸的颗粒,并且无意表达任何特定的形状限制。特别地,“纳米颗粒”涵盖纳米球、纳米管、纳米盒、纳米晶簇、纳米棒等。在某些实施方案中,本文考虑的纳米颗粒和/或纳米颗粒核具有大体多面体或球形的几何形状。
如本文所用,“流感”是指寻求唾液酸的空气传播的(人或动物)rna病毒,例如甲型流感病毒、乙型流感病毒、丙型流感病毒和丁型流感病毒。甲型流感病毒包括以下血清型:h1n1、h2n2、h3n2、h5n1、h7n7、h1n2、h9n2、h7n2、h7n3、h10n7、h7n9和h6n1。
如本文所用,术语“烷基”是指含有1至50个碳原子、优选4至30个碳原子的直链烃。烷基的代表性实例包括但不限于甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基……
如本文所用,术语“羧基烷基”是指通过本文所定义的烷基与母体分子部分连接的羧基。
尽管已知α2,6-连接的唾液酸与人流感病毒相互作用,但提供高亲和力结合的确切聚糖序列在文献中仍然不清楚。本发明人已经证明,大多数的人流感病毒以高亲和力结合以两个或多个、优选三个或四个三糖部分为末端的聚糖,特别是以6-唾液酸-n-乙酰基乳糖胺(6’sln)或3-唾液酸-n-乙酰基乳糖胺(3’sln)为末端的聚糖。
本发明的一个方面提供了一种杀病毒纳米颗粒,其包含核和与所述核共价连接的多个配体,其中所述配体的至少一部分包含三糖部分,并且其中:
-所述核是金属纳米颗粒或有机材料,其中,优选地,所述金属纳米颗粒选自包括以下的组:金纳米颗粒、铁氧化物纳米颗粒、银纳米颗粒、铂纳米颗粒、钴纳米颗粒、锌纳米颗粒、二氧化硅纳米颗粒、硒化镉纳米颗粒、金银合金纳米颗粒、氧化铝纳米颗粒、氧化铜纳米颗粒、氧化镁纳米颗粒、氧化镍纳米颗粒、二氧化钛纳米颗粒、氧化锌纳米粒子,更优选地,金属纳米颗粒是金纳米颗粒,并且其中有机材料选自包括以下的组:环糊精、聚合物、树状聚合物和树枝突聚合物(dendron),优选地,所述有机材料是环糊精,
-所述配体是相同或不同的,并且是基于任选取代的烷基的配体或基于聚乙二醇(peg)的配体。优选地,基于任选取代的烷基的配体是基于任选取代的c4-c30烷基的配体,更优选地,所述基于任选取代的烷基的配体是基于任选取代的c4-c30羧基烷基;优选地,基于peg的配体选自包括peg3、peg4、peg5、peg6、peg7、peg8的组;更优选地,所述配体衍生自包括聚乙二醇5(peg5)、16-巯基十六烷酸(c15)和11-巯基十一烷酸的组,
-所述三糖部分是3-唾液酸-n-乙酰基乳糖胺(3’sln)和/或6-唾液酸-n-乙酰基乳糖胺(6’sln)。
在本发明的上下文中,三糖部分以使得任何其他配体都不妨碍三糖部分与流感病毒之间的相互作用的方式暴露于共价结合到纳米颗粒(np)的外表面的配体上。
核的平均直径为约1.0nm至约200nm,优选为1nm至5nm,最优选为1.5nm至3nm。总的纳米颗粒尺寸具有3nm至250nm、或3nm至200nm、优选3nm至10nm、更优选4.5nm至6nm的平均粒径。
在一些实施方案中,本发明的杀病毒纳米颗粒中的核是有机材料,优选聚合物,其中聚合物选自包括以下的组:聚丙烯酸(paa)、聚乙烯醇(pva)、聚乙二醇(peg)、聚乳酸(pla)、聚乙交酯(pga)、聚二噁烷酮(pdo)和聚乳酸-乙醇酸共聚物。
在一些实施方案中,本发明的杀病毒纳米颗粒中的核是有机材料,优选地选自包括聚酰胺胺(pamam)和bis-mpa的组的树状聚合物。
在一些实施方案中,本发明的杀病毒纳米颗粒中的核是有机材料,优选地选自包括聚酰胺胺(pamam)和bis-mpa的组的树枝突聚合物。
在优选的实施方案中,本发明的杀病毒纳米颗粒中的核是有机材料,其为环糊精。
环糊精(cd)是天然存在的环状葡萄糖衍生物,其由α(14)连接的吡喃葡萄糖苷单元组成。它们的环状结构形成截锥形,其葡萄糖单元的伯羟基在窄面上,仲羟基在宽面上。每个面都可以轻松独立地进行功能化。最常用的天然cd具有6、7和8个吡喃葡萄糖苷单元,分别称为α、β和γ-环糊精。优选的环糊精是β。由于cd的环状结构,它们具有能够与客体分子形成超分子包合物的腔。由于cd是天然存在的,易于功能化,具有用于客体包合的腔并且是生物相容的,因此已发现它们可用于许多商业应用中,包括药物输送、空气清新剂等。cd的各个面的反应性的差异已被用于合成众多经改性的环糊精。cd的主要面更容易被改性,可以控制取代的程度和位置。具有良好离去基团的cd衍生物(例如,卤化的cd)是cd功能化的重要中间体。通过用碘代单元取代cd的所有伯羟基单元,得到使得主要面能够完全官能化并同时保留仲羟基和刚性截锥形完整的中间体。在一个实施方案中,先合成七-6-碘-6-脱氧-β-环糊精,然后与巯基十一烷磺酸酯(mercaptoundecaosulphonate,mus)反应以产生在主要面上用十一烷磺酸酯基团官能化的cd。然后可以独立地改性环糊精的次要面以引入其他的增溶基团、染料分子、聚合物等。此外,β-cd的尺寸(d约为1.5nm)落入本发明的核的优选的纳米尺寸之内,并与ha球状头部(约5nm)很好地匹配。β-环糊精具有被认为有助于杀病毒活性的刚性的化学结构,并且取决于窄面,可以具有最多7个带有三糖的配体,优选具有3至4个带有三糖的配体,其中三个是流感病毒ha球状头中唾液酸结合点的数量。
本发明的杀病毒纳米颗粒也可以是纯化的单分子或化合物,其也旨在包括在本发明的范围内。
本发明的一个实施方案提供了一种杀病毒纳米颗粒,其包含核和与所述核共价连接的多个配体,其中所述配体的至少一部分包含三糖部分,并且其中:
-所述核是环糊精,优选地选自包括α-环糊精、β-环糊精、γ-环糊精或其组合的组,
-所述配体是相同或不同的,并且是基于任选取代的烷基的配体,优选基于任选取代的c4-c30烷基的配体,更优选基于任选取代的c6-c15烷基的配体,
-每个三糖部分选自3-唾液酸-n-乙酰基乳糖胺(3’sln)和6唾液酸-n-乙酰基乳糖胺(6’sln)。
在本发明的杀病毒纳米颗粒的一些实施方案中,所述配体中的一些或全部包含3’sln,所述配体中的一些或全部包含6’sln,并且所述配体中的一些但并非全部不包含三糖部分。
本发明的杀病毒纳米颗粒,其中所述核为环糊精,可以由式(i)表示:
其中,
m是2至8,优选m是2至7、或2至6,最优选m是3或4,
n是2至28、或4至13、或4至30、或6至15,优选是2至28、或4至13,在一些实施方案中,n是2或4或6至13或28或30,和
优选地,环糊精选自包括α-环糊精、β-环糊精、γ-环糊精或其组合的组。
本发明的另一方面提供了由式(ii)表示的杀病毒纳米颗粒或其药学上可接受的盐:
其中,
每个r独立地是基于任选取代的烷基的配体,其中,所述配体中的至少两个具有选自包括3-唾液酸-n-乙酰基乳糖胺(3’sln)和6-唾液酸-n-乙酰基乳糖胺(6’sln)的组的三糖部分,或其中所述配体中的至少一个具有3’sln,另一个具有6’sln;优选地,基于任选取代的烷基的配体是基于任选取代的c4-c30烷基的配体,更优选地是基于任选取代的c6-c15烷基的配体,或包含6’sln的基于任选取代的c6-c15烷基的配体;
每个r’独立地是h、-(ch2)y-cooh、-(ch2)y-so3-、聚合物或水溶性基团;优选地,r’是h;优选地,r’独立地是h、-(ch2)y-cooh、-(ch2)y-so3-或聚合物;优选地,r’独立地是-(ch2)y-cooh、-(ch2)y-so3-或聚合物;优选地,r’独立地是h、-(ch2)y-cooh或-(ch2)y-so3-;优选地,r’独立地是-(ch2)y-cooh或-(ch2)y-so3-;
x是6、7或8;和
y是至少4至约20的整数,优选地,y是至少4,优选y是4至20,优选y是7至11,优选y最是10。在其他实施方案中,y是至少6、至少7、至少8、至少9、至少10、至少11。在其他实施方案中,y是至多100、至多70、至多50、至多25、至多20、至多15。
本发明的杀病毒纳米颗粒中的聚合物可以选自合成聚合物和天然聚合物二者。在本发明的一个实施方案中,所述合成聚合物选自包括但不限于以下的组:聚(乙二醇)(peg)、聚(乙烯醇)(pva)、聚(丙烯酰胺)(paam)、聚(丙烯酸正丁酯)、聚(α-酯)、(peg-b-ppo-b-peg)、聚(n-异丙基丙烯酰胺)(pnipaam)、聚乳酸乙醇酸(plga)和/或其组合。在本发明的另一个实施方案中,所述天然聚合物选自包括以下的组:葡聚糖、糊精、葡萄糖、纤维素和/或其组合。
在本发明的杀病毒纳米颗粒的一些实施方案中,三糖部分优选为6’sln,其对人流感病毒株具有特异性。在本发明的杀病毒纳米颗粒的其他实施方案中,三糖部分优选为3’sln,其对禽流感病毒株具有特异性。
本发明的杀病毒纳米颗粒的配体(或配体化合物)通常足够长(至少2个、或至少4个、或至少6个碳原子)且是疏水的。
通常,在本发明的上下文中,基于任选取代的烷基的配体选自包括以下的组:基于己烷的配体、基于戊烷的配体、基于辛烷的配体、基于十一烷的配体、基于十六烷的配体。
本发明的杀病毒纳米颗粒的基于取代的烷基的配体、基于取代的c4-c30烷基配体和取代的c4-c30羧基烷基被1、2、3、4或5个独立地选自包括以下的组的取代基取代:烯基、烯基硫基、烯基氧基、烷氧基、烷氧烷氧基、烷氧烷氧烷氧基、烷氧烷氧烷基、烷氧烷基、烷氧羰基、烷氧羰基烷氧基、烷氧羰基烷基、烷氧磺酰基、烷基、烷基酰胺烷基、烷基羰基、烷基羰基烷氧基、烷基羰基烷基、烷基羰基烷硫基、烷基羰基氧基、烷基羰基硫基、烷基亚磺酰基、烷基亚磺酰基烷基、烷基磺酰基、烷基磺酰基烷基、烷基硫基、烷基硫基烷基、烷基硫基烷氧基、炔基、炔基氧基、炔基硫基、芳基、芳基羰基、芳基氧基、芳基磺酰基、羧基、羧基烷氧基、羧基烷基、氰基、氰基烷氧基、氰基烷基、氰基烷硫基、1,3-二氧代环戊基(1,3-dioxolanyl)、二氧杂环己烷基、二噻烷基、亚乙基二氧基、甲酰基、甲酰基烷氧基、甲酰基烷基、卤代烯基、卤代烯氧基、卤代烷氧基、卤代烷基、卤代炔基、卤代炔基氧基、卤素、杂环、杂环羰基、杂环氧基、杂环磺酰基、羟基、羟基烷氧基、羟烷基、巯基、巯基烷氧基、巯基烷基、亚甲基二氧基和硝基。优选地,基于取代的烷基的配体,基于取代的c4-c30烷基的配体和取代的c4-c30羧基烷基用一个巯基基团取代(取代未改性的环糊精上相应的氧)。优选地,基于取代的烷基的配体是基于烷基酰胺基烷基取代的c4-c30、或c2-c28、或c4-c13烷基的配体。
所述配体与包含三糖部分的配体之间的百分比比例为75%:25%至95%:5%;优选为88%:12%。
在本公开的上下文中,“多个配体”是指由本发明的多个配体部分地或完全地包被的杀病毒纳米颗粒核,其中所述配体中的至少一部分包括本发明的三糖部分。包被可以是均质的、非结构化的或结构化的。在一些实施方案中,杀病毒纳米颗粒包含非常高密度(hd)的包含本发明的三糖部分的配体,例如占总配体的25%。在一些实施方案中,杀病毒纳米颗粒每nm2包含约2至约5个本发明的配体,其中所述配体中的至少一部分包含三糖部分。在其他实施方案中,杀病毒纳米颗粒每nm2包含四个本发明的配体,其中所述配体中的至少一部分包含三糖部分。
在本发明的一些实施方案中,本发明的多个配体包括至少两种结构上不同的配体的混合物,例如聚乙二醇5(peg(5))和16-巯基十六酸(c15)的混合物。如本文所用,术语“至少两种结构上不同的配体的混合物”是指如上所定义的两种或更多种本发明的配体的组合,其中所述配体在至少一个位置上的化学组成上彼此不同。可以有利地组织混合物,使得不带三糖部分的配体为带有三糖部分的配体提供最佳的间隔并且不阻碍三糖部分与流感病毒ha之间的相互作用。因此,在不带三糖部分的配体与带有三糖部分的配体之间的百分比比例范围为约75:25至约95:5,优选为约88:12。
根据本发明的一个实施方案,已经合成了peg(5)和16-巯基十六酸(c15)混合的配体金纳米颗粒(np)。peg(5)增强了纳米颗粒的水溶性,而c15是接枝三糖的配体。配体的选择基于两个原因:1)c15的长度足以靶向ha上三个相距约4nm的唾液酸结合点;2)碳基刚性配体增强了杀病毒活性。
配体通常以最优化三糖部分与流感血球凝集素的结合的量存在于核的表面上。核通常每nm2具有四个配体。在一些实施方案中,每nm2的核具有约2至约5个配体。
本发明杀病毒纳米颗粒的重大优点是详细的毒性分析没有显示出组织结构的任何改变,也没有显示出促炎性细胞因子的释放。体内试验表明,用本发明的杀病毒纳米颗粒进行治疗显著改善了被感染小鼠的健康状况,并降低了肺部中的病毒载量,而与在感染前还在感染后添加药物无关。
本发明的另一方面公开了一种药物组合物,其包含有效量的一种或多种本发明的杀病毒纳米颗粒和至少一种药学上可接受的赋形剂、载剂和/或稀释剂。
关于合适的赋形剂、载剂和稀释剂,可以参考描述这些的标准文献,例如"comprehensivemedicinalchemistry”的第5卷的第25.2章,佩加蒙出版社,1990年;以及h.p.fiedler,editiocantor的“lexikonderhilfsstoffefürpharmazie,kosmetikundangrenzendegebiete”,2002年。术语“药学上可接受的载剂、赋形剂和/或稀释剂”是指可用于制备药物组合物的通常安全且具有可接受的毒性的载剂、赋形剂或稀释剂。可接受的载剂、赋形剂或稀释剂包括兽医用以及人药用可接受的那些。在说明书和权利要求书中使用的“药学上可接受的载剂、赋形剂和/或稀释剂”包括一种和多于一种这样的载剂、赋形剂和/或稀释剂。
任选地,本发明的药物组合物还包含一种或多种另外的活性剂,优选抗病毒剂。
用于本发明方法中的本发明的杀病毒纳米颗粒可以掺入用于治疗施用的多种制剂和药物中。更特别地,本文提供的杀病毒纳米颗粒可以通过与适当的药学上可接受的载剂、赋形剂和/或稀释剂组合而配制成药物组合物,并且可以配制成固体、半固体、液体或气体形式的制剂,例如片剂、胶囊剂、丸剂、粉剂、颗粒剂、糖衣丸、凝胶剂、浆剂、软膏剂、溶液剂、栓剂、注射剂、吸入剂和气雾剂。这样,可以以各种方式实现杀病毒纳米颗粒的施用,包括口服、颊含、吸入(经肺、经鼻)、经直肠、经肠胃外、经腹膜内、经真皮内、经皮、经颅内和/或气管内施用。此外,杀病毒纳米颗粒可以局部而非全身的方式并以长效或缓释制剂的形式施用。杀病毒纳米颗粒可以与常用的赋形剂、稀释剂或载剂一起配制,并压制成片剂,或配制为方便口服施用的酏剂或溶液剂,或通过肌内或静脉内途径施用。杀病毒纳米颗粒可以经皮施用,并且可以配制成缓释剂型等。杀病毒纳米颗粒可以单独施用、彼此组合施用、或者可以与其他已知化合物组合使用。用于本发明的合适制剂记载在remington'spharmaceuticalsciences(mackpublishingcompany(1985)philadelphia,pa,第17版)中,其通过引用并入本文。此外,对于药物递送方法的简要综述,参见langer,science(1990)249:1527-1533,其通过引用并入本文。
可以制备缓释制剂。缓释制剂的合适实例包括含有本发明的杀病毒纳米颗粒的固体疏水性聚合物的半透性基质,该基质呈定型制品的形式,例如膜或微胶囊。缓释基质的实例包括聚酯、水凝胶(例如,聚(2-羟乙基-甲基丙烯酸酯)或聚(乙烯醇)),聚乳酸(美国专利第3,773,919号),l-谷氨酸和γ-乙基-l-谷氨酸的共聚物、不可降解的乙烯-乙酸乙烯酯、可降解的乳酸-乙醇酸共聚物如luprondepot(tm)(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林形成的可注射微球)和聚-d-(-)-3-羟基丁酸。
本发明的杀病毒纳米颗粒也可以被包埋在例如通过凝聚技术或通过界面聚合制备的微胶囊中,所述微胶囊例如分别在胶体药物递送系统(例如,脂质体、白蛋白微球、微乳剂、纳米颗粒和纳米胶囊)或大乳剂中的羟甲基纤维素或明胶-微胶囊和聚(甲基丙烯酸甲酯)微胶囊。此类技术公开于remington'spharmaceuticalsciences16thedition,osol,a.ed.(1980)。
本文所述的药物组合物可以以本领域技术人员已知的方式制造,即,通过常规的混合、溶解、制粒、糖衣制造、浸出、乳化、包囊、包埋或冻干方法。以下方法和赋形剂仅是示例性的,绝非限制性的。对于注射,可以通过将杀病毒纳米颗粒(和任选的其他活性剂)溶解、悬浮或乳化于水性或非水性溶剂(例如,植物油或其他类似的油、合成脂肪酸甘油酯、高级脂肪酸或丙二醇的酯)中制成制剂;并且如果需要,可以与常规添加剂一起,例如增溶剂、等渗剂、助悬剂、乳化剂、稳定剂和防腐剂。优选地,本发明的杀病毒纳米颗粒可以在水溶液中配制,优选在生理相容的缓冲液(如汉克斯氏溶液、林格氏溶液或生理盐水缓冲液)中配制。对于跨粘膜给药,在制剂中使用适合于待渗透屏障的渗透剂。这样的渗透剂是本领域公知的。
优选地,用于肠胃外施用的药物制剂包括水溶性形式的杀病毒纳米颗粒的水溶液。另外,可以将杀病毒纳米颗粒的悬液制备为合适的油性注射悬液。合适的亲脂性溶剂或媒介物包括脂肪油(如芝麻油),或合成脂肪酸酯(如油酸乙酯或甘油三酸酯),或脂质体。水性注射悬液可以包含增加悬液粘度的物质,例如羧甲基纤维素钠、山梨糖醇或葡聚糖。任选地,悬液还可以包含合适的稳定剂或增加杀病毒纳米颗粒的溶解度以允许制备高浓度溶液的试剂。
可以与载体材料组合以产生单一剂型的本发明的杀病毒纳米颗粒的量将根据所治疗的病毒性疾病、哺乳动物物种和特定的给药方式而变化。还应理解,如本领域技术人员所熟知的,任何特定患者的具体剂量水平将取决于多种因素,包括所采用的具体化合物的活性;被治疗者的年龄、体重、总体健康状况、性别和饮食;施用的时间和途径;排泄率;先前已施用过的其他药物;以及正在治疗的具体病毒性疾病的严重性。
本发明的另一方面提供了一种治疗和/或预防流感病毒感染和/或与流感病毒有关的疾病的方法,所述方法包括向有此需要的受试者施用治疗有效量的一种或多种本发明的杀病毒纳米颗粒。
本发明的另一方面提供了本发明的杀病毒纳米颗粒,其用于治疗和/或预防流感病毒感染和/或与流感病毒有关的疾病。
如本文所用,术语“受试者”或“患者”在本领域中是众所周知的,并且在本文中可互换使用以指哺乳动物,包括狗、猫、大鼠、小鼠、猴、牛、马、山羊、绵羊、猪、骆驼,以及最优选的人类。这些术语也包括其他动物,例如鸡。在优选的实施方案中,术语“受试者”或“患者”是指人和动物,例如狗、猫、大鼠、小鼠、猴、牛、马、山羊、绵羊、猪、骆驼、鸡。在一些实施方案中,所述受试者是需要治疗的受试者或由流感病毒感染的受试者。在其他实施方案中,受试者可以是由禽流感感染的动物,例如鸡。然而,在其他实施方案中,所述受试者可以是健康受试者或已经接受过治疗的受试者。该术语不表示具体的年龄或性别。因此,旨在覆盖成年、儿童和新生受试者,无论是男性/雄性还是女性/雌性。
“治疗/处理”是指治疗性处理和预后或预防措施。需要治疗的受试者包括已经被流感病毒感染的那些以及要预防流感病毒感染的那些。因此,本文中待治疗的哺乳动物(优选人)可能已经被诊断出被流感病毒感染,或者可能是易于或容易被流感病毒感染。治疗包括缓解由于流感病毒感染引起的疾病或病状的至少一种症状,治愈和/或预防由于流感病毒感染引起的疾病或病状的发展。预防是指例如通过影响进入后病毒事件而减弱或降低流感病毒引起感染或疾病的能力。
用于治疗目的的“哺乳动物”是指被分类为哺乳动物的任何动物,包括人、家畜和农场动物或宠物,例如狗、马、猫、牛、猴等。优选地,哺乳动物是人。
术语“治疗有效量”是指有效地改变接受的受试者中的流感病毒并使之呈惰性的本发明的杀病毒纳米颗粒的量,和/或该量的存在导致接受的受试者的生理学上可检测的改变,例如,缓解了与病毒感染有关的至少一种症状,防止或降低了至少一种病毒剂的传播速率。
本发明的另一方面提供了一种杀病毒组合物,其包含有效量的一种或多种本发明的杀病毒纳米颗粒和任选的至少一种合适的载剂或气溶胶载剂。“有效量”是指足以不可逆地抑制流感病毒的量;即足以获得杀病毒作用的量。在一个实施方案中,合适的载剂选自包括以下的组:稳定剂、香料、着色剂、乳化剂、增稠剂、润湿剂或其混合物。在另一个实施方案中,杀病毒组合物可以是液体、凝胶、泡沫、喷雾剂或乳剂的形式。在另一个实施方案中,杀病毒组合物可以是空气清新剂、灭菌溶液或消毒溶液。
本发明的另一方面提供了一种设备(或产品),其包含:本发明的杀病毒组合物或一种或多种本发明的杀病毒纳米颗粒,以及用于施用和/或分配本发明的杀病毒纳米颗粒的装置。在另一个实施方案中,所述装置包括分配器、喷雾器、或用本发明的杀病毒纳米颗粒浸透的固体载体。在另一个实施方案中,载体是织物或无纺布、纺织品、纸巾、棉绒、吸收性聚合物片、或海绵。
本发明的另一方面提供了使用本发明的杀病毒纳米颗粒或本发明的杀病毒组合物或本发明的药物组合物进行消毒和/或灭菌的方法。
在一个优选的实施方案中,消毒和/或灭菌的方法包括以下步骤:(i)提供至少一种本发明的杀病毒纳米颗粒或本发明的杀病毒组合物或本发明的药物组合物,(ii)使被流感病毒污染的表面或怀疑被流感病毒污染的表面与至少一种本发明的杀病毒纳米颗粒或本发明的杀病毒组合物或本发明的药物组合物接触足够的时间以获得杀病毒效果。在一些实施方案中,被流感病毒污染的表面是人或动物的皮肤。在其他实施方案中,被流感病毒污染的表面是无生命的表面,例如医疗设备、衣物、掩罩、家具、房间等。
本发明的另一方面提供了本发明的杀病毒纳米颗粒或本发明的杀病毒组合物或本发明的药物组合物用于灭菌和/或消毒的用途。在一些实施方案中,灭菌和消毒用于被流感病毒污染的表面或怀疑被流感病毒污染的表面。在一些优选的实施方案中,所述表面是人或动物的皮肤。在其他优选的实施方案中,所述表面是无生命的表面,例如医疗设备、衣物、掩罩、家具、房间等。在一个实施方案中,本发明的杀病毒组合物或本发明的药物组合物用作频繁使用的杀病毒的手消毒剂。在另一个实施方案中,本发明的杀病毒组合物或本发明的药物组合物通过喷雾施用。在另一个实施方案中,将本发明的杀病毒组合物或本发明的药物组合物施用于保护性掩罩上。
本领域技术人员将理解,本文描述的发明除了特别描述的之外,还可以进行变化和修改。应当理解,本发明包括所有这样的变化和修改,而不背离其精神或基本特征。本发明还单独或共同包括本说明书中提及或指出的所有步骤、特征、组合物和化合物,以及所述步骤或特征的任何和所有组合或任何两个或更多个。因此,本公开被认为是在所有方面中均是示例性的,而不是限制性的,本发明的范围由所附权利要求表示,并且等同含义和范围内的所有改变均旨在包含在其中。
参考以下实施例会更充分地理解前述描述。然而,这些实施例是实施本发明的方法的示例,并且无意于限制本发明范围。
实施例
实验数据
密度测试
合成了三种不同密度的6-唾液酸-n-乙酰基乳糖胺(6’sln)的纳米颗粒,以证明最佳的6’sln密度(图1)。还进行了peg(5)和3-唾液酸-n-乙酰基乳糖胺(3’sln)包被的金纳米颗粒的对照实验。
对两种甲型流感病毒株h1n1(neth/09)和h3n2(sing/04)和一种乙型流感病毒株yamagata进行了比较剂量-反应的研究。ld-6’sln纳米颗粒抗所有测试病毒的半数抑制浓度(ec50)最低。大体上,纳米颗粒对甲型亚型的抑制作用要好于对乙型亚型的抑制作用。
表1:不同纳米颗粒抗h1n1(neth/09)株的体外半数抑制浓度(ec50)和半数细胞毒性浓度(cc50)。分别基于纳米颗粒和三糖/纳米颗粒计算摩尔浓度。
表2:不同纳米颗粒抗h3n2sing/04株的ec50和cc50。
表3:不同纳米颗粒抗乙型流感/yamagata的ec50和cc50。
然后进行杀病毒测试,以确定抑制机制是否不可逆。在杀病毒测试中,将纳米颗粒以相应ic99浓度与病毒孵育一定时间。然后对接种物进行连续稀释,并测量病毒的残留感染性。通过将病毒浓度相对于剂量-反应实验提高十倍,测试了ld6’sln纳米颗粒抗neth/09和sing/04株的杀病毒活性。neth/09株的滴度降低了2个对数,而sing/04的滴度降低了1.5个对数。病毒滴度降低1-2个对数表示该病毒被不可逆地抑制。
tem研究以证明病毒-纳米颗粒相互作用
病毒-纳米颗粒相互作用也用电子显微镜(tem)证明。将h3n2vic/11病毒与ld6’sln纳米颗粒孵育1小时。在制备tem网格之后,进行甲基钨染色。ld6’sln纳米颗粒完全覆盖了大多数病毒(图2b)。用peg(5)纳米颗粒进行对照实验,其中纳米颗粒遍布但不附着于病毒包膜(图2c)。
纳米颗粒抑制禽流感病毒的潜力
当动物流感病毒株与人流感病毒株混合时,流感大流行通常会出现。因此,下一个目标是用本发明的纳米颗粒不可逆地抑制禽流感病毒株。初步研究是用一种鸡蛋适应性病毒株cal/09进行。neth/09和cal/09是两种非常相似的人类h1n1株。ld-6’sln纳米颗粒对neth/09株具有很强的活性。但是,使用鸡蛋复制的cal/09株以较高的亲和力结合ld3’sln纳米颗粒(表4)。该结果表明ld-3’sln纳米颗粒抑制禽流感病毒株。
表4:鸡蛋适应性病毒株倾向于-2,3连接,小鼠适应性病毒株倾向于-2,6连接。
从金核至环糊精核
c15-6’sln接枝的金纳米颗粒不可逆地抑制人流感病毒。然而,重要的是将金核改变为有机材料以用于药物应用。在诸如聚合物、树状聚合物和树枝突聚合物等不同的有机材料中,环糊精(cd)是优选的接枝带有6’sln以靶向ha的配体的核。
cd的尺寸(d约为1.5nm)可比于与本发明的金(金属)纳米颗粒(约3nm),并且与ha球状头非常匹配(约5nm)。与金(金属)纳米颗粒相似,环糊精具有刚性的化学结构,与配体一起有助于杀灭病毒。同样,β-环糊精最多可以具有7个三糖(优选3或4个三糖),其中3个是ha球状头中唾液酸结合点的确切数目(图3a)。因此,用c15-6’sln改性β-cd的方式与金纳米颗粒非常相似。
相比以前的带有唾液酸的有机材料,在不同的人流感病毒上获得的ec50值显著较低(图3b)。经改性的环糊精的杀病毒活性已在体内和离体实验中得到证实,其中病毒滴度降低了几个对数(图3c和图3d)。离体成功的结果表明,经改性的环糊精会在体内不可逆地抑制病毒。
本文显示,三糖以及配体的选择对于用纳米材料不可逆地抑制人流感病毒非常重要。金纳米颗粒和环糊精这两种不同核上的c15-6’sln配体以极低的纳米材料浓度抑制了数种人流感病毒株。实现了低nm范围(1nm至100nm)的ec50浓度(相对于三糖单位),而类似材料的文献ec50值则高出50至500倍。
经改性的环糊精的体外抗病毒活性
为了研究化学结构与抗病毒活性之间的关系,用不同配体(含有或不含有三糖)改性β-环糊精(β-cd)。示例性的经改性的环糊精如图4所示。它们带有可比数量的三糖(参见图5和表5),由1h核磁共振光谱(nmr)测定。进行了抗甲型流感/荷兰/2009(h1n1)株(甲型/nl/09)的剂量-反应分析,以比较这些纳米颗粒的抑制活性(图6)。感染后24小时(hpi),用免疫细胞化学分析定量感染。带有足够长的疏水性配体和6’sln端基(c6-6’sln、c11-6’sln和c14-6’sln)的β-cd对甲型流感/nl/09感染细胞表现出强大的抑制活性,ec50值在纳摩尔范围。另一方面,带有较短的c1-6’sln配体的β-cd对感染的抑制作用较差。引入足够长的配体明显增强了端基的柔韧性;因此抑制浓度降低。当疏水性配体被亲水性peg8配体(peg8-6’sln)取代时,ec50具有可比性(但略高)。
表5:通过1hnmr及相应的分子量测定的每个β-环糊精中6’sln或3’sln的平均数目。
表现出抗甲型/nl/09的最佳抑制活性的c11-6’sln纳米颗粒显示出抗来自甲型和乙型的人流感毒株的强大的抗病毒活性(表6和图7)。重要的是,它抑制了最近从日内瓦大学医院的患者中分离出的且仅在细胞中传代一次的甲型(h1n1)和乙型临床株(从2017/2018流感季节开始)。c11-6’sln没有显示抗hsv-2(一种结合hspg的病毒)的任何抗病毒活性,表明该化合物对唾液酸依赖性病毒具有特异性。
已知6’sln特异于人类流感病毒株,而3’sln则优选禽流感病毒株为首选附着点。为了证明这种方法的普遍性,特别是抗已知具有跨物种屏障能力的流感病毒株,合成了c11-3’sln并对其抗禽流感病毒株进行了测试(图4)。c11-3’sln分别以4.1和8.8μg/ml的浓度成功抑制了两种禽流感病毒h5n1和h7n1(见表6)。实际上,这些结果证实了适于抗人病毒株的策略。重要的是,其中一种禽流感病毒h5n1具有引起下一次流感大流行的巨大潜力。此外,还测试了c11-3’sln是否可以抑制人甲型/nl/09病毒株,以及c11-6’sln是否也具有抗禽流感病毒株h5n1的活性。c11-3’sln表现出抗甲型/nl/09的良好抑制活性(图4和表6),而c11-6’sln没有显示出抗h5n1的任何活性(表6和图8)。这些结果与比较禽病毒株和人病毒株与不同类型唾液酸的结合亲和力的先前文献相符。禽流感病毒株(尤其是h5n1病毒株)优先结合α-2,3连接的唾液酸,该唾液酸具有稀薄且直的反式构象。另一方面,人病毒株的较宽的唾液酸结合位点可以容纳α-2,6连接的唾液酸的大的顺式构象和较窄的α-2,3连接的唾液酸的顺式构象。
表6:c11-6’sln和c11-3’sln抗不同流感株的抑制活性。
*乙型yamagata亚型
cc50:最大半数细胞毒性浓度。
接下来,进行杀病毒测试以确定抑制机理,即是杀病毒的(不可逆)还是抑病毒的(可逆)。具有β-环糊精核和6’sln部分但配体不同的相似纳米颗粒的合成突显了赋予杀病毒作用的结构特征(图9和图10)。推测不可逆病毒抑制的关键因素之一是结合部分(此处为6’sln)由疏水性配体承担。为了验证该假设,对c11-6’sln和p8-6’sln进行了比较。简而言之,将具有完全保护作用的量的化合物(10μg的c11-6’和50μg的p8-6’)与甲型/nl/09孵育1小时。进行接种物的系列稀释,然后评估感染性。在c11-6’的情况下,(a)中的图表明稀释后可以保持完全的保护,而(c)中的图表明该特性出现在针对多种不同病毒株中。这被称为不可逆的(即抗稀释性)抑制活性,是杀病毒机制。在p8-6’的情况下,(b)中的图表明,尽管在初始浓度下存在完全保护,但稀释后,与对照样品(仅病毒)的感染力差异消失,即抑制作用被发现是可逆的(抑病毒的)。这两种纳米颗粒仅在配体的疏水性上不同,并且显示出相当的抑制活性。在杀病毒测试中,c11-6’sln使病毒滴度降低了1000倍(图9b),而在p8-6’sln的情况下,感染完全恢复(图9a)。因此,c11-6’sln对病毒具有不可逆的抑制作用,而p8-6’sln的作用是可逆的。值得一提的是,两种纳米颗粒均对细胞无毒(图9a和图9b)。进一步研究了c11-6’sln对其他流感病毒株的杀灭病毒活性,证实了其与病毒株无关的不可逆活性(图9c)。
经改性的环糊精的离体活性
在人气道重构上皮的3d模型
此外,在用c11-6’sln处理的组织中,病毒复制的抑制还反映在不存在感染细胞和处理后组织的未变形态,这与未处理组织或p8-6’sln处理的组织显著不同(图11b)。免疫荧光图像和顶端洗涤物中缺少乳酸脱氢酶(ldh)释放表明纤毛细胞层以及生理性纤毛跳动和组织完整性得以保留(图11b和图12)。与之形成鲜明对比的是,未经处理的组织或经p8-6’sln处理的对照由于纤毛细胞层的改变和感染细胞的存在而厚度减小(图11b)。为了排除通过qpcr检测到的经处理的组织中残留的病毒水平具有感染性,将这些组织培养23天,但未观察到病毒滴度随时间的推移而增加,而未经处理的组织则持续在掉落病毒(sheddingvirus)(图13)。重要的是,在更严格的后处理条件下也进行了离体实验,在这种条件下,每24小时施用c11-6’sln(30微克/组织),共4天,从1dpi开始以模拟治疗性施用。同样,在这些条件下,纳米颗粒显示出显著的抑制活性,证明了其作为治疗剂的潜力(图11c)。在相同的离体模型中,评估了每天给药的高剂量的c11-6’sln的生物相容性。在上述条件下,c11-6’sln没有显示任何细胞毒性或促炎活性(图14)。
经改性的环糊精的体内活性
在共同处理和后处理条件下,对balb/c小鼠进行了体内实验。在共同处理实验中,通过鼻内途径同时给小鼠施用c11-6’sln(每只小鼠25μg)和甲型/nl/09(每只小鼠100个感染颗粒)。每天测量小鼠的体温和体重,以评估c11-6’sln给药对感染动物的生理状况的影响。在2dpi,一半的小鼠被随机安乐死,其余的小鼠则用c11-6’sln进行继续处理。将第二组小鼠在4dpi处以安乐死。从支气管肺泡灌洗液(bal)定量病毒滴度(图15a)。观察到经处理的小鼠感染后第2天和第4天的病毒滴度显著降低(图15a)。与未经处理的小鼠相比,c11-6’sln的抗病毒活性也显著降低了发病率,并显著维持了体重和体温(图15b和图15c)。总的来说,这些结果证明了c11-6’sln纳米颗粒具有预防体内感染和病毒在肺中传播的能力。
还通过后处理条件评估了c11-6’sln的体内治疗潜力。小鼠用甲型/nl/09感染(每只小鼠100个感染颗粒),并在6hpi用c11-6’sln处理(14μg/小鼠),每天以相同剂量的纳米颗粒持续接下来的三天(图15d至图15f)。每天测量小鼠的体重和体温。尽管c11-6’sln在后处理条件下的效力较弱,但仍延迟了感染的进程。经处理的小鼠显示出发病迹象的减少(图15d和图15e)和更好的临床评分。被感染动物的生理状态的这些改善与存活时间延长相关(图15f)。
方法
经改性的环糊精的合成
化学品:neu5acα(2,6)-galβ(1-4)-glcnac-β-乙胺和neu5acα(2,3)-galβ(1-4)-glcnac-β-乙胺购自tcichemicals。七-(6-脱氧-6-巯基)-β-环糊精和羧甲基-β-环糊精钠盐购自cyclodextrin-shop。11-十二碳烯酸购自abcrgmbh。14-十五碳烯酸购自larodanab。马来酰亚胺-peg8-ch2ch2cooh购自purepeg。所有其他化学品和溶剂均购自sigma-aldrich。
方法:通过三个步骤合成了靶向流感病毒的环糊精衍生物。第一步是将配体缀合到环糊精上。第二步是对配体的–cooh端基进行n-羟基琥珀酰亚胺(nhs)活化。第三步是将sln接枝到配体上。
步骤1:用配体改性β-环糊精
在紫外灯(250w)的存在下,将0.04mmol的七-(6-脱氧-6-巯基)-β-环糊精与0.28mmol带有烯丙基和羧酸端基的双官能分子(例如6-庚烯酸、11-十二碳烯酸或14-十五碳烯酸)(配体)在5ml的dmso中一起搅拌过夜。通过离心从dcm-二乙醚混合物沉淀得到七-(6-脱氧-6-链烷酸二硫酮)-β-环糊精衍生物,并将其在真空下干燥。
为了用peg8间隔基改性β-环糊精,将0.04mmol的七-(6-脱氧-6-巯基)-β-环糊精与0.28mmol的马来酰亚胺-peg8-ch2ch2cooh在5ml的磷酸盐缓冲液(ph6.8)中搅拌过夜。通过透析纯化经改性的β-环糊精,并冻干干燥。
步骤2:nhs活化反应
将0.04mmol步骤1中获得的环糊精衍生物分别与1.12mmol的n-羟基琥珀酰亚胺(nhs)、0.56mmol的乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc-hcl)和0.02mmol的4-二甲基氨基吡啶(dmap)在5ml的dmso中一起搅拌过夜。首先由冰冷的水沉淀出所得的nhs活化的环糊精衍生物,然后用乙腈和乙醚洗涤。产物在真空下干燥。
为了获得c1-6’,跳过步骤1,直接进行nhs活化反应。加入1.12mmol的nhs、0.56mmol的edc-hcl和0.02mmol的dmap,直接活化羧甲基-β-环糊精钠盐(0.04mmol)。使活化反应过夜进行。首先从dcm-二乙醚混合物中沉淀出所得的环糊精衍生物,并进一步洗涤3次。产物在真空下干燥。6’sln接枝的步骤与步骤3相同。
步骤3:三糖接枝
将5.6μmol的neu5acα(2,6)-galβ(1-4)-glcnac-β-乙胺(在c11-3’的情况下为neu5acα(2,3)-galβ(1-4)-glcnac-β-乙胺)与1.6μmol步骤2中获得的环糊精衍生物混合。加入15μmol三乙胺(tea),并使反应在1mldmso中过夜进行。反应产物用0.01m磷酸盐缓冲液(ph:7.5)稀释,并用amicon过滤器(mwco:3k)进行浓缩。用蒸馏水进一步洗涤得到的七-(6-脱氧-6-sln-乙基羧酰胺基-烷基硫基)-β-环糊精衍生物,并冷冻干燥。通过1h和dosynmr研究证实了三糖接枝到配体改性的环糊精上(图16和17)。
c15-6’sln改性的环糊精的合成
对β-cd进行c15改性:在uv光下,将55mg经硫醇改性的β-cd和70mg的14-十五碳烯酸在5ml的dmso中搅拌过夜。
对c15-β-cd进行nhs活化:所得材料用100mg的nhs、75mg的edc和2.5mg的dmap在dmf中过夜活化。从冰冷的水沉淀出nhs活化的c15-β-cd,并进一步洗涤3次。最后一次沉淀在乙腈中进行。
将6’sln接枝到c15-β-cd上:5mg的c15-β-cd和5mg的胺官能化的6’sln和3mg的tea在dmso中搅拌过夜。所得材料使用amicon过滤器清洁。
peg纳米颗粒的合成
peg(5)纳米颗粒的合成:将15ml的etoh中的88.6mg四氯金(3)酸三水合物(haucl4·3h2o)与5ml的etoh中的56mg的hs-peg(5)混合10分钟。向该混合物中逐滴加入37.5ml的etoh中的94.6mg硼氢化钠(nabh4)。为了完成纳米颗粒的形成,进行过夜反应。使用etoh-h2o溶剂混合物,通过amicon过滤器清洁所得的纳米颗粒。
peg(5)-c15混合的配体纳米颗粒:在dmf中,用1.5mg的16-巯基己酸(hs-c15-cooh)和20mg的peg(5)纳米颗粒过夜进行配体交换反应。从dmf-二乙醚混合物中沉淀出纳米颗粒,并进一步洗涤3次。
用nhs活化纳米颗粒:在dmf中,使用10mg的n-羟基琥珀酰亚胺酯(nhs)、2mg的乙基碳二亚胺盐酸盐(edc)和0.1mg的4-(二甲氨基)-吡啶(dmap)过夜活化15mg的纳米颗粒。从dmf-二乙基醚混合物中沉淀出所得纳米颗粒,并进一步洗涤3次。
将6’sln接枝到纳米颗粒上:将1ml的dmso中的5mg的nhs活化的纳米颗粒与3ml的0.1m磷酸盐缓冲液(ph:7.5)中的1.7mg胺官能化的6’sln混合。反应5小时后,用amicon过滤器清洁6’sln接枝的纳米颗粒。
生物学检测
材料:dmem–购自thermofischerscientific的glutamax培养基。用于洗涤缓冲液的
细胞培养
mdck(madin-darby犬肾细胞)细胞系购自atcc(美国典型培养物保藏中心,罗克维尔,马里兰州)。将细胞在含有葡萄糖补充剂的dulbecco改良的eagle培养基(dmem+glutamaxtm)中培养,该培养基含有10%的胎牛血清(fbs)和1%的青霉素/链霉素。mdck细胞系在37℃的含co2(5%)的潮湿环境中生长。
病毒株
hsv-2的临床分离株最初由m.pistello教授(意大利比萨大学)提供,并通过在vero细胞上的噬菌斑测定进行繁殖和滴定。h1n1neth09和乙型yamagata是m.schmolke教授(日内瓦大学)的礼物。禽类株nibrg-23(使用甲型/土耳其/土耳其/1/2005h5n1表面蛋白和甲型/pr/8/34(h1n1)骨架通过反向遗传方法制备)从英国国立生物标准与控制研究所(pottersbar)获得,并在10日龄的带胚鸡蛋中进一步生长,然后进行病毒纯化和表征。来自日内瓦大学医院的匿名患者提供了临床样本。在tpck处理的胰蛋白酶(0.2mg/ml)存在的情况下,所有流感病毒株均在mdck细胞上通过icc繁殖并滴定。
细胞活力检测
细胞活力通过mts[3-(4,5-二甲基噻唑-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺基苯基)-2h-四唑鎓]检测来测量。在与抗病毒检测相同的实验条件下,将接种在96孔板中的融合细胞培养物与不同浓度的纳米颗粒或配体一式三份孵育。根据制造商的说明,通过celltiter96增殖检测试剂盒(promega,麦迪逊,威斯康星州,美国)确定细胞活力。使用酶标仪(型号680,biorad)在490nm下测量吸光度。通过比较经处理的细胞的吸光度与仅用培养基培养的细胞之一的吸光度,将在不同浓度的纳米颗粒或环糊精对细胞活力的影响以百分比表示。使用prism软件(graph-padsoftware,sandiego,ca)确定50%的细胞毒性浓度(cc50)和95%的置信区间(ci)。
抑制检测
将mdck细胞提前24小时在96孔板中预铺板。将浓度增加的材料与流感病毒(对于h5n1,moi为0.02或0.01,对于其他病毒,moi为0.1)在37℃孵育1小时,然后将混合物添加到细胞中。病毒吸附后(在37℃放置1小时),除去病毒接种物,洗涤细胞并添加新鲜培养基。在37℃孵育24小时后,用免疫细胞化学(icc)分析法分析感染情况。固定细胞并用甲醇透化。然后加入一抗(1:100稀释)并在37℃孵育1小时。用洗涤缓冲液(dpbs+tween0.05%)洗涤细胞3次;然后加入二抗(1:750稀释)。1小时后,洗涤细胞并加入dab溶液。对感染细胞进行计数,比较处理和未处理条件下感染细胞的数量来计算感染的百分比。
在h5n1的情况下,还进行了基于流式细胞术的抑制检测。将mdck细胞提前24小时在24孔板中预铺板(75,000细胞/孔)。将浓度增加的材料与流感病毒(moi:0.04)在37℃孵育1小时,然后将混合物添加到细胞中。病毒吸附后(在37℃放置1小时),除去病毒接种物,洗涤细胞并添加新鲜培养基。在37℃孵育5小时后,用流式细胞术分析感染情况。简而言之,将细胞用胰蛋白酶消化,并在室温下使用ic固定缓冲液(thermofisherscientific,荷兰)固定15分钟,然后在4℃使用1xic透化缓冲液(thermofisherscientific,荷兰)透化15分钟。在4℃用抗甲型流感病毒核蛋白小鼠单克隆抗体[d67j](fitc)(abcamab210526,荷兰)对细胞染色30分钟。抗体在透化缓冲液中的稀释度为1:80,每管加入50μl。使用facscalibur3软件进行facs分析。使用prism软件确定导致感染细胞数量减少50%的浓度(有效浓度(ec50))。facs的门控策略如图18所示。首先基于fsc/ssc进行门控,然后制作fitc的负门。将该门控应用于剩余的样品。
通过萤光素酶活性评估h7n1的感染性。将mdck细胞以5×104接种在96孔板上。24小时后,用无血清培养基代替培养基。将浓度增加的c11-3’与100pfu的编码纳米萤光素酶的h7n1甲型/土耳其/意大利/977/1999孵育。将混合物在37℃孵育1小时,然后再添加到细胞中,再在37℃孵育1小时(每孔100μl)。洗涤细胞,并用1μg/ml的tpck-胰蛋白酶的无血清培养基代替培养基。感染后24小时,洗涤细胞,然后用每孔40μl的在pbs中以1/2稀释的nano
杀病毒检测
将病毒(病灶形成单位(ffu):105/ml)和测试材料(ec99浓度,表7)在37℃孵育1小时。对病毒-材料复合物以及未处理的对照进行连续稀释,并将其转移到细胞上。1小时后,除去混合物,并加入新鲜培养基。第二天,用icc测定法评估病毒滴度。对于icc测定法,遵循上述相同的步骤。
表7:进行体外杀病毒测试的材料浓度。
数据分析
全部结果是以一式两份进行的三次独立实验的平均值给出。抑制曲线的ec50值是使用graphpadprism5.0版程序(graphpadsoftware,圣地亚哥,加利福尼亚,美国)通过回归分析以拟合可变斜率-s形剂量-反应曲线来计算的。
离体
共同处理no.1:将h1n1荷兰/09株(pfu:104-105)和cd-c15-6’sln(400ug/ml)同时添加到mucilair(人气道上皮细胞的重建)中。4小时后,除去上清液,并加入新鲜培养基。用qpcr每24小时追踪上清液的病毒滴度。
共同处理no.2:由健康供体的鼻息肉上皮细胞的混合物在气液界面培养体外重建的人气道上皮细胞(mucilair组织)(epithelixsàrl,日内瓦,瑞士)。将h1n1pdm2009临床流感株(1e4rna拷贝/组织)和c11-6’(50μg/组织)与未经处理的对照转移到未经预孵育的组织上。孵育4小时后,将组织洗涤两次。每天更换基础培养基。为了进行每日qpcr测量,将200ul培养基添加到组织,然后20分钟后收集。通过使用qpcr并用quantatect试剂盒(#204443;qiagen,hilden,德国)在steponeabithermocycler中定量用ezna病毒提取试剂盒(omegabiotek)提取的rna。
后处理:mucilair组织感染了h1n1pdm2009(1e4拷贝/组织)。4小时后,除去接种物,并洗涤组织。20小时后,先对20’然后对c11-6’(30μg/组织)进行顶端洗涤,或者在未处理的组织中从顶端加入等量的培养基。每天,在20’顶端洗涤后,都要进行新的c11-6’添加。然后如上所述提取rna,并进行qpcr。在无病毒的情况下进行了类似步骤用于毒性研究。
免疫荧光
通过直接用甲型流感病毒抗体(lightdiagnostic)检测被流感病毒感染的细胞,并将β微管蛋白第一兔抗体(abcam)用作纤毛细胞的标志物。使用alexa488-山羊抗兔抗体和alexa594-山羊抗小鼠抗体(lifetechnologies)作为二抗,细胞核用dapi染色。用zeisslsm700meta共焦显微镜采集图像,并由imaris处理。
乳酸脱氢酶测定(ldh)
用细胞毒性检测试剂盒(roche04744926001)测量基础培养基中ldh的释放。
mtt测定
在mucilair培养基(1mg/ml)中稀释mtt溶液,并在24孔板中基础地加入300μl。在37℃孵育4小时后,将组织转移到新板中,并用1ml的dmso裂解。在570nm下读取上清液。比较经处理的组织和未处理过的组织,计算活力百分比。
elisa
通过elisa(r&ddy206-05、dy266-05、dy278-05、dy208-05和dy1598b-05)测量基础培养基中的白细胞介素-6(il-6)、cxc基序趋化因子10(cxcl10或ip-10)、cc基序趋化因子5(ccl5或rantes)、白细胞介素-8(il-8或cxcl-8)和干扰素λ(il-29/il-28b),然后每天用不同浓度的cd处理。
活体内
预处理:在第0天,用50μl的pbs或c11-6’(50μl中25μg)处理四组balb/c小鼠(每组5只),并立即接种甲型/nl/09(102ffu)。每天测量小鼠的体温和体重。感染后两天,处死2组小鼠(一组为pbs处理,另一组为c11-6’处理)。收集肺匀浆和鼻粘膜及支气管肺泡灌洗液,以通过qpcr测量定量病毒滴度。c11-6’处理组用等量的纳米颗粒再次处理。两天后,处死所有剩余的小鼠,收集肺匀浆和鼻粘膜。组织破裂后,用trizol提取rna,并通过qpcr定量,同时对bal进行噬菌斑测定。进行了两个独立的实验。
后处理:2组balb/c小鼠(每组10只)被甲型/nl/09(102ffu)感染,并在感染后6小时处理,随后每天处理,持续7天。每天测量小鼠的体温和体重。在生存研究中使用人道终点:当体重降低到起始重量的75%时,通过颈脱位法对小鼠实施安乐死。此外,还对达到垂死状态(无反应和对刺激无意识)的动物实施了安乐死。
剂量-反应测定
将固定的病毒浓度(ffu:103)与不同剂量的纳米颗粒一起在37℃孵育1小时。然后将混合物转移到细胞上。1小时后,移出混合物并洗涤细胞。第二天,用免疫细胞化学(icc)分析法分析感染情况。
参考文献
1.mammen,m.,choi,s.-k.&whitesides,g.m.polyvalentinteractionsinbiologicalsystems:implicationsfordesignanduseofmultivalentligandsandinhibitors.angew.chem.int.ed.37,2754–2794(1998).
2.reuter,j.d.etal.inhibitionofviraladhesionandinfectionbysialic-acid-conjugateddendriticpolymers.bioconjug.chem.10,271–278(1999).
3.papp,i.etal.inhibitionofinfluenzavirusinfectionbymultivalentsialic-acid-functionalizedgoldnanoparticles.small6,(2010).
4.papp,i.etal.inhibitionofinfluenzavirusactivitybymultivalentglycoarchitectureswithmatchedsizes.chembiochem12,887–895(2011).
5.tang,s.etal.antiviralagentsfrommultivalentpresentationofsialyloligosaccharidesonbrushpolymers.acsmacrolett.5,413–418(2016).
6.kwon,s.-j.etal.nanostructuredglycanarchitectureisimportantintheinhibitionofinfluenzaavirusinfection.nat.nanotechnol.12,48–54(2017).
- 还没有人留言评论。精彩留言会获得点赞!