一种治疗非酒精性脂肪性肝病的药物及其制备方法与流程
本发明涉及医用配制品,具体涉及含有来自传统草药的未确定结构的药物制剂。
背景技术:
非酒精性脂肪性肝病(non-alcoholicfattyliverdisease,nafld)是除了酒精和其他明确因素引起的以肝细胞内脂质蓄积及肝细胞脂肪变为主要表现的一种临床病理综合征,包括单纯性脂肪肝、脂肪性肝炎、可进展为脂肪性肝纤维化和肝硬化,其发病具有隐匿性、迁延性、普遍性等特点。不良生活方式导致的营养过剩是nafld公认的危险因素,肝脏是重要的脂质代谢器官,当脂质过多或肝脏脂质代谢发生障碍时,脂肪在肝细胞中过度堆积形成脂肪肝。nafld可引起肝病残疾和死亡,且与代谢综合征、动脉硬化性心血管疾病、结直肠肿瘤等的高发密切相关。中医认为,nafld属于肝癖、胁痛、积聚等范畴,病位在肝,与脾肾相关,痰、湿、浊、瘀、热为其主要病理因素。近年来,随着人民生活水平提高,nafld发病率逐年升高,已成为我国第一大慢性肝病,严重危害人民生命健康。但在nafld的防治上,西医尚无疗效理想的药物,且西药具有较大副作用加重肝损害。
如何有效防治nafld成为临床亟待解决的难题,中医药在nafld的防治上也进行了探索,代表方有以疏肝健脾为治则的逍遥散、疏肝健脾汤,以清热化湿为治则的三仁汤、茵陈蒿汤、甘露消毒丹,以祛痰化瘀为治则的膈下逐瘀汤合二陈汤加减等,这些方药对nafld具有一定疗效,但存在疗程长、动物实验结果与临床差距大、成分复杂等问题,因此进一步发掘中医药宝库,寻找更优的防治nafld的中药制剂具有重要意义。
技术实现要素:
本发明的目的在于提供一种新的治疗非酒精性脂肪性肝病的药物,该药物具有药简力专,疗效显著的优点。
本发明实现上述目的的技术解决方案是:
一种治疗非酒精性脂肪性肝病的药物,该药物由有效成份和医学上可接受的赋形剂组成,其中所述的有效成份由以下重量百分比的原料药制成:
黄连9~14%,丹参24~35%,酸枣仁31~47%,灵芝16~24%。
本发明药物,其中所述的原料药的最佳配比为:
黄连12%,丹参29%,酸枣仁39%,灵芝20%。
本发明所诉的药物为口服剂,如颗粒剂、胶囊剂或片剂。
本发明所述的药物可以采用各种常见的方法制备,其中一种简便易行的方法由以下步骤组成:
(1)按配比称取原料药,加入4~6倍的水,煎煮两次,第一次煮沸后武火煎50分钟,第二次煮沸后武火煎40分钟;
(2)合并两次滤液,经旋转蒸发仪后制成生药量为1g/ml药液,经高温蒸汽法将中药液进行灭菌处理在80℃条件下将滤液浓缩至相对密度为1.25的清膏,然后在75℃的条件下制成干膏,粉碎成细粉;
(3)加入适量的医学可接受的赋形剂,按常规方法制成颗粒剂、胶囊剂或片剂。
本发明所述的组方由黄连和丹参为主药,配以酸枣仁、灵芝制成。方中,黄连清热泻火为君;臣以丹参祛瘀通经,二者配合,共奏清热泻火、活血散瘀之效;以酸枣仁、灵芝为佐药,补肝肾宁心。全方共奏清热泻火、活血散瘀、补肝肾宁心之功。
本发明的药物不仅药简力专,效果显著,组合物药材均为常见药材,价格适中,材料易得且制备工艺简单,适于产业化生产。
本发明药物对nafld的治疗效果,可通过下述实验研究得到进一步证实。
在实验研究工作中,发现本发明药物对apoe基因敲除nafld小鼠具有治疗作用,能有效调节血脂水平,改善肝脏脂肪变性,降低谷丙转氨酶(alanineaminotransferase,alt)、谷草转氨酶(aspartateaminotransferase,ast)水平,从而减轻非酒精性脂肪性肝损伤;同时还发现,本发明药物还能升高小鼠肝脏脂代谢相关蛋白水平如atp结合盒转运蛋白a1(atp-bindingcassettetransportera1,abca1)、过氧化物酶体增殖物激活受体-γ(peroxisomeproliferator-activatedreceptor-γ,ppar-γ),降低固醇调节元结合蛋白1(sterolregulatoryelementbindingprotein1,srebp1)蛋白水平;结合多年的临床实践,表明本发明药物降脂护肝作用确切。
一、实验方案
(一)材料与方法
1.实验动物
健康6周龄雄性apoe-/-小鼠36只,c57bl/6小鼠6只,spf级,体重23-26克,由北京维通利华实验动物技术有限公司提供,动物许可证号:scxk(京)2016-0006。饲养条件为spf级,室温保持在22-24℃,相对湿度50%,光照时间12h/12h。高脂饲料(脂肪含量21%,胆固醇0.15%,蛋白质15.5%,63.35%原粮)由广东省医学实验动物中心配制。
2.实验药物
取下述实施1的颗粒剂加入蒸馏水配制成浓度分别为相当于含0.45、0.9、1.8g/ml生药的药液,无菌条件装瓶,置4℃冰箱备用。
取辛伐他汀片剂加入蒸馏水制成浓度含量为相当于含0.005g/ml有效成分的药液,无菌条件装瓶,置4℃冰箱备用。
3.动物分组和建立模型
30只apoe-/-小鼠随机分为模型组、阳性对照组、实验组1、实验组2、实验组3,每组6只;6只同周龄c57bl/6小鼠作为空白组。适应性喂养1周后,除空白组给予普通饲料外,其余各组均给予高脂饲料。高脂饮食造模12周后,实验组1~3及阳性对照组均按1ml/kg(小鼠的体重)药液灌胃,每天1次,每周5天,连续灌胃12周;其中,实验组1给以浓度为0.45g/ml的药液,实验组2给以浓度为0.9g/ml的药液,实验组3给以浓度为1.8g/ml的药液,阳性对照组给以浓度为0.005g/ml的辛伐他汀药液。模型组、空白组给予等体积生理盐水。各组小鼠自由饮水,根据小鼠体质量(每周测量1次),以校正给药量,12周后停止药物干预,结束实验。
4.标本取材
末次给药后禁食12小时,小鼠给予10%水合氯醛麻醉后采用心脏取血,然后打开胸腔,剪开心包,暴露心脏,由心尖部以100mmhg压力灌注生理盐水5分钟。分离肝脏组织,将肝脏组织投入新鲜配制的4%多聚甲醛固定液中在4℃冰箱过夜,次日置换缓冲液。取横切面的小鼠肝脏标本,制作石蜡切片进行苏木精-伊红(he)染色,制作冰冻切片进行油红染色并观察肝脏的组织学特点。血液样本3000rpm,4℃离心10min后,取血清,检测血清肝功指标、血脂水平。
5.实时定量pcr(quantitativereal-timepcr,qrt-pcr)检测小鼠肝脏脂代谢基因mrna的表达
trizol法提取小鼠肝脏总rna,并检验rna纯度。以rna为模版,用primescripttmrtreagentkitwithgdnaeraser试剂盒逆转录合成cdna。按照
表1qrt-pcr引物序列
6.westernblotting法检测小鼠肝脏脂代谢相关蛋白表达
各组小鼠取30mg肝脏加入300ul含1%pmsf裂解液研磨,冰上裂解30min,12000rpm、4℃离心15min后取上清进行bca定量,95℃金属浴变性5min,-80℃保存。每组取60μg蛋白,用8%sds-page凝胶电泳分离,冰上电转至pvdf膜,5%bsa常温封闭2h,一抗(ppar-γ、abca1、srebp1均为1:1500稀释)4℃孵育过夜,tbst洗膜3次,每次5min,二抗(1:5000)常温孵育2h,tbst洗膜3次,每次10min,用化学发光法检测目的蛋白,凝胶成像仪拍照后,imagej定量分析。
7.统计学处理
采用spss22.0软件进行数据统计学分析,实验数据以均数±标准差
(二)实验结果
1.本发明对apoe-/-小鼠肝功指标的影响
与空白组相比,模型组小鼠血清中alt、ast水平均显著升高(p<0.01),提示模型组小鼠产生肝损伤,结合血脂及病理结果提示造模成功。与模型组相比,各实验组小鼠血清中alt、ast水平随着药物剂量增大显著降低(p<0.05)。实验组1、2、3与阳性对照组相比,阳性对照组小鼠血清alt低于实验组1(p<0.05),而ast水平无显著差异(p>0.05),说明本药物可减轻非酒精性脂肪性肝损伤,且中、高剂量药物与辛伐他汀效果无明显差异。见表2。
表2本发明药物对nafld小鼠肝功指标的影响(
注:与空白组比较,##p<0.01;与模型组比较,*p<0.05,**p<0.01;与阳性对照组比较,δp<0.05,3p>0.05
2.本发明药物对apoe-/-小鼠血脂的影响
与空白组相比,模型组小鼠血清中总胆固醇(totalcholesterol,tc)、甘油三酯(triglyceride,tg)、低密度脂蛋白胆固醇(lowdensitylipoproteinchesterol,ldl-c)水平均显著升高(p<0.01),高密度脂蛋白(highdensitylipteincholesterol,hdl-c)水平降低但无统计学意义(p>0.05)。与模型组相比,实验组1、2、3及阳性对照组小鼠血清tc、tg、ldl-c水平显著降低,hdl-c水平显著升高,差异具有统计学意义(p<0.05)。实验组1、2、3与阳性对照组相比,小鼠血清tg、tc、hdl-c水平均无显著差异(p>0.05),而实验组1小鼠血清ldl-c水平高于阳性对照组(p<0.05)。说明本药物能有效降低血脂,且中、高剂量药物降血脂作用与辛伐他汀无明显差异。见表3。
表3本发明药物对nafld小鼠血脂水平的影响(
注:与空白组比较,##p<0.01,1p>0.05;与模型组比较,*p<0.05,**p<0.01;与阳性对照组比较,δp<0.05,3p>0.05
3.本发明药物对实验小鼠脂肪肝的影响
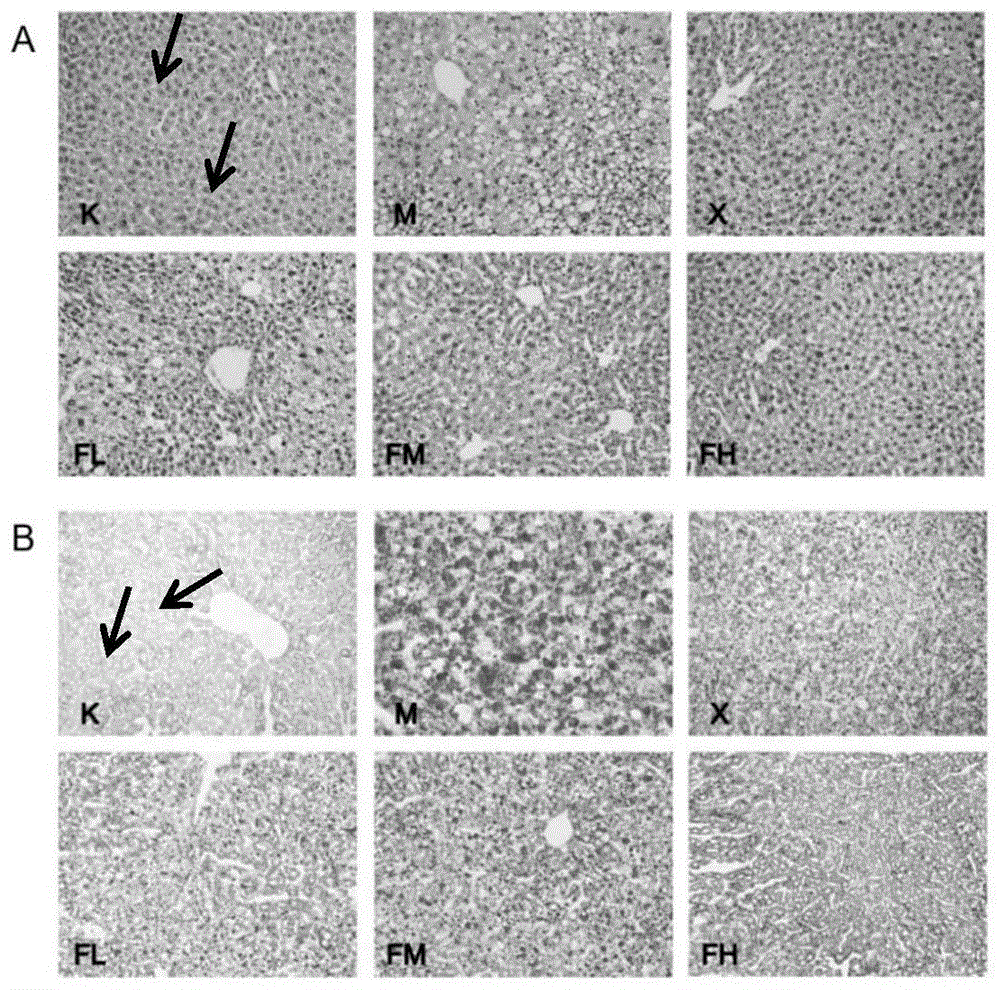
he及油红染色发现,空白组肝小叶结构完整,肝细胞排列整齐,未见脂肪变性及炎细胞浸润;模型组肝脏有明显脂肪滴(如箭头所示)形成,出现脂肪变性,部分细胞核被明显挤压偏位,肝细胞排列不规则;与模型组比较,实验组1、2、3及阳性对照组肝脏损伤程度减轻,肝小叶结构较完整清晰。实验组1、2、3肝脏损伤程度与阳性对照组相比无明显差异。见附图1。
4.本发明药物对apoe-/-小鼠肝脏脂代谢基因的影响
qpcr结果显示,与空白组相比,模型组小鼠abca1、ppar-γ、srebp1的mrna水平均显著升高(p<0.05)。与模型组相比,实验组1、2、3及阳性对照组小鼠abca1的mrna水平均下降,其中,实验组1、3下降值有统计学意义(p<0.05);实验组1、2、3及阳性对照组小鼠ppar-γ的mrna水平均显著下降(p<0.01),而srebp1无显著差异(p>0.05)。与阳性对照组相比,实验组1、2、3小鼠肝脏abca1、ppar-γ的mrna水平均无显著差异(p>0.05);实验组1小鼠srebp1的mrna水平升高(p<0.05)。各组小鼠ppar-α、lxr、fasn组间无显著差异(p>0.05)。结合westernblotting结果,提示本药物未通过上述肝脏脂代谢基因水平对非酒精性脂肪性肝损伤进行调控。见表4。
表4本发明药物对apoe-/-小鼠肝脏脂代谢基因的影响(
注:与空白组比较,#p<0.05,##p<0.01,1p>0.05;与模型组比较,*p<0.05,**p<0.01,2p>0.05;与阳性对照组比较,δp<0.05,3p>0.05
5.本发明药物对apoe-/-小鼠肝脏脂代谢相关蛋白的影响
westernblotting结果显示,与空白组相比,模型组小鼠abca1、ppar-γ蛋白水平显著降低,srebp1蛋白水平显著升高,差异有统计学意义(p<0.05)。与模型组相比,实验组1、2、3小鼠的abca1、ppar-γ蛋白水平升高,其中实验组2、3蛋白升高值具有统计学意义(p<0.05),实验组1、2、3小鼠的srebp1蛋白水平降低(p<0.05),阳性对照组蛋白水平变化趋势与实验组相同,其中ppar-γ蛋白水平升高值有统计学意义(p<0.05),而abca1、srebp1蛋白水平变化值无统计学意义(p>0.05)。与阳性对照组相比,实验组1、2、3小鼠的abca1、ppar-γ、srebp1蛋白水平均无显著差异(p>0.05)。abca1、ppar-γ、srebp1均是脂质代谢的重要调节蛋白,因此,本药物能通过升高ppar-γ、abca1、降低srebp1等脂代谢相关蛋白调节脂代谢减轻非酒精性脂肪性肝损伤。见表5、附图2。
表5本发明药物对apoe-/-小鼠肝脏脂代谢相关蛋白的影响(
注:与空白组比较,#p<0.05,1p>0.05;与模型组比较,*p<0.05,2p>0.05;与阳性对照组比较,3p>0.05
附图说明
图1为本发明药物对高脂血症小鼠肝脏组织病理学影响的显微照片;其中,a图为h&e染色,b图为油红染色,×200;a图和b图中,k为空白组,m为模型组,x为阳性对照组,fl为实验组3,fm为实验组2,fh为实验组1,箭头所指位置为肝脏内脂质沉积。
图2为本发明药物对apoe-/-小鼠肝脏脂代谢蛋白水平的影响的蛋白电泳条带,图中分组代号k、m、x、fl、fm和fh的含义与图1相同。
具体实施方式
实施例1(颗粒剂)
1、处方
黄连612g,丹参1479g,酸枣仁1989g,灵芝1020g。
2、制备方法
(1)取原料药,加水煎煮2次,第一次煮沸后武火煎50分钟,第二次煮沸后武火煎40分钟;
(2)煎煮两次,合并两次滤液,经旋转蒸发仪浓缩后制成生药量为1g·ml药液,经高温蒸汽法将中药液进行灭菌处理;
(3)在80℃下将滤液浓缩至相对密度为1.25的清膏,置烘箱内在75℃的条件制成干膏,粉碎成细粉;
(4)在获得的干膏细粉中加入适量糊精和淀粉至1000g,再加水制成颗粒,然后干燥、整粒,分装成9g/包(每包含药物干粉约5.4g)。
实施例2(颗粒剂)
1、处方
黄连483g,丹参1386g,酸枣仁2069g,灵芝1162g。
2、制备方法
(1)取原料药,加水煎煮2次,第一次煮沸后武火煎50分钟,第二次煮沸后武火煎40分钟;
(2)煎煮两次,合并两次滤液,经旋转蒸发仪浓缩后制成生药量为1g·ml药液,经高温蒸汽法将中药液进行灭菌处理;
(3)在80℃下将滤液浓缩至相对密度为1.25的清膏,置烘箱内在75℃的条件制成干膏,粉碎成细粉;
(4)在获得的干膏细粉中加入适量糊精和淀粉至1000g,再加水制成颗粒,然后干燥、整粒,分装成15g/包(每包含药物干粉约5.4g)。
实施例3(颗粒剂)
处方
黄连711g,丹参1344g,酸枣仁1945g,灵芝1100g。
2、制备方法
(1)取原料药,加水煎煮2次,第一次煮沸后武火煎50分钟,第二次煮沸后武火煎40分钟;
(2)煎煮两次,合并两次滤液,经旋转蒸发仪浓缩后制成生药量为1g·ml药液,经高温蒸汽法将中药液进行灭菌处理;
(3)在80℃下将滤液浓缩至相对密度为1.25的清膏,置烘箱内在75℃的条件制成干膏,粉碎成细粉;
(4)在获得的干膏细粉中加入适量糊精和淀粉至1000g,再加水制成颗粒,然后干燥、整粒,分装成9g/包(每包含药物干粉约5.4g)。
实施例4(胶囊剂)
将按照实施例1的方法制备成的药物颗粒,装入明胶胶囊,制成胶囊剂。
实施例5(片剂)
将按照实施例1的方法制备成的药物颗粒,采用常规方法压片,制成片剂。
- 还没有人留言评论。精彩留言会获得点赞!