PLPP1在制备T细胞免疫肿瘤相关药剂中的应用的制作方法
本申请属于细胞免疫学生物技术领域,具体涉及plpp1在制备t细胞免疫肿瘤相关药剂中的应用专利申请。
背景技术:
近年来,为抑制恶性肿瘤对人类健康威胁,嵌合抗原受体t(chimericantigenreceptort,car-t)细胞治疗技术和免疫检查点阻断抗体(immunecheckpointblockade,icb)技术(icb治疗主要运用于肺癌、食管癌、胃癌和黑色素瘤等各种实体肿瘤)得到了快速发展,并在部分类型血液和实体肿瘤患者治疗中取得了一定成功,较好提高了患者5年生存率。但是实际应用表明,这些以t细胞为基础的免疫治疗技术仅在少数患者中有效,特别是在实体肿瘤患者中有效率较低。
已有研究认为:实体瘤微环境与t细胞之间的相互作用是影响免疫治疗疗效的关键因素,而实体瘤微环境中存在众多免疫抑制分子,例如pd-l1、ctla-4、ido等,其中pd-l1被认为是抑制t细胞活性的关键分子,pd-l1通过活化t细胞上pd-1进而抑制t细胞的肿瘤杀伤活性。基于此,以靶向pdl1/pd-1和ctla4的部分单抗药物得到了一定应用,并表现出一定应用效果。例如:ipilimumab(anti-ctla4)、pembrolizumab(anti-pd-1)和nivolumab(anti-pd-1)等。
就t细胞发育而言,其主要生理过程为:在胸腺内t细胞成熟后,会进入到人的外周循环系统,在适应性免疫反应中发挥主要作用,其中静息期的t细胞在受到外界抗原或自身突变抗原刺激后,进一步分化为效应t细胞及记忆t细胞,进而发挥免疫功能。
就t细胞生理代谢过程而言,当t细胞处于静息期时,葡萄糖和氨基酸的分解代谢为细胞的生命活动提供能量的来源;当t细胞由静息期进入活化状态后,t细胞的代谢特征会发生改变,细胞会从外界获取并消耗大量的营养物质,用于细胞内部物质的合成和能量需求,这些代谢通路主要有有氧糖酵解、谷氨酰胺分解代谢、氧化磷酸化等。
理论上,靶向pd-l1或pd-1的阻断抗体治疗均能改善肿瘤治疗,但实际上,临床研究显示,环境因素能够导致t细胞自身代谢改变,进而影响t细胞响应阻断治疗的反应性和肿瘤治疗效果。因此,改善t细胞免疫治疗的前提是深入了解免疫抑制因素与t细胞代谢之间的相互作用以及其对阻断治疗的影响,从而发现关键代谢分子以研发更加有效的联合治疗策略。
技术实现要素:
本申请目的在于通过对plpp1在制备t细胞代谢、免疫功能发挥中作用的研究,为相关肿瘤预防或治疗奠定一定技术基础。
本申请所采取的技术方案详述如下。
plpp1在制备t细胞免疫肿瘤相关药剂中的应用,所述plpp1(phospholipidphosphatase1,磷脂磷酸酶1)为调控t细胞(cd8+)磷脂代谢关键酶;在肿瘤微环境中,代谢关键酶plpp1表达的降低导致了cd8+t细胞磷脂代谢异常,进而导致cd8+t细胞整体代谢异常,并最终导致t细胞功能异常;或者说,plpp1的表达与肿瘤微环境中cd8+t细胞的活化、浸润及功能具有正相关关系,也即,cd8+t细胞中plpp1的表达降低会导致t细胞增殖、代谢及功能降低,而plpp1高表达能够促进肿瘤组织中t细胞的浸润以及功能的发挥;所述磷脂代谢包括但不限于:磷脂酸(phosphatidicacid,pa)、甘油二酯(diacylglycerol,dg),磷脂酰胆碱(phosphatidylcholine,pc)和磷脂酰乙醇胺(phosphatidylethanolamine,pe)这几个物质的代谢;所述t细胞功能包括但不限于ifn-γ和tnf-α的分泌;所述t细胞代谢包括但不限于:糖代谢、胆固醇代谢、脂肪酸代谢和氧化磷酸化;具体表现中,pdl1/pd-1结合后,对于cd8+t细胞代谢及功能的降低,依赖于plpp1的表达的降低;而当plpp1表达降低时,通过调节降低胞内ca2+流浓度并以此作为调节通路,使得t细胞增殖功能、t细胞免疫功能、t细胞代谢功能也都明显降低,或者说,当plpp1表达降低时,t细胞的增殖、杀伤功能、代谢以及胞内ca2+流浓度均明显降低。
具体信号通路中,pdl1/pd-1结合后,通过抑制akt/mtor信号通路的活化,进而增加gata1的核转位,最终降低细胞中plpp1的表达;具体应用中,pdl1阻断型单抗应用后,通过恢复cd8+t细胞中akt/mtor信号通路,增加plpp1的表达,从而促进t细胞的浸润及功能,最终延缓肿瘤细胞的生长。
所述plpp1在制备t细胞免疫肿瘤相关药剂中的应用,其中所述肿瘤包括但不限于:食管癌、肺癌、结肠癌或黑色素瘤等实体瘤。
t细胞在活化的过程中,除了表面会高表达共刺激分子之外,细胞表面的共抑制性分子也高表达,如pd-1等,这些共刺激分子和共抑制分子协同参与了细胞的活化。t细胞活化后,细胞内相应的信号通路活化,进而导致t细胞内各种活化相关转录因子发生核转位,最终促进t细胞的增殖,生存以及效应功能的发挥。
已有研究认为,t细胞活化相关的信号通路主要有pi3k/akt、pkc、ras/erk和钙调蛋白/nfat等。而肿瘤微环境中t细胞功能及增殖能力均受到抑制,其主要原因是由于肿瘤微环境中存在大量的免疫抑制因素,如免疫抑制性细胞(肿瘤相关巨噬细胞或髓源性抑制细胞等),细胞因子(il6、il10等)。这些免疫抑制因素,最终都将作用于t细胞,导致t细胞内部信号通路异常。虽然肿瘤微环境中pdl1/pd-1信号通路在t细胞的肿瘤杀伤过程中发挥着至关重要的作用,但临床试验中发现即使阻断pdl1/pd-1信号通路,仍然会有一部分患者不具有临床反应性。为此,发明人通过系列实验,对pdl1/pd-1信号通路的作用机制做了进一步深入研究,结果表明:pdl1/pd-1信号通路激活后,进一步抑制了akt/mtor信号通路,通过转录因子gata1来调控t细胞磷脂代谢关键酶plpp1的表达,最终通过t细胞代谢功能变化来实现t细胞功能调节。
附图说明
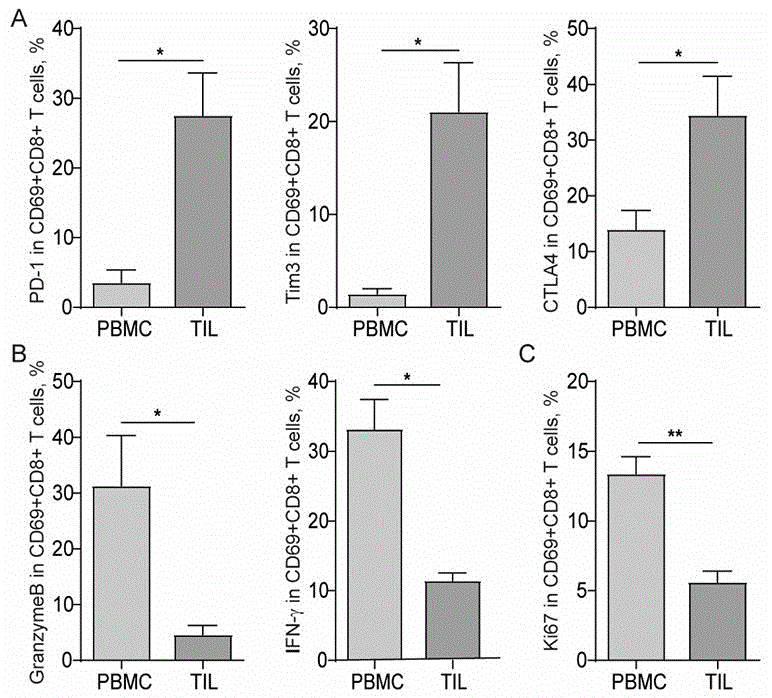
图1为肺癌患者外周血和肿瘤组织部位t细胞功能和增殖情况(密度梯度离心法获得pbmc,肿瘤组织消化法获得til(肿瘤浸润淋巴细胞)),其中,a:肺癌患者pbmc和til中cd69+cd8+t细胞表面共抑制分子的表达;b:肺癌患者pbmc和til中cd69+cd8+t细胞杀伤性细胞因子的分泌;c:肺癌患者pbmc和til中cd69+cd8+t细胞中细胞增殖相关分子的表达;
图2为肺癌患者肿瘤组织部位plpp1high和plpp1low的cd69+cd8+t细胞功能;其中,a:肺癌患者肿瘤组织中plpp1high和plpp1low的cd69+cd8+t细胞功能的流式展示图;
b:肺癌患者肿瘤组织中plpp1high和plpp1low的cd69+cd8+t细胞功能的统计图;
图3为小鼠黑色素瘤肿瘤组织中plpp1high和plpp1low的抗原特异性t细胞功能与增殖;其中,a:小鼠恶性黑色素瘤模型建立;b:小鼠肿瘤生长曲线;c:恶性黑色素瘤肿瘤组织中plpp1high和plpp1low的抗原特异性t细胞ifn-γ的分泌;d:恶性黑色素瘤肿瘤组织中plpp1high和plpp1low的抗原特异性t细胞ki67的表达;
图4为plpp1敲低后cd8+t细胞代谢相关酶的变化;其中,a:plpp1-sh1和plpp1-sh2cd8+t细胞中糖酵解相关酶的变化;b:plpp1-sh1和plpp1-sh2cd8+t细胞中脂代谢相关酶的变化;纵坐标值为plpp1-sh组代谢酶的相对表达量/nc组代谢酶的相对表达量,左边是plpp1-sh1,右边为plpp1-sh2,虚线以上代表plpp-sh组表达升高的酶,虚线以下代表plpp-sh组表达降低的酶;
图5为plpp1敲低后cd8+t细胞中ecar和ocr的变化;其中,a:plpp1-sh1cd8+t细胞ocr的变化;b:plpp1-sh1cd8+t细胞中ecar的变化;c:plpp1-sh1和plpp1-sh2cd8+t细胞中线粒体变化;
图6为plpp1敲低后cd8+t细胞的增殖情况;其中,a:plpp1-sh1和plpp1-sh2cd8+t细胞的凋亡;b:plpp1-sh1和plpp1-sh2cd8+t细胞的数目;c:plpp1-sh1和plpp1-sh2cd8+t细胞增殖细胞的比例;d:plpp1-sh1和plpp1-sh2cd8+t细胞ki67的表达;
图7为plpp1敲低后cd8+t细胞的功能变化;其中,a:pma/离子霉素刺激后plpp1-sh1和plpp1-sh2cd8+t细胞ifn-γ和tnf-α的分泌;b:okt3刺激后plpp1-sh1和plpp1-sh2cd8+t细胞胞质中ca2+流的变化;c:okt3刺激后plpp1-sh1和plpp1-sh2cd8+t细胞ifn-γ和tnf-α的分泌;
图8为cd8+t细胞与肿瘤细胞共孵育后plpp1的变化;其中,a:健康人活化的cd8+t细胞与肺癌细胞系h460和a549共孵育后plpp1的表达;b:小鼠脾脏中活化的ot-1细胞与小鼠恶性黑色素瘤b16-ova共孵育后plpp1的表达;c:肺癌患者肿瘤组织中plpp1+的活化cd8+t细胞中共抑制分子pd-1、ctla4和tim3的表达;
图9为pdl1/pd-1结合后cd8+t细胞增殖及plpp1表达的变化;其中,a:健康人活化的cd8+t细胞以及与肺癌细胞系a549共孵育后t细胞表面pd-1的表达;b:健康人活化的cd8+t细胞以及与肺癌细胞系a549共孵育后肿瘤细胞表面pdl1的表达;c:活化的cd8+t细胞以及pdl1fc片段培养的活化cd8+t细胞中plpp1的表达;d:活化的cd8+t细胞以及pdl1fc片段培养的活化cd8+t细胞中mki67的表达;
图10为pdl1/pd-1结合后cd8+t细胞中plpp1表达及功能的变化;其中,a:健康人活化的cd8+t细胞以及pdl1fc片段培养的活化cd8+t细胞中plpp1和ifn-γ的表达;b:健康人活化的cd8+t细胞以及pdl1fc片段培养的活化cd8+t细胞中plpp1的表达;c:crispr/cas9技术对活化的cd8+t细胞表面pd-1的敲低效率;d:pdl1fc片段对活化的cd8+t细胞以及crispr-pd-1cd8+t细胞中plpp1表达的影响;e:pdl1fc片段以及pd1阻断型抗体对活化的cd8+t细胞中plpp1表达的影响;
图11为pdl1/pd-1结合后cd8+t细胞以及plpp1敲低后cd8+t细胞代谢的变化;其中,a:健康人活化的cd8+t细胞以及pdl1fc片段培养的活化cd8+t细胞中ocr的变化;b:健康人活化的plpp1-sh1cd8+t细胞以及pdl1fc片段培养的活化的plpp1-sh1cd8+t细胞中ocr的变化;c:cd8+t细胞,plpp1-sh1和plpp1-sh2cd8+t细胞在pdl1fc片段处理和未处理时胞内线粒体变化的流式示意图;d:cd8+t细胞,plpp1-sh1和plpp1-sh2cd8+t细胞在pdl1fc片段处理和未处理时胞内线粒体变化的统计图;
图12为pdl1/pd-1结合后cd8+t细胞以及plpp1敲低后cd8+t细胞功能的变化;其中,a:cd8+t细胞、plpp1-sh1cd8+t细胞在pdl1fc片段处理和未处理时胞内ca2+浓度的变化;b:cd8+t细胞、plpp1-sh1和plpp1-sh2cd8+t细胞在pdl1fc片段处理和未处理时胞内tnf-α变化的统计图;c:cd8+t细胞,plpp1-sh1和plpp1-sh2cd8+t细胞在pdl1fc片段处理和未处理时胞内ifn-γ变化的统计图;
图13为pdl1单抗治疗后小鼠恶性黑色素瘤中抗原特异性t细胞中plpp1表达及功能变化;其中,a:小鼠恶性黑色素瘤接种,ot-1过继回输及单抗治疗的模式流程图;b:pdl1单抗治疗和未治疗的小鼠肿瘤体积变化曲线;c:pdl1单抗治疗和未治疗的小鼠肿瘤组织中pd-1hightcrvβ5+cd45.2+cd8+t细胞和pd-1-tcrvβ5+cd45.2+cd8+t细胞中plpp1的表达;d:pdl1单抗治疗和未治疗的小鼠肿瘤组织tcrvβ5+cd45.2+cd8+t细胞中ifn-γ、granzymeb和cd107a的表达;
图14为pdl1/pd-1结合对cd8+t细胞中akt/mtor信号通路的影响;其中,a:gse90728数据库中肺癌患者肿瘤微环境中cd8+t细胞中plpp1的表达与pi3k/akt/mtor信号通路的关系;b:pdl1fc片段处理jurkat和jutkat-pd1细胞系后akt/mtor信号通路的变化;c:pdl1fc片段处理健康人来源的活化的cd8+t细胞后p-akt的比例变化;d:pdl1fc片段处理健康人来源的活化的cd8+t细胞后akt/mtor信号通路和plpp1的变化;nc为对照组,即pdl1fc未处理组;pdl1fc为pdl1fc处理组;
图15为pdl1/pd-1结合对cd8+t细胞中转录因子的影响;其中,a:pdl1fc片段处理活化的cd8+t细胞后转录因子变化热图;b:pdl1fc片段处理活化的cd8+t细胞后转录因子变化倍数(pdl1fc组/nc组);c:pdl1fc片段处理后变化2倍的转录因子与promo网站预测的转录因子的韦恩分析;d:活化的cd8+t细胞中转录因子沉默后plpp1的变化;图16为gata1与cd8+t细胞中plpp1启动子区的结合分析;其中,a:gata1与plpp1启动区的结合位点展示图;b:gata1与plpp1启动区结合位点的结合能力分析;c:akt抑制剂处理后gata1与plpp1启动区结合位点的结合能力分析,control代表akt抑制剂未处理组;
图17为gata1在cd8+t细胞中plpp1启动子区不同位点的结合分析;其中,a:gata1识别并结合至dna的靶序列示意图;b:gata1识别序列的野生型和突变型;c:gata1与cd8+t细胞中plpp1启动子区域site1的结合分析;d:gata1与cd8+t细胞中plpp1启动子区域site2的结合分析;
图18为gata1在cd8+t细胞中的核转位分析;其中,a:pdl1fc片段或pd-1阻断型抗体处理后cd8+t细胞中gata1核转位的成像流式示意图;b:pdl1fc片段或pd-1阻断型抗体处理后cd8+t细胞中gata1核转位的流式比例图;c:akt抑制剂处理后cd8+t细胞中gata1的核转位和plpp1的表达变化;各附图中,*p<0.05,**p<0.01。
具体实施方式
下面结合附图和实施例对本申请做进一步的解释说明。在介绍具体实施例前,就下述实施例中所涉及部分生物材料、实验试剂、实验设备等部分实验背景简介如下。
生物材料:
食管癌、肺癌或结肠癌患者的外周血,以及癌旁正常组织和肿瘤组织,经伦理委员会审批后,均来自于郑州大学第一附属医院相关科室;健康供者外周血,来自河南省郑州市红十字血液中心;肺癌肿瘤细胞系h460和a549,来自中科院细胞所;spf级cd45.1c57bl/6n野生型雌性小鼠,来自北京大学基础医学院;spf级cd45.2ot-1小鼠,以及b16-ova细胞系、293t细胞系、jurkat细胞系,来自中国医学科学院北京协和医学院;质粒psih1-h1-congfp-shrna、质粒pspcas9(bb)-2a-gfp(px458),购自biovector质粒载体菌种细胞基因保藏中心;质粒pcdna3.1(+)-3*flag,来自南京ppl质粒与蛋白共享库;质粒pgl3-basic和质粒prl-tk,来自美国promega公司;相关pcr引物和短发卡rna(shorthairpinrna,shrna)序列、小干扰rna(smallinterferingrna,sirna)序列、向导rna(guiderna,grna)序列如下(均由上海生工合成提供,实验过程中未列出引物参考现有技术常规设计或现有引物即可):
β-actin上游:5’-ctccatcctggcctcgctgt-3’,β-actin下游:5’-gctgtcaccttcaccgttcc-3’;plpp1上游:5’-acgccccacactgcaattt-3’,plpp1下游:5’-tgagtccagtcaacacatcgc-3’;plpp1-shrna1上游:5’-gctgtttgtggcactttatcttcctgtca-3’,plpp1-shrna1下游:5’-gaataaagtgccacaaacagcttttt-3’;plpp1-shrna2上游:5’-gctgtatatgtatcggattcttcctgtca-3’,plpp1-shrna2下游:5’-gaaatccgatacatatacagcttttt-3’;pd-1-grna上游:5’-gtctgggcggtgctacaact-3’,pd-1-grna下游:5’-agttgtagcaccgcccagac-3’;gata1上游:5’-atggagttccctggcctggg-3’,gata1下游:5’-tcatgagctgagcggagcca-3’;gata1-sirna1(si1)上游:5’-caggygyacccauugcucaacugua-3’,gata1-sirna1(si1)下游:5’-uacaguugagcaauggguacaccug-3’;gata1-sirna2(si2)上游:5’-ggaaggaugguauucagacucgaaa-3’,gata1-sirna2(si2)下游:5’-uuucgagucugaauaccauccuucc-3’;
主要试剂:
nucleospinrnaxs(微量组织rna提取试剂盒),德国mn;cd8microbeads(human)、macs缓冲液、tumordissociationkit(human)、tcelltransacttn,德国miltenyibiotec;rt²profilerpcrarray、rt2firststrand试剂盒,德国qiagen;faststartessentialdnagreenmaster,瑞士roche;ppap2aantibody,英国biorbyt;jetprime(转染剂),法国ployplus;反转录试剂盒,日本takara;anti-cd8alphaantibody、anti-ppap2aantibody、gata1antibody,abcam公司产品;alexafluor®555donkeyanti-rabbitigg、alexafluor®488goatanti-mouseigg、alexafluor®488donkeyanti-rabbitigg、apc/cyanine7anti-humancd8、apc/cyanine7anti-mousecd8、apc-humantnf-α、apcanti-humanifn-γ、apcanti-humanki67、apcanti-mouseifn-γ、peanti-humancd69、pe/cyanine7anti-humancd69、pe/cyanine7anti-mousecd45.2、pedonkeyanti-rabbitigg、peanti-humanctla4、peanti-humantim3、peanti-humanpd-1、peanti-humanpdl1、peanti-mouseki67、peanti-mousegranzymeb、peanti-mousecd107a、apc-annexinv、percp/cy5.5anti-mousetcrvβ5.1,5.2、mojosortmousecd8tcellisolationkit、leaf™purifiedanti-humancd3antibody、ultrapurifiedantimousecd3,美国biolegend;β-actin、p-akt(ser473)antibody、p-mtor(ser2448)antibody、p-s6(ser235/236)antibody、b-actinantibody、tbpantibody、chip试剂盒,美国cst;invivomabantimpdl1(10f.9g2)、invivomabratigg2bisotypecontrol,美国bioxcell;dual-gloluciferaseassaysystem,美国promega;icfixationbuffer、permeabilizationbuffer(10x),美国ebioscience;recombinanthumanpd-l1fcchimeraprotein,美国r&d;cellproliferationdyeefluor™670、mitotracker®deepredfm、rhod-2(am)、ecl发光液,美国thermofisherscientific;限制性内切酶bamh1、ecor1、age1、xho1、nhe1以及quickligation™kit,美国neb;xfcellmitostresstestkit、xfglycolysisstresstestkit,美国agilent;
hrp偶联的山羊抗兔igg、hrp偶联的山羊抗鼠igg,北京中衫金桥;细胞核蛋白和浆蛋白抽提试剂盒,上海beyotime;
部分实验设备:
超高效液相、nanodrop2000、seahorsexfe96细胞能量代谢分析仪,美国agilent;高分辨质谱,美国absciex;六色流式细胞检测仪,美国bd;荧光定量pcr扩增仪、pcr扩增仪,美国bio-rad;成像分析流式细胞仪,美国merck;小鼠活体荧光成像仪,美国perkinelmer;化学发光成像系统,美国bio-rad;
部分实验检测方法(未详述操作参考现有技术即可):
cd8+t细胞功能检测:facs缓冲液重悬细胞后,加入apc/cyanine7anti-humancd8抗体、pe/cyanine7anti-humancd69(含apc/cyanine7anti-mousecd8、percp/cy5.5anti-mousetcrvβ5.1/5.2、pe/cyanine7anti-mousecd45.2),4℃避光孵育15分钟;随后进行固定并破膜,加入ppap2aantibody(1:1000稀释)、apc-humantnf-α(或apcanti-humanifn-γ(含apcanti-mouseifn-γ)),4℃避光孵育30分钟;再加入pedonkeyanti-rabbitigg,4℃避光孵育15分钟;离心清洗后,facs缓冲液重悬,流式上机检测;
t细胞增殖检测:采用染料efluor™670标记法或ki67染色法上机检测cd8+t细胞的增殖;细胞凋亡检测:利用apc-annexinv处理,上机检测cd8+t细胞的凋亡比例;t细胞ca2+流检测:利用钙离子探针rhod-2am检测cd8+t细胞ca2+流;ecar及ocr检测:利用ecar海马能量代谢检测专用培养基(seahorsexfbasemedium)配合2-dg或抗霉素a分别进行cd8+t细胞胞外酸化率(extracellularacidificationrate,ecar)检测和cd8+t细胞耗氧率(o2consumptionrate,ocr)检测;t细胞线粒体检测:利用mitotracker®deepredfm处理,通过上机检测荧光强度变化情况来对cd8+t细胞线粒体检测判定。
实施例1
发明人认为实体瘤的微环境与t细胞功能发挥具有紧密的关联作用,而微环境的形成又是t细胞与肿瘤组织共同作用的结果,为探讨和确定肿瘤微环境中与肿瘤相关的t细胞代谢的关键影响因子,发明人进行了系列实验,具体介绍如下。
(一)相关表达分子差异
为确定实际分子表达差异,发明人分别取肺癌患者外周血和肿瘤组织样品,将其处理为2-4mm的小碎块,利用三酶(酶h、酶r、酶a)处理并进行组织消化后,采用密度梯度离心法提取了人外周血单个核细胞(peripheralbloodmononuclearcell,pbmc),进一步利用cd8microbeads采用磁分选方式分离获得cd8+t细胞,最后利用anti-humancd69抗体流式分选获得cd69+t细胞,此即活化的cd8+t细胞(也即cd69+cd8+t细胞)。随后,对此cd8+t细胞表达共抑制分子(pd-1,ctla4和tim3)、功能分子(granzymeb和ifn-γ)以及增殖相关分子ki67的差异情况进行了检测分析(具体操作参考现有技术或试剂盒说明书即可)。对5例样品统计结果如图1所示。分析可以看出,与pbmc相比,肿瘤浸润淋巴细胞(tumorinfiltratedlymphocyte,til)中cd69+cd8+t细胞表面pd-1、ctla4和tim3的表达显著上调(图1a);granzymeb和ifn-γ的分泌的减少(图1b);另外,til中cd69+cd8+t细胞中ki67的表达下调(图1c)。这些结果均表明:pd-1、ctla4和tim3在肿瘤组织中的表达水平较高,而granzymeb、ifn-γ和ki67表达水平较低,表明cd8+t细胞在肿瘤微环境中受到抑制;也即:til中cd8+t细胞功能失调,同时细胞增殖能力明显下调,进而最终导致t细胞对肿瘤细胞杀伤能力降低。
(二)具体生理指标差异
在上述初步流式细胞检测分析基础上,可以发现t细胞在肿瘤微环境中处于功能耗竭状态,而基于已有研究,发明人推断认为肿瘤微环境中t细胞内部脂类分子分布可能处于异常状态。据此,在淬灭cd69+cd8+t细胞中代谢物质后,利用超高效液相质谱法检测了细胞内的脂类分子类型和丰度情况(具体参考现有技术即可)。结果发现:til中cd69+cd8+t细胞中脂类分子分布与pbmc中的明显不同,进一步分析差异脂质分子发现:在肿瘤组织中,cd8+t细胞有较高丰度的磷脂酸(phosphatidicacid,pa)和较低丰度的甘油二酯(diacylglycerol,dg),磷脂酰胆碱(phosphatidylcholine,pc)和磷脂酰乙醇胺(phosphatidylethanolamine,pe)。上述结果表明,t细胞中pa分解代谢通路受到抑制且不能够被有效利用,而pa是合成pc和pe这两种磷脂分子的主要底物,其中在磷脂分子的合成过程中,dg作为中间产物的表达也是降低的。这一结果表明:cd8+t细胞中磷脂分子的合成能力减弱;换言之:til中cd69+cd8+t细胞内部dg含量较低,同时细胞膜主要组成成分pc和pe的含量也处于较低水平,据此可以初步认定:til中cd8+t细胞脂代谢异常参与了t细胞的功能及增殖调控。
由于pa合成pc和pe这两种磷脂分子的代谢过程主要受plpp1的调控,也即,plpp1是t细胞磷脂代谢改变的关键酶,因此,进一步地,发明人利用nucleospinrnaxs试剂盒及参考现有技术,提取cd69+cd8+t细胞的rna后反转录为cdna,以此为模板,发明人利用rt-pcr(内参基因β-actin)技术,结合流式细胞术和细胞免疫荧光技术检测了肿瘤患者外周血和肿瘤组织中活化cd8+t细胞磷脂代谢相关酶plpp1的表达情况。癌旁正常组织以及肿瘤组织中活化的cd8+t细胞中plpp1的表达检测结果表明:与外周血和癌旁正常组织相比,肿瘤组织中活化的cd8+t细胞plpp1的表达下调。而通过免疫荧光和流式细胞术的方法对til中活化的cd8+t细胞中plpp1蛋白水平的表达情况检测结果页表明:til中活化的cd8+t细胞中plpp1表达较低。
(三)plpp1表达与信号通路以及t细胞功能分子的相关性
基于上述分析可以看出,肿瘤微环境t细胞中plpp1的降低导致了细胞磷脂合成代谢过程受损。为了全面了解plpp1的表达对t细胞的影响,发明人对现有geo数据库gse90728数据(该数据库主要对非小细胞肺癌患者肿瘤组织和癌旁正常组织的cd8+t细胞进行了rna测序分析)中cd8+t细胞情况进行了再次分析,以分析plpp1表达与信号通路以及t细胞功能分子的相关性。分析过程中,根据plpp1表达的高低分组后,通过对差异基因进行go富集分析、以及gsea分析,结果均表明plpp1与细胞的脂肪酸代谢,氧化磷酸化以及细胞中ifn-γ的分泌相关,这一结果进一步证明了plpp1在调控t细胞增殖及活化的过程中发挥了主要作用。进一步根据肿瘤组织部位cd8+t细胞的浸润高低分为til高浸润(tilhi),中等浸润(tilint)和低浸润组(tillow)后,研究发现,plpp1在tilhi组的相对表达量较高。结合已有研究(til浸润较多的肿瘤患者的肿瘤组织中的t细胞主要呈现出组织固有的记忆细胞亚型,其中cd103是这种细胞的主要标志性分子之一),根据til中cd8+t细胞中cd103的表达,将其分为:cd103高表达组(cd103hi),cd103中等表达组(cd103int)和cd103低表达组(cd103low)。结果表明,plpp1在cd103hi组的相对表达量较高。
结合前期gsea分析结果(发现plpp1与ifn-γ的分泌相关),进一步分析了plpp1与cd8+t细胞中活化及功能相关分子之间的相关性,结果显示:plpp1与细胞增殖和周期相关的基因mki67、top2a和cdk4等具有正相关关系,同时与细胞活化和功能相关的基因也具有正相关关系,例如itgae、id3、lck、cd27、gamb和cxcl13等。
而已有研究发现t细胞活化分泌的ifn-γ能够通过与其自身的受体结合,从而导致t细胞的凋亡。而我们通过分析plpp1与ifngr1的相关性,发现这两个分子之间具有负相关的关系,这表明:plpp1在促进t细胞功能发挥的同时避免了ifn-γ诱导的凋亡现象的发生。
(四)其他实体肿瘤影响及与预后关联
与上述研究方法类似,发明人进一步对食管癌和结直肠癌患者的外周血和肿瘤组织中cd69+cd8+t细胞中plpp1的表达情况进行了检测和分析。结果表明:与外周血相比,不论在食管癌还是结直肠癌患者中,肿瘤组织部位cd69+cd8+t细胞中plpp1的表达均降低,该表明:plpp1对t细胞的磷脂代谢及其功能的影响是广泛性的,不具有肿瘤特异性。进一步地,结合现有具有患者预后信息的geo数据库,发明人分析了不同肿瘤患者肿瘤组织中til浸润和plpp1表达对其预后的影响。通过分析plpp1对结直肠癌患者、恶性黑色素瘤患者、肾癌患者以及肺癌患者til浸润和预后的影响发现:plpp1高表达的肿瘤患者中til浸润多的患者预后较好,然而在plpp1低表达的肿瘤患者中til浸润多的患者预后则不好。这表明:plpp1高表达能够促进肿瘤组织中t细胞的浸润以及功能的发挥,从而控制肿瘤的进展,而plpp1低表达不能提高t细胞的肿瘤杀伤效果。换言之:plpp1表达水平与肿瘤浸润cd8+t细胞数量正相关,plpp1的高表达能够增加肿瘤微环境中t细胞的浸润及肿瘤杀伤能力。
总体上,肿瘤微环境中t细胞功能缺失已有较多报道,而肿瘤微环境中t细胞的耗竭是肿瘤微环境中各种因素综合作用结果。本实施例中,发明人通过系列实验和分析认为:肿瘤微环境中t细胞的磷脂代谢异常与其功能的发挥具有密切联系,进一步来说:实体肿瘤患者中,肿瘤浸润cd8+t细胞的脂类代谢水平受到抑制,而其中磷脂代谢相关酶plpp1与t细胞在肿瘤部位的浸润水平和活化程度紧密相关,plpp1表达下调是t细胞脂类代谢改变的关键酶。
实施例2
在实施例1基础上,发明人进一步利用基因工程技术通过敲低plpp1,以对plpp1对活化的cd8+t细胞代谢及功能影响情况进行了研究分析,具体研究过程简介如下。
(一)流式分析plpp1低表达和高表达的cd8+t细胞中功能分子差异
实施例1中,利用现有数据库统计已经初步表明:cd8+t细胞中plpp1的表达与其功能和代谢相关。为了进一步验证这种关联性,发明人利用流式细胞术检测了肺癌患者肿瘤微环境中plpp1high和plpp1low的cd8+t细胞中相关因子(具体参考现有技术操作即可)。结果如图2所示。分析可以看出:与plpp1lowcd8+t细胞相比,plpp1highcd8+t细胞能够分泌较高水平的杀伤性细胞因子ifn-γ和tnf-α(图2a和图2b)。也即,通过对比分析肺癌肿瘤组织部位plpp1低表达和高表达的cd8+t细胞中功能分子(ifn-γ和tnf-α)的差异,进一步证明了:与plpp1低表达的cd8+t细胞相比,plpp1高表达的cd8+t细胞具有更好的免疫功能。
(二)构建恶性黑色素瘤小鼠模型,并进一步验证分析
在上述分析基础上,发明人进一步构建了恶性黑色素瘤小鼠模型,通过流式细胞术再次对比分析了小鼠肿瘤组织部位plpp1低表达和高表达的cd8+t细胞中功能分子(ifn-γ)和增殖相关分子(ki67)的表达差异。
需要解释的是,所述小鼠t细胞耗竭肿瘤模型(也即恶性黑色素瘤模型,本模型主要用于t细胞耗竭的研究,肿瘤体积不会因为ot-1细胞的回输而消退)参考如下步骤构建即可:(1)将小鼠黑色素瘤细胞系b16-ova细胞消化后,pbs重悬,调整细胞浓度为3-4×106/ml左右;(2)取cd45.1-c57bl/6n野生型雌性小鼠,每只小鼠皮下接种100µl的b16-ova细胞,即3-4×105个用于小鼠皮下成瘤;(3)皮下注射肿瘤细胞第8天左右,分选ot-1t细胞,并使用ultrapurifiedantimousecd3刺激活化t细胞12小时;(4)待小鼠肿瘤生长直径达到0.25-0.40cm时(大约皮下注射肿瘤细胞第8-9天),尾静脉回输活化后的ot-1t细胞(回输2×106个);(5)细胞回输第9天时,麻醉处死小鼠,研磨小鼠肿瘤组织,使用70µm滤器过滤细胞悬液并离心;pbs重悬细胞沉淀后,4℃保存备用。
需要说明的是,利用链霉亲和素标记的磁珠阴选分离获得小鼠的cd8+ot-1t细胞(ot-1t细胞主要用于尾静脉回输,采用阴选分离方法主要以降低实验干扰)。
细胞回输第9天时的观察发现,小鼠的肿瘤体积并未消退,而是呈现稳定增长的趋势(图3a和图3b)。进一步通过流式细胞术对肿瘤组织中plpp1high和plpp1low的抗原特异性t细胞(cd45.2+tcrvβ5+cd8+t)的功能差异分析可以发现:在小鼠的恶性黑色素瘤组织中,plpp1highcd45.2+tcrvβ5+cd8+t细胞分泌ifn-γ的能力明显高于plpp1lowcd45.2+tcrvβ5+cd8+t细胞,同时plpp1highcd45.2+tcrvβ5+cd8+t细胞的增殖能力也明显升高(图3c和图3d)。简言之:小鼠恶性黑色素瘤组织部位plpp1高表达的cd8+t细胞的功能和增殖能力高于plpp1低表达的细胞。
(三)plpp1敲低后对cd8+t细胞影响
前述研究基础上,为进一步明确plpp1对cd8+t细胞功能影响,利用分子克隆技术,发明人构建了plpp1-sh质粒(即:psih1-h1-congfp-shplpp1质粒),并转染了健康人外周血来源的活化后的cd8+t细胞,利用超高效液相色谱技术对活化后的cd8+t细胞以及plpp1-sh1和plpp1-sh2cd8+t细胞中脂类分子类型和丰度进行了检测分析。具体实验过程及结果简介如下。
所述psih1-h1-congfp-shplpp1质粒(包括两个质粒:plpp1-sh1、plpp1-sh2),其构建过程参考如下(具体操作参考相关试剂盒说明书及现有技术即可):首先,对psih1-h1-congfp-shrna质粒进行bamh1、ecor1双酶切,回收、纯化酶切产物;其次,将plpp1-sh1和plpp1-sh2上、下游两端加上酶切后psih1-h1-congfp-shrna切口两端的同源臂后(由上海生工合成提供)后,进行退火处理;再次,利用快速链接酶将酶切后的psih1-h1-congfp-shrna质粒分别与退火后的plpp1-sh1和plpp1-sh2序列进行连接;最后,将连接后的psih1-h1-congfp-shplpp1质粒转化感受态细胞,并利用lb培养基进行筛选、鉴定,确保重组正确,对重组正确的质粒提取备用。
具体感染cd8+t细胞时:首先,利用jetprime转染试剂、包装质粒pmd2g和包装质粒pspax2,将psih1-h1-congfp-shplpp1质粒转染293t细胞以进行包装和感染,感染完成后培养72小时,收集上清备用或者直接感染细胞(上清液即为包装后病毒颗粒);其次,按每1×107个cd8+t细胞中加100µltcelltransacttn比例,活化t细胞48h用于细胞感染(细胞状态:先变大变圆,后期发生形变);最后,24孔板中,按每5×106个活化cd8+t细胞加100µl病毒上清(即,包装后病毒颗粒)和5µg/mlpolybrene比例,进行感染最终获得plpp1-shcd8+t细胞,培养(利用rpmi-1640完全培养基)72小时后,流式细胞术检测fitc通道的荧光强度以及plpp1的表达,同时检测t细胞转染效率和目的蛋白敲低效率。
plpp1是磷脂代谢过程中的催化酶,能够调控dg分子以及磷脂分子pe和pc的合成。检测结果表明,体外活化健康人的cd8+t细胞后,plpp1在t细胞活化后蛋白水平表达升高,这表明:活化后的t细胞可能通过plpp1分子参与细胞的增殖、功能及代谢调控。对病毒感染过程中t细胞感染效率检测结果表明,plpp1-sh1和plpp1-sh2的感染效率均达到了80%以上;进一步流式细胞术检测gpf+cd8+t细胞中plpp1的蛋白表达情况表明,与阴性对照(nc)相比,plpp1-sh1和plpp1-sh2cd8+t细胞中plpp1的表达水平下调。
流式分选法纯化gpf+cd8+t细胞后,利用rt-pcr法对敲低效率进行了检测,同时结合超高效液相色谱质谱技术对细胞内磷脂的分布情况进行了检测。结果表明:与阴性对照(nc)相比,plpp1-sh1和plpp1-sh2cd8+t细胞中plpp1的敲低水平达到50%左右;而质谱分析结果发现,与nc组相比,plpp1-sh1和plpp1-sh2cd8+t细胞中大部分pc和pe的含量降低;进一步通路富集分析后发现,plpp1-sh1和plpp1-sh2cd8+t细胞中甘油磷脂代谢通路明显下调,另外鞘磷脂代谢和糖基化磷脂酰肌醇的生物合成过程也下调,这些结果都进一步证明了plpp1确实能够调控t细胞的磷脂代谢,尤其对pc和pe分子调控最为明显。
(四)具体代谢差异分析
针对步骤(三)plpp1敲低后的plpp1-shcd8+t细胞,发明人利用rt-pcr法和海马能量检测技术分别进一步检测了活化后的cd8+t细胞以及plpp1-sh1和plpp1-sh2cd8+t细胞中代谢通路相关酶的表达情况、ecar(extracellularacidificationrate,胞外酸化率)和ocr的代谢速率;同时利用流式细胞术检测了活化后的cd8+t细胞以及plpp1-sh1和plpp1-sh2cd8+t细胞的增殖、凋亡、功能以及胞内ca2+浓度。具体情况简介如下。
(1)细胞代谢相关酶表达情况
如前所述,基于现有数据库分析可以发现:plpp1除了能够影响细胞脂类代谢,同时也能够影响细胞的氧化磷酸化。为进一步确定具体影响情况,发明人利用rt-pcr技术检测了plpp1敲低后cd8+t细胞中糖代谢、胆固醇代谢、脂肪酸代谢过程中的关键酶。结果表明:与nc组相比,plpp1-sh1和plpp1-sh2cd8+t细胞糖酵解相关酶hk2、gpi、pfkm、pkm2、tpi、eno1和ldha的表达均降低(图4a)。另外胆固醇代谢相关酶hmgcr、hmgcs1、sqle和idi1的表达也降低;脂肪酸代谢也处于下降状态,如cpt-1、acaca和fasn的表达在plpp1敲低的cd8+t细胞中下降(图4b)。
尽管plpp1敲低后对细胞整体的代谢水平有影响,但总体而言,plpp1主要影响了t细胞的糖酵解过程中对葡萄糖的利用,如hk2的表达低20%-30%;而在脂代谢过程中对脂肪酸合成代谢的影响远大于胆固醇代谢和脂肪酸氧化,如acaca和fasn的表达均下降20%-30%。因此,总体可以认定:plpp1敲低对细胞代谢的影响主要表现在磷脂合成代谢、脂肪酸合成代谢和糖酵解。换言之,plpp1敲低后,cd8+t细胞整体代谢水平也表现出明显降低。
(2)细胞代谢的ecar和ocr情况
进一步地,为更好体现cd8+t细胞代谢水平的变化,我们对t细胞的ecar和ocr速率进行了检测。一般而言,ecar主要反应细胞糖酵解代谢的变化,若细胞糖酵解能力增强,则细胞ecar增高;ocr主要反应了细胞的耗氧率,而细胞氧化磷酸化代谢的进行,会消耗细胞的氧气,因此ocr代表了细胞氧化磷酸化过程的强弱。
前述对现有肿瘤患者数据库分析表明:plpp1表达越高的t细胞,氧化磷酸化水平越高。而结合本实施例检测结果表明,体外敲低plpp1后,细胞的糖酵解能力降低,同时脂肪酸氧化也降低。而氧化磷酸化的过程需要乙酰辅酶a的参与,其中糖酵解和脂肪酸氧化代谢过程的降低则会降低细胞内乙酰辅酶a的含量,从而降低细胞的氧化磷酸化。具体而言,对其中一种sh敲低的cd8+t细胞进行ecar和ocr分析结果显示:plpp1-sh1cd8+t细胞ecar和ocr的速率明显降低,ocr中基础呼吸速率和最大呼吸速率均降低(图5a和图5b)。另外由于细胞整体代谢,尤其氧化磷酸化的增加,能够导致细胞内线粒体复制、形变、融合并变大,因此我们进一步检测了细胞内线粒体的活跃程度。结果表明,与nc组相比,plpp1-sh1和plpp1-sh2cd8+t细胞中线粒体的活跃程度明显降低(图5c),这也反应了细胞氧化磷酸化代谢过程的降低。基于这些结果可以认定:plpp1敲低后cd8+t细胞中ecar和ocr的代谢速率也明显降低。
(3)细胞增殖情况
前述现有数据库分析结果初步认定了:肿瘤微环境中plpp1高表达的cd8+t细胞,细胞分裂和dna复制能力较强。而对plpp1敲低后cd8+t细胞凋亡情况进行检测,结果显示:plpp1分子降低不影响t细胞的凋亡(图6a)。但不影响细胞凋亡,并不表示对增殖情况也不具有影响,为此,对plpp1敲低后t细胞的增殖情况需要进一步分析。
具体增殖情况分析时:分别将1×106个nc、plpp1-sh1和plpp1-sh2cd8+t细胞铺于细胞培养板中,加入t细胞活化试剂并培养3天,再次细胞计数。结果发现:plpp1-sh1和plpp1-sh2cd8+t细胞几乎不增殖(图6b)。另外,我们将nc、plpp1-sh1和plpp1-sh2cd8+t细胞分别标记带荧光的染料,并体外培养3天后,流式检测细胞的增殖比例,结果发现:具有增殖能力的plpp1-sh1和plpp1-sh2cd8+t细胞只有50%左右(图6c);进一步通过流式细胞术检测cd8+t细胞ki67的表达情况后,结果发现,与nc相比,ki67在plpp1-sh1和plpp1-sh2cd8+t细胞中的表达比例均降低(图6d)。综上结果可以认定:plpp1敲低后,cd8+t细胞增殖能力也明显减弱。
(4)具体细胞功能影响
实施例1中,对t细胞内部dg含量检测结果表明,肺癌患者的肿瘤组织的t细胞内部dg含量较低,而本申请针对体外plpp1敲低后检测结果表明,plpp1敲低的cd8+t细胞中dg的含量依然降低,这表明:plpp1可能通过dg分子影响了t细胞功能。
结合已有关于plpp1分子与ca2+流调控、以及t细胞功能活化的过程中ca2+流作用研究,发明人对plpp1是否影响了t细胞的ca2+流变化并最终影响了t细胞的功能进行了进一步研究。具体而言:使用pma和离子霉素活化t细胞后,发现:plpp1敲低后,cd8+t细胞分泌ifn-γ和tnf-α的水平并没有明显下降,其中只有plpp1-sh2cd8+t细胞中tnf-α的分泌水平轻微下调(图7a)。
一般而言,离子霉素能够上调细胞质内ca2+的含量,从而活化t细胞下游的钙调蛋白,增强细胞的功能,因此可以认定:离子霉素中和了plpp1敲低引起的ca2+流变化,从而导致t细胞功能无差异。为此,后续的t细胞功能检测实验中我们使用t细胞活化试剂是cd3单抗(okt3),以更好的模拟t细胞活化的整个过程。进一步对细胞染料标记t细胞中ca2+流的变化检测结果表明,plpp2-sh1和plpp1-sh2cd8+t细胞经过okt3刺激后,t细胞胞质内ca2+浓度并没有显著升高(图7b),而利用okt3刺激plpp1敲低的cd8+t细胞后,其分泌ifn-γ和tnf-α的量则显著下降(图7c)。
cd8+t细胞作为机体适应性免疫系统中的一种杀伤性细胞,能够识别外来物并保护机体不受伤害,例如病毒,突变抗原等。而肿瘤细胞是机体正常细胞恶变而产生的,能够逃避机体的免疫监视作用,逃避cd8+t细胞的杀伤,进而造成肿瘤的局部扩增和转移。而随着肿瘤细胞的不断扩增,肿瘤微环境的形成又进一步抑制了cd8+t细胞的功能,导致t细胞的耗竭。本实施例中,通过构建小鼠耗竭肿瘤模型以及敲低plpp1表达,进一步证明了:plpp1的表达在cd8+t细胞活化后明显升高,而肿瘤微环境中plpp1highcd8+t细胞的功能和增殖能力较高;当plpp1敲低后,cd8+t细胞整体代谢水平均下调,如磷脂代谢、糖酵解和脂肪酸合成代谢等;但plpp1敲低后对cd8+t细胞凋亡不构成影响,但是t细胞增殖能力明显降低;进一步分析表明:plpp1敲低后,活化的cd8+t细胞胞质内ca2+浓度降低,同时t细胞分泌杀伤性细胞因子ifn-γ和tnf-α的能力降低。简言之:作为一种多次跨膜蛋白,plpp1不仅用来催化脂肪酸分解,对于cd8+t细胞功能及代谢具有直接的调控作用,当plpp1表达降低时,t细胞的增殖、杀伤功能、代谢以及胞内ca2+流浓度均明显降低。
实施例3
结合实施例1、2结果,已经可以明确plpp1对于调控t细胞增殖及功能发挥具有重要影响,因此,进一步地,发明人对肿瘤微环境中调控cd8+t细胞中plpp1表达的关键分子进行了进一步研究。具体研究情况简介如下。
(一)相关分子的初步检测
首先,通过流式细胞术检测对比肺癌患者肿瘤组织中plpp1高表达和低表达的活化cd8+t细胞表面共抑制分子(pd-1,ctla4和tim3)的表达差异。随后,参考现有技术及前述操作,将体外将健康人外周血来源的活化48小时的cd8+t细胞与肺癌肿瘤细胞系h460和a549共孵育24小时;随后通过rt-pcr和流式细胞术检测共孵育后t细胞中plpp1的表达,以及t细胞表面pd-1和肿瘤细胞表面pdl1的表达,具体实验过程可参考如下(具体操作参考相关试剂盒说明书或现有技术即可):facs缓冲液重悬细胞后,加入apc/cyanine7anti-humancd8抗体、pe/cyanine7anti-humancd69、peanti-humanpd-1/peanti-humanctla4/peanti-humantim3(含peanti-humanpd-1,peanti-humanpdl1),4℃避光孵育15分钟;随后进行固定并破膜,加入ppap2aantibody(1:1000稀释)、alexafluor®488donkeyanti-rabbitigg,4℃避光孵育15分钟;离心清洗后,facs缓冲液重悬,流式上机检测。在将活化的t细胞与肺癌肿瘤细胞系h460和a549孵育实验中,结果发现:与单独培养或肿瘤上清培养的cd8+t细胞相比,与h460和a549直接共孵育的cd8+t细胞中plpp1的表达显著降低(图8a)。进一步地,在将小鼠的ot-1t细胞与b16-ova分别以不同的比例(5:1,10:1,20:1和50:1)共孵育4小时和12小时后,统计表明:随着共孵育时间的增长以及比例的增加,ot-1t细胞中plpp1的表达下降(图8b)。在对肺癌患者肿瘤微环境中plpp1+cd69+cd8+t细胞表面相关共抑制分子的表达检测分析时,结果显示:plpp1low的t细胞表面pd-1的表达水平较高,然而plpp1high的t细胞表面pd-1的表达水平较低,差异具有统计学意义;同时,plpp1low的t细胞表面ctla4的表达较高,tim3的表达较低,但是差异没有统计学意义(图8c)。
综上结果表明:肿瘤细胞和t细胞共孵育后,细胞表面相关分子的结合能够降低t细胞中plpp1的表达。
为确定具体分子类型,发明人进一步对活化cd8+t细胞与a549共孵育的体系中cd8+t细胞中pd-1的表达以及a549细胞上pdl1的表达情况进行了检测。结果发现:共孵育体系中cd8+t细胞表面pd-1的表达明显高于单独培养的cd8+t细胞(图9a),同时共孵育体系中a549表面pdl1的表达也明显高于单独培养的a549肿瘤细胞系(图9b)。这一结果表明:t细胞表面pd-1与其配体pdl1的结合可能参与了plpp1的调控。
基于现有gse122149数据库中测序数据(该数据库中主要将t细胞分为两组:一组通过cd3/cd28单抗活化cd8+t细胞,另一组在活化cd8+t细胞的同时加入pdl1fc片段),统计分析发现:cd8+t细胞活化后plpp1的表达不断升高,但是pdl1fc片段培养后则抑制了plpp1的表达(图9c);同时pdl1fc片段培养后,活化的cd8+t细胞中mki67的表达也在不同的活化时间点降低(图9d)。
发明人认为:plpp1高表达的cd8+t细胞表面pd-1表达较低,plpp1低表达的cd8+t细胞中pd-1表达较高;而综合临床样本分析和体外共孵育的实验结果可以初步认定:pd-1与其配体pdl1的结合能够降低t细胞中plpp1的表达。
(二)pdl1fc片段加入
前述统计结果表明,pdl1fc片段的加入对plpp1表达具有直接影响,为此,发明人在体外活化cd8+t细胞过程中,加入了pdl1fc片段,以用于结合t细胞表面的pd-1。进一步利用成像流式细胞仪分析pdl1fc片段培养后活化的cd8+t细胞中plpp1的表达以及功能相关分子ifn-γ的表达。结果显示:cd8+t细胞中plpp1和ifn-γ的表达经过pdl1fc片段培养后明显降低(图10a),流式细胞仪分析也证明了同样结果,且差异具有统计学意义(图10b)。
为了进一步验证该结果,发明人利用crispr/cas9技术敲除活化的cd8+t细胞表面pd-1表达,操作过程参考如下(具体操作步骤参考现有技术即可):首先,利用age1和ecor1限制性内切酶对pspcas9(bb)-2a-gfp(px458)质粒进行双酶切,并回收、纯化;其次,将pd-1grna上下游的两端分别加上酶切后pspcas9(bb)-2a-gfp(px458)切口两端的同源臂(由上海生工合成提供),并进行退火处理(即将含有同源臂的pd-1grna上游、含有同源臂的pd-1grna下游置于沸水中后,自然冷却至室温即可);再次,利用快速链接酶将所回收的酶切后pspcas9(bb)-2a-gfp(px458)质粒片段与上述退火后pd-1grna序列进行连接(即,构建获得pspcas9(bb)-2a-gfp(px458)-pd-1grna质粒);再次,将上述连接产物转化感受态细胞,并进行筛选、鉴定,确保构建正确,并提取构建正确的质粒备用;最后,将磁分选后的cd8+t细胞利用tcelltransacttn活化后,利用jetprime转染质粒将上述pspcas9(bb)-2a-gfp(px458)-pd-1grna质粒对其进行转染,培养48~72小时后,检测t细胞的敲除效率(即细胞表面pd-1的表达情况)。
对crispr/cas9技术敲除活化的cd8+t细胞表面pd-1的表达情况检测结果表明:t细胞表面pd-1的表达由37.4%减少至12.3%(图10c)。进一步westernblot检测发现:crispr/cas9敲除pd1的cd8+t细胞经过pdl1fc片段培养后plpp1的蛋白表达并没有下降(图10d)。进一步地,在使用pdl1fc片段培养cd8+t细胞的同时加入了pd-1阻断性抗体,结果发现:pd-1阻断性抗体处理后,cd8+t细胞中plpp1的表达得到了恢复(图10e)。
(三)pdl1fc片段对cd8+t细胞代谢及功能影响的进一步分析
上述实验结果已经初步表明:pdl1/pd-1结合能够调控t细胞中plpp1的表达以及功能,而对于pdl1/pd-1结合调控t细胞的代谢及功能是否依赖plpp1分子的表达,发明人进行了进一步分析和验证。
首先,我们敲低了cd8+t细胞中plpp1的表达,随后使用pdl1fc片段培养cd8+t细胞和plpp1-sh1cd8+t细胞(具体操作参考前述内容及现有技术即可)。通过海马能量检测技术和流式细胞术检测pdl1fc处理后cd8+t细胞以及plpp1-sh1和plpp1-sh2cd8+t细胞中ocr的代谢速率、细胞内线粒体功能变化以及细胞功能和胞内ca2+浓度变化情况。研究结果显示:pdl1fc片段培养cd8+t细胞后能够降低t细胞的ocr速率(图11a),但是plpp1敲低的cd8+t细胞中ocr速率没有明显变化(图11b)。进一步对cd8+t细胞中线粒体变化检测结果表明:经过pdl1fc片段培养后,plpp1-sh1和plpp1-sh2cd8+t细胞中线粒体的荧光强度并没有明显变化,然而对照组的cd8+t细胞经过处理后线粒体的荧光强度明显下调(图11c和图11d)。这些结果表明:pdl1/pd-1结合后对cd8+t细胞代谢及线粒体的调控主要是通过plpp1的表达来发挥作用的。
另一方面,对pdl1fc培养后cd8+t细胞以及plpp1敲低后的cd8+t细胞的功能变化的检测结果表明:cd8+t细胞经过pdl1fc培养后细胞内ca2+浓度明显下降,但是当cd8+t细胞中plpp1敲低后再次经过pdl1fc培养后其胞内的ca2+浓度没有明显的变化(图12a)。而在利用pdl1fc片段培养活化的cd8+t细胞、plpp1-sh1和plpp1-sh2cd8+t细胞24小时后,实验结果显示:pdl1fc片段培养cd8+t细胞后能够降低t细胞杀伤性细胞因子ifn-γ和tnf-α的分泌,然而plpp1-sh1和plpp1-sh2cd8+t细胞经过pdl1fc片段培养后,ifn-γ和tnf-α的表达并没有明显变化(图12b和图12c)。
综合这些实验结果,同样证明了:pdl1/pd-1降低cd8+t细胞的功能也是通过plpp1的表达发挥作用的。
(四)结合pdl1阻断型单抗的动物模型实验
上述体外实验均表明:pdl1/pd-1结合能够降低cd8+t细胞中plpp1的表达,进而降低t细胞的代谢和功能。为进一步验证,发明人构建了恶性黑色素瘤小鼠模型,待肿瘤长出后,进行ot-1细胞回输治疗并在不同的时间点进行pdl1阻断型单抗治疗(待小鼠ot-1t细胞通过尾静脉回输至小鼠体内后,分别在第3天和第7天腹腔注射200µginvivomabantimpdl1(10f.9g2)或invivomabratigg2bisotypecontrol),最后检测肿瘤微环境中ot-1t细胞中plpp1的表达以及功能状态(流程如图13a所示)。结果表明:与对照组相比,pdl1单抗治疗组中小鼠黑色素瘤的体积增长速度较慢(图13b)。
而对肿瘤组织中t细胞(流式分选获得pd-1hightcrvβ5+cd45.2+cd8+t细胞和pd-1-tcrvβ5+cd45.2+cd8+t细胞,rt-pcr法检测分选后的t细胞中plpp1的表达)的功能检测分析表明:pd-1hightcrvβ5+cd45.2+cd8+t细胞在经过pdl1单抗治疗后细胞中plpp1的表达上调,然而pd-1-tcrvβ5+cd45.2+cd8+t细胞却没有明显变化(图13c),这表明:t细胞中plpp1的表达直接受pdl1/pd-1的调控。pdl1单抗治疗在上调plpp1表达的同时,也增加了tcrvβ5+cd45.2+cd8+t细胞的功能分子的表达,如ifn-γ、granzymeb和cd107a(图13d)。换言之,pdl1阻断型单抗治疗后,恢复了肿瘤微环境中抗原特异性t细胞中plpp1的表达并恢复其杀伤功能,并最终降低了肿瘤细胞的生长速度。
就上述相关实验结果,发明人总结如下:cd8+t细胞活化后,细胞表面除了共刺激分子高表达,同时共抑制分子的表达升高,如pd-1和ctla4等,而肿瘤微环境中cd8+t细胞耗竭是造成肿瘤进一步发生发展的原因之一,也即:肿瘤微环境中t细胞耗竭会伴随着各种免疫共抑制分子高表达,例如pd-1,ctla4和tim3等。基于前述实施例1、2研究结果已经可以明确:肿瘤微环境中cd8+t细胞中plpp1的表达降低能够降低细胞内磷脂合成代谢、胆固醇代谢以及脂肪酸代谢等;同时通过调控t细胞的ca2+变化,进而调控t细胞的功能。本实施例中,通过相关实验则进一步证明了:pd-1与其配体pdl1结合后,能够影响t细胞的线粒体状态,同时降低t细胞的ocr速率,并最终降低t细胞的功能,而pdl1/pd-1对t细胞功能调节又是通过调节细胞内磷脂代谢通路中关键酶plpp1的表达来实现的。也即,plpp1是肿瘤微环境中pdl1/pd-1信号通路调控t细胞功能和代谢的关键分子。
实施例4
实施例3基础上,已经可以明确pdl1/pd-1信号通路对t细胞功能和代谢调节依赖于plpp1这一关键分子,但这种调节通路中具体的信号通路仍是不够清楚的,为此,发明人做了进一步深入研究和探讨。具体实验及结果简介如下。
(一)pdl1fc处理后akt/mtor信号通路影响
前述在对geo数据库gse90728中肺癌患者肿瘤微环境中cd8+t细胞的rna测序数据进行gsea分析时,发现在plpp1表达较高的患者中t细胞中pi3k/akt/mtor信号通路活化程度较高(图14a)。为进一步验证这一通路,发明人利用pdl1fc处理健康人外周血来源的活化的cd8+t细胞以及jurkat和jurkat-pd1细胞系,最后通过流式细胞术和westernblot技术检测pdl1fc处理后这些细胞中akt/mtor信号通路的变化。
在使用pdl1fc片段培养jurkat和jurkat-pd1细胞系并在不同的时间点检测细胞内akt/mtor信号通路的活化程度后,实验结果表明:在pd-l1fc培养后的15分钟细胞内akt/mtor信号通路抑制作用较弱,而是在培养1小时之后akt/mtor信号通路明显被抑制,其中在1或2小时差异最明显(图14b),后期检测信号通路蛋白的磷酸化均在1小时左右检测。而体外培养并活化健康人外周血来源的cd8+t细胞,并使用pdl1fc片段培养t细胞后,结果发现:与未处理组(nc组)相比,pdlifc处理组(pdl1fc组)中pd-1+cd8+t细胞中p-akt的表达比例明显下降(图14c)。同时,利用westernblot技术检测细胞内信号蛋白的磷酸化的结果显示:pdl1fc组细胞内akt和s6的磷酸化水平下降,同时细胞plpp1的表达下降(图14d)。
综合上述结果,可以初步认定:pdl1/pd-1结合后,抑制了cd8+t细胞中akt/mtor信号通路,从而下调plpp1的表达。
(二)相关转录因子分析
为确定信号通路中相关转录因子变化情况,发明人利用pcrarray和现有技术预测分析了pdl1fc处理后健康人外周血来源的cd8+t细胞中转录因子的变化,同时通过体外敲低cd8+t细胞中相关转录因子实验检测了细胞中plpp1的表达变化。结果表明:通过pcrarray的方法检测到细胞内常见的转录因子发生了明显变化(图15a),具体而言:pdl1fc处理后,t细胞中有14个转录因子发生了明显变化(变化倍数在2倍以上),其中5个转录因子上调,9个转录因子下调(图15b)。进一步将plpp1基因的启动子区在promo网站中进行转录因子结合位点预测分析,发现能够与其结合的预测转录因子有76个,我们将这76和预测转录因子与pdl1fc培养后具有变化的转录因子进行交集分析,最终发现只有5个转录因子(gata1,e2f1,hnf1a,hnf4a和arnt)可能参与调控plpp1的表达(图15c)。进一步地,我们设计、合成并转染这些转录因子至活化的cd8+t细胞中,以确定这些转录因子是否能够影响plpp1的表达(其中2个转录因子在t细胞中表达水平很低,因此直接做了排除)。结果表明:hnf1a和hnf4a在t细胞中几乎不表达,因此认为这两个变化的转录因子并不是主要调控因素;而cd8+t细胞中gata1的表达抑制后,plpp1的表达明显上调(图15d)。基于此,可以初步认定:pdl1/pd-1结合后能够上调gata1的表达,从而最终降低plpp1的表达。
(三)chip分析(chromatinimmunoprecipitation,染色质免疫共沉淀技术,也称结合位点分析法)
gata1作为一类转录因子,主要是通过结合在该基因的dna序列上发挥调控作用。为此,我们使用chip技术检测了检测转录因子gata1与靶基因plpp1上游启动子区的结合情况,并进一步通过双荧光素酶实验验证了gata1是否能够与plpp1的启动子区结合情况。而由于gata1调控目的基因的表达一般需要入核来发挥功能,因此,发明人又通过成像流式和westernblot技术检测了pdl1fc处理后cd8+t细胞中gata1的核转位情况。
通过promo和jaspar网站结合分析时,可以发现gata1与plpp1启动子结合评分最高的两个位点site1(-1453bp~-1443bp)和site2(-1145bp~-1135bp)(图16a)。而chip实验发现gata1与plpp1启动子区域的这两个位点都能够结合(图16b)。在体外使用akt抑制剂处理活化的cd8+t细胞后,再次通过chip实验发现:akt信号通路抑制后,gata1结合plpp1启动子两个位点的能力明显增强(图16c)。
为了进一步验证gata1是否能够通过结合plpp1启动子区调控该基因的表达,我们进行了双荧光素酶实验。具体而言,我们将plpp1的启动子区结合位点进行了突变,通过分子克隆和细胞转染技术将plpp1的野生型和突变型的启动子区域转染至过表达gata1或对照的293t细胞(图17a和图17b)。与chip实验结果不同,我们发现:plpp1site2启动子区域突变后,过表达gata1的293t细胞中荧光强度增强(图17d),而site1位点则没有明显变化(图17c),这表明:gata1能够与plpp1启动子区的site2位点结合,从而降低plpp1的表达。
总之,在初步认定gata1能够通过与plpp1启动子区结合从而调控plpp1的表达基础上,我们再次使用pdl1fc片段或pd-1阻断性抗体培养体外活化的cd8+t细胞,通过成像流式细胞仪分析发现:t细胞经过pdl1fc片段培养后gata1的核转位比例由23.8%增加至40.1%,但是同时经过pd-1阻断性抗体处理后gata1的核转位比例下降(图18a和图18b)。进一步通过akt抑制剂处理体外活化的cd8+t细胞并westernblot检测后发现:akt抑制剂处理后t细胞中plpp1的表达降低,同时gata1的核转位(n-gata1/c-gata1)增加(图18c)。综合上述结果,都表明了:pdl1/pd-1降低cd8+t细胞中plpp1的表达主要是通过抑制akt/mtor信号通路导致gata1核转位增加引起的;或者说:pdl1/pd-1通过抑制akt/mtor的活化,增强cd8+t细胞中gata1的核转位,进而降低plpp1表达。
(四)小鼠恶性黑色素瘤模型实验
在上述体外实验证明pdl1/pd-1能够通过抑制akt/mtor信号通路的活化进而降低plpp1的表达基础上,我们进一步构建了恶性黑色素瘤小鼠模型,待肺部肿瘤长出后,通过尾静脉回输b16-ova-luc细胞进行ot-1细胞回输治疗(尾静脉注射方式回输小鼠ot-1t细胞),并在不同的时间点(分别在第3天和第7天腹腔注射200µginvivomabantimpdl1(10f.9g2)或invivomabratigg2bisotypecontrol)进行pdl1阻断型单抗治疗。
结果表明:荷瘤小鼠经过pdl1阻断型单抗治疗后肿瘤生长速率明显下降。
在肿瘤细胞接种第19天后,麻醉处死小鼠并将肺部肿瘤进行石蜡包埋、切片,h&e染色确定小鼠肺部肿瘤形成。分析可以发现,与前期动物实验的流式结果一致,组织免疫荧光显示pdl1阻断型单抗治疗后小鼠肺部肿瘤组织部位plpp1+cd8+t细胞浸润数目明显增多。我们还发现:肿瘤组织部位这些抗原特异性t细胞中p-akt和p-mtor的表达比例明显升高。
综合上述结果同样表明了:pdl1阻断型单抗治疗后能够再次激活肿瘤组织部位cd8+t细胞中akt/mtor信号通路,从而提高肿瘤微环境中plpp1+cd8+t细胞的浸润,降低肿瘤细胞的生长速度,也即:pdl1/pd-1结合降低cd8+t细胞中plpp1的表达是通过降低akt/mtor信号通路引起的。
基于本实施例,可以总结如下:调控t细胞活化或耗竭的转录因子具有多种,在本实施例中,通过系列实验基本证明了:pdl1/pd-1主要通过抑制cd8+t细胞中akt/mtor信号通路的活化,从而促进gata1这一转录因子的核转位,最终导致了plpp1表达降低,并最终抑制了t细胞的增殖、代谢及功能的发挥。
- 还没有人留言评论。精彩留言会获得点赞!