十八烷基化修饰的多肽在制备抑制血小板聚集的药物中的应用的制作方法
本发明属于生物医学技术领域,尤其涉及十八烷基化修饰的多肽在制备抑制血小板聚集的药物中的应用。
背景技术:
血栓是血流在心血管系统血管内面剥落处或修补处的表面所形成的小凝血斑块。在凝血生理过程中,血栓是凝血系统级联反应的最终产物,它主要由沉积的血小板,不溶性纤维蛋白,积聚的白细胞和红细胞组成。血管中血栓的形成会阻碍血流的流动,甚至导致血管的完全闭塞,血栓从血管内壁剥落和脱离容易形成游走型栓塞。由此引发的心脑血管疾病包括心肌梗死、脑血栓、动脉血栓栓塞和静脉血栓栓塞等。血栓疾病形成是由遗传和环境因素相互作用、相互影响的多因素变化过程。其发病形式多样,而且往往具有反复性,综合发病率高居各种疾病之首,近年来还有发病率逐渐增加,发病时间年轻化的趋势,严重威胁着人类健康,是当代医学研究和药物研发的重点和热点之一。
血小板在血栓形成过程中起到至关重要的作用,血小板通过糖蛋白gp1b复合物粘附于内皮下结合的血管性血友病因子(vwf)。这种初始相互作用本身和血小板激动剂的释放是导致细胞内ca2+升高的信号。ca2+的升高诱导血小板形态改变,前列腺素合成,颗粒内容物的释放和血小板整合素αiibβ3的构象变化。活化血小板中的αiibβ3变得能够结合纤维蛋白原和其他粘附蛋白并介导血小板凝聚(初级止血塞)。此外,活化的血小板表面为凝血反应提供了有效的催化表面,最终导致纤维蛋白的形成(二次止血)。心血管疾病是非传染性疾病中死亡率最高的疾病,心血管疾病不仅发病率高,也是我国死亡率最高的疾病,我国心血管病患病率及死亡率仍处于上升阶段,心血管疾病的防治病刻不容缓。目前临床上用于预防和治疗血栓性疾病的药物主要有抗凝血药物,溶血栓药物和抗血小板聚集药物,但是常见的抗血栓药物如阿司匹林、氯吡格雷等往往会产生药效减弱、肠胃刺激、粒细胞减少、出血风险增加等副作用。
技术实现要素:
有鉴于此,本发明的目的在于提供十八烷基化修饰的多肽在制备抑制血小板聚集的药物中的应用。本发明十八烷基化修饰的多肽能够显著抑制血小板的聚集。
为了实现上述发明目的,本发明提供了以下技术方案:
本发明还提供了十八烷基化修饰的多肽在制备抑制血小板聚集的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。
本发明还提供了十八烷基化修饰的多肽在制备抑制14-3-3ζ和整合素αiibβ3蛋白结合的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。
本发明还提供了十八烷基化修饰的多肽在制备抑制血小板延展的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。
本发明还提供了十八烷基化修饰的多肽在制备抑制akt1蛋白磷酸化的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。
本发明还提供了十八烷基化修饰的多肽在制备抑制c-src蛋白磷酸化的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。
本发明提供了本发明还提供了十八烷基化修饰的多肽在制备抑制14-3-3ζ、c-src蛋白与整合素αiibβ3蛋白结合的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。
本发明提供了十八烷基化修饰的多肽在制备抑制血小板聚集的药物中的应用。本发明十八烷基化修饰的多肽能够显著抑制血小板的聚集。14-3-3ζ蛋白可以通过促进c-src蛋白和整合素αiibβ3蛋白的相互作用进而促进血小板聚集,本发明通过抑制14-3-3ζ蛋白和整合素αiibβ3蛋白的相互作用实现抗血小板聚集的功能。
本发明的有益效果:
1.十八烷基化多肽来源于整合素αiibβ3,通过抑制14-3-3ζ蛋白和整合素αiibβ3蛋白的相互作用从而影响血小板外向内信号通路实现抑制血小板聚集功能;
2.十八烷基化多肽不会显著影响血小板和纤维蛋白原的结合,从而降低了出血风险。
附图说明
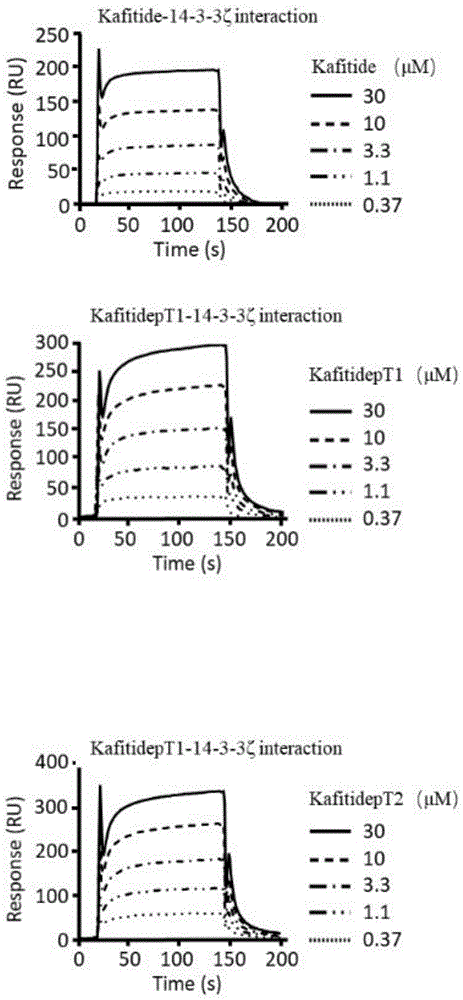
图1显示kafitide多肽及其磷酸化类似物与14-3-3ζ蛋白的结合情况;
图2显示myristoylated-kafitide多肽及其磷酸化类似物在抗血小板聚集中的作用;
图3显示myristoylated-kafitide多肽及其磷酸化类似物对血小板和纤维蛋白原结合的影响;
图4显示myristoylated-kafitide多肽及其磷酸化类似物对整合素外向内信号通路的相关蛋白的影响。
具体实施方式
本发明提供了本发明提供了十八烷基化修饰的多肽在制备抑制血小板聚集的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。在本发明中,所述十八烷基修饰在左起第一个氨基酸上。在本发明中,能够产生抗血小板聚集的核心氨基酸序列为多肽中的txt,x为其它任意氨基酸,t为苏氨酸,且磷酸化苏氨酸多肽活性会显著增强。
在本发明中,非烷基化的多肽无法进入血小板内,十八烷基化修饰的目的是增强多肽进入血小板的能力。
本发明还提供了十八烷基化修饰的多肽在制备抑制14-3-3ζ和整合素αiibβ3蛋白结合的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。本发明具体实施例中,对需要使用到的14-3-3ζ的来源没有特殊限定,优选使用本领域技术人员公知的常规市售产品即可,如货号af2669,品牌r&d的14-3-3ζ。
本发明还提供了十八烷基化修饰的多肽在制备抑制血小板延展的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。
本发明还提供了十八烷基化修饰的多肽在制备抑制akt1蛋白磷酸化的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。
本发明还提供了十八烷基化修饰的多肽在制备抑制c-src蛋白磷酸化的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。
本发明还提供了十八烷基化修饰的多肽在制备抑制14-3-3ζ、整合素αiibβ3蛋白和c-src蛋白结合的药物中的应用,所述多肽的氨基酸序列选自seqidno.1~16中的一种或几种。
本发明对所述药物剂型及剂型的制备方法没有特殊限定,采用多肽在医学上可接受的剂型及常规制备方法制备即可。在本发明中,所述药物中多肽为唯一活性物质。
在本发明中,所述多肽的序列如下:
seqidno.1:keatstf;
seqidno.2(myristoylated-kafitidept1):
myristoylated-plykea{pt}stft;
seqidno.3(myristoylated-kafitidept2):
myristoylated-plykeats{pt}ft;
seqidno.4(myristoylated-kafitidept1-1-10aa):myristoylated-plykea{pt}stf;
seqidno.5(myristoylated-kafitide-6aa):myristoylated-keatst;
seqidno.6(kafitidep-6aa):kea{pt}st;
seqidno.7(kafitidep-51aa):kea{pt}s;
seqidno.8(kafitidep-5aa):ea{pt}st;
seqidno.9(kafitidep-42a)a:kea{pt};
seqidno.10(kafitidep-42aa):ea{pt}s;
seqidno.11(kafitidep-4aa):a{pt}st;
seqidno.12(myristoylated-kafitide-3aa):myristoylated-eat;
seqidno.13(myristoylated-kafitidep-3aa):myristoylated-ea{pt};
seqidno.14(myristoylated-kafitideb2p-7aa):myristoylated-ksa{pt}ttv;
seqidno.15(myristoylated-kafitideb1-7aa):myristoylated-ksavttv;
seqidno.16(myristoylated-kafitideb2-7aa):myristoylated-ksatttv。
在本发明中,所述氨基酸序列中的p表示磷酸化,myristoylated表示十八烷基修饰。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
1.kafitide多肽(十八烷基化多肽,以下简称kafitide多肽,氨基酸序列如seqidno.1所示)及其磷酸化类似物(氨基酸序列如seqidno.2和3所示)与14-3-3ζ蛋白的结合实验
将14-3-3ζ蛋白(响应值为9810ru)结合到cm5芯片(使用0.4m的edc(1-ethyl-3-[3-dimethylaminopropyl]carbodiimidehydrochloride)和10mmnhs(n-hydroxysuccinimide)活化芯片,并用1m的乙醇胺(ethanolamine)封闭)上,使用表面等离子共振仪对不同浓度的kafitide多肽及其磷酸化类似物(氨基酸序列如seqidno.2和3所示)与14-3-3ζ蛋白的结合情况进行检测,得到不同浓度(分别为0.37,1.1,3.3,10,30μm)下kafitide多肽及其磷酸化类似物(氨基酸序列如seqidno.2和3所示)与14-3-3ζ蛋白的结合响应值,从而计算得出kafitide多肽及其磷酸化类似物(氨基酸序列如seqidno.2和3所示)与14-3-3ζ蛋白的结合解离常数。以溶解kafitide多肽及其磷酸化类似物的缓冲液pbs为对照。结果见图1。
kafitide多肽(氨基酸序列如seqidno.1)与14-3-3ζ蛋白的结合速率常数(ka)为8.6×102(m-1s-1),解离速率常数(kd)1.8×10-2(s-1),最大响应值(rmax)581(ru),平衡解离常数(kd)2.1×10-5(m),kafitidept1(氨基酸序列如seqidno.2所示)与14-3-3ζ蛋白的ka、kd、rmax和kd值分别为1.1×103(m-1s-1)、9.6×10-3(s-1)、681(ru)、8.7×10-6(m),kafitidept2(氨基酸序列如seqidno.3所示)与14-3-3ζ蛋白的ka、kd、rmax和kd值分别为3.7×103(m-1s-1)、1.3×10-2(s-1)、629(ru)、3.4×10-6(m)。从得到的平衡解离常数来看,kafitide多肽及其磷酸化类似物与14-3-3ζ蛋白存在很显著的结合。
实施例2
血小板聚集抑制实验
血小板聚集抑制实验
1、健康人血小板使用台式液洗涤后,用台式b液稀释至2.5×108/ml。取300μl洗过的血小板,加入不同浓度样品,37℃孵育5min后,添加0.03u/ml的凝血酶和1μg/ml的胶原诱导聚集,在血小板聚集仪上绘制5min内的聚集曲线。以样品溶剂处理过的血小板聚集作为对照。
2、如图2所示,myristoylated-kafitide多肽(氨基酸序列如seqidno.1)及其磷酸化类似物(氨基酸序列如seqidno.2和3)以梯度依赖的形式抑制由thrombin诱导的血小板的聚集。10μm的myristoylated-kafitide多肽能抑制约50%的血小板的聚集,而1μm的myristoylated-kafitide多肽(氨基酸序列如seqidno.1)的磷酸化类似物(myristoylated-kafitidept1和myristoylated-kafitidept2)(氨基酸序列如seqidno.2和3)能抑制约50%的血小板的聚集。
3、检测胶原诱导的血小板聚集使用洗涤的人血小板。如图2所示,kafitide多肽(氨基酸序列如seqidno.1)及其磷酸化类似物(氨基酸序列如seqidno.2和3)以梯度依赖的方式抑制由1μg/ml胶原诱导的血小板的聚集。5μm的myristoylated-kafitide多肽能抑制约50%的血小板的聚集,而10μm的myristoylated-kafitide多肽的磷酸化类似物(myristoylated-kafitidept1和myristoylated-kafitidept2)能完全抑制的血小板的聚集。
血小板洗涤方法如下:
a.每个1.5mlep管装1.4ml血小板(浓缩血小板血浆),室温400g离心5min,弃上清;
b.每管用0.5ml台式a液重悬血小板,把两管重悬的血小板合并到新的1.5mlep管,混匀,400g室温离心5min;
c.每管用1ml台式a液重悬血小板,移到新的ep管中400g室温离心5min;
d.每管用1ml台式b液重悬血小板,并用台式b液调整血小板到适当的浓度。
台式液母液(1l):nahco31g,nacl8g,nah2po40.05g,kcl0.2g,mgcl20.2g。
台式a液(ph6.5):50ml母液,bsa0.175g,0.5medta250μl,glucose0.05g。
台式b液(ph7.35-7.45):50ml母液,glucose0.05g。
实施例3
血小板延展和黏附实验
取浓度为1*107/ml的血小板,分别加入kafitide多肽(30μm,氨基酸序列myristoylated-keatstf),kafitidescr多肽(seqidno.17:tksetfa)作为阴性对照,同浓度的integrilin(依替巴肽)作为阳性对照。混匀后放在37℃恒温箱中,孵育10min。12孔板中加入1mg/ml的纤维蛋白原,风干后,加入孵育好的血小板,加入凝血酶(0.12u/ml),混匀后置于恒温箱中,孵育40min,去除12孔板中的血小板混合液,加入pbs去除掉没有与纤维蛋白原结合而贴壁的血小板,加入4%多聚甲醛固定,10min后,去掉多聚甲醛,用pbs洗涤三次,每次5min,之后用pbs溶解的0.3%的tritonx-100溶液破膜,10min后去除,加入pbs清洗三次,每次5min,之后用2%的bsa溶液封闭1hour,pbs洗涤两次后加入1:500的p-selectin抗体(血小板激活后p-selectin会转移到胞外)和标记有fitc荧光的鬼笔环肽(用于标记血小板骨架),避光4℃过夜孵育,用pbs洗涤三次后,避光加入tritc的p-selectin二抗(已过滤),室温避光孵育1h。pbs洗涤五次,每次5min。使用激光共聚焦显微镜观察并记录实验结果。
取浓度为1*107/ml的血小板,分别加入myristoylated-kafitide多肽(30μm,氨基酸序列myristoylated-keatstf),myristoylated-kafitidescr多肽作为阴性对照,同浓度的integrilin作为阳性对照。加入0.1mg/ml的fitc荧光标记的纤维蛋白原,分组加入样品,放入37℃烘箱40min后,使用细胞流式分析仪检测血小板与纤维蛋白原的结合情况。
如图3中的a所示,myristoylated-kafitide多肽并不会影响血小板与纤维蛋白原的结合,即多肽并不会影响血小板的黏附功能。并且myristoylated-kafitide多肽可以显著抑制血小板的延展。
如图3中的b所示,流式实验myristoylated-kafitide多肽不会显著影响血小板与纤维蛋白原的的结合。
实施例4
myristoylated-kafitide多肽(seqidno.1)对整合素外向内信号通路的相关蛋白的影响
(1)洗过的血小板,使用血小板聚集仪,用胶原(1μg/ml)和凝血酶(0.03u/ml)诱导激活,加入不同浓度(0,4,20,100μm)的myristoylated-kafitide多肽抑制血小板的激活,获得血小板样品获得后,充分裂解;
(2)取20μldynabeadsproteina,用磁力架吸附磁珠后,去除溶液,加入200μl加入0.02%tween-20的pbs溶液,清洗两次后,加入2μl的β3蛋白抗体,室温孵育10min。
(3)使用磁力架吸附磁珠,去除溶液,血小板样品充分裂解后,10000g离心5min,取上清加入到磁珠中,室温孵育10-30min(根据蛋白与抗体的结合特异性调整孵育时间);
(4)用pbs溶液清洗三次后每管加入20μl的50mmglycine溶液(ph2.8),20μl的pbs溶液,和10μl的5xloadingbuffer,混匀后沸水浴5min后,离心,上清液上样,进行蛋白电泳。
结果如图4,myristoylated-kafitide多肽可以通过抑制akt1蛋白(图4中的a)和c-src蛋白(图4中的b)的磷酸化,从而浓度依赖性的抑制不同激动剂诱导的血小板聚集,并且通过免疫共沉淀实验结果我们发现,myristoylated-kafitide多肽可以显著抑制整合素β3蛋白与c-src蛋白和14-3-3ζ蛋白的结合。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>中国科学院昆明动物研究所
<120>十八烷基化修饰的多肽在制备抑制血小板聚集的药物中的应用
<160>16
<170>siposequencelisting1.0
<210>1
<211>7
<212>prt
<213>人工序列(artificialsequence)
<400>1
lysglualathrserthrphe
15
<210>2
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>2
proleutyrlysglualathrserthrphethr
1510
<210>3
<211>11
<212>prt
<213>人工序列(artificialsequence)
<400>3
proleutyrlysglualathrserthrphethr
1510
<210>4
<211>10
<212>prt
<213>人工序列(artificialsequence)
<400>4
proleutyrlysglualathrserthrphe
1510
<210>5
<211>6
<212>prt
<213>人工序列(artificialsequence)
<400>5
lysglualathrserthr
15
<210>6
<211>6
<212>prt
<213>人工序列(artificialsequence)
<400>6
lysglualathrserthr
15
<210>7
<211>5
<212>prt
<213>人工序列(artificialsequence)
<400>7
lysglualathrser
15
<210>8
<211>5
<212>prt
<213>人工序列(artificialsequence)
<400>8
glualathrserthr
15
<210>9
<211>4
<212>prt
<213>人工序列(artificialsequence)
<400>9
lysglualathr
1
<210>10
<211>4
<212>prt
<213>人工序列(artificialsequence)
<400>10
glualathrser
1
<210>11
<211>4
<212>prt
<213>人工序列(artificialsequence)
<400>11
alathrserthr
1
<210>12
<211>3
<212>prt
<213>人工序列(artificialsequence)
<400>12
glualathr
1
<210>13
<211>3
<212>prt
<213>人工序列(artificialsequence)
<400>13
glualathr
1
<210>14
<211>7
<212>prt
<213>人工序列(artificialsequence)
<400>14
lysseralathrthrthrval
15
<210>15
<211>7
<212>prt
<213>人工序列(artificialsequence)
<400>15
lysseralavalthrthrval
15
<210>16
<211>7
<212>prt
<213>人工序列(artificialsequence)
<400>16
lysseralathrthrthrval
15
- 还没有人留言评论。精彩留言会获得点赞!