一种Ad-NK4修饰的DC疫苗构建方法与流程
本发明涉及疫苗技术领域,具体涉及一种ad-nk4修饰的dc疫苗构建方法。
背景技术:
树突状细胞,是机体功能最强的专职抗原递呈细胞,它能高效地摄取、加工处理和递呈抗原,未成熟dc具有较强的迁移能力,成熟dc能有效激活初始t细胞,处于启动、调控、并维持免疫应答的中心环节。
dc肿瘤疫苗是将肿瘤细胞的dna,rna,肿瘤细胞裂解物,肿瘤抗原蛋白/多肽等致敏dc细胞,利用dc强大的呈递功能,激活患者体内的t细胞免疫应答,从而发挥治疗肿瘤的作用。但是肿瘤免疫抑制(tme)大大限制了dc肿瘤疫苗的发展,常规dc疫苗的免疫效力不够理想。
nk4是一种hgf特异性拮抗剂,也是血管形成抑制剂,因其能够阻断hgf/c-met途径和肿瘤血管形成而成为抗肿瘤治疗的策略之一。本申请人既往的研究表明,在转染条件下ad-nk4对树突状细胞的免疫功能具有改善作用,然而,如何在分子层面构建ad-nk4修饰的dc疫苗,以实现对骨髓瘤的免疫治疗,目前尚无可以借鉴的现有技术。
技术实现要素:
本发明旨在针对现有技术的技术缺陷,提供一种ad-nk4修饰的dc疫苗构建方法,以解决常规dc疫苗对骨髓瘤免疫效果较低的技术问题。
本发明要解决的另一技术问题是,如何在分子层面构建ad-nk4修饰的dc疫苗。
为实现以上技术目的,本发明采用以下技术方案:
一种ad-nk4修饰的dc疫苗构建方法,包括以下步骤:
1)制备人多发性骨髓瘤细胞裂解物;
2)从多发性骨髓瘤患者外周血分离dc,并利用ad-nk4转染;
3)利用步骤1)的人多发性骨髓瘤细胞裂解物致敏步骤2)转染后的dc。
作为优选,步骤1)包括以下步骤:收集u266细胞,1000rpm离心5min,pbs重悬;液氮冷冻1min,而后在37℃环境下融解,重复3次;5000rpm离心10min,收集上清,经0.22μm孔径滤器过滤并收集,检测其中蛋白浓度。
作为优选,步骤2)包括以下步骤:取多发性骨髓瘤患者的外周血,获取外周血单个核细胞pbmncs,采用cd14磁珠分选收获的pnmncs;收获的cd14+的pbmncs,用终浓度100ng/ml的rhgm-csf和终浓度50ng/ml的rhil-4诱导分化为dcs;以ad-nk4转染dcs。
作为优选,步骤3)包括以下步骤:在dc培养的第6天,室温下融解u266细胞裂解产物,根据所测蛋白浓度加入蛋白溶液,至终浓度为100μg/ml,以致敏不同处理组诱导培养的dc,在37℃、5%co2培养箱中孵育12h;收集促成熟的dc,1000rpm离心5min,即得到ad-nk4修饰的dc疫苗。
作为优选,步骤1)中,在液氮冷冻前,对重悬液中的细胞进行计数。
作为优选,步骤1)中,在液氮冷冻过程中,重悬液容纳于冻存管中,每管1.5ml。
作为优选,步骤1)中,所述在37℃环境下融解,是在37℃的水浴箱中实现的。
作为优选,步骤1)中,对蛋白浓度的检测是利用bca蛋白质浓度检测试剂盒实现的。
作为优选,步骤2)中,外周血单个核细胞pbmncs是利用密度梯度离心法获得的。
作为优选,还包括以下步骤4):取步骤3)所得的ad-nk4修饰的dc疫苗,加入pbs溶解后,吹打均匀、计数,送流式进行鉴定。
本发明提供了一种ad-nk4修饰的dc疫苗构建方法。该技术方案首先制备人多发性骨髓瘤细胞裂解物,同时从多发性骨髓瘤患者外周血分离dc,并利用ad-nk4转染,最后,利用人多发性骨髓瘤细胞裂解物致敏由ad-nk4转染后的dc,从而获得ad-nk4修饰的dc疫苗。在此基础上,分别通过体内实验和体外实验考察了该疫苗的免疫效力。结果证实,本发明所构建的dc疫苗在体外可显著抑制mm细胞的增殖,同时具有诱导凋亡作用,在细胞增殖、细胞周期、凋亡及akt-mtor相关蛋白的表达均有明显的变化;体内实验部分,以本发明疫苗给药的实验组,其肿瘤的体积明显较小,肿瘤明显得到抑制,从而证实了本发明的技术效果。
附图说明
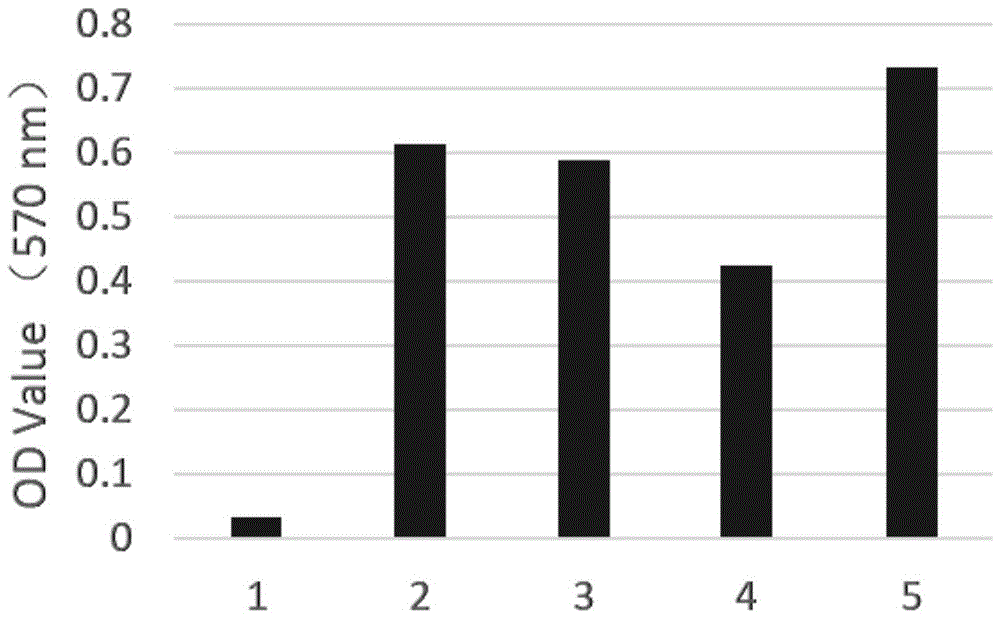
图1是本发明具体实施方式中,各实验组对mm细胞增殖的影响结果图;图中,1~5分别为ad-nk4-dc疫苗组、pbs-dc疫苗组、ad-control-dc疫苗组、ad-nk4组和空白对照组。
图2是本发明具体实施方式中,各实验组对mm细胞诱导凋亡的结果图;图中,1~5分别为ad-nk4-dc疫苗组、pbs-dc疫苗组、ad-control-dc疫苗组、ad-nk4组和空白对照组。
图3是本发明具体实施方式中,各实验组中mm细胞的增殖、凋亡及相关通路蛋白的表达情况变化图;图中,1~5分别为ad-nk4-dc疫苗组、pbs-dc疫苗组、ad-control-dc疫苗组、ad-nk4组和空白对照组。
图4是本发明具体实施方式中,在给与不同实验组药物后,受试对象的肿瘤实体图;图中,1~5分别为ad-nk4-dc疫苗作用组、ad-control-dc疫苗作用组、pbs-dc疫苗作用组、ad-nk4组及空白对照组。
图5是本发明具体实施方式中,在给与不同实验组药物后,受试对象的肿瘤组织he染色图;图中,1~5分别为空白对照组、pbs-dc疫苗作用组、ad-control-dc疫苗作用组、ad-nk4组及ad-nk4-dc疫苗作用组。
图6是本发明具体实施方式中,在给与不同实验组药物后,受试对象的肿瘤免疫组织化学检测结果图;图中,1~5分别为空白对照组、pbs-dc疫苗作用组、ad-control-dc疫苗作用组、ad-nk4组及ad-nk4-dc疫苗作用组。
图7是本发明具体实施方式中,在给与不同实验组药物后,受试对象的肿瘤tunel凋亡检测结果图;图中,1~5分别为ad-control-dc疫苗作用组、、ad-nk4组、ad-nk4-dc疫苗作用组、pbs-dc疫苗作用组及空白对照组
图8是本发明具体实施方式中,在给与不同实验组药物后,受试对象的肿瘤组织细胞凋亡、增殖及相关通路蛋白的表达变化图;图中,1~5分别为ad-nk4-dc疫苗组、pbs-dc疫苗组、ad-control-dc疫苗组、ad-nk4组和空白对照组。
具体实施方式
以下将对本发明的具体实施方式进行详细描述。为了避免过多不必要的细节,在以下实施例中对属于公知的结构或功能将不进行详细描述。以下实施例中所使用的近似性语言可用于定量表述,表明在不改变基本功能的情况下可允许数量有一定的变动。除有定义外,以下实施例中所用的技术和科学术语具有与本发明所属领域技术人员普遍理解的相同含义。
一、mm细胞裂解物负载的dc疫苗的构建及鉴定
a.收集u266细胞,1000rpm/min离心5min,pbs重悬,计数。分装于冻存管中,每管1.5ml。液氮冷冻1min,快速置于37℃水浴箱融解,重复3次。5000rpm/min离心10min。收集所有上清液,经0.22μm的滤器过滤并收集。根据改良型bca蛋白质浓度检测试剂盒测定蛋白浓度;
b.分离培养mm患者外周血来源的dc:取多发性骨髓瘤患者的外周血,密度梯度离心法获取外周血单个核细胞(pbmncs),采用cd14磁珠分选收获的pnmncs。收获的cd14+的pbmncs,用100ng/ml(终浓度)rhgm-csf和50ng/ml(终浓度)rhil-4诱导分化为dcs。以ad-nk4和ad-gfp转染dcs。
c.在dc培养的第6天,室温下融解u266细胞裂解产物,根据所测蛋白浓度加入蛋白溶液(终浓度为100μg/ml)以致敏不同处理组诱导培养的dc(同第一部分dc的培养和处理),在37℃、5%c02培养箱中孵育12h。收集促成熟的dc,1000rpm/min离心5min,得到的即为不同处理组的dc疫苗(ad-nk4-dc疫苗、ad-control-dc疫苗和pbs-dc疫苗)。取少许加入pbs溶解后,吹打均匀、计数,送流式进行鉴定。
分组和处理:将u266细胞分别与上述构建的不同处理组的dc疫苗及ad-nk4、
pbs(空白对照组)共培养,即分为ad-nk4-dc疫苗作用组、ad-control-dc疫苗作用组、pbs-dc疫苗作用组、ad-nk4组及空白对照组,然后采用以下方法分析ad-nk4修饰的dc疫苗体外抗骨髓瘤效应:
以下通过实验方法考察ad-nk4-dc疫苗的免疫效力。
二、在细胞水平上,探讨ad-nk4修饰的dc疫苗体外抗骨髓瘤作用
方法:利用mtt、流式细胞仪和westernblot等方法证实ad-nk4修饰的dc疫苗对mm细胞的增殖能力、凋亡及侵袭等影响。
结果:与对照组相比较,ad-nk4修饰的dc疫苗(即ad-nk4-dc疫苗)显著抑制mm细胞的增殖(见图1)和诱导凋亡作用(图2),同时通过westernblot结果也显示在细胞增殖、细胞周期、凋亡及akt-mtor相关蛋白的表达均有明显的变化(图3)。
以上结果表明:ad-nk4修饰的dc疫苗在体外发挥强大的抗骨髓瘤作用。
三、利用mm动物模型,探讨ad-nk4修饰的dc疫苗体内抗mm作用
方法:测定肿瘤体积以评估肿瘤增殖情况、tunel试剂盒检测肿瘤细胞凋亡情况、免疫组化染色检测cd31的表达、westernblot检测各组肿瘤组织中与细胞增殖、凋亡及信号转导通路相关蛋白表达的情况。
结果:与对照组相比较,ad-nk4修饰的dc疫苗(即ad-nk4-dc疫苗组)在肿瘤的体积明显较小(见图4)。肿瘤细胞he染色后呈紫红色,排布密集,
对照组肿瘤组织内部毛细血管分布丰富,给药组中虽然仍有大量癌细胞,但正常细胞较多,毛细血管分布较少,ad-nk4-dc疫苗组肿瘤明显得到抑制(见图5)。cd31普遍在血管组织中表达,如图6所示,通过cd31免疫组化检测,可以看出ad-nk4-dc疫苗组的肿瘤组织中,cd31表达量明显低于其余各组。tunel凋亡检测结果显示:ad-nk4-dc疫苗组的肿瘤组织的凋亡细胞数量明显高于其余各组(见图7)。westernblot结果显示:各组肿瘤组织的细胞增殖、凋亡及akt-mtor通路相关蛋白的表达也有较为明显的改变(见图8)。
以上结果表明:ad-nk4修饰的dc疫苗在mm小鼠体内均有强大的抗骨髓瘤作用,可能与akt-mtor通路的调控有关。
以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,并不用以限制本发明。凡在本发明的申请范围内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!