用于治疗动脉粥样硬化的组合物的制药用途的制作方法
本发明涉及动脉粥样硬化的治疗,特别涉及由微泡载带的治疗剂对动脉粥样硬化的治疗用途。
背景技术:
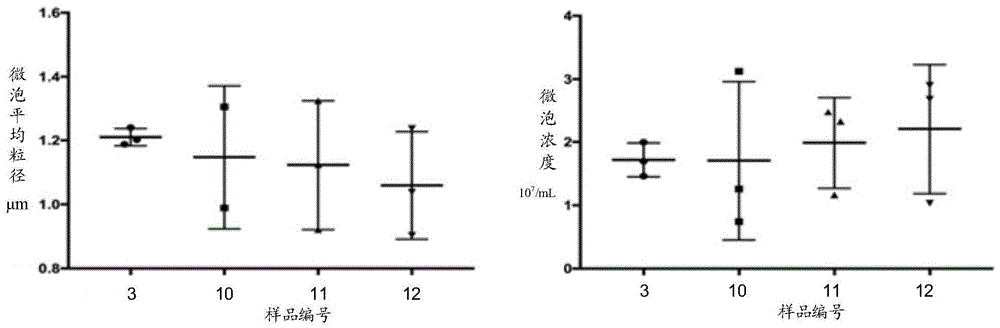
:健康的动脉具有弹性,但随着时间的推移,动脉壁会变硬,这种情况通常称为动脉硬化。受累动脉的病变从内膜开始,局部有脂质积聚、纤维组织增生和钙质沉着,形成斑块。由于在动脉内膜积聚的脂质外观呈黄色粥样,因此称为动脉粥样硬化。它是心脑血管系统疾病中最常见的疾病,主要影响身体内的大中动脉,如冠状动脉、颈动脉、脑动脉、肾动脉等。动脉粥样硬化是一种缓慢进行性疾病,可能在童年时就开始,早期无明显症状,之后可出现头晕、胸闷等,全球每年约有2000万人死于动脉粥样硬化性疾病。目前,治疗动脉粥样硬化的主要方式包括药物治疗、手术治疗等。药物治疗主要包括:施用降血脂药物、抗血小板药物、扩张血管药物、溶血栓和抗凝血药物等;手术治疗主要针对狭窄或闭塞动脉进行再通、重建或旁路移植等外科手术,也可行血管腔内放置支架等介入治疗。wengao等在“coppersulfidenanoparticlesasaphotothermalswitchfortrpv1signalingtoattenuateatherosclerosis”(naturecommunications,(2018)9:231)中公开了利用cus作为光热材料,用于打开trpv1通道,再辅以激光辐照,以减轻动脉粥样硬化。中国专利申请公开cn103917637a中公开了一种“靶向微泡”,该微泡包括含有流体的芯、锚定部分和靶向部分,通过对钙离子具有亲和力的化学基团(即,膦酸基团)可将该微泡靶向到含钙的组织或病灶,如结石、粥样斑块、钙化组织或斑块等,并通过空化作用(如利用电磁能量或超声能量)使微泡破裂后释放出足以造成靶组织或病灶(如结石、斑块等)的破坏(如溶解或碎裂)的能量。然而,该专利申请中没有公开针对粥样斑块的具体治疗方法和治疗效果。而且该方法可能造成斑块碎裂,而碎裂的部分随血液循环可能反而带来诸如栓塞的严重后果。因此,目前仍需有效且安全的治疗动脉粥样硬化的药物和方法。技术实现要素:有鉴于此,本发明的主要目的在于提供一种对治疗动脉粥样硬化有效且不会造成斑块碎裂、脱落的药剂的制药用途。为此,本发明提供一种包括微泡与铜离子的组合物在制备治疗动脉粥样硬化的药物中的应用。本发明的组合物可用于任何部位的动脉中存在的粥样硬化的治疗,尤其包括主动脉(如胸主动脉和腹主动脉)和冠状动脉的粥样硬化的治疗。本发明的组合物对于动脉粥样硬化引起的相关疾病(例如冠状动脉粥样硬化引起的冠心病)同样具有治疗效果。所述组合物包括:含有浓度大于1×106个/ml、粒径小于10μm的微泡和有效治疗量的铜离子的溶液,其中所述微泡具有芯-包膜结构,所述微泡的芯含有流体,所述微泡的包膜由药学可接受的成膜材料构成。所述微泡的芯所含流体在患者体内的环境下为气态。所述流体为惰性,具有在标准条件下低于35℃的沸点,优选低于30℃的沸点。当流体在体内释放后,可以气体形式容易地排出体外,基本无副作用。可列举的此类流体有:空气、二氧化碳、c1~6的氟代烷烃(如全氟丙烷、五氟戊烷等)等。较为优选的是全氟丙烷。药学可接受的成膜材料可为白蛋白或磷脂等材料,但不限于此。根据具体实施方式,较优选的为人血白蛋白。本发明的微泡可以是常规用作声学造影剂的那些微泡(如等,但不限于此)。此外,也可以是不同于声学造影剂的那些微泡。例如本发明的微泡可以是在循环系统中能保持稳定并能够通过超声造影观察到,但在高能量超声波的振动下易于破裂的微泡。例如本发明的微泡的包膜可由人血白蛋白构成。所述铜离子与所述药学可接受的成膜材料形成为配合物,优选为螯合物。根据一种实施方式,所述微泡的包膜的表面可进一步具有有利于所述微泡富集到动脉粥样斑块的靶向部分。所述靶向部分可为具有可螯合钙的取代基的化学基团。所述取代基可为氨基、羧基、磷酰基、巯基等。具体地,所述靶向部分可具有属于骨靶向剂家族的双膦酸盐基团。根据一种实施方式,所述微泡的浓度为0.5×107到1.5×107个/ml,优选为1.0×107到1.3×107个/ml。所述微泡可具有1~5μm,优选具有1~2μm的平均直径。所述有效治疗量的cu2+可为在所述组合物中具有35~105mg/ml的浓度的cu2+,优选为具有45~85mg/ml的浓度的cu2+。所述组合物还可进一步包括药学上可接受的载剂。具体地,所述载剂可为葡萄糖溶液、生理盐水或去离子水。根据具体实施方式,所述药物为注射剂。更具体地,所述药物为针剂或粉针剂。例如,可以是所述组合物的溶液形式,或者将所述溶液形式的组合物冻干得到粉针剂型的所述药物。根据具体实施方式,在对所述药物施加外部能量时可引起所述微泡的空化。具体地,所述能量为超声能量或电磁能量。本发明中,所述治疗动脉粥样硬化为抑制粥样斑块尺寸增长和/或减小粥样斑块尺寸。所述粥样斑块可为处于任何阶段的动脉粥样斑块。通过以下将详述的实施例可知,被测动物的动脉中发生的动脉粥样硬化斑块有的处于脂纹期(动脉内膜表面有白色的脂质条纹),有的处于纤维斑块期(病理切片可见斑块内有平滑肌细胞增生、胶原增生、巨噬细胞浸润的情况),本发明的组合物均可起效。因而,本发明的组合物可用于处于任何阶段的动脉粥样硬化的治疗,可明显减轻或抑制斑块的发展,与治疗前相比甚至能够减少斑块的面积和体积,降低斑块中的脂质(尤其是总胆固醇和鞘磷脂)含量。由于本发明的组合物通过铜离子起效,对斑块的稳定性没有影响,不会造成斑块的脱落,因而能够安全地使用。附图说明图1示出了对制备例中以第3、10、11和12号样品的制备方法制备的不同批次的组合物测定其粒径和微泡浓度的差异性对比;图2为实施例中所用动物模型的建立及分组流程图;图3为实施例4中对主动脉进行不同测试的组织分配示意图;图4为实施例3建立动物模型实验中正常饮食组和高胆固醇饲料组经饲喂12周后主动脉经油红o染色的结果,其中a1为腹主动脉染色后的照片,标尺=1000μm,a2为被染色斑块的面积占血管平铺面积的百分比的统计结果,t检验双侧检验,*p<0.05;b1为胸主动脉染色后的照片,标尺=1000μm,b2为被染色斑块的面积占血管平铺面积的百分比的统计结果,t检验双侧检验,*p<0.05;图5为实施例3建立动物模型实验中正常饮食组和高胆固醇饲料组经饲喂12周后腹主动脉组织横切面切片经苏木素伊红染色后的光学显微镜照片,其中a和a为正常饮食组,可见内膜光滑,未见斑块;b和b为高胆固醇饮食组,可见内膜下形成斑块,图中,a和b的标尺=100μm,a和b的标尺=50μm;图6为实施例3建立动物模型实验中高胆固醇饲料组经饲喂12周后对心脏不同部位的组织切片经苏木素伊红染色后的光学显微镜照片,其中a为心脏左室壁、b为心脏室间隔和c为心脏右室壁;图7为实施例3建立动物模型实验中正常饮食组和高胆固醇饲料组经饲喂12周后主动脉内中膜中铜含量的对比结果,t检验双侧检验,*p<0.05;图8为实施例3建立动物模型实验中正常饮食组和高胆固醇饲料组经饲喂12周后心脏(a)、肝脏(b)、脾(c)和肺(d)中铜含量的对比结果,t检验双侧检验,*p<0.05;图9为实施例3建立动物模型实验中正常饮食组和高胆固醇饲料组经饲喂12周后血清总胆固醇(tc)含量(a)、低密度脂蛋白胆固醇(ldl)含量(b)、高密度脂蛋白胆固醇(hdl)含量(c)和甘油三酯(tg)含量(d)的检测结果对比图,t检验双侧检验,*p<0.05,***0.0001<p<0.05;图10为根据实施例4对各组动物干预后,腹主动脉经油红o染色后,斑块面积相对血管平铺面积的百分比统计图,其中a为造模后干预前的斑块面积百分比与未经干预,正常饮食三个周期后的斑块面积统计对比,可见在造模后正常饮食情况下,斑块继续生长,又增长了94.73%;b为造模后经干预的微泡组和cu-微泡组与未干预组的斑块百分比的统计对比,其中cu-微泡组相对微泡组和未干预组,斑块面积百分比显著减小,t检验双侧检验,*p<0.05;图11为根据实施例4对各组动物干预后,各组腹主动脉截面的弹力纤维(evg)染色切片显微镜照片;图12为根据实施例4对各组动物干预后,各组腹主动脉截面的弹力纤维(evg)染色切片中斑块截面积的统计图,a为造模后干预前组(as&干预前)的斑块面积百分比与未干预组(as&未干预),正常饮食(正常组)三个周期后的斑块面积统计对比,可见在造模后正常饮食情况下,斑块截面积增长了37.39%;b为造模后经三个周期干预的微泡组(as&mb+us)和cu-微泡组(as&cu-mb+us)与未干预组的斑块百分比的统计对比,其中cu-微泡组相对微泡组和未干预组,斑块截面积分别显著减小45.75%和27.16%;图13为根据实施例4对各组动物干预后,各组腹主动脉截面的油红o染色的切片显微镜照片,标尺=200μm;图14采用冰冻切片油红o染色的方法,对斑块中的脂质进行染色。与干预前组(as&干预前)相比,未干预组(as&未干预)腹主动脉脂质成分不变。经过三个周期干预后,cu-微泡组(as&cu-mb+us)与未干预组(as&未干预)相比,脂质成分有减少趋势,减少率为33.96%,与微泡组(as&mb+us)相比脂质成分减少率为53.15%;而微泡组(as&mb+us)与未干预组(as&untreated)相比脂质成分有增加趋势;图15为根据实施例4对各组动物干预后,各组腹主动脉中总胆固醇(tc)、鞘磷脂(sm)、游离脂肪酸(ffa)和甘油三酯(tg)的量的统计学分析图;图16为根据实施例4对各组动物干预后,对切片进行天狼猩红固绿染色显示胶原成分的显微镜照片,标尺=200μm;图17为根据实施例4对各组动物干预后,对切片进行天狼猩红固绿染色后对斑块中胶原成分面积的统计学分析图;图18为根据实施例4对各组动物干预后,采用冰冻切片免疫组化法,用α-sma为标记物指示平滑肌细胞的各组的显微镜照片,标尺=200μm;图19为根据实施例4对各组动物干预后,采用冰冻切片免疫组化法,用α-sma为标记物指示平滑肌细胞的面积占斑块面积比值的统计学分析图,其中a为对比干预前组(as&干预前)和未干预组(as&未干预)的平滑肌细胞面积占斑块面积比值的统计学分析图,b为对比了未干预组(as&未干预)、微泡组(as&mb+us)和cu-微泡组(as&cu-mb+us)的平滑肌细胞面积占斑块面积比值的统计学分析图,t检验,**0.001<p<0.05;图20为根据实施例4对各组动物干预后,采用石蜡切片免疫组化法,用cd68为标记物指示巨噬细胞的各组的显微镜照片,标尺=200μm;图21为根据实施例4对各组动物干预后,采用石蜡切片免疫组化方法,用cd68为标记物指示巨噬细胞的面积占斑块面积比值的统计学分析图,其中a为对比干预前组(as&干预前)和未干预组(as&未干预)的巨噬细胞面积占斑块面积比值的统计学分析图,b为对比了未干预组(as&未干预)、微泡组(as&mb+us)和cu-微泡组(as&cu-mb+us)的巨噬细胞面积占斑块面积比值的统计学分析图;图22为根据实施例4对各组动物干预后,采用冰冻切片免疫组化法,用α-sma为标记物指示平滑肌细胞的各组的显微镜照片,通过平滑肌细胞所处的斑块近管腔一侧的分布来指示纤维帽的厚度,其中如未干预组所图示,虚线围出的较窄部分为纤维帽,虚线围出的较宽部分为斑块,标尺=200μm;图23为根据实施例4对各组动物干预后,采用冰冻切片免疫组化法,用α-sma为标记物指示纤维帽厚度占斑块厚度比值的统计学分析图,其中a为对比干预前组(as&干预前)和未干预组(as&未干预)的纤维帽厚度占斑块厚度比值的统计学分析图,b为对比了未干预组(as&未干预)、微泡组(as&mb+us)和cu-微泡组(as&cu-mb+us)的纤维帽厚度占斑块厚度比值的统计学分析图,t检验,*p<0.05。图24为根据实施例5对各组动物干预后,冠状动脉经油红o染色后,斑块面积相对血管平铺面积的百分比统计图,其中a为取材观察左主干冠脉到左前降支部分,cu-微泡组血管壁平均斑块面积17.86%,未干预组血管壁平均斑块面积52.67%;b为取材观察右冠脉,cu-微泡组血管壁平均斑块面积43.87%,未干预组血管壁平均斑块面积79.92%。图25为根据实施例5对各组动物干预后,左冠脉截面的油红o脂质染色切片的显微照片,以及计算脂质占斑块的面积进行统计学分析的图。cu-微泡组(as&cu-mb+us)相比于未干预组(as&未干预),脂质成分减少76.8%。图26为根据实施例5对各组动物干预后,左冠脉截面的天狼猩红固绿染色切片的显微照片,以及计算胶原占斑块的面积进行统计学分析的图,cu-微泡组(as&cu-mb+us)相比于未干预组(as&未干预),胶原成分增加一倍。图27为根据实施例5对各组动物干预后,左冠脉截面的平滑肌细胞染色切片的显微照片,以及计算平滑肌细胞占斑块的面积进行统计学分析的图,cu-微泡组(as&cu-mb+us)相比于未干预组(as&未干预),平滑肌细胞成分增加了约60%。图28为根据实施例5对各组动物干预后,左冠脉截面的巨噬细胞染色切片的显微照片,以及计算巨噬细胞占斑块的面积进行统计学分析的图,cu-微泡组(as&cu-mb+us)相比于未干预组(as&未干预),巨噬细胞成分无明显差异。具体实施方式下面将结合本发明实施方式及附图,对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式仅仅是本发明的一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。需要说明的是,在本发明实施例中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的方法或者装置不仅包括所明确记载的要素,而且还包括没有明确列出的其他要素,或者是还包括为实施方法或者装置所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括该要素的方法或者装置中还存在另外的相关要素。本发明的组合物可通过以下方法制备。例如可向含有一定浓度的人血白蛋白和一定浓度的含铜离子源的葡萄糖溶液中充入形成所述微泡的芯的流体,并在超声破碎仪中进行振动混合,得到能够稳定存在的微泡溶液体系。该体系中,铜离子稳定地以配合物形式与人血白蛋白结合。其中铜离子源可为水溶性铜盐,如硫酸铜、硝酸铜、氯化铜等。制备本发明微泡的方法不限于以上示例的方法。更具体的制备方法可以是公开在中国专利申请no.201010223282.3中的方法,该专利申请全文被引用合并于本文中。实施例1组合物的制备及稳定性测试按体积比为3:1:9混合5wt%人血白蛋白溶液(hsa),下表1所示的不同浓度的硫酸铜溶液(cuso4)和5wt%葡萄糖溶液并向混合溶液中充入全氟丙烷约76.077ml后使用超声破碎仪声振液气混合物(30%的振幅作用120秒,80%的振幅作用30秒)。即制得本发明的组合物,4℃保存。在4℃保存期间观察微泡溶液体系的稳定性,其中静置5小时以内微泡破裂的为极不稳定(以××表示);静置12小时以内微泡破裂的为不稳定(以×表示);静置24小时以内微泡破裂的为稳定(以δ表示);静置1~3个月微泡不破裂的为稳定性较佳(以〇表示);以及静置3个月以上微泡不破裂的为稳定性极佳(以◎表示)。将所得的各溶液与色板进行颜色对比,对颜色进行定性,并观察其保存稳定性,结果见表1。表1白蛋白—硫酸铜络合物颜色定性及稳定性结果发现,制备的铜-白蛋白微泡溶液体系为粉色系的具有较好的稳定性,其中1.0mg/mlcuso4制备的微泡体系稳定最佳,在4℃冰箱中可稳定存放3个月以上。而1.5mg/ml,2.0mg/mlcuso4溶液制备的微泡体系稳定性不足,静置过夜后微泡破裂;3.0mg/mlcuso4溶液制备的铜白蛋白微泡稳定性最差,静置2小时后微泡破裂。进一步检测各批次微泡的粒径分布和浓度,发现粉色系微泡体系各批次间粒径分布均匀、浓度均一。其他色系各批次间粒径分布和浓度差异性校大。参见图1,其中3号微泡体系的平均粒径和浓度分别为1.21±0.03μm,(1.72±0.27)×107/ml;10号微泡体系的平均粒径和浓度分别为1.15±0.22μm,(1.70±1.25)×107/ml;11号微泡体系的平均粒径和浓度分别为1.12±0.20μm,(1.99±0.72)×107/ml;12号微泡体系的平均粒径和浓度分别为1.06±0.17μm,(2.21±1.02)×107/ml。其中,1.5mg/ml,2.0mg/ml,3.0mg/mlcuso4溶液制备的铜白蛋白微泡粒径分布、微泡浓度差异较大。通过该稳定性实施例发现,含白蛋白的溶液和含铜离子的溶液以适当的浓度和比例混合可获得稳定的微泡体系,而体系中微泡的粒径随不同的批次有一定的波动。实施例2本发明组合物的制备用5wt%的人血白蛋白溶液与1mg/ml的硫酸铜溶液以3:1的比例混合,然后向白蛋白-硫酸铜混合溶液中定量充入76.077ml的全氟丙烷,然后采用超声破碎仪(20khz)声振液气混合物至混合物呈淡粉色乳状悬液。最终,经检测该组合物溶液中微泡平均粒径约为1.05μm,铜浓度约为48.88±4.647μg/ml。将所得溶液4℃保存,用于以下实施例中。用5wt%的人血白蛋白溶液与5wt%的葡萄糖溶液以3:1的比例混合,然后向5%白蛋白-5%葡萄糖溶液中定量充入全氟丙烷38.04ml,然后采用超声破碎仪(20khz)声振液气混合物至混合物呈白色乳状悬液。最终,经检测该组合物溶液中微泡平均粒径和微泡平均浓度分别约为0.839μm,2.93×107个/ml。将所得溶液4℃保存,用于以下实施例中。实施例3兔动脉粥样硬化模型的建立本实验采用高胆固醇饮食饲喂法,高胆固醇饲料由四川省实验动物专委会养殖场制作。具体方法如下:向粉碎后的普通饲料按1%质量加入胆固醇颗粒,混合后再重新压制成含有高胆固醇的颗粒饲料。新西兰大白兔对高胆固醇饲料敏感,单纯提高饲料中的胆固醇就可诱导动物形成动脉粥样硬化病变,病变过程在病理生理下与人类的病变过程类似。且不加其他干预只用饮食诱导,能更好的模拟人类。对新西兰大白兔用上述高胆固醇饮食饲喂12周建立兔动脉粥样硬化模型。按照以下实施例4中的取材及测定方法在建模结束后对正常饲喂的动物和饲喂高胆固醇饲料的动物的主动脉中的斑块形成、心脏病变、血管及脏器中的铜流失情况以及血清中的脂质含量进行检测。其中,对腹主动脉、胸主动脉进行油红o染色可明显看出,高胆固醇饮食的兔腹主动脉、胸主动脉的内膜下可见明显红色隆起斑块,而正常饮食组的兔胸主动脉内膜光滑,未见斑块形成(参见图4)。he染色同样可以看到腹主动脉横切面上内膜向管腔内凸起,且增厚的内膜中有多核空泡状的泡沫细胞(参见图5)。此外,对心脏不同部位的组织进行he染色,可见高胆固醇饮食组的兔心脏各个位置血管均出现病变,心肌中也出现脂肪组织(参见图6),病变严重的已经接近血管完全堵塞。将主动脉外膜剥离,利用原子吸收光谱法测定主动脉内中膜的铜含量,发现高胆固醇饮食组主动脉中铜含量与正常饮食组相比,显著下降(下降了约39%)(参见图7),且其他脏器(如心脏(a)、肝脏(b)、脾(c)和肺(d))也有明显下降(参见图8)。此外,参见图9,对血清中的总胆固醇(tc,图9a)、低密度脂蛋白胆固醇(ldl,图9b)、高密度脂蛋白胆固醇(hdl,图9c)和甘油三酯(tg,图9d)含量进行测定和比较,发现高胆固醇饮食组的血清中总胆固醇和低密度脂蛋白胆固醇的量相比于正常饮食组显著升高,且血清中的甘油三酯的平均含量也是正常饮食组的2.25倍。由此证明建模成功。实施例4本发明组合物对动脉粥样斑块的作用分组及处理方法:对44只新西兰大白兔,适应性饲喂1周后,将动物按照体重随机分入正常饮食组(n=11)和动脉粥样硬化病变组(n=33)。高胆固醇饮食饲喂12周建立兔动脉粥样硬化模型,造模结束后按照体重随机分为四组,其中一组为干预前组(as&干预前,n=7),且同时在正常饮食组中按照体重随机选取5只与干预前组做对照(正常-1组),造模结束后两组立即取材。其余三组分别为未干预组(as&未干预,n=8)、cu-微泡组(as&cu-mb+us,n=9)、以及微泡组(as&mb+us,n=9)。将剩余正常饮食组命名为正常组(n=6)。详细流程及分组见图2。干预方法:将兔呈仰卧位固定于固定板上并除去腹部被毛。干预时,将5ml试剂分五次注射,每次快速团注1ml且同时用机械指数1.2的超声(philipsiu22探头l9-3)在距离腹腔干5cm左右的腹主动脉靶向破裂释放,每毫升试剂释放时间为1分钟。通过超声成像观察试剂破裂释放完全后结束干预。对as&mb+us组和as&cu-mb+us组每三天干预一次,干预8次为一个周期,共三个周期(合计24次)。as&未干预组只重复固定兔的操作,未注射任何液体。取材及测定方法:在实验终点对动物进行称重、采血后,取材。采血:自兔耳中动脉采集空腹血。主动脉:动物通过耳缘静脉注射过量戊巴比妥钠(1.5ml/kg剂量)麻醉致死。沿兔腹部中线剖开,使腹部暴露后剥离出主动脉。依次结扎腹腔干分支、肠系膜上动脉分支、右肾动脉分支和左肾动脉分支这四个分支,起到标记位置和防止大出血的作用。开胸后进一步取出整段主动脉并在生理盐水中涮洗血管至淡黄色。其中胸主动脉和腹主动脉以膈肌为界。主动脉的组织分配:用刀片将血管切成三段(图3):第一段血管1用于制作病理切片,进行组织学检测;第二段血管中,左半侧血管2用于进行大体oro染色,右半侧血管3用于进行铜检测;第三段血管4,存于液氮用于脂质成分检测分析等。血清生化分析:采用比色法对血液样本中的总胆固醇(tc)、低密度脂蛋白胆固醇(ldl)、高密度脂蛋白胆固醇(hdl)和甘油三酯(tg)进行分析。新鲜组织油红o染色(大体oro染色):将组织在多聚甲醛中固定10分钟后,用oro染色,染色后将主动脉内膜剥离,使含斑块的血管内膜面朝上,通过体视显微镜观察,采集图片,用photoshop软件测量内膜面积和斑块面积。冰冻切片油红o染色:冰冻切片用oro染液染色,用苏木素复染核。封片后立即用显微镜观察采图,采用imagepro-plus6.0软件测量斑块面积与oro阳性区域面积,并计算出阳性面积与斑块总面积的比值。天狼猩红固绿染色:石蜡切片用天狼猩红固绿染色液染色。封片后用100倍显微镜观察、采图,采用imagepro-plus6.0软件测量斑块面积与天狼星红阳性区域面积,并计算出阳性面积与斑块总面积的比值。弹力纤维染色:对石蜡切片用verhoff’s工作液染成黑色,用2%三氯化铁分色液进行分色,使弹力纤维呈黑色,其他成分呈灰色,最后置于vg染液中复染,使背景呈淡红色。封片后尽快用显微镜进行图像采集。免疫组化处理:按照常规方法进行免疫组化处理,封片后的切片可在常温下保存。在100倍显微镜下观察并采图。使用imagepro-plus6.0软件对斑块形态进行勾勒并对斑块内阳性表达区域的大小进行统计分析。铜浓度的检测:采用原子吸收光谱法(原子吸收光谱仪:ice3500,thermo公司)测定血清和组织中的铜浓度。腹主动脉中脂质含量的检测:采用比色法对腹主动脉中的总胆固醇(tc)、鞘磷脂(sm)、游离脂肪酸(ffa)和甘油三酯(tg)的含量进行检测。斑块易损指数:研究认为,巨噬细胞和斑块中的脂质是促使斑块不稳定的成分,而平滑肌细胞与胶原则是促使细胞稳定的成分。因此斑块易损指数按下式计算:斑块易损指数=(巨噬细胞%+脂质成分%)/(平滑肌细胞%+胶原%)。数据处理与统计分析:本文中所有实验数据使用spss20.0统计分析软件进行分析。两组单因素分析采用studentt检验,未干预组(as&未干预)、微泡组(as&mb+us)、cu-微泡组(as&cu-mb+us)采用one-wayanova比较。当one-wayanova比较的三组差异具有统计学意义时,再进一步进行snk两两组间比较。当数据不符合正态分布时采用秩和检验,以α=0.05为检验水准,p<0.05即具有统计学差异。检测结果:4.1.粥样斑块尺寸变化4.1.1粥样斑块面积百分比的变化在按照前述干预方法,在建模后进行干预,根据油红o染色结果计算斑块面积相对血管平铺面积的百分比,结果如下表2所示,另外腹主动脉部分各组斑块面积的统计结果见图10所示。表2由表2和图10可见,在铜的作用下,粥样斑块的面积百分比显著减少,与未干预组以及微泡中不含铜的组相比均具有显著性差异(p<0.05)。4.1.2粥样斑块截面面积进一步观察腹主动脉横截面的弹力纤维(evg)染色切片(参见图11,其中虚线范围内为斑块横截面),并计算血管横截面中斑块的面积,进行统计分析示于图12。如图11和12所示,与干预前组(as&干预前)相比,未干预组(as&未干预)的腹主动脉截面中斑块截面积继续增长,增长率达37.39%(图12a)。微泡组(as&mb+us)的斑块截面积甚至大于未干预组大体;而cu-微泡组(as&cu-mb+us)则出现显著缩小,与未干预组相比斑块面积减小了27.16%,与微泡组相比减小了45.75%。上述结果说明cu离子对斑块增长的抑制以及对斑块尺寸的减小是至关重要的。仅微泡本身在病变位置的空化对斑块的增长几乎没有抑制作用。4.2.斑块稳定性变化4.2.1.斑块中脂质成分变化观察腹主动脉截面的油红o脂质染色切片(参见图13),并计算脂质占斑块的面积进行统计分析(参见图14)。由图13可见,cu-微泡组(as&cu-mb+us)相比于微泡组(as&mb+us)和未干预组(as&未干预),斑块中的脂质显著减少。其中cu-微泡组相对于微泡组,脂质成分减少33.96%;相对于未干预组,脂质成分减少53.15%。进一步检测各组腹主动脉中总胆固醇(tc)、鞘磷脂(sm)、游离脂肪酸(ffa)和甘油三酯(tg)的量,并进行统计分析,见图15所示。其中cu-微泡组与未处理组相比,总胆固醇下降了52.1%,鞘磷脂下降了57%,游离脂肪酸下降了40.5%;与微泡组相比,总胆固醇下降了49.7%,鞘磷脂下降了42.3%,游离脂肪酸下降了55.5%。4.2.2.斑块中胶原成分变化观察用天狼猩红固绿染色的各组切片,其中红色指示胶原成分(参见图16),胶原成分的面积的统计学分析图示于图17。其中,与干预前组(as&干预前)相比,未干预组(as&未干预)的胶原成分显著增加,微泡组(as&mb+us)和cu-微泡组(as&cu-mb+us)胶原成分进一步增加,且cu-微泡组与微泡组相比胶原成分有增加趋势,增长率为17.14%。通常认为,斑块中的胶原成分越多越有利于斑块的稳定性。由上述各自实验的结果可以看出,微泡组和cu-微泡组中胶原成分有略微的增加。4.2.3.斑块中平滑肌细胞占比变化采用冰冻切片免疫组化方法,用α-sma为标记物指示平滑肌细胞。对斑块中平滑肌细胞面积占斑块面积(图18中虚线围出的部分)的比值进行统计,示于图19中。其中,未干预组(as&未干预)与干预前组(as&干预前)相比,斑块中平滑肌细胞含量有上升趋势,增长了近40%(图19a),而未干预组、微泡组(as&mb+us)和cu-微泡组(as&cu-mb+us)之间没有明显差异(图19b)。通常认为,斑块中的平滑肌越多斑块的稳定性越好。由上述各自实验的结果可以看出,本发明的组合物对平滑肌没有影响。4.2.4.斑块中巨噬细胞占比变化采用石蜡切片免疫组化方法,用cd68为标记物指示巨噬细胞(参见图20),并通过巨噬细胞面积占斑块面积的比值来反应不稳定因素,其统计学分析图如图21所示。由图21可见,各组之间,巨噬细胞的面积占斑块面积的比值并无明显差异。通常认为,斑块中的巨噬细胞越少斑块的稳定性好。由上述各自实验的结果可以看出,本发明的组合物对巨噬细胞数量没有明显影响。4.2.5.斑块中纤维帽厚度的变化采用冰冻切片免疫组化方法,用α-sma为标记物指示平滑肌细胞。通过平滑肌细胞所处的斑块近管腔一侧的分布来指示纤维帽的厚度。斑块中纤维帽厚度(图22中虚线围出的较窄部分)与斑块厚度(图22中虚线围出的较宽部分)的比值进行统计,示于图23中。其中,未干预组(as&未干预)与干预前组(as&干预前)相比,纤维帽相对斑块厚度的比例显著增加(图23a),而未干预组、微泡组(as&mb+us)和cu-微泡组(as&cu-mb+us)之间没有明显变化(图23b)。通常来说,纤维帽厚度的变化是斑块结构变化的指标。纤维帽厚度与斑块厚度的比值越大,斑块越稳定。由图22可以看出cu-微泡组的纤维帽的厚度和斑块的厚度相对于未干预组均有减小,但比值无明显变化。统计学结果说明本发明的组合物对纤维帽相对斑块厚度的比例不产生显著影响。4.2.6.斑块易损指数的变化根据前面4.2.1~4.2.4中测得的各项参数,计算斑块的易损指数。斑块的易损指数按下式计算:斑块易损指数=(巨噬细胞%+脂质成分%)/(平滑肌细胞%+胶原%)。上式中,巨噬细胞%、脂质成分%、平滑肌细胞%和胶原%分别为以上测得的巨噬细胞、脂质成分、平滑肌细胞及胶原的面积占斑块面积的百分数。计算得到各组的平均斑块易损指数见下表3。表3组别干预前组未干预组微泡组cu-微泡组斑块易损指数0.4150.2390.2640.196实施例5本发明组合物对冠状动脉粥样斑块的作用本实施例兔动脉粥样硬化模型的建立同实施例3,所用微泡组合物是实施例2制备的。按照实施例4类似的方法处理8只新西兰大白兔,并分为未干预组(as&未干预)(n=3)和cu-微泡组(as&cu-mb+us)(n=5)。取材方法如下:冠脉取材:左冠脉取材:从主动脉根部开始向心尖分离出左主冠脉及左前降支,取材总长度约1.3cm,其中将靠近主动脉根部的0.3cm左冠脉用于制作病理切片,剩余约1cm进行大体oro分析。右冠脉取材:从主动脉根部开始向右心室分离出右冠脉,取材总长度约1.3cm,其中将靠近主动脉根部的0.3cm右冠脉用于制作病理切片,剩余约1cm进行大体oro分析。检测结果:5.1粥样斑块尺寸变化5.1.1粥样斑块面积百分比的变化在按照前述干预方法,在建模后进行干预,根据油红o染色结果计算斑块面积相对血管平铺面积的百分比,结果如下表4所示,另外左冠脉、右冠脉各组斑块面积的统计结果见图24所示。表4斑块位置as&未干预as&cu-mb+us左冠脉52.69%17.86%右冠脉79.92%43.87%5.2斑块稳定性变化5.2.1.斑块中脂质成分变化观察左冠脉截面的油红o脂质染色切片(参见图25),并计算脂质占斑块的面积进行统计分析(参见图25)。cu-微泡组(as&cu-mb+us)相比于未干预组,脂质成分减少76.8%。5.2.2斑块中胶原成分变化观察左冠脉截面的天狼猩红固绿染色切片(参见图26),并计算胶原占斑块的面积进行统计分析(参见图26)。cu-微泡组(as&cu-mb+us)相比于未干预组,胶原成分增加一倍。通常认为,斑块中的胶原成分越多越有利于斑块的稳定性。由上述各自实验的结果可以看出,cu-微泡组相比于未干预组,胶原成分增加一倍。5.2.3斑块中平滑肌细胞占比变化观察左冠脉截面的平滑肌细胞染色切片(参见图27),并计算平滑肌细胞占斑块的面积进行统计分析(参见图27)。cu-微泡组(as&cu-mb+us)相比于未干预组,平滑肌细胞成分增加了约60%。通常认为,斑块中的平滑肌越多斑块的稳定性越好。由上述各自实验的结果可以看出,cu-微泡组(as&cu-mb+us)相比于未干预组,平滑肌细胞成分增加了约60%。5.2.4斑块中巨噬细胞占比变化观察左冠脉截面的巨噬细胞染色切片(参见图28),并计算巨噬细胞占斑块的面积进行统计分析(参见图28)。cu-微泡组(as&cu-mb+us)相比于未干预组,巨噬细胞成分无明显差异。通常认为,斑块中的巨噬细胞越少斑块的稳定性好。由上述各自实验的结果可以看出,本发明的组合物对巨噬细胞数量没有明显影响。可见本发明的组合物联合超声处理的干预不影响斑块的稳定性,且有使斑块稳定性增强的趋势,而单纯的微泡联合超声处理有使斑块稳定性下降的趋势。该结果提示,与之前提出的利用微泡空化破碎斑块不同,cu离子对斑块的作用可能是原位缩小斑块,并有一定防止斑块脱落的作用。以上仅为本发明的优选实施方式,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的
技术领域:
均包括在本发明的专利保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1