幽门螺旋杆菌四价毒力因子GEM颗粒疫苗及制备方法与应用与流程
幽门螺旋杆菌四价毒力因子gem颗粒疫苗及制备方法与应用
技术领域
[0001]
本申请涉及生物医学及生物工程领域,具体而言,涉及幽门螺旋杆菌四价毒力因子gem颗粒疫苗。
背景技术:
[0002]
幽门螺旋杆菌(hp)是胃炎、胃溃疡和胃癌的重要致病因子,世界感染率超过50%,我国hp感染率高达58.07%,且呈现明显的家庭聚集性,形式更加严峻。目前,临床治疗hp感染性胃病的方法主要是多联抗生素疗法,但是面临着抗生物导致hp耐药性、治疗后再感染、抗生素破坏肠道微生态平衡、药物毒副作用和病人依从性差等问题,难以在hp感染人群中大规模推广使用,研发有效的hp疫苗具有很好的应用前景。
[0003]
口服类疫苗的免疫原性一般较弱,需使用大量抗原多次接种,且免疫应答持续时间较短,容易产生免疫耐受。微皱褶细胞(m细胞)是胃肠道黏膜免疫系统中一种特化的抗原转运细胞,散布于黏膜上皮细胞间,能将抗原从胃肠腔内转运到上皮下的淋巴组织,诱导黏膜免疫反应。m细胞是胃肠道黏膜免疫系统的“入口”,其对抗原的摄取是启动胃肠黏膜免疫应答关键的第一步。因此,“抗原能否被m细胞大量摄取”是口服类疫苗免疫成败的关键所在。利用“与m细胞表面受体相结合的m细胞靶向肽”,将抗原靶向递呈给m细胞,增加其对抗原的摄取和转运效率,激发高水平黏膜免疫应答,是一种提高口服类疫苗免疫效果的有效策略。
[0004]
口服类疫苗在激发胃肠道黏膜免疫应答和特异性细胞免疫应答具有一定优势,但是直接口服给药,疫苗效果往往甚微,其中主要原因是:胃肠道中存在大量的酸和蛋白水解酶,会破坏疫苗抗原。因此,研究安全有效的黏膜免疫投递系统是口服类疫苗研究领域的一个热点。乳酸菌是一群在人体肠道内的常见益生细菌,作为口服类疫苗的黏膜免疫投递系统,具安全性高等独特优势。另外,将抗原展示在乳酸菌表面更符合黏膜疫苗的要求。锚定蛋白是细菌表面展示技术中的核心组件。n-乙酰胞壁质酶(acma)是在乳酸菌表面展示系统中常用的一种锚定蛋白。然而,在胞内表达的acma往往跨膜转运活性不强。基于acma设计更为有效的乳酸菌细胞表面展示系统,仍是一项亟待研究的工作。
技术实现要素:
[0005]
本申请的第一方面,公开了幽门螺旋杆菌四价毒力因子gem颗粒疫苗,gem颗粒疫苗包括在gem颗粒表面展示重组抗原sam
e-fvpe;重组抗原sam
e-fvpe含有核心组件sam
e
和幽门螺旋杆菌毒力因子多表位肽fvpe。
[0006]
gem颗粒表面展示技术是一种基于革兰氏阳性增强基质颗粒(即gem颗粒)的非活性、非遗传修饰的新型乳酸菌表面展示技术,称之为gem颗粒表面展示技术,又叫细菌样颗粒表面展示技术。gem颗粒表面展示技术主要利用热酸处理乳酸菌,去除蛋白质和核酸等大分子物质,制备仅含有细胞壁肽聚糖骨架的空心颗粒,叫gem颗粒;将高纯度疫苗抗原与gem颗粒混合,疫苗抗原通过与其偶联的锚定蛋白展示在gem颗粒表面,制备的疫苗叫gem颗粒
疫苗,又叫细菌样颗粒疫苗。
[0007]
幽门螺旋杆菌主要通过黏附因子粘附胃黏膜细胞,然后可释放一些毒力因子,破坏胃黏膜细胞,导致慢性胃炎、消化性胃溃疡和胃癌等疾病的发生。幽门螺旋杆菌的毒力因子主要有:尿素酶、细胞毒素相关蛋白a(caga)、空泡毒素相关蛋白a(vaca)、中性粒细胞激活蛋白nap等。hp毒力因子多表位疫苗fvpe主要含有来自hp关键毒力因子(尿素酶、caga和vaca)的优势抗原表位或区段和中性粒细胞激活蛋白nap,研究已证实fvpe具有很好的防治hp感染的免疫效果。
[0008]
幽门螺旋杆菌四价毒力因子gem颗粒疫苗gem-sam
e-fvpe特点如下:(1)gem颗粒疫苗gem-sam
e-fvpe在gem颗粒表面展示有重组抗原sam
e-fvpe;重组抗原sam
e-fvpe含有核心组件sam
e
和幽门螺旋杆菌毒力因子多表位肽fvpe。(2)gem颗粒疫苗gem-sam
e-fvpe表面展示的重组抗原sam
e-fvpe具有m细胞靶向的性质,可增加胃肠道m细胞对重组抗原sam
e-fvpe的摄取量和转运效率,增强胃肠道黏膜特异性免疫应答。(3)gem颗粒疫苗gem-sam
e-fvpe可激发机体产生针对幽门螺旋杆菌多种关键毒力因子的特异性黏膜免疫应答。
[0009]
幽门螺旋杆菌毒力因子多表位肽fvpe主要含有来自hp关键毒力因子(尿素酶、caga和vaca)的优势抗原表位或区段和中性粒细胞激活蛋白nap,研究已证实fvpe具有很好的防治hp感染的免疫效果。
[0010]
在前述的第一方面的一些实施例中,毒力因子多表位肽fvpe的氨基酸序列如seq id no.1所示,编码毒力因子多表位肽fvpe的核苷酸序列如seq id no.2所示。
[0011]
在前述的第一方面的一些实施例中,核心组件sam
e
的氨基酸序列如seq id no.3所示,编码核心组件sam
e
的核苷酸序列如seq id no.4所示。
[0012]
在前述的第一方面的一些实施例中,重组抗原sam
e-fvpe的氨基酸序列如seq id no.5所示;重组抗原sam
e-fvpe的核苷酸序列如seq id no.6所示。
[0013]
在实施例中,重组抗原sam
e-fvpe中,是通过将毒力因子fvpe的序列插入到核心组件sam
e
中得到。
[0014]
本申请的第二方面,公开了幽门螺旋杆菌四价毒力因子gem颗粒疫苗在制备防治幽门螺旋杆菌引起的疾病的药物中的应用。
[0015]
本申请的第三方面,幽门螺旋杆菌四价毒力因子gem颗粒疫苗的制备方法,包括以下步骤:合成如序列seq id no.4所示的核心组件sam
e
基因片段,将sam
e
基因片段通过酶切和连接,克隆到pczn1载体上,得到pesam
e
重组载体;通过扩增得到如序列seq id no.2所示的毒力因子多表位肽fvpe基因片段,将fvpe片段与经双酶切的pesam
e
重组载体混合,通过一步法无缝克隆技术将fvpe片段克隆进pesam
e
重组载体,得到pesam
e-fvpe重组载体;将pesam
e-fvpe重组载体转化进宿主细胞,通过培养和诱导剂诱导表达,纯化得到重组抗原sam
e-fvpe;通过三氯乙酸制备乳酸菌的gem颗粒,将制备的gem颗粒和重组抗原sam
e-fvpe混合重悬,得到gem颗粒疫苗gem-sam
e-fvpe。
[0016]
在前述第三方面的一些实施例中,诱导剂为iptg,诱导剂的工作浓度为0.5mmol/l。
[0017]
在实施例中,通过iptg的诱导,重组表达菌株能快速大量的表达重组抗原sam
e-fvpe。
[0018]
在前述第三方面的一些实施例中,表达宿主细胞为大肠杆菌;优选地,大肠杆菌选自arcticexpress (de3),dh5α,top10,bl21(de3),bl21(de3)plyss或rosetta;进一步优选地,大肠杆菌为arcticexpress (de3)。
[0019]
在实施例中,蛋白表达的宿主细胞有多种,本实施例中优选大肠杆菌中的arcticexpress (de3)菌株进行表达。
[0020]
通过大肠杆菌的表达系统,能快速高效的表达出目的蛋白,提高重组蛋白的收率和质量。
[0021]
在前述第三方面的一些实施例中,纯化重组抗原包括层析和透析;柱层析选用ni-ida-sepharose cl-6b亲和层析柱;透析的透析液为20 mm tris-hcl,0.10 m nacl,ph8.0的透析液。
[0022]
在实施例中,通过亲和层析和透析的处理,不仅能提高重组蛋白的浓度和质量,还能通过透析等方法,除去蛋白中的一些毒素。提高了蛋白的浓度,能提高蛋白的免疫效果,透析除去毒素,能提高的蛋白的安全性。
[0023]
在前述第三方面的一些实施例中,层析缓冲液的流速为0.5-1ml/min,透析的透析液为20 mmol/l tris-hcl,0.10 mol/l nacl,ph8.0的溶液。
[0024]
在实施例中,通过合适流速的缓冲液的冲洗,就能较好的纯化出蛋白质。通过合适浓度的透析液的透析,可以较好的将毒素等除去,又不至于破坏蛋白质的结构和功能。
[0025]
与现有技术相比,本申请的有益效果为:本申请提供的幽门螺旋杆菌四价毒力因子gem颗粒疫苗gem-sam
e-fvpe,主要是将含有核心组件sam
e
和幽门螺旋杆菌毒力因子多表位肽fvpe的重组抗原sam
e-fvpe展示在gem颗粒表面制备而成,具有良好的抗原表面展示性质。幽门螺旋杆菌四价毒力因子gem颗粒疫苗gem-sam
e-fvpe同时具有良好的胃肠道m细胞靶向性,可高效地将重组抗原sam
e-fvpe靶向递送给胃肠道m细胞,激发胃肠道产生针对幽门螺旋杆菌多种毒力因子的特异性黏膜免疫应答。幽门螺旋杆菌四价毒力因子gem颗粒疫苗gem-sam
e-fvpe可应用于防治幽门螺旋杆菌相关性胃病。
附图说明
[0026]
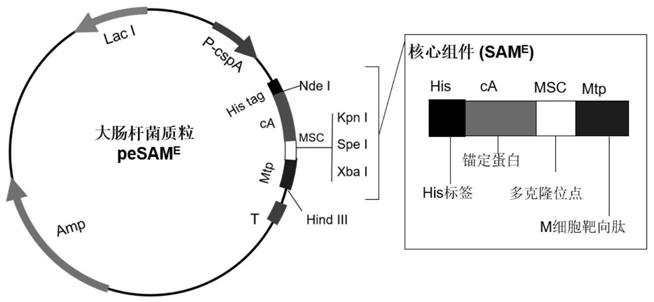
图1是实施例1中大肠杆菌质粒pesam
e
的示意图;图2是实施例1中大肠杆菌质粒pesam
e
的双酶切电泳图;图3是实验例2中大肠杆菌质粒pesam
e-fvpe的双酶切电泳图;图4是实验例3中大肠杆菌e. coli-pesam
e-fvpe的诱导表达结果图;图5是实验例4中对gem颗粒疫苗gem-sam
e-fvpe的抗原表面展示性鉴定图;图6是实验例5中gem颗粒疫苗gem-sam
e-fvpe的m细胞靶向性鉴定图;图7是实验例6中gem颗粒疫苗gem-sam
e-fvpe免疫治疗幽门螺旋杆菌感染效果图;图8是实验例7中gem颗粒疫苗gem-sam
e-fvpe免疫治疗后诱导小鼠产生抗体的示意图。
具体实施方式
[0027]
下面将结合实施例对本申请的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本申请,而不应视为限制本申请的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0028]
材料1.iptg溶液:称取1.2g iptg置于50ml离心管中,加入40ml无菌水,充分混匀溶解后,定容至50ml。用0.22μm滤器过滤除菌,小份分装,-20℃保存。
[0029]
2.氨苄青霉素(amp)贮液(100 mg/ml):称取100mg 氨苄青霉素(amp)溶于1ml无菌水,制得浓度为100mg/ml 的贮存液,通过0.22
µ
m细菌滤器过滤除菌,溶液分装保存于-20℃冰箱中。
[0030]
3.lb培养基:(1)lb液体培养基:称取10g胰蛋白胨、5g酵母提取物和5g nacl,加蒸馏水至1000ml,调整ph至7.4,高压蒸气灭菌。(2)lb固体培养基:1.5g琼脂粉/100ml lb培养液,高压灭菌后,倾倒平板。
[0031]
4.dna电泳缓冲液(50
×
tae):称取242g tris、37.2g na2edta
·
2h2o和57.1ml 冰乙酸,加水至1000ml,使用时稀释50倍。
[0032]
5.sds-page电泳缓冲液(5
×
):称取tris粉末15.1g、甘氨酸 94g、sds 5.0g;加入约800ml的去离子水,搅拌溶解;加去离子水定容至1l,室温保存;注意:加水时应让水延着壁缓缓流下,以避免由于sds的原因产生很多泡沫。
[0033]
6.考马斯亮蓝蛋白染色试剂:(1)考马斯亮蓝r-250染液:0.29g考马斯亮蓝r-250溶解在250ml脱色液中。(2)固定液:500ml乙醇、100ml冰醋酸用蒸馏水稀释至1000ml。(3)脱色液:250ml乙醇、80ml冰醋酸用蒸馏水稀释至1000ml。(4)保存液:25ml 87%甘油溶于225ml脱色液中。
[0034]
7.实验动物:balb/c小鼠为spf级,雄性,8~10周龄,购自宁夏医科大学实验动物中心。
[0035]
8.elisa试剂:(1)包被液:1.6g na2co3,2.9g nahco3,0.2g nan3,加双蒸水至1l,调ph值至9.6。(2)洗涤液:分别称取0.2g kh2po4,2.9g na2hpo4∙
12h2o,8.0g nacl,0.2g kcl,0.5ml tween-20,加入ddh2o定容至1000 ml(pbst)。(3)封闭液:称取3.0g bsa溶解于100ml洗涤缓冲液中,过滤除菌后4℃保存。(4)底物液:可溶性单组份tmb底物溶液。(5)终止液:量取蒸馏水178.3ml,逐滴加入浓硫酸21.7ml(1m h2so4)。
[0036]
9.bhi血平板:称取3.5g bhi干粉,加蒸馏水93ml,1.5g 琼脂粉,121℃灭菌13min,待冷却至60℃以下,加入7ml脱纤维羊血,多粘菌素b(终浓度5μg/ml),万古霉素(终浓度10μg/ml)和甲氧苄氨嘧啶(终浓度5μg/ml),分装至培养皿,冷却后备用。
[0037]
以下结合实施例对本申请的特征和性能作进一步的详细描述。
[0038]
实施例1:大肠杆菌质粒pesam
e
的构建根据核心组件sam
e
的氨基酸序列seq id no.3,设计优化其编码基因并合成核心组件sam
e
的基因序列如seq id no.4所示。
[0039]
提取pczn1载体质粒,并用nde i/hind iii双酶切pczn1载体质粒和核心组件sam
e
;37℃,2 h;利用dna回收试剂盒回收sam
e
基因和pczn1载体双酶切产物。将回收的pczn1
线性化载体和sam
e
基因片段通过互补的粘性末端,在t4 dna 连接酶的作用下连接成闭合环状的dna分子,即形成大肠杆菌质粒pesam
e
。
[0040]
质粒结构如图1所示,将连接完成的的质粒检测,通过双酶切并进行电泳检测,结果如图2所示,图中泳道1为大肠杆菌质粒pesam
e
,泳道2为双酶切的结果;双酶切结果与实际一致。送样进行测序,测序结果准确,且无移码突变。
[0041]
实施例2:大肠杆菌重组质粒pesam
e-fvpe的构建将得到的大肠杆菌重组质粒pesam
e
,用kpn
ꢀⅰ
和xba
ꢀⅰ
双酶切,37℃,2 h,利用dna回收试剂盒回收pesam
e
双酶切线性化片段;根据序列seq id no.2所示的序列扩增得到表达如seq id no.1所示的氨基酸序列的fvpe基因基因片段(两端带有与线性化克隆载体pesam
e
两末端完全一致的15bp同源序列)。将回收的pesam
e
线性化载体和fvpe基因混合,利用一步法无缝克隆技术连接成闭合环状的dna分子,即形成大肠杆菌重组质粒pesam
e-fvpe。
[0042]
将大肠杆菌重组质粒pesam
e-fvpe通过双酶切后进行电泳,结果如图3所示,图中泳道1为大肠杆菌重组质粒pesam
e-fvpe;泳道2为nde
ꢀⅰ
和hind
ꢀⅲ
酶切后的大肠杆菌重组质粒pesam
e-fvpe;与实际一致。将获得的重组大肠杆菌重组质粒pesam
e-fvpe进行测序验证,结果显示构建的大肠杆菌重组质粒pesam
e-fvpe序列准确且无移码突变。
[0043]
实施例3:重组抗原sam
e-fvpe的表达、纯化和检测将获得的大肠杆菌重组质粒pesam
e-fvpe转化宿主细胞进行蛋白表达和纯化。
[0044]
(1)e.coli-pesam
e-fvpe的诱导表达:将验证正确的重组表达质粒pesam
e-fvpe转化进大肠杆菌arcticexpress (de3)中。将阳性克隆子接种于含50μg/ml amp的3 ml lb培养液的试管中,37℃,220 rpm,振摇过夜;次日,按1:100接种于50 μg/ml amp的30 ml lb培养液中,37℃,220 rpm,振摇培养约2h,至菌体od
600
为0.6-0.8;然后,加入iptg至终浓度为0.5 mm,11℃,220 rpm,振摇过夜,诱导重组蛋白表达。
[0045]
(2)sds-page检测e.coli-pesam
e-fvpe的表达情况:e.coli-pesam
e-fvpe经诱导表达后,取出1 ml培养物,10000g室温离心2 min,弃上清,用100 μl上样缓冲液重悬菌体沉淀;剩余培养物4000g,离心10 min,弃上清,用 pbs重悬菌体沉淀;重悬液进行超声波破碎后,分别取上清液与沉淀液加入上样缓冲液重悬,进行sds-page检测分析。
[0046]
(3)重组抗原sam
e-fvpe的纯化:利用低压层析系统,包涵体溶液以0.5 ml/min流速上样至ni-ida binding-buffer预平衡的ni-ida-sepharose cl-6b亲和层析柱;用ni-ida binding-buffer以0.5 ml/min流速冲洗,至流出液od280值到达基线;用ni-ida washing-buffer以1 ml/min流速冲洗,至流出液od
280
值到达基线;用ni-ida elution-buffer以1 ml/min流速洗脱目的蛋白,收集流出液;上述收集的蛋白溶液加入透析袋中,使用20 mm tris-hcl,0.10 m nacl,ph8.0进行透析过夜,进行12% sds-page和western blot鉴定分析。
[0047]
sds-page检测结果如图4a所示,诱导表达后,经sds-page检测,表明:e. coli-pesam
e-fvpe在约101kd处出现目的蛋白条带,与重组抗原sam
e-fvpe的理论大小相符合(图4a);经ni-ida蛋白纯化后,可获得高纯度重组抗原sam
e-fvpe,纯度约为98.86%,纯化的效果较好(图4b);mouse anti-fvpe可识别sam
e-fvpe,但是鼠正常血清不是识别sam
e-fvpe(图4c),表达的蛋白可以被相应的抗体识别。
[0048]
实施例4:gem颗粒疫苗gem-sam
e-fvpe的制备和抗原表面展示性质的鉴定
通过三氯乙酸制备乳酸菌的gem颗粒,将制备的gem颗粒与纯化的重组抗原sam
e-fvpe混合重悬,制备gem颗粒疫苗gem-sam
e-fvpe。
[0049]
将gem-sam
e-fvpe、gem-sam
e
、sam
e-fvpe和gem颗粒分别包被至elsia板,4℃过夜。洗4次后,加入300 μl/孔封闭液,37℃,2h。洗4次后,加mouse anti-fvpe(1:3000)到elisa板,100μl/孔,37 ℃,60 min。洗4次后,加入hrp标记的羊抗鼠igg(1:10000),100μl/孔,37℃,60 min。洗4次后,加入tmb显色液,室温,10min,加100μl终止液,测定od
450
值。
[0050]
结果如图5所示,gem-sam
e-fvpe和重组抗原sam
e-fvpe能够与mouse anti-fvpe发生特异性反应,但gem-sam
e
和gem不能与mouse anti-fvpe发生特异性反应,说明gem-sam
e-fvpe表面展示有sam
e-fvpe抗原,gem-sam
e
表面无sam
e-fvpe抗原。
[0051]
实施例5:gem颗粒疫苗gem-sam
e-fvpe的m细胞靶向性的鉴定balb/c小鼠禁食一晚(约12h),麻醉,打开腹部,将回肠中区约2cm长度结扎形成一个封闭的回肠袢,将100μl gem颗粒疫苗gem-sam
e-fvpe和gem颗粒注入回肠袢,约1h后,切除回肠袢,pbs反复冲洗三次后,用4%多聚甲醛固定。组织切片经3%山羊血清封闭后,接着分别与rabbit anti-fvpe多克隆抗体和goat anti-rabbit igg h&l (alexa fluor
®ꢀ
647)抗体孵育。派尔淋巴结上的m细胞由mouse anti-gp2 mab (alexa fluor
®ꢀ
488)进行标记;细胞核由dapi进行染色。
[0052]
结果如图6所示,与对照gem颗粒相比,gem颗粒疫苗gem-sam
e-fvpe能结合到靶细胞,具有良好的m细胞靶向性质;而对照中均没有靶向结果。
[0053]
实施例6:gem颗粒疫苗gem-sam
e-fvpe治疗hp感染效果的鉴定(1)小鼠实验流程实验分组:gem-sam
e-fvpe免疫组、gem-sam
e
免疫组和gem颗粒免疫组;每组10只小鼠,共30只。
[0054]
hp感染小鼠模型的制备:各组小鼠分别于1、3、5、7天灌胃幽门螺旋杆菌,共计4次,每次300 μl /只,浓度为1
×
10
10 cfu/ml。
[0055]
小鼠免疫:分别于15,22,29,36天免疫gem颗粒疫苗gem-sam
e-fvpe、gem-sam
e
和gem,共计4次,每次300μl /只,浓度为1
×
10
10 cfu/ml(即3
×
109cfu)。
[0056]
小鼠处死:在第50天将小鼠处死,取样进行检验。
[0057]
(2)小鼠胃部hp的定量培养检测称取一定重量的小鼠胃组织,用生理盐水冲去内容物,在0.5 ml生理盐水中制备组织均浆液,吸取20 μl均浆液,按照1:10、1:100和1:1000倍稀释。每个稀释度各取100 μl均匀涂布在bhi血平板上,37 ℃,微需氧培养3~5天。用细菌革兰氏染色和过氧化氢触酶等方法鉴定hp菌落。对鉴定为阳性的hp菌落进行计数,菌落计数换算成每克胃组织菌落形成单位数(cfu/g),计算公式为:hp定植密度=hp菌落数
×
稀释度/胃重量。
[0058]
(3)小鼠胃部组织病理学检测:he染色:用石蜡包埋经10%甲醛固定的小鼠胃组织,切成约6 μm厚的组织切片,he染色观察胃组织炎症情况,并进行组织病理学评分。
[0059]
评分标准如下:无明显可见白细胞(淋巴细胞和中性粒细胞)浸润为0分;在胃粘膜固有层深部有少许散在白细胞浸润为1分;
在胃粘膜深部至中部固有层有中等程度白细胞浸润为2分;在胃粘膜深部至中部固有层有大量白细胞浸润,少量微脓肿为3分;在胃粘膜固有层全层至黏膜下层有严重弥散性白细胞浸润,微脓肿较多为4分。
[0060]
免疫组织化学染色:石蜡切片脱蜡后,经正常山羊血清封闭,室温,10min;滴加适当比例稀释的rabbit anti-hp,37℃,1h;经洗涤后,滴加羊抗兔igg-hrp,37℃,10min;dab显色,冲洗,复染,封片。
[0061]
结果如图7所示,经gem-sam
e-fvpe免疫治疗hp感染的小鼠后,hp定量培养和尿素酶活性检测,结果表明:gem-sam
e-fvpe免疫组小鼠胃部的hp定植数显著减少,尿素酶活性降低(图7a和图7b);胃组织病理学实验结果表明:gem-sam
e
和gem免疫组小鼠的胃黏膜和胃黏膜下层有大量白细胞浸润,胃部炎症比较明显,有明显hp定植;而gem-sam
e-fvpe免疫组小鼠的胃部炎症显著减轻,无明显hp定植(图7c、图7d和图7e)。
[0062]
实施例7:gem颗粒疫苗gem-sam
e-fvpe免疫治疗后小鼠特异性抗体的检测hp感染的小鼠经gem颗粒疫苗gem-sam
e-fvpe免疫治疗后,处死,取血清1:1000稀释,取胃黏液和肠液1:5倍稀释。按100 μl/孔加入已包被hp裂解液的elisa板,37 ℃,60 min。洗4次后,加入hrp标记羊抗鼠igg或iga(1:10000),100 μl/孔,37 ℃,60 min。洗4次后,加入tmb显色液,室温避光10 min,加100 μl终止液,测定od
450
值。
[0063]
结果如图8所示,其中图8a为血清igg抗体检测,图8b为黏膜siga抗体检测。elisa实验结果表明gem-sam
e-fvpe免疫组小鼠能产生hp特异性igg、siga;然而,gem-sam
e
和gem免疫组小鼠不能够产生hp特异性igg、siga(图8a、图8b)。
[0064]
综上可以看出,本发明提供的gem颗粒疫苗gem-sam
e-fvpe,在gem颗粒表面展示有重组抗原sam
e-fvpe,且可将重组抗原sam
e-fvpe靶向投送给胃肠道的m细胞,提高m细胞对疫苗抗原的摄取和转运效率,诱导机体产生针对hp多种关键毒力因子的特异性黏膜免疫应答,具有防治幽门螺旋杆菌感染相关性胃病的潜力。
[0065]
以上所描述的实施例是本申请一部分实施例,而不是全部的实施例。本申请的实施例的详细描述并非旨在限制要求保护的本申请的范围,而是仅仅表示本申请的选定实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1