一种具有抗疲劳作用的杜仲雄花提取物制备方法及应用与流程
[0001]
本发明涉及保健食品领域,尤其涉及一种具有抗疲劳作用的杜仲雄花提取物制备方法及应用。
背景技术:
[0002]
全世界超过20%的人受到疲劳的影响,现代社会,疲劳已成为影响人类健康、工作效率和生活质量的严重问题。疲劳表现为排除疾病因素或生理因素所致的躯体或心理上的诸多表现,如神疲乏力,注意力不集中,头脑昏沉,活力低下,或动则心慌气喘等。缓解疲劳作为保健功能食品研究方向之一,在所开发的产品中占有较大比重。国家批准的15062个保健食品,其中缓解体力疲劳的产品就有2082个。
[0003]
未来,抗疲劳产品会被广大消费者认可,机制明确、物质组成清楚的抗疲劳产品将更会受欢迎。市场调研发现,我国虽已相应开发了固体饮料、糖果、巧克力、咖啡、饼干等不同产品形态的杜仲雄花抗疲劳产品,但整体处于刚起步阶段,对杜仲雄花抗疲劳真正的功能因子缺乏深入的研究。从作用机制上进行深入的探索,为该原料的功能进行赋能,在此基础上开发相应的产品,将具有更好的研究价值和市场前景。
[0004]
2014年6月国家卫生计生委批准杜仲雄花为新食品原料。杜仲雄花含有人体所需的胶原蛋白,其成份抗疲劳作用十分显著。对于长期伏案工作或缺乏运动的人群是最好的茶饮之一。从上世纪80年代开始,杜仲雄花因其抗疲劳、镇静和抗衰老作用以泡茶方式在中国广泛应用。因此,开发研究药效明确且安全的新型抗疲劳的保健食品十分必要。
[0005]
杜仲雄花(male flower of eucommia ulmoides)是人工种植的杜仲雄株树(eucommia ulmoides oliv.)开的花。2014年6月国家卫生计生委批准杜仲雄花为新食品原料。2014年6月国家卫生计生委批准杜仲雄花为新食品原料。发明人通过研究发现,杜仲雄花提取物及杜仲雄花中单体成分可促进睾丸间质细胞睾酮的分泌,可用于抗疲劳为主要功能的保健食品。
技术实现要素:
[0006]
本发明为解决上述问题,提供了一种具有促进睾丸间质细胞睾酮的分泌的具有抗疲劳作用的杜仲雄花提取物的制备方法及应用,发明人通过研究发现,杜仲雄花提取物可促进睾丸间质细胞睾酮的分泌,可用于抗疲劳为主要功能的保健食品。
[0007]
本发明所采取的技术方案:一种具有抗疲劳作用的杜仲雄花提取物制备方法,其步骤为:取一定量杜仲雄花,杜仲雄花用15倍质量的水提取,100℃回流2小时,过滤取滤液待用,再向杜仲雄花中加15倍质量水,二次煮沸回流,过滤收集滤液,两次滤液混合,进行浓缩喷雾干燥,得到杜仲雄花提取物。
[0008]
所述的滤液进行浓缩时采用65℃真空下旋转蒸发浓缩。
[0009]
所述的杜仲雄花提取液过滤时采用至少200目的滤网或滤布过滤。
[0010]
所述的杜仲雄花提取物在制备用于抗疲劳的药品或保健食品的应用。
[0011]
所述的杜仲雄花提取物与药剂或保健食品中认可的辅料,采用现代制剂技术,制成以杜仲雄花提取物为主的各种剂型,包括浸膏、片剂、颗粒剂、丸剂、胶囊剂、散剂和口服液。
[0012]
本发明的有益效果:本发明将杜仲雄花采用水提取,过滤浓缩得到提取物,经过实验证明杜仲雄花提取物及杜仲雄花中单体成分可促进睾丸间质细胞睾酮的分泌,可用于抗疲劳为主要功能的保健食品。
附图说明
[0013]
图1为本发明的睾丸间质细胞鉴定图,图1中a图为离心后细胞分离条带照片;图1中b图为纯化后的睾丸间质细胞形态图;图1中c图为纯化后的睾丸间质细胞经3β-hsd特异性染色(贴壁细胞)图;图1中d图为纯化后的睾丸间质细胞经3β-hsd特异性染色(悬浮细胞)图。
[0014]
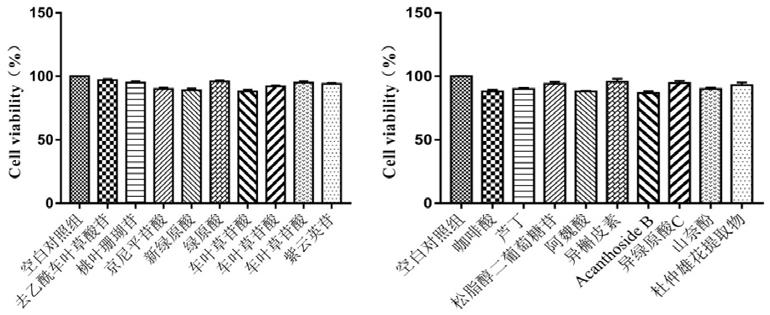
图2为睾丸间质细胞在不同样品干预下的细胞存活率测试结果图。
[0015]
图3为杜仲雄花提取物及杜仲雄花中单体成分对睾丸间质细胞睾酮分泌影响图。
具体实施方式
[0016]
下面将结合具体实施例和实验方案对本发明进行详细阐述:实施例1一种具有抗疲劳作用的杜仲雄花提取物制备方法,其步骤为:取一定量杜仲雄花,杜仲雄花用15倍质量的水提取,100℃回流2小时,过滤取滤液待用,再向杜仲雄花中加15倍质量水,二次煮沸回流,过滤收集滤液,两次滤液混合,采用65℃真空下旋转蒸发进行浓缩,再喷雾干燥,得到杜仲雄花提取物。
[0017]
所述的杜仲雄花提取液过滤时采用至少200目的滤网或滤布过滤。
[0018]
所述的杜仲雄花提取物在制备用于抗疲劳的药品或保健食品的应用。
[0019]
所述的杜仲雄花提取物与药剂或保健食品中认可的辅料,采用现代制剂技术,制成以杜仲雄花提取物为主的各种剂型,包括浸膏、片剂、颗粒剂、丸剂、胶囊剂、散剂和口服液。
[0020]
杜仲雄花提取物对睾丸间质细胞睾酮的分泌作用进行实验安排:实验仪器:电子分析天平(ms204s, 梅特勒-托利多公司);移液器(research plus,德国 eppendorf);高温高压灭菌锅(mls-3751l-pc,日本三洋公司);电热鼓风干燥箱(gzx-9070mbe,上海博迅实业有限公司);磁力搅拌器(cjb-16,巩义市予华仪器有限责任公司);超净工作台(dl-cj-2n,北京东联哈尔仪器制造有限公司);二氧化碳培养箱(bnp-80ch,上海一恒科学仪器有限公司);荧光倒置显微镜(ix-73,日本奥林巴斯株式会社);超低温冰箱(dw-hl538,中科美菱低温科技有限责任公司);酶标仪(bio-tek synergy 2,美国gene公司);微量振荡器(qt-1,上海琪特分析仪器有限公司),冷冻离心机(德国eppendorf,centrifuge 5804 r),电泳仪(junyijy1000c),荧光定量pcr仪(美国罗氏,lightcycler480 ii),超微量紫外分光光度计(美国thermo scientific,nanodrop 2000c)。
[0021]
实验试剂:dme/f-12培养基(ac10550270),hyclone公司;胶原酶ⅰ,invitrogen公司;胎牛血清,gibco公司,马血清,gibco公司,新生牛血清,浙江天杭生物科技有限公司;双抗,gibco公司,percoll分离液,biosharp生物科技;丙酮酸钠,amresco公司;nbt,biosharp生物科技;dhea,上海麦克林生化科技有限公司;β-nad,上海麦克林生化科技有限公司;尼克酰胺,北京索莱宝科技有限公司;0.4%台盼蓝染液,北京索莱宝科技有限公司;22人绒毛膜促性腺激素hcg,中国食品药品检定研究院;2.5%胰酶,gibco公司;dmso,sigma公司;睾酮酶联免疫试剂盒,南京建成生物工程研究所;cck-8试剂盒,biosharp生物科技。
[0022]
实验方法:细胞分离纯化:即原代细胞的获取:将spf级健康成年雄性大鼠脱颈椎处死(由湖北省疾控中心实验动物研究所提供),然后置于75%乙醇中淋洗30 s,用无菌剪刀剖开腹腔并剥离取出睾丸,置盛有pbs的培养皿内,去掉外周脂肪并用pbs浸洗2次,后至冰上脱膜,剪碎,加入少量dmem/f12培养基浸没,于34 ℃恒温震荡15 min,取出用镊子将睾丸实质轻轻拨散,加入适量0.05%胶原酶,于37 ℃水浴恒温振荡器(120 rpm)消化15 min,取出,加入3倍体积dmem/f12完全培养液(含9%胎牛血清、1%马血清、0.5%丙酮酸钠、1%双抗)终止消化,可适当放置2 min使不分散组织分解,然后用70 μm尼龙滤网过滤,置4 ℃,230 g离心机内离心10 min,用dmem/f12完全培养基洗涤细胞两次,每次5 min,弃上清用2 ml完全培养基重悬。对于滤膜过滤留下的组织,再加酶裂解液,然后如上操作终止消化并重悬细胞。
[0023]
将重悬细胞加到预制的percoll密度梯度离心液上(梯度至上而下为5%, 30%, 58%,70%,每个梯度各2 ml),4℃ 3000 rpm,离心30 min后,用吸管小心吸取第二条条带,并加完全培养基1000 rpm离心洗涤两次,每次5 min,取细胞沉淀。然后加入适量完全培养基接种到细胞瓶内,于37 ℃,5%co2培养箱内培养,24 h换液,每2天更换一次培养液。
[0024]
细胞形态学观察:收集对数期细胞,调整细胞悬液浓度,每孔加入100
ꢀµ
l,将细胞按1
×
106/ml接种于6孔培养板中,用倒置显微镜观察细胞在接种后不同时间内的细胞形态变化。
[0025]
3β-hsd酶染色液法检测纯度:将nbt与dhea共同溶于dmso中,使两者的终浓度均为10 mg
·
ml-1
,此为a液;将nad溶于pbs缓冲液中,使其终浓度为10 mg
·
ml-1
,此为b液;将尼克酰胺溶于pbs缓冲液中,使其终浓度为1 mg
·
ml-1
,此为c液。将10
ꢀµ
l的a液,100
ꢀµ
lb液,100
ꢀµ
l c液及790
ꢀµ
l的pbs溶液配成1ml的3β-hsd染色剂。将原代睾丸间质细胞置入96孔板中培养24小时,将培养孔中培养液吸出,加入新配的3β-hsd染色剂,200
ꢀµ
l每孔。将96孔板置入培养箱孵育1 h后显微镜观察。选取10张片子,平均每张计数20个高倍镜视野,取其平均值作为睾丸间质细胞的纯度值。细胞纯度计算公式:阳性染色细胞数/总细胞数
×
100%。
[0026]
台盼蓝染色法细胞活力检测:细胞存活率用台盼蓝染色排除法检测,活细胞为无色透明,死细胞为蓝色。将原代培养的睾丸细胞用dmem-f12培养液制成密度为1
×
106
·
ml-1的细胞悬浮液,然后将细胞悬浮液及0.4%台盼蓝溶液,各取一滴充分混匀,静置3 min后用细胞计数板分别计数活细胞和死细胞。存活率=活细胞/(活细胞+死亡细胞)
ꢀ×
100%。
[0027]
细胞毒性测定:采用cck-8法,取对数生长期的睾丸间质细胞,用0.25%胰酶消化后轻轻吹打成单细胞悬液,加入新鲜培养液进行细胞计数,最终以每孔100 μl、5
×
103个细胞接种于96孔培养板(空白组用等体积pbs代替),置于37℃、5%co2培养箱内培养24 h后,换入新鲜100 μl培养液并加入不同样品干预。另外设置对照组和空白组(调零孔),每组设3个平行孔,其中对照组接种细胞加入样品等体积的培养液,空白组不接种细胞只加入培养液。加药后将96孔板于培养箱中孵育72 h后,每孔加入cck-8溶液100 μl,放入培养箱孵育4 h,于450 nm处测吸光度,计算其相应抑制率及半数抑制浓度(ic50值),抑制率=(对照组od-加药组od)/(对照组od-空白组od)
×
100%elisa检测大鼠睾丸间质细胞睾酮分泌:收集对数期细胞,调整细胞悬液浓度3
×
104
·
ml-1
,以每孔300
ꢀµ
l接种于24孔培养板,5%co2,37℃孵育培养24 h,至细胞单层铺满孔底,更换270
ꢀµ
l新鲜培养液并加入30
ꢀµ
l药物,使其终浓度分别为25 μg
·
ml-1
、5 μg
·
ml-1
、1 μg
·
ml-1
,并以含0.1%dmso作为对照组。37℃,5%co2培养24 h,收集细胞上清液,于4℃ 2600 rpm离心20 min,取上清用于睾酮含量的检测,检测方法参照试剂盒说明书。
[0028]
实验结果:睾丸间质细胞鉴定:附图1所示,离心后细胞分离条带见图1中a图,4 ml处有一条带为睾丸间质细胞。纯化后的睾丸间质细胞形态如图1中b图。睾丸间质细胞在体外原代培养24 h,用3β-hsd特异性染色,如图1中c图、图1中d图所示:可见大部分细胞的胞质呈蓝黑色,胞体有细长的触角伸出,少部分的细胞胞质染色较淡,呈淡灰蓝色。细胞纯度大于90%。用台盼蓝染色法染色,计算活力可达75%以上。
[0029]
睾丸间质细胞形态:图1中a图睾丸间质细胞分离条带,图中最下部为血细胞,4 ml处条带为睾丸间质细胞,6 ml处条带为组织碎片及上皮细胞;图1中b图纯化后的睾丸间质细胞形态;图1中c图纯化后的睾丸间质细胞经3β-hsd特异性染色(贴壁细胞);图1中d图纯化后的睾丸间质细胞经3β-hsd特异性染色(贴壁细胞)。
[0030]
细胞存活率测试:由图2可以看出,经cck-8检测,在10 μg
·
ml-1
以下时杜仲雄花提取物的细胞生存率均大于85%,未见明显细胞毒作用。在100 μm以下时杜仲雄花中单体成分的细胞生存率大于85%,未见明显细胞毒作用,说明杜仲雄花提取物及杜仲雄花中单体成分对细胞没有毒性。
[0031]
杜仲雄花提取物及杜仲雄花中单体成分对大鼠睾丸间质细胞睾酮分泌的影响:如图3可以看出,杜仲雄花提取物0.361 μg/ml、咖啡酸、去乙酰车叶草苷酸、柚皮素、acanthoside b、京尼平苷酸、芦丁和槲皮素在50μm时均能促进睾丸间质细胞分泌睾酮,可用于抗疲劳为主要功能和保健食品。
[0032]
以上对本发明的实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1