可生物降解的磁控PVA微马达支架及其制备方法与应用与流程
可生物降解的磁控pva微马达支架及其制备方法与应用
技术领域
[0001]
本发明属于生物材料领域,具体涉及可生物降解的磁控pva微马达支架及其制备方法与应用。
背景技术:
[0002]
微马达是一种人工动力装置,具有优良的运动性能和精准导航的性能,在生物医学领域具有广阔的应用前景,为了使微马达在生物医学领域中有更广泛的应用,提高微马达系统的生物相容性具有重要的研究意义。
[0003]
血管支架植入是治疗血管狭窄相关疾病的有效医学干预手段,但现有技术中,传统材料制备得到的血管支架存在生物相容性不足、需要引入额外的形状扩张装置等问题,而且,为了确保植入的准确性,需要采用高侵入的治疗方法,而这些问题的存在容易造成血管再狭窄和动脉损伤,从而降低了治疗的有效性。
[0004]
因此,为了实现血管支架更广泛有效的临床应用,需要研发一类能有效克服现有问题,能实现低侵入、高精准治疗的新型血管支架系统,以拓宽微马达在生物医学领域中的应用。
技术实现要素:
[0005]
本发明的目的在于提供一种水凝胶材料;
[0006]
本发明的另一目的在于提供一种磁控水凝胶材料的制备方法;
[0007]
本发明的另一目的在于提供一种医用支架;
[0008]
本发明的另一目的在于提供上述水凝胶材料或上述制备方法制备得到磁控水凝胶材料或上述医用支架在体内通道扩张中的应用。
[0009]
本发明所采取的技术方案是:
[0010]
本发明的第一个方面,提供:
[0011]
一种水凝胶材料,该水凝胶材料中含有聚乙烯醇、磁性粒子和交联剂;
[0012]
其中,上述磁性粒子包括fe3o4纳米粒子;上述交联剂包括三聚氰胺。
[0013]
发明人发现,采用可生物降解的高分子材料聚乙烯醇(pva)制备形状记忆水凝胶,引入磁性颗粒四氧化三铁(fe3o4)纳米粒子,使体系具有可磁场驱动和控制的性能,在磁场下,可以运动至指定部位。
[0014]
本发明的第二个方面,提供:
[0015]
一种磁控水凝胶材料的制备方法,其特征在于,包括以下步骤:
[0016]
(1)将聚乙烯醇、磁性粒子、交联剂和水混合,加热溶解;
[0017]
(2)加入磁性粒子,交联得到一级交联产物;
[0018]
(3)将步骤(2)得到的一级交联产物冷冻解冻,即得磁控水凝胶材料。
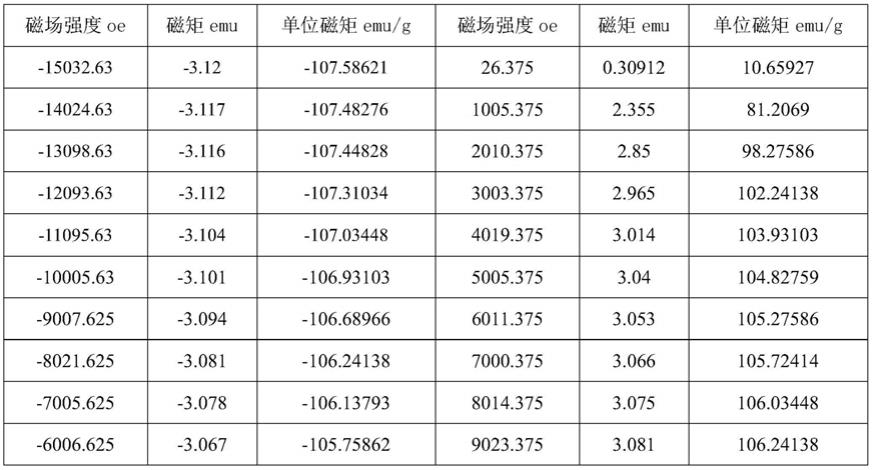
[0019]
通过加入三聚氰胺提供氢键交联点形成一级交联,在变形时拉伸为小直径的临时形状,随后通过冷冻解冻法形成pva链间结晶的二级交联固定临时形状。该制备方法可以使
该材料到达的指定部位后通过施加能量(如加热至一定温度并维持一定的时间或者施加一定时间和声强的超声)破坏二级交联后,即恢复为大直径螺旋形以支撑血管。
[0020]
其中,在步骤(1)中还可以选择加入医用染剂,如罗丹明b水溶液,以便于实际观察。
[0021]
进一步地,上述磁性粒子包括fe3o4纳米粒子;上述交联剂包括三聚氰胺。
[0022]
进一步地,上述步骤(1)中聚乙烯醇的混合质量百分比为30-40wt%,所述交联剂的混合质量百分比为1-1.5wt%。
[0023]
当然,本领域技术人员也可以根据实际使用需求,合理调整加入的混合质量百分比,以得到特定性能的磁控水凝胶材料。
[0024]
进一步地,上述步骤(2)还包括对上述一级交联产物进行塑形处理。
[0025]
更进一步地,上述塑形包括将上述一级交联产物制备成螺旋状。
[0026]
此外,为了提高磁性微马达血管支架系统的运动效率,使其在血液等较粘稠的生物介质中保持良好的运动性能,将磁性微马达血管支架制备为螺旋形状是一种较好的选择,这是由于在液体中,螺旋的旋转可以模拟细菌鞭毛的高效运动方式,产生向前的推力将旋转运动转化为平移运动,运动速率较高,并且在旋转磁场下可以实现磁性微马达血管支架的精确的三维导航和获得相比其他驱动方式更加高效的运动性能。将微马达制备为螺旋形状除了保证系统在生物介质中可以有较好的运动性能以外,在其用作血管支架植入体内时,螺旋形的设计使血管支架具有很好的柔韧性和弹性,而且螺旋的几何形状可以适应动脉血管中的旋动流现象,这种旋转血流模式会增加血管壁切应力,这种切应力对抑制新生内膜的形成有一定的作用,螺旋形的设计由于可以适应旋动流现象而使植入位点的血管壁切应力得到一定程度上的维持,抑制支架植入后内膜增生不良反应的发生。
[0027]
进一步地,上述冷冻温度为小于等于-20℃,冷冻时间为30-35min。
[0028]
进一步地,上述解冻温度为室温,解冻时间大于等于6h。
[0029]
反复冷冻解冻可以使本发明中的磁性水凝胶材料形成pva链间结晶的二级交联固定临时形状,以便于在磁性微马达血管支架到达的指定部位施加能量(如加热至一定温度并维持一定的时间或者施加一定时间和声强的超声)破坏二级交联后,即恢复为大直径螺旋形以支撑血管。
[0030]
本发明的第三个方面,提供:
[0031]
一种医用支架,该医用支架由上述水凝胶材料或上述制备方法制备得到磁控水凝胶材料制备得到。
[0032]
进一步地,上述医用支架包括血管支架。
[0033]
本发明的第四个方面,提供:
[0034]
上述水凝胶材料或上述制备方法制备得到磁控水凝胶材料或上述医用支架在体内通道扩张中的应用。
[0035]
本发明的有益效果是:
[0036]
1.使用本发明中的材料制备得到的血管支架采用超声触发形状记忆,并配合磁驱动马达的运动性能,可以简化材料配方的调节过程和植入流程,控制血管支架在体内运动到达目标位置,再以对机体无害的超声触发形状恢复,无需定点植入,进一步降低侵入性和植入风险,更加符合实际应用需求。
[0037]
2.本发明中的磁控pva微马达血管支架为螺旋状,在旋转磁场下可以实现精确的三维导航和获得相比其他驱动方式更加高效的运动性能。而且在其用作血管支架植入体内时,螺旋形的设计使血管支架具有很好的柔韧性和弹性,而且螺旋的几何形状可以适应动脉血管中的旋动流现象,这种旋转血流模式会增加血管壁切应力,这种切应力对抑制新生内膜的形成有一定的作用,螺旋形的设计由于可以适应旋动流现象而使植入位点的血管壁切应力得到一定程度上的维持,抑制支架植入后内膜增生不良反应的发生。
[0038]
3.本发明中的材料为可生物降解高分子材料,制备成磁控微马达血管支架后,具有生物相容性高、驱动方式高效且符合体内应用、形状记忆性能良好的特点,将该体系用于运动可控的自膨胀式血管支架的低侵入性植入,可应用于治疗血管狭窄相关血管疾病,具有重要的研究意义和应用价值。
附图说明
[0039]
图1为本发明中的磁控pva微马达支架的制备示意图,a为初始形状的一级交联形态,b处于临时形状的二级交联磁控pva微马达支架;
[0040]
图2为四氧化三铁纳米粒子的磁滞曲线;
[0041]
图3为本发明中的磁控pva微马达支架的磁滞曲线;
[0042]
图4为本发明中的磁控pva微马达支架在超纯水中对磁场的响应示意图;
[0043]
图5为磁控pva微马达支架的拉伸力与位移距离关系图;
[0044]
图6为本发明中的磁控pva微马达支架的形状记忆现象,a为磁控pva微马达支架初始形状,b为临时形状(二级交联),c为回复形状;其中,各图中右下角白色比例尺为2.4mm。
具体实施方式
[0045]
为了使本发明的发明目的、技术方案及其技术效果更加清晰,以下结合具体实施方式,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的具体实施方式仅仅是为了解释本发明,并非为了限定本发明。
[0046]
所使用的实验材料和试剂,若无特别说明,均为常规可从商业途径所获得的耗材和试剂。
[0047]
试验材料
[0048]
聚乙烯醇(pva-117,m
w
~145000)和三聚氰胺均购于阿拉丁试剂公司;
[0049]
罗丹明b购自acros试剂公司。
[0050]
磁控水凝胶材料的合成
[0051]
称取2.69g pva和0.117g三聚氰胺,加入3ml罗丹明b水溶液(1mg/ml)和2ml超纯水(混合后的水凝胶中pva的质量分数为35wt%,三聚氰胺的质量分数为1.5wt%),于90℃水浴下混合溶解2h以上,完成溶解后,加入6mg fe3o4纳米粒子,搅拌混合均匀,在室温下过夜交联,形成三聚氰胺和pva分子间的氢键交联,得到一级交联产物。
[0052]
把一级交联产物放置在-20℃冰箱中冷冻30min,取出在室温下解冻6h以上,重复3次,得到磁控水凝胶材料。
[0053]
磁控pva微马达支架的制备
[0054]
制备方法同磁控水凝胶材料的合成。
[0055]
区别在于:在加入6mg fe3o4纳米粒子搅拌混合均匀后,将混合溶液进行塑形处理,在室温下过夜交联,形成三聚氰胺和pva分子间的氢键交联,得到一级交联产物。然后在弹性形变范围内,拉伸一级交联产物,将其拉伸至较小直径的临时形状(按照使用目的可调节至合适的尺寸),并用长尾夹临时固定。然后把一级交联产物放置在-20℃冰箱中冷冻30min,取出在室温下解冻6h以上,重复3次,得到磁控pva微马达支架。
[0056]
塑形处理的具体步骤为:
[0057]
将混合溶液转移至5ml注射器中,将注射器针头替换为14g点胶针头(外径1.82
±
0.02mm,内径1.50
±
0.03mm),推动注射器活塞挤出混合溶液并缠绕在塑料吸管(外径4.0mm)上以形成螺旋形状。
[0058]
制备得到的磁控pva微马达支架如图1所示。
[0059]
混合有fe3o4纳米粒子的一级交联产物经14g点胶针头挤出并缠绕成螺旋形,以三聚氰胺作为一级物理交联点,使水凝胶固定初始形状后得到的磁性螺旋形水凝胶如图1a所示,在弹性形变范围内拉伸,并通过长尾夹施加外力临时固定直径较小的临时形状,经过冷冻解冻处理后,得到的二级交联的磁控pva微马达支架如图1b所示。
[0060]
可以发现,经过冷冻解冻后,临时形状无需施加外力即可固定,这表明磁控水凝胶材料的聚合物三维网络中形成了二级交联。该磁控水凝胶材料的二级交联是pva链结晶导致的,在弹性形变被外力固定时,高分子体系中的应力处于不平衡的状态,有恢复为初始形状的趋势,但是弹性形变的恢复无法完成。冷冻解冻法中的冷冻过程是一个骤冷的过程,可使pva链产生结晶,先前无法进行的弹性形变恢复必然以内应力的形式冻结在pva链中,因此,经过弹性形变得到的临时形状可以在常温下固定。此外,图1b中的磁控水凝胶材料相比图1a中的磁控水凝胶材料,其透明度有所降低,这是由于pva结晶微区的光散射使水凝胶呈现半透明状态,这同样也证明了pva链结晶即二级交联的形成。
[0061]
磁控pva微马达支架的效果测试
[0062]
(1)磁控pva微马达支架的磁场控制运动性能测试
[0063]
将上述制备得到的磁控pva微马达支架悬浮于超纯水中,在0mm、5mm、10mm的距离下放置磁铁并移动,测试微马达支架对于磁场变化响应的灵敏度和在水体系中的可运动性,观察并记录螺旋马达的运动状态。
[0064]
结果如图2-4和表1-2所示。
[0065]
表1 fe3o4纳米粒子的磁性能数据
[0066][0067][0068]
表2磁控pva微马达支架的磁性能数据
[0069]
磁场强度oe磁矩emu单位磁矩emu/g磁场强度oe磁矩emu单位磁矩emu/g15000.008953.65e-041.91e-05-1015.04787-1.66e-04-8.72e-0614041.341723.64e-041.90e-05-2030.07933-2.52e-04-1.32e-0513026.314593.63e-041.90e-05-3045.111-2.93e-04-1.53e-0512011.280673.61e-041.89e-05-4003.76245-3.15e-04-1.65e-0510037.595543.57e-041.87e-05-5018.79887-3.29e-04-1.72e-059022.555633.54e-041.85e-05-6033.84213-3.39e-04-1.77e-058007.512263.50e-041.83e-05-7048.88004-3.46e-04-1.81e-057048.881153.46e-041.81e-05-8007.51761-3.50e-04-1.83e-056033.830363.39e-041.78e-05-9022.56254-3.54e-04-1.85e-055018.783073.29e-041.72e-05-10037.59792-3.57e-04-1.87e-054003.758833.15e-041.65e-05-11052.63332-3.59e-04-1.88e-053045.115152.94e-041.54e-05-12011.2836-3.61e-04-1.89e-052030.072182.54e-041.33e-05-13003.59908-3.63e-04-1.90e-051015.032471.70e-048.92e-06-14028.78167-3.64e-04-1.90e-0556.390541.43e-057.51e-07-14999.99848-3.65e-04-1.91e-05-0.003533.28e-061.72e-07
ꢀꢀꢀ
[0070]
将磁控pva微马达支架悬浮于超纯水中,当方块磁铁距离马达0mm、5mm和10mm时,马达均可以跟随方块磁铁的移动而迅速产生位移,距离0mm时,磁铁和马达的移动可以达到
同步,随着距离的增加。达到10mm时,马达移动略有滞后,但对磁场变化仍有较灵敏的响应而跟随方块磁铁移动。产生这种现象的原因是fe3o4纳米粒子是一种铁磁性材料,在常温或者体温下应用时,处于其居里温度以下,在外界磁场作用下,能够受磁场吸引而沿着磁感应强度的方向运动,从而带动pva水凝胶基体产生位移,这说明了fe3o4纳米粒子成功复合到pva水凝胶中。构建得到的磁控pva微马达支架对磁场变化可以产生灵敏的响应,在水或水溶液体系中可以具有良好的运动性能。在增大方块磁铁和马达之间的距离后,即降低磁场磁感应强度后,这种对磁场变化的灵敏的响应性可以在一定程度上得到保持,此现象表明,在较低磁感应强度的磁场下,磁控pva微马达仍然可以被驱动,同时也说明了马达的运动速度与磁场的磁感应强度和磁感应强度的变化速率相关。
[0071]
基于此实验结果,在马达的进一步研究和实际应用时,由于旋转磁场可以使螺旋形马达产生旋转运动,螺旋的旋转可以产生向前的推力将旋转运动转化为平移运动,因此采用较低磁感应强度的旋转磁场对螺旋形磁控pva微马达支架进行驱动和导航具有很高的可行性,在血清等生物介质中的磁场响应性和运动性也具有可参考性。
[0072]
(2)磁控pva微马达支架的拉伸试性能测试
[0073]
将上述实施例制备得到的磁控pva微马达支架进行拉伸测试。
[0074]
随机选取上述实施例制备得到的5根磁控pva微马达支架,测量其拉伸前的原始标距,根据对磁控pva微马达支架施加的拉伸力计算磁控pva微马达支架的拉伸强度。
[0075]
结果如表3和图5所示。
[0076]
表3磁控pva微马达支架的拉伸强度
[0077][0078]
如表3和图5所示,本发明中的磁控pva微马达支架的拉伸强度优异,最大可承受5.33n的拉力,拉伸轻度平均可达19.96mpa,完全可以满足作为体内血管支架使用的技术要求。
[0079]
(3)磁控pva微马达支架的形状记忆性能测试
[0080]
将上述实施例制备得到的磁控pva微马达支架放置于70℃水浴中,水浴5min,测试其形状记忆性能。
[0081]
磁控pva微马达支架的回复率(r
r
),可由式(1)计算:
[0082][0083]
式中,l0为初始形状的长度或内外直径,l1为临时形状的长度或内外直径,l2为回复形状的长度或内外直径。
[0084]
结果如图6所示。
[0085]
初始形状的平均长度为5.92mm,平均内径为4.00mm,平均外径为5.09mm;临时形状的平均长度为8.54mm,平均内径为0.58mm,平均外径为0.96mm;回复形状的平均长度为7.39mm,平均内径为1.13mm,平均外径为1.48mm。由式(1)可得,磁控pva微马达支架的长度回复率为43.9%,内径回复率为16.1%,外径回复率为12.6%,形状恢复现象明显但回复率较小,这表明在磁控pva微马达支架的制备过程中可能产生了一定的链松弛或者该形状恢复触发条件下,水凝胶中存在一些未释放的内应力,因此,为了符合实际应用需求,在进一步的研究中,应注意制备过程中,在实施变形时水凝胶处于弹性形变范围和缩短外力施加时间;在触发形状恢复时,给予更多的破坏二级交联的能量,如更高的温度或超声声强和更长的保温时间或超声施加时间。
[0086]
(4)磁控pva微马达支架的超声触发效果测试
[0087]
在通过加热等方式破坏磁控pva微马达支架的二级交联后,微马达可以从临时形状在一定程度上恢复至初始形状,这是因为二级交联来源于pva链结晶,当通过加热等方式使结晶微区熔融后,pva的链段运动被解冻,未完成的弹性形变恢复在内应力的驱使下完成,在宏观上就表现为磁控pva微马达支架的形状恢复。从而,以可以推论到得到,该微马达系统在用作血管支架时,可以以小直径的临时形状方便地植入,再由磁场控制至指定部位,触发形状恢复,直径变大以支撑血管。
[0088]
基于该系统的形状恢复机理,超声也可以作为破坏二级交联的能量来源,因为pva水凝胶的一级交联基本是由pva链和三聚氰胺分子之间的非晶区氢键形成,由于周围存在大量的水分子,pva链之间较难发生分子间摩擦,大多数超声波可以在这些区域传播而不破坏氢键,也不会产生大量的热量,而二级交联主要是由在三聚氰胺存在下pva链结晶形成的,超声波在结晶区的传播会导致pva分子链间强烈的摩擦,从而产生有效的热量并使热量限制在结晶微区内。
[0089]
测试探究发现,对磁控pva微马达支架施加声强为2.0w/cm2的超声5min后,同样可以达到70℃水浴触发形状恢复的效果。
[0090]
常规超声治疗所用的超声波可以使超声探头表面的附近区域温度接近70℃,因此,综合上述因素可达到熔融结晶微区使形变恢复的目的,而且超声的使用相比起非接触式远程局部加热而言,可以避免组织损伤,安全性更高、更符合医学应用的要求,因此,本发明中的磁控pva微马达支架也可以结合超声触发形状恢复以进一步发展与应用。
[0091]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1