Furin抑制剂在制备治疗骨质疏松药物方面的应用的制作方法
本发明属骨疾病治疗技术应用领域,涉及furin抑制剂在制备治疗骨质疏松药物方面的应用。
背景技术:
在生命发育生长过程中,骨骼作为一个高度活跃的器官持续不断地经历着骨吸收和骨形成这两个彼此独立又相互偶联的事件,两者之间的动态平衡维持了骨骼的结构和功能,其中成骨细胞作为行使骨形成功能的细胞,主要负责骨基质的合成、分泌和矿化,破骨细胞作为骨吸收的主要参与者,介导了正常生理情况下以及个别骨吸收相关的疾病发生,两者在骨重建中具有重要作用。在正常的生理条件下,破骨细胞的骨吸收与成骨细胞的骨形成相互偶联达到动态平衡,维持着骨组织的完整性和力学强度。然而随着老龄化的日益加剧,成骨细胞的分化增殖能力和生物学功能逐渐降低,特别是老年人骨形成功能明显衰退,引起骨重建活动失衡,骨量丢失,最终导致骨质疏松症。目前,骨质疏松现已成为一个世界性的公共卫生健康问题。根据国际骨质疏松组织(internationalosteoporosisfoundation)报告全世界范围内有近2亿人口患有骨质疏松症,每年有超过890万人口因骨质疏松导致骨折。目前临床上常用的抗骨松药物各种不同程度的副反应,并且靶标性不明显。因此,找到深入解析和认识成骨细胞的分化及骨形成功能,寻找有效的关键调控因子,有助于更好的了解骨质疏松的发病机制,寻找特异性疾病诊断指标和开发新的治疗,进而对于防治骨质疏松症具有重大意义。
furin是一个丝氨酸蛋白酶,属于前体蛋白加工酶家族,在所有脊椎动物和许多无脊椎动物的绝大多数细胞中都有表达。它是一种由794个氨基酸组成的ⅰ型跨膜蛋白,结构包含信号肽、前体肽、催化结构域和p结构域。广泛表达的furin参与体内众多蛋白、多肽的成熟过程,可剪切各种含特定序列arg-xaa-(lys/arg)-arg的分泌型前体蛋白,包括大多数的肽类激素、神经肽,也包括许多生长因子、受体、基质金属蛋白酶等,进而参与机体的各大系统和组织的生理过程。尽管furin参与了哺乳动物许多重要的生理过程,但在骨骼发育过程中,特别是成骨细胞的分化及骨形成过程,国内外未见相关报道。
技术实现要素:
本发明的目的就是要开发furin抑制剂的医药用途,同时为临床提供一种治疗骨质疏松的可靠有效药物。
发明人通过配对c57bl/6furin-flox与prx.1-cre小鼠,得到在骨髓间充质干细胞中条件性敲除furin基因小鼠。结果发现与野生小鼠比较,条件性敲除furin小鼠骨小梁密度明显增加,骨小梁数量明显增多,骨小梁间隔明显变小。提示furin可能通过影响成骨细胞从而具备潜在治疗骨质疏松的靶点。在此基础上,将furin作为药物靶点用于筛选治疗骨质疏松的药物,进一步研究dec-rvkr-cmk(cmk;c34h66cin11o5)作为furin的特异性抑制剂对去卵巢小鼠骨质疏松症引起的骨丢失的治疗作用。发现dec-rvkr-cmk(cmk)抗骨质疏松作用,从而发明了cmk的一种新的医药用途,即完成了在制备治疗骨质疏松药物方面的应用。
本发明的目的通过以下技术方案实现:
提供furin抑制剂在制备治疗疾病方面的药物应用,例如治疗骨质疏松药物。
进一步的,所述的furin抑制剂为cmk。
进一步的,所述骨质疏松是由卵巢切除引起,但不总限于此。
进一步的,所述的治疗骨质疏松药物由cmk活性组分和药学上可接受的辅料组成。
cmk具有抗骨质疏松的显著性作用,且不具有毒副性,安全性高,具有特异性治疗性质。因此,cmk有开发成抗骨质疏松药物的前景,为骨质疏松的治疗提供有效途径。
附图说明
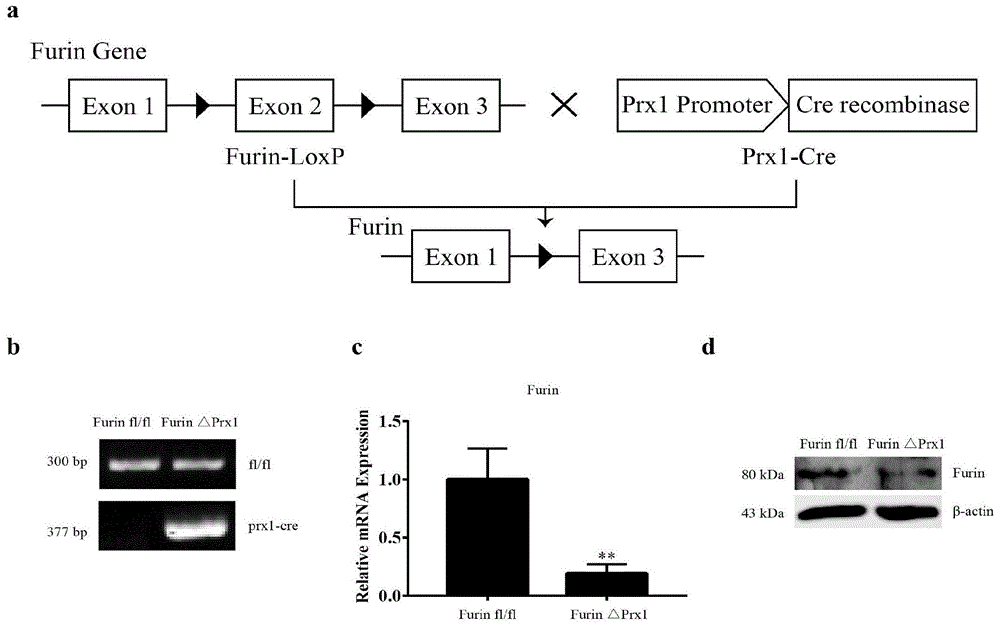
图1为构建条件性敲除小鼠示意图,其中图1-a为条件性敲除furin小鼠模型构建策略;图1-b为基因型鉴定结果;图1-c为mrna相对表达量结果;图1-d为蛋白表达结果;
图2为micro-ct对野生型,纯合子雌性或雄性小鼠骨组织扫描的结果图,其中图2-a为骨骼形态示意图;图2-b、图2-c、图2-d、图2-e分别为骨小梁体积(bv/tv)、骨小梁数量(tb.n)、骨小梁厚度(tb.tn)、骨小梁分离度(tb.sp)的定量分析统计结果;
图3为x线对野生型,纯合子雌性或雄性小鼠下肢骨和脊柱骨扫描结果图;
图4为野生型,纯合子雌性或雄性小鼠h&e、tracp染色结果示意图;
图5为野生型,纯合子雌性或雄性小鼠硬组织切片结果示意图;
图6为去卵巢小鼠骨质疏松症模型的micro-ct扫描结果示意图;
图7为去卵巢小鼠骨质疏松症模型的h&e染色和tracp染色结果示意图。
具体实施方式
下面结合具体实施例,对本发明作进一步详细的阐述,但本发明的实施方式并不局限于实施例表示的范围。这些实施例仅用于说明本发明,而非用于限制本发明的范围。此外,在阅读本发明的内容后,本领域的技术人员可以对本发明作各种修改,这些等价变化同样落于本发明所附权利要求书所限定的范围。
实施例1
一、材料和试剂
1、cmk购自cymanchemical公司,批号为14965;手术剪;固定液;
二、实验方法
1、构建条件性敲除小鼠
通过将furin-flox小鼠与prx.1-cre小鼠进行配对,对后代进行基因鉴定,得到杂合子后,进一步纯化,最终获得在骨髓间充质干细胞条件性敲除furin基因的纯合子小鼠,命名为furinfl/fl,prx.1-cre,同窝对照小鼠为野生型furinfl/fl;并对小鼠基因敲除效率进行蛋白水平和mrna水平验证。在此工作基础上,我们取12周小鼠及不同性别进行比较野生型及纯合子二种不同小鼠的大小、体重的变化;
利用micro-ct、x线对野生型,纯合子小鼠骨组织进行扫描,比较分析小鼠骨骼形态、骨密度等参数的变化;
硬组织切片及h&e、tracp染色对小鼠进行组织形态学分析,比较野生型,纯合子小鼠骨组织形态学变化。
2、卵巢切除诱导的小鼠骨质疏松症的模型建立和分析
卵巢切除诱导的骨质疏松小鼠模型的建立按照广西医科大学动物伦理委员会的指导原则进行。首先将40只12周龄的c57bl/6j小鼠随机分为4组:假手术组(注射pbs),手术组(ovx+pbs),低剂量组(双侧卵巢切除+cmk1mg/kg)和高剂量组(双侧卵巢切除+cmk10mg/kg)。
具体建模过程如下,用水合氯醛将小鼠麻醉后,经双侧腰背部行手术切口进入腹腔,切除双侧卵巢。假手术组找到卵巢后不摘除,切除附近少量脂肪,其余同手术组。手术过程均在严格无菌条件下进行,术后小鼠放至笼中自由活动与禁食。术后一周给予cmk注射治疗,按1mg/kg和10mg/kg给药1次/2天,连续6周。手术组与假手术组则给予同量的pbs。给药结束后,气体麻醉动物,取眼球血,颈椎脱臼处死后分离双侧胫骨,左侧胫骨通过micro-ct扫描,进行扫描、3维重构分析。
通过组织形态学方法分析骨微结构的改变,并对药物作用后骨组织中破骨细胞数目进行对比分析。将小鼠的胫骨取下后,剔除软组织,置于4%多聚甲醛中固定24-48小时,然后用10%edta浸泡组织,于脱钙机中脱钙,大约5-7天。脱钙完成后,进行包埋,切片后进行h&e染色和tracp染色。
2、统计
所有数据均以平均值±标准偏差(sd)表示,每个实验重复三次,结果表示为三次的平均值。采用spss17.0软件(ibm,usa)进行数据分析。使用anova分析实验组和对照组之间的差异。在*p<0.05,**p<0.01或***p<0.01时差异有统计学意义。
三、结果
1.利用cre-loxp系统,构建骨髓间充质干细胞条件性敲除furin小鼠模型,并对小鼠基因敲除效率进行蛋白水平和mrna水平验证,结果如图1所示。
利用micro-ct分析,我们发现在骨髓间充质干细胞内敲除furin基因后,雌性或雄性条件性敲除小鼠表现为骨量升高表型,与野生型furinfl/fl小鼠比较,furinfl/fl,prx.1-cre雌性或雄性小鼠骨组织骨小梁密度明显增加,骨小梁数量明显增多,骨小梁间隔明显变小,骨量明显增加(图2所示)。这提示furin是治疗骨量丢失的潜在靶点。
在此基础上,应用x线分析野生型furinfl/fl和条件性敲除furinfl/fl,prx.1-cre小鼠的下肢骨和脊柱骨的骨密度,图3结果提示条件性敲除小鼠的下肢骨和脊柱骨骨密度明显高于野生型小鼠。
显示通过骨组织免疫组化染色分析,与furinfl/fl小鼠相比,furinfl/fl,prx.1-cre雌性或雄性小鼠骨组织中骨量显著增加(图4所示),这提示furin可作为潜在的治疗骨量丢失的靶点。
利用硬组织切片技术,进一步发现与furinfl/fl小鼠相比,furinfl/fl,prx.1-cre雌性或雄性小鼠骨组织骨量骨组织中骨量显著升高(图5所示)。
2.cmk对去卵巢小鼠的治疗作用
通过构建ovx双侧卵巢切除骨质疏松小鼠模型,在阳性对照组中,双侧卵巢切除导致小鼠的骨密度明显降低,利用cmk进行体内干预,micro-ct分析发现,与ovx模型组比较,cmk处理组小鼠骨组织骨小梁密度明显增加,骨小梁间隔明显变小,小鼠骨量明显增加(图6所示)。
进一步通过骨组织免疫组化分析,与ovx模型组比较,cmk处理组能够明显抑制ovx引起的骨量丢失(图7所示)。
micro-ct与组织形态学分析研究结果一致,这提示cmk具有抗骨质疏松的作用。
四、讨论
在本研究中,发明人观察到cmk在体内可以改善双侧卵巢切除引起的骨质疏松症。
据此发明人认为cmk可能对骨相关疾病,如骨质疏松的预防具有巨大的潜力和临床价值。
越来越多的研究表明骨质疏松的发生、发展与骨重建失衡引起的骨丢失密切相关。骨重建活动需要三种关键细胞共同参与调控:破骨细胞、成骨细胞与骨细胞。随着年龄的增长,成骨细胞的分化增殖能力和生物学功能降低,破骨细胞骨吸收越发活跃,引起骨重建活动失衡,骨量丢失,最终导致骨质疏松症。
前体蛋白加工酶参与机体生理活动,许多信号通路需要前体蛋白酶对其前体进行剪切才能发挥生物学功能,但机制尚不清楚。其家族是一个由9个成员组成的内切蛋白酶家族:pcsk1,pcsk2,furin,pcsk4,pcsk5,pcsk6,pcsk7,mbtps1和pcsk9。发明人在前期研究中,通过biogps数据库(http://biogps.gnf.org)统计分析,前体蛋白加工酶家族中furin基因在成骨细胞分化过程中具有明显表达,然而furin在成骨分化及骨形成方面的研究尚不清楚。
因此,发明人利用furin-flox和prx.1-cre小鼠杂交,得到条件性敲除小鼠。经分析表明,敲除小鼠呈现骨量升高,这提示furin在成骨细胞分化及功能中具有重要作用。由此,发明人推测,furin抑制剂cmk对骨稳态有一定影响,可以达到缓解骨量丢失疾病的作用,如骨质疏松症。
发明人通过构建双侧卵巢切除来模拟骨质疏松症模型,并给予cmk治疗,结果发现cmk治疗组对比单纯行ovx手术组,骨量明显升高,这提示,cmk对骨质疏松有一定的保护作用。
结论:cmk作为furin的特异性抑制剂,其有开发成抗骨质疏松药物的前景,为骨质疏松的治疗提供有效途径。本发明可能为预防骨质疏松性疾病提供了一种新的治疗思路。
- 还没有人留言评论。精彩留言会获得点赞!